Доклады Российской академии наук. Науки о жизни, 2021, T. 500, № 1, стр. 478-482
АМИНОКИСЛОТНЫЙ СПЕКТР ПЛАЗМЫ КРОВИ ЭНДЕМИЧНОГО И ИНВАЗИВНОГО ВИДОВ ЗЕМНОВОДНЫХ ФАУНЫ УРАЛА
Л. А. Ковальчук 1, *, Л. В. Черная 1, В. А. Мищенко 1, Д. Л. Берзин 1, академик РАН В. Н. Большаков 1
1 Федеральное государственное бюджетное учреждение науки Институт экологии растений и животных Уральского отделения Российской академии наук
Екатеринбург, Россия
* E-mail: kovalchuk@ipae.uran.ru
Поступила в редакцию 20.05.2021
После доработки 31.05.2021
Принята к публикации 31.05.2021
Аннотация
Впервые представлены результаты сравнительного анализа свободных аминокислот в плазме крови земноводных фауны Урала: эндемичного вида – сибирского углозуба (Salamandrella keyserlingii Dybovsky, 1870) и инвазивного вида – озерной лягушки (Pelophylax ridibundus Pallas, 1771). Показана видовая разнонаправленность адаптивных стратегий терморезистентных амфибионтов, как к отрицательным, так и к положительным температурам.
Амфибии, будучи одной из доминирующих групп среди всех классов позвоночных животных, вносят существенный вклад в видовое разнообразие не только водных, но и наземных экосистем. В настоящее время около трети видов этих животных находится под угрозой исчезновения [1, 2]. Представители фауны земноводных Урала из отряда Caudata – сибирский углозуб (Salamandrella keyserlingii Dybovsky, 1870) и из отряда Anura – озерная лягушка (Pelophylax ridibundus Pallas, 1771) вызывают повышенный интерес, поскольку обладают разнонаправленностью адаптивных стратегий как пойкилотермные амфибионты, обитающие в диапазоне экстремально положительных и отрицательных температур [3, 4]. Исследователи отмечают повышенную холодоустойчивость самцов и самок сибирского углозуба и их способность переносить отрицательные температуры до –35...–40°С, не теряя активности при 0...+2°С [5, 6]. Стратегия существования сибирского углозуба в условиях низких положительных и даже отрицательных температур способствует возможности расширения его ареала, северная граница которого проходит за Полярным кругом. Животные не переносят длительное пребывание на солнце и при температуре в тени около +27°С погибают. В это же время инвазивный для Урала вид – озерная лягушка толерантна к высоким положительным температурам. На Урале данный вид первоначально заселил термальные водоемы антропогенного происхождения (водоемы-охладители Верхнетагильской и Рефтинской ГРЭС, Свердловская область). Известно его обитание в горячих источниках, где температура воды достигает +30°С, а иногда и выше [4, 7]. Аминокислоты и их производные, как универсальные биологические модификаторы и регуляторы важнейших метаболических реакций, ответственны за поддержание биологической целостности организма [3]. Известна регуляторная роль свободных АК в формировании адаптивной стратегии животных, обеспечивающая устойчивость популяционного гомеостаза в условиях как водного, так и наземного микроклимата [8–11]. Однако в имеющейся литературе информация о метаболизме свободных аминокислот в плазме крови амфибий фауны Урала не представлена. Впервые нами исследовано содержание свободных аминокислот (АК) в плазме крови половозрелых самцов земноводных (n = 11), обитающих в нерестовых водоемах и в прибрежных наземных укрытиях при среднесуточной температуре воздуха +23°С на территории Свердловской области (58°0′0″ с.ш., 62°0′0″ в.д.). Климат района исследования континентальный с продолжительной холодной зимой и сравнительно теплым коротким летом. Типичный инвазивный вид – озерная лягушка отловлена в неглубоких заводях реки Тагил. Летом температура воды составляет в среднем 27.5 ± 0.4°С. В период отлова углозубов в прибрежной зоне водоема – Калиновский пруд на территории лесопарка городской агломерации Екатеринбурга, температура воды составляла в среднем 21 ± 0.3°С. Животных доставляли в лабораторию в день отлова в июле–августе 2019 г. Образцы крови животных брали из миокарда. Плазму получали центрифугированием крови в рефрижераторной ультрацентрифуге K-23D (Германия) в вакутайнерах “Bekton Dickinson ВР” (Великобритания) с ЭДТА в течение 15 мин при 3000 об/мин. Содержание свободных аминокислот (АК) в плазме крови животных определяли методом высокоэффективной жидкостной хроматографии на анализаторе Agilent 1260 Infinity II (Германия). Концентрацию АК выражали в мкмоль/л и в процентах от суммарного содержания. Выполнен анализ 187 аминокислотных проб. Результаты обработаны с использованием пакета лицензионных прикладных программ “Statistica v. 10.0”. Метод главных компонент (PCA) реализован посредством статистической среды R (R 3.1.2, пакеты “Vegan” и “Ade4”) [12].
Аминокислотный спектр плазмы крови амфибий представлен 17 АК: аспартат, глутамат, серин, гистидин, глицин, треонин, аргинин, аланин, тирозин, цистеин, валин, метионин, фенилаланин, изолейцин, лейцин, лизин, пролин. Сравнительный анализ показал значимые межвидовые различия по фонду свободных АК в плазме крови: у озерной лягушки 1470.4 ± 49.0 мкмоль/л и сибирского углозуба 1086.1 ± 15.4 мкмоль/л (р < 0.0001). У исследованных амфибий, как и у теплокровных животных, присутствует полный спектр функционально значимых незаменимых АК: треонин, валин, лизин, лейцин, изолейцин, метионин, фенилаланин, аргинин, гистидин (табл. 1). Следует отметить, что незаменимые АК не могут быть получены в процессе биосинтеза и должны поступать в организм в виде пищевых белков извне, а отсутствие НАК ведет к угрожающим жизни явлениям [9]. Заслуживает внимание высокое процентное содержание НАК в крови сибирского углозуба – 53.4% и у озерной лягушки – 55.6% от общего фонда АК. По данным исследователей на равновесие азотистого и белкового обмена в организме амфибий указывает коэффициент отношения метаболических групп: незаменимых АК к заменимым АК [8–10]. Отмечен стабильно высокий аминокислотный баланс в плазме крови как у сибирского углозуба: КНАК/ЗАК = 1.15, так и у озерной лягушки КНАК/ЗАК = 1.25.
Таблица 1.
Содержание свободных аминокислот (мкмоль/л ) в плазме крови самцов S. keyserlingii и P. ridibundus. Средние значения (m), стандартная ошибка (SE) и доверительный интервал [95%CI]
| АК | Сибирский углозуб | Озерная лягушка |
|---|---|---|
| Histidine | 188.9 ± 5.1 [174.9–203.1]* | 80.2 ± 5.9 [65.1–95.3] |
| Threonine | 35.4 ± 0.8 [33.3–37.6] | 70.3 ± 6.0 [54.9–85.7]* |
| Arginine | 78.6 ± 4.0 [67.5–89.8]* | 38.6 ± 1.6 [34.5–42.6] |
| Valine | 31.9 ± 0.9 [29.6–34.3] | 81.9 ± 3.9 [71.6–92.1]* |
| Methionine | 72.4 ± 2.3 [66.3–78.6]* | 18.4 ± 2.8 [11.3–25.5] |
| Phenylalanine | 27.4 ± 0.9 [24.9–29.8] | 49.1 ± 3.0 [41.3–56.9]* |
| Isoleucine | 7.7 ± 0.2 [7.2–8.2] | 61.5 ± 2.6 [54.7–68.2]* |
| Leucine | 33.8 ± 1.1 [30.9–36.8] | 221.2 ± 12.4 [189.3–253.0]* |
| Lysine | 103.3 ± 1.2 [99.9–106.6] | 195.3 ± 7.3 [176.7–213.9]* |
| НАК | 579.6 ± 5.8 [563.4–595.7] | 816.4 ± 19.5 [766.3–866.4]* |
| Фонд свободных АК | 1086.1 ± 15.4 [1043.2–1128.9] | 1470.4 ± 49.0 [1344.0–1596.3]* |
Аминокислотный спектр плазмы крови амфибионтов отражает не только энергетический метаболизм, участие в синтезе белка, но и его адаптивную роль в эволюционно закрепленных процессах при изменчивости широкого диапазона температур среды обитания. Доминирующими АК плазмы крови сибирского углозуба являются аспартат, цистеин, аргинин и гистидин: их суммарное содержание – 48% от общего пула, что в 3.6 раза выше, чем у озерной лягушки. Высокая концентрация гликогенного аспартата в плазме крови сибирского углозуба свидетельствует также и о его роли в качестве низкотемпературного адаптогена для этого вида [14]. Наибольший вклад в фонд незаменимых АК углозуба вносят аминокислоты, кратность превышения которых в сравнении с озерной лягушкой составила для гистидина – 2.4; аргинина – 2.0; метионина – 3.9. Следует отметить и высокое суммарное содержание метионина и цистеина, как иммуномодуляторов в плазме крови углозубов (177.6 мкмоль/л), что на порядок превышает содержание этих АК (16.3 мкмоль/л) у озерной лягушки.
Полученные нами, а также литературные данные, позволяют считать, что значительная аккумуляция представленных аминокислот в плазме крови сибирского углозуба способствует защите клеточных мембран от функциональной дестабилизации и, возможно, предполагает их протекторную роль в условиях низких температур [10, 13–15].
У теплоустойчивой озерной лягушки суммарное содержание основных гликогенных АК: аланина (16.5%), глутамата (6.2%), глицина (9.3%) от общего фонда АК составляет 32%, что в 2.0 раза выше, чем у углозуба. Особенностью АК фонда лягушки, согласно нашим результатам, являются значительные концентрации лейцина до 15.1% и лизина до 13.3% от общего пула. Доминирующая аккумуляция этих АК дает основание полагать, что их высокое содержание, обусловленное участием в энергообменных процессах, предполагает и особую резервную роль в обеспечении устойчивости и толерантности лягушек к околонулевым температурам [11, 14, 15].
Методом главных компонент визуализирована видовая специфика незаменимых аминокислот плазмы крови сибирского углозуба S. keyserlingii и озерной лягушки P. ridibundus. По первой главной компоненте (РС1), на которую приходится 88.34% общей дисперсии данных, показана существенная пространственная дифференциация особей озерной лягушки и сибирского углозуба согласно процентному содержанию незаменимых АК в плазме крови (рис. 1). Наиболее высокие корреляции с РС1 отмечены для гистидина (0.98), аргинина (0.98), метионина (0.99), особенно высокое содержание которых в крови характерно для особей углозуба, а также изолейцина (–0.98) и лейцина (–0.99) – для лягушек (р < 0.001). Вклад каждой из этих эссенциальных аминокислот в межвидовые различия превышает 12.03% (табл. 2).
Рис. 1.
Содержание незаменимых аминокислот (% от фонда АК) плазмы крови самцов сибирского углозуба S. keyserlingii и озерной лягушки P. ridibundus в пространстве главных компонент. PC1, PC2 – оси главных компонент, % – процент дисперсии данных, объясненных главной компонентой; стрелки отражают корреляцию главных компонент с исходными показателями (аминокислоты); эллипсы представляют собой 95% доверительные области.
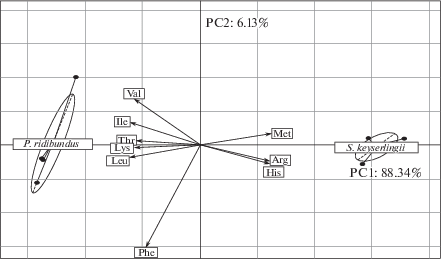
Таблица 2.
Результаты компонентного анализа незаменимых аминокислот (% от фонда АК) в плазме крови самцов сибирского углозуба и озерной лягушки (коэффициенты корреляции между 9 аминокислотами плазмы крови и основными компонентами РС1 и РС2 [пакет “Ade4”])
| АК, % (i = 9) | Нагрузки (loadings, aij) | Вклад в главную компоненту (Contribution = ($a_{{ij}}^{2}$ * 100)/λj, %) |
||
|---|---|---|---|---|
| Главные компоненты (Principal Components – PC), j = 1, 2 | ||||
| 1 | 2 | 1 | 2 | |
| Histidine | 0.98*** | –0.12 | 12.17 | 2.52 |
| Threonine | –0.89** | 0.03 | 10.04 | 0.14 |
| Arginine | 0.98*** | –0.10 | 12.12 | 1.82 |
| Valine | –0.92*** | 0.29 | 10.71 | 15.25 |
| Methionine | 0.99*** | 0.07 | 12.22 | 0.84 |
| Phenylalanine | –0.76* | –0.64 | 7.24 | 74.71 |
| Isoleucine | –0.98*** | 0.14 | 12.04 | 3.62 |
| Leucine | –0.99*** | –0.08 | 12.27 | 1.04 |
| Lysine | –0.94*** | –0.02 | 11.19 | 0.06 |
| Собственные значения (eigenvalues, λj) PC | Дисперсия, объясненная PC (%) | |||
| 7.95 | 0.55 | 88.34 | 6.13 | |
Наименьший вклад в общую дисперсию данных вносит фенилаланин (7.24%), его корреляция с РС1 составила –0.76 (р < 0.05). Для процентного содержания этой ароматической аминокислоты в крови исследуемых групп амфибий были отмечены наименьшие, но статистически значимые, межвидовые различия (р < 0.01).
Таким образом, впервые исследовано содержание свободных аминокислот в плазме крови земноводных фауны Урала: эндемичного вида – сибирского углозуба и инвазивного вида – озерной лягушки. Полученные результаты позволяют оценить видовую специфику аминокислотного спектра, обеспечивающего выживание и эврибионтность исследованных видов в широком температурном диапазоне.
Список литературы
Stuart S.N., Chanson J.S., Cox N.A., et al. Status and trends of amphibian decline and extinction worldwide // Science. 2004. V. 306. № 5702. P. 1783–1786.
Global amphibian assessment. International Union for Conservation of Nature and Natural Resources. 2008. Cambridge, UK. Available from: http://www.globalamphibians.org
Hochachka P.W., Somero G.N. Biochemical adaptation: mechanism and process in physiological evolution. Oxford University Press. New York; 2002.
Большаков В.Н., Вершинин В.Л. Амфибии и рептилии Среднего Урала. Екатеринбург; 2005.
Куницын А.А. Материалы по распространению и экологии сибирского углозуба (Hynobius keyserlingii, Dybovsky, 1870) // Байкальский зоологический журнал. № 3. С. 31–34.
Берман Д.И., Мещерякова Е.Н., Булахова Н.А. Экстремальные отрицательные температуры и потери массы сибирским углозубом (Salamandrella keyserlingii, Amphibia, Hynobiidae) // Доклады Академии Наук. 2016. Т. 468. № 5. С. 590–593.
Лада Г.А., Тепляков А.А. Особенности биологии озерной лягушки Pelophylax ridibundus (Pallas, 1771) в условиях теплового загрязнения // Вестник Тамбовского университета. Серия: Естественные и технические науки. 2014. Т. 19. №. 1. С. 194–196.
Wu G. Amino acids: metabolism, functions, and nutrition // Amino Acids. 2009. V. 37. № 1. P. 1–17.
Mishchenko V.A., Kovalchuk L.A., Bolshakov V.N., et al. Comparative Analysis of the Amino Acid Spectrum of Blood Plasma in Chiroptera (Vespertilio murinus L., 1758 and Myotis dasycneme B., 1825) in the Fauna of the Ural Mountains // Doklady Biological Sciences. 2018. V. 481. № 6. P. 157–159.
Kovalchuk L.A., Mishchenko V.A., Mikshevich N.V., et al. Free amino acids profile in blood plasma of bats (Myotis dasycneme Boie, 1825) exposed to low positive and near-zero temperatures // Journal of Evolutionary Biochemistry and Physiology. 2018. V. 54. № 4. P. 281–291.
Каранова М.В. Влияние острого холодового шока на пулы свободных аминокислот прудовой рыбы ротана Perccottus glehni (Eleotridae, Perciformes) // Известия РАН. Серия биологическая. 2011. № 2. С. 153–161.
Chessel D., Dufour A.B., Thioulouse J. The ade 4 package-I: One-table methods // R News. 2004. № 4. P. 5–10.
Озернюк Н.Д. Температурные адаптации. М.: изд-во Московского ун-та. 2000.
Каранова М.В. Вторичные метаболиты и аспарагиновая кислота в мозге амфибий R. temporaria как низкотемпературные адаптогены // Журнал эволюционной биохимии и физиологии. 2020. Т. 56. № 3. С. 207–212.
Li N.G. Relationships between cold hardiness, and ice nucleating activity, glycerol and protein contents in the hemolymph of caterpillars, Aporia crataegi L. // Cryo Letters. 2012. V. 33. № 2. P. 134–142.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


