Доклады Российской академии наук. Науки о жизни, 2021, T. 500, № 1, стр. 470-473
РОЛЬ ИОНОВ КАЛИЯ В РЕГУЛЯЦИИ КАЛЬЦИЙ-АКТИВИРУЕМЫХ ХЛОРНЫХ КАНАЛОВ
В. Л. Замойский 1, *, Е. В. Бовина 1, член-корреспондент РАН С. О. Бачурин 1, В. В. Григорьев 1
1 Федеральное государственное бюджетное учреждение науки Институт физиологически активных веществ РАН
142432 Черноголовка, Московская область, Россия
* E-mail: vzam@yandex.ru
Поступила в редакцию 11.04.2021
После доработки 22.05.2021
Принята к публикации 23.05.2021
Аннотация
Методом patch-clamp в конфигурации whole cell показано, что ионы внешнего калия играют важную роль в регулировании кальций-активируемых хлорных каналов (КАХК). Показана четкая зависимость проводимости КАХК от изменений концентрации ионов калия с наружной стороны мембраны клетки. Влияние, оказываемое калием на проводимость КАХК в диапазоне 0–15 мМ, существенно больше, чем влияние, вызываемое им на другие ионные токи – натриевые или калиевые. Есть основания полагать, что такое изменение проводимости КАХК может вносить свой вклад в патофизиологические процессы, характерные для гипокалиемии и гиперкалиемии.
Вопрос регуляции кальций-активируемых хлорных каналов (КАХК) является весьма актуальным в свете значительного участия КАХК во многих важнейших физиологических и патофизиологических процессах в организме млекопитающих, в том числе и человека. Доказана роль КАХК в механизмах гипертонии, астмы, муковисцидоза, ноцицепции, нарушении функционирования желудочно-кишечного тракта, урологических патологиях [1–4], замедлении рефлексов и нарушении умственных процессов [5]. Ряд симптомов указывают на то, что нарушения в работе КАХК могут лежать в основе ряда клинических проявлений гипокалиемии [6, 7] и гиперкалиемии [8].
Хотя установлены некоторые механизмы взаимодействия КАХК с различными клеточными сигнальными путями [9], многие другие возможные механизмы регуляции КАХК остаются неисследованными.
Целью данной работы было исследование роли эндогенных электролитов, а именно, ионов калия в регуляции токов КАХК. Как известно, калий играет важнейшую роль в физиологических процессах, и даже незначительные изменения в концентрации его ионов в крови или спино-мозговой жидкости приводят к весьма существенным патофизиологическим процессам, описываемых терминами гипокалиемия и гиперкалиемия.
В результате установлено, что ионы калия с наружной стороны клеточной мембраны играют важную роль в регулировании кальций-активируемых хлорных токов. Показана четкая зависимость амплитуды и потенциала реверсии хлорных токов от изменений концентрации наружного калия. Изменения в работе кальций-активируемых хлорных каналов существенно больше, чем изменения, оказываемые теми же концентрациями наружного калия на другие ионные каналы – натриевые или катионные (калиевые). Есть основания полагать, что изменение амплитуд хлорных токов вносит свой вклад в патофизиологические процессы, характерные для гипокалиемии и гиперкалиемии.
Исследования осуществляли электрофизиологическим методом на свежевыделенных нейронах Пуркинье из мозжечка (12–15 дней) мозга крыс самцов линии Вистар (n = 19). Выделение единичных нейронов проводили ферментно-механическим способом [10]. Трансмембранные токи отдельных нервных клеток регистрировали методом локальной фиксации потенциала (patch-clamp) в конфигурации на целой клетке (whole-cell) с помощью прибора EPC-9 (“HEKA”, Германия) [11]. Данные обрабатывали при помощи программы Pulsfit (“HEKA”, Германия).
В экспериментах использовали физиологический раствор, содержащий 140 мМ NaCl (140 мМ NaCl, 5 мМ KCl, 2 мМ MgCl2, 2 мМ CaCl2, HEPES 10 мМ, рН 7.36, осмолярность 305 мосм), в микропипетке–электроде – раствор, содержащий 140 мМ KCl (140 мМ KCl, 2 мМ MgCl2, 1 мМ CaCl2, EGTA 11 мМ, HEPES 10 мМ, K2ATP 5 мМ, рН 7.2, осмолярность 285 мосм).
РЕЗУЛЬТАТЫ
При потенциале фиксации –70 мВ в ответ на нарастающие ступени деполяризующих импульсов по +10 мВ регистрировались ионные токи от целой клетки, состоящие из токов положительной и отрицательной полярности (рис. 1а).
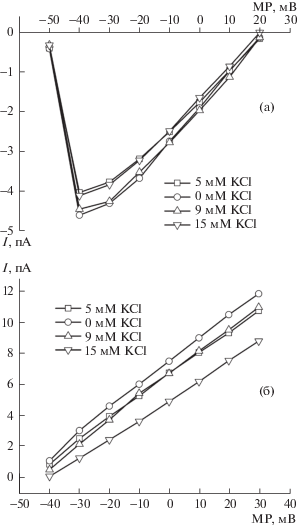
Рис. 1.
Влияние различных концентраций калия во внешнем растворе на амплитуду хлорных токов. а – Кривые записи токов при разных концентрациях калия (потенциал фиксации –70 мВ): 1–5 мМ, 2–0 мМ, 3–9 мМ, 4–15 мМ; б – графики амплитуды хлорных токов при различных концентрациях калия (потенциал фиксации –70 мВ). По оси ординат – величина тока в пА; по оси абсцисс – уровень мембранного потенциала в мВ.

Такие ответы соответствуют классическим представлениям: быстрый, входящий в клетку ток ионов натрия, вызывающий деполяризацию мембраны, и выходящие токи, переносимые ионами калия, компенсирующими деполяризацию на мембране.
По окончании каждого тестового импульса, в зависимости от ионных условий, можно было регистрировать небольшой ток, направленный “вверх” от базовой линии. Максимальная величина этого тока обычно не превышала 100–300 пА. При потенциале на мембране ниже –20 мВ этот ток реверсирует, приобретает входящее направление, однако его амплитуды не превышали 50–80 пА. В предыдущих исследованиях нами было показано, что этот ток является кальций-активируемым хлорным током [12–14]. Уменьшение наружной концентрации ионов калия вело к увеличению (или к появлению, в случае отсутствия при 5 мМ) этого выходящего тока, который достигал максимальных значений (до 1.8 нА) при 0 мМ калия (рис. 1а, 1б). Увеличение концентрации внешнего калия свыше 5 мМ вело к сдвигу потенциала реверсии тока в область –60 мВ на мембране клетки. При концентрации калия порядка 7 мМ происходила полная реверсия направления тока, который становился входящим. На графике видно, что амплитуда входящего тока увеличивалась значительно при увеличении калия до 9 мМ, а особенно она вырастала при увеличения калия до 15 мМ (рис. 1а, 1б). Было также установлено, что амплитуды и проводимость этого тока незначительно зависят от потенциала фиксации: при –40 мВ токи имели несколько большую амплитуду, чем при –70 мВ, а при –100 мВ токи были немного меньше, чем при –70 мВ.
В то же время влияние изменений в концентрации внешнего калия на входящие быстрые натриевые токи (рис. 2А) и на выходящие (преимущественно, калиевые) токи (рис. 2Б) было незначительным и не превышало 20%.
Рис. 2.
Влияние различных концентраций калия во внешнем растворе на амплитуду входящих и выходящих токов в нейронах Пуркинье. а – график зависимости амплитуды быстрых натриевых токов от концентрации калия (потенциал фиксации –70 мВ); б – график зависимости амплитуды выходящих (преимущественно, калиевых) токов от концентрации калия (потенциал фиксации –70 мВ).
Наши исследования показали, что изменения в концентрации внешнего калия приводят к существенному изменению амплитуды и проводимости хлорного тока через КАХК. Изменения в работе КАХК существенно больше, чем изменения, оказываемые теми же концентрациями наружного калия на другие ионные каналы – натриевые или катионные (калиевые). Это указывает на то, что калий осуществляет более избирательное действие на токи КАХК.
Полученные результаты свидетельствуют о том, что существует избирательное влияние некоторых экстраклеточных катионов и анионов на другие ионные каналы. Хорошо известным фактом является четкая зависимость активации целого ряда каналов – калиевых, хлорных и других – от концентрации внутриклеточного кальция. О влиянии каких-либо экстраклеточных ионов на каналы, проводящие отличные от них ионы, известно крайне мало.
Ранее нами показана зависимость быстрых натриевых токов в нейронах Пуркинье от концентрации наружного хлора [15]. Изложенные в этой статье (и ранее) результаты позволяют говорить о том, что наряду с внутриклеточной регуляцией кальцием в нейронах имеется значительное влияние ряда ключевых ионов – калия, хлора – на функционирование соседних каналов (и проводимых ими токах), осуществляемое ими с наружной стороны мембраны, т.е. концентрациями этих ионов в межклеточной (спиномозговой) жидкости.
Список литературы
Kunzelmann K., Tian Y., Martins J.R., Faria D., Kongsuphol P., Ousingsawat J., Thevenod F., Roussa E., Rock J., Schreiber R. // Pflugers Arch., 2011. V. 462. P. 195–208.
Kamaleddin M.A. // J. Cell Physiol., 2018. V. 233. P. 787–798.
Ji Q., Guo S., Wang X., Pang C., Zhan Y., Chen Y., An H. // J Cell Physiol. 2019. V. 234. P. 7856–7873.
Григорьев В.В. // Биомедицинская химия. 2021. Т. 67. № 1. С. 17–33.
Huang W.C., Xiao S., Huang F., Harfe B.D. et al. // Neuron. 2012. V. 12. № 74(1). P. 179–192.
Guo S., Chen Y., Pang C., Wang X., Qi J., Mo L., Zhang H., An H., Zhan Y. //
Yu K., Whitlock J.M., Lee K., Ortlund E.A., Cui Y.Y., Hartzell H.C. // Elife. 2015. V. 4. P. e06901.
Wang B., Li C., Huai R., Qu Z. // Journal of Molecular and Cellular Cardiology.
Crottès D., Jan L.Y. // Cell Calcium. 2019. V. 82. P. 102050.
Kaneda M., Nakamura H., Akaike N. // Neurosci.Res. 1988. V. 5. P. 299–315.
Hamill O.P., Marty A., Neher E., Sakmann B., Sigworth F.J. // Pflugers Arch. 1981. V. 391. P. 85–100.
Вихарева Е.А., Замойский В.Л., Григорьев В.В., Бачурин C.O. // ДАН, 2015. Т. 465, С. 372–374.
Вихарева Е.А., Замойский В.Л., Григорьев В.В. // БЭБМ, 2016. Т. 162, С. 672–677.
Замойский В.Л., Вихарева Е.А., Григорьев В.В., Бачурин С.О. // ДАН, 2016. Т. 470. С. 347–349.
Замойский В.Л., Григорьев В.В. // ДАН, 2017. Т. 477. С. 493–495.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


