Доклады Российской академии наук. Науки о жизни, 2021, T. 501, № 1, стр. 543-546
ОСОБЕННОСТИ ИММУНОГЕМАТОЛОГИЧЕСКИХ ПАРАМЕТРОВ ПЕРЕЛЕТНОГО (Vespertilio murinus Linnaeus, 1758) И ОСЕДЛОГО (Myotis dasycneme Boie, 1825) ВИДОВ РУКОКРЫЛЫХ ФАУНЫ УРАЛА
Л. А. Ковальчук 1, *, В. А. Мищенко 1, Л. В. Черная 1, академик РАН В. Н. Большаков 1
1 Федеральное государственное бюджетное учреждение науки Институт экологии растений и животных Уральского отделения Российской академии наук
Екатеринбург, Россия
* E-mail: kovalchuk@ipae.uran.ru
Поступила в редакцию 19.08.2021
После доработки 03.09.2021
Принята к публикации 03.09.2021
Аннотация
Впервые представлены результаты сравнительного анализа гематологических параметров рукокрылых из природных популяций Уральского региона: у прудовой ночницы (Myotis dasycneme Boie, 1825) – оседлый вид и у двухцветного кожана (Vespertilio murinus Linnaeus, 1758) – перелетный вид. Показаны значимые различия по содержанию в крови лейкоцитов (р = 0.05), эритроцитов и тромбоцитов (р = 0.001) и установлены межвидовые различия в лейкограммах как по содержанию гранулоцитов (р = 0.04), так и агранулоцитов (р = 0.05). Для мигрирующих V. murinus характерен значительный вклад неспецифической защитной системы крови (54.9%) в адаптивные реакции организма. У прудовой ночницы выраженный лимфоцитарный профиль (58.5%) свидетельствует об активации приобретенного адаптивного иммунитета. Двухцветные кожаны в сравнении с прудовыми ночницами характеризуются более высоким уровнем врожденного иммунитета.
Изучение механизмов адаптации рукокрылых представляет особый интерес в связи с их уникальными биологическими характеристиками: приспособление к активному полету, сезонные миграции и впадение в зимнюю спячку, сопровождающееся физиологической гипотермией и состоянием торпора. Фауна летучих мышей Урала изучена достаточно полно [1]. Однако при значительном фактическом материале по их биологии и экологии основная информация о функциональных возможностях системы крови насекомоядных летучих мышей, обеспечивающих адаптивную стратегию оседлых и перелетных видов, явно ограничена [2–4].
Представленная статья посвящена проблемам формирования адаптивной стратегии летучих мышей в поддержании гомеостаза животных при воздействии перманентно изменяющихся факторов среды. Сравнительный анализ иммуногематологических параметров двух видов экологически контрастных насекомоядных летучих мышей из природных популяций Уральского региона: прудовой ночницы и двухцветного кожана проводится впервые.
Животные отловлены паутинными сетями в зонах массового обитания летних колоний на территории Челябинской области (55°00′55″ N, 60°09′30″ Е) в июле 2014 г. В качестве объектов исследования были взяты многочисленные и широко распространенные на Урале виды летучих мышей: двухцветный кожан Vespertilio murinus Linnaeus, 1758 (мезофильный перелетный вид) отловлен на побережье оз. Большой Кисегач, прудовая ночница Myotis dasycneme Boie, 1825 (бореальный оседлый и зимующий вид) – в окрестностях оз. Малое Миассово. Прудовая ночница в основном зимует в пещерах, начиная со второй половины сентября до начала мая при температурах от 0 до + 2оС в условиях чрезвычайно высокой влажности. Двухцветный кожан в мае месяце прилетает на Южный Урал в места выведения потомства, а во второй половине августа мигрирует на расстояние несколько тысяч километров в юго-западном направлении к местам зимовки [1]. Животных без признаков заболеваний доставляли в лабораторию в отдельных контейнерах в день отлова. Экспериментальные группы (n = 9) представлены сеголетками (subadultus). Содержание рукокрылых осуществляли согласно международным принципам Хельсинкской декларации [5].
Плазму получали центрифугированием крови в рефрижераторной ультрацентрифуге K-23D (Германия) в вакутайнерах “Bekton Dickinson ВР” (Великобритания) с ЭДТА в течение 15 мин при 3000 об/мин. Показатели периферической крови определяли на гематологическом анализаторе “BC-5800” (Mindray, Китай). Лейкоцитарную формулу подсчитывали в мазках крови, окрашенных по Романовскому-Гимзе (на 100 лейкоцитов). У экспериментальных животных исследовано 17 показателей периферической крови. Результаты обработаны с использованием пакета лицензионных прикладных программ “Statistica v. 10.0”. Метод главных компонент (PCA) реализован посредством статистической среды R (R 3.1.2, пакеты “Vegan” и “Ade4”) [6].
Исследование периферической крови показало, что у двухцветного кожана содержание эритроцитов в 1.6 раза выше, чем у прудовой ночницы (р = 0.001) (табл. 1), что при повышенной средней концентрации гемоглобина в эритроците, по-видимому, является отражением эффективного кислородного режима во время длительных перелетов. Этому способствует и уменьшение в крови среднего объема эритроцитов в 1.4 раза (р = 0.001), а также двукратное повышение количества тромбоцитов (р = 0.001) и тромбокрита (р = 0.02) в периферической крови перелетного вида в сравнении с показателями крови прудовых ночниц.
Таблица 1.
Показатели периферической крови летучих мышей. Среднее арифметическое ($X_{{M\,{\text{boot}}}}^{{}}$), ошибка среднего (SEboot) и доверительный интервал ([95% CIboot]) бутстреп-распределения
| Показатели | Прудовая ночница | Двухцветный кожан | p |
|---|---|---|---|
| Эритроциты (RBC), Т/л | 5.7 ± 0.4 [5.0–6.3] | 9.2 ± 0.6* [8.1–10.6] | 0.001 |
| Лейкоциты, Г/л | 3.3 ± 0.5 [2.4–4.4] | 5.9 ± 0.8* [4.1–7.6] | 0.05 |
| Гемоглобин (HGB), г/л | 101.5 ± 5.6 [89.8–110.5] | 127.1 ± 8.1 [111.8–142.8] | 0.08 |
| Гематокритный показатель (HCT), % | 29.9 ± 1.9 [25.6–32.9] | 33.3 ± 1.5 [30.6–36.5] | 0.29 |
| Средний объем эритроцита (MCV), фл | 52.3 ± 0.5 [51.6–53.4] | 36.8 ± 1.1* [34.7–39.1] | 0.001 |
| Среднее содержание гемоглобина в эритроците (MCH), пг | 17.8 ± 0.2 [17.4–18.2] | 13.9 ± 0.4* [13.2–14.8] | 0.001 |
| Средняя концентрация гемоглобина в эритроците (MCHC), г/л | 340.9 ± 4.7 [333.0–350.3] | 379.5 ± 7.3* [365.0–394.2] | 0.001 |
| Тромбоциты (PLT), г/л | 213.1 ± 28.0 [160.5–265.5] | 476.3 ± 26.1* [421.2–522.0] | 0.001 |
| Средний объем тромбоцитов (MPV), фл | 6.6 ± 0.1 [6.4–6.9] | 5.2 ± 0.2* [4.8–5.5] | 0.001 |
| Тромбокрит (PCT), % | 0.1 ± 0.0 [0.1–0.2] | 0.3 ± 0.0* [0.2–0.3] | 0.02 |
Исследователи рассматривают активацию тромбоцитопоэза при физических нагрузках, действии низких температур и гипоксии, воздействии антропогенных, биотических стресс-факторов в качестве эффекторов иммунной системы [7]. Тромбоциты, участвуя в иммунных и аллергических реакциях наряду с макрофагами, нейтрофилами и эозинофилами, формируют первую линию защиты организма от патогенов. У двухцветного кожана в сравнении с прудовой ночницей содержание лейкоцитов превышает в 1.8 раза (р = 0.05) (табл. 1). Лейкоциты поддерживают гомеостаз, формируя кровяной и тканевой барьеры против микробной, вирусной и паразитарной инфекций.
Метод главных компонент (РСА) позволил визуализировать видовую изменчивость показателей периферической крови двухцветного кожана и прудовой ночницы (рис. 1). Анализ показал, что 77.95% общей дисперсии параметров красной крови и тромбоцитов приходится на первую главную компоненту (РС1) и 12.63% – на вторую (РС2). Наибольший вклад в межвидовую изменчивость показателей красной крови по РС1 вносят эритроциты (13.49%), средний объем эритроцита (13.01%), тромбоциты (12.99%), тромбокрит (12.17%), среднее содержание гемоглобина (11.88%), а их значимые коэффициенты корреляции с РС1 составляют –0.97, –0.96, –0.95, –0.92, 0.91 – соответственно (р = 0.001).
Рис. 1.
Показатели красной крови двух видов летучих мышей в пространстве первых двух главных компонент. PC1, PC2 – оси главных компонент, % – процент дисперсии данных, объясненных главной компонентой; стрелки отражают корреляцию главных компонент с исходными показателями; эллипсы представляют собой 95% доверительные области; ПН – прудовая ночница, ДК – двухцветный кожан.
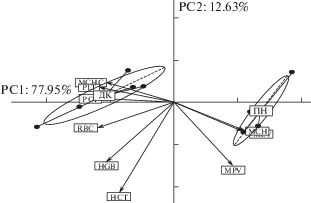
Первая главная компонента по этим переменным четко выделяет в самостоятельные группы оседлый (ПН) и перелетный (ДК) виды (рис. 1). Вторая главная компонента РС2 сильно коррелирует (–0.70) с гематокритным показателем (вклад 43.20%), и в меньшей степени – с гемоглобином (вклад 18.86%), что также подтверждает неоднородность особей исследованных двух экологически контрастных видов по данным показателям.
Лейкоцитарный состав крови рукокрылых представлен гранулоцитами (нейтрофилы: юные, палочкоядерные, сегментоядерные и эозинофилы) и агранулоцитами (моноциты и лимфоциты) (табл. 2).
Таблица 2.
Лейкоцитарный состав периферической крови летучих мышей. Среднее арифметическое ($X_{{M\,{\text{boot}}}}^{{}}$), ошибка среднего (SEboot) и доверительный интервал ([95% CIboot]) бутстреп-распределения
| Показатели | Прудовая ночница | Двухцветный кожан | p |
|---|---|---|---|
| Нейтрофилы, % | 39.8 ± 1.4 [37.0–42.5] | 54.0 ± 3.3* [47.2–60.2] | 0.01 |
| • юные, % | 2.5 ± 1.1 [0.5–4.8] | 8.0 ± 1.3* [5.2–10.4] | 0.05 |
| • палочкоядерные, % | 26.0 ± 3.2 [18.8–30.0] | 24.6 ± 3.0 [18.8–30.6] | 0.77 |
| • сегментоядерные, % | 11.2 ± 2.9 [6.0–16.8] | 21.4 ± 2.5* [17.6–27.0] | 0.05 |
| Лимфоциты, % | 56.0 ± 1.8 [52.3-59.0] | 43.4 ± 3.1* [37.6–49.2] | 0.04 |
| Моноциты, % | 2.5 ± 0.8 [0.8–3.8] | 1.6 ± 0.8 [0.4–3.4] | 0.38 |
| Эозинофилы, % | 1.3 ± 0.4 [0.5–2.0] | 1.0 ± 0.3 [0.4–1.6] | 0.39 |
| Гранулоциты, % | 41.0 ± 1.8 [37.5–44.5] | 54.9 ± 3.4* [48.0–61.4] | 0.04 |
| Агранулоциты, % | 58.5 ± 2.1 [54.5–62.5] | 44.9±3.5* [38.6–52.0] | 0.05 |
Лимфоциты, как основа гуморального иммунитета, ограничивают распространение инфекций, участвуя в адекватном иммунологическом ответе организма [8]. У оседлого вида M. dasycneme следует отметить высокое содержание лимфоцитов (56.0%), обеспечивающих значительную эффективность клеточного иммунитета (р = 0.04). Показательна активная неспецифическая защита организма от токсических воздействий, вирусных и бактериальных инфекций у перелетного вида – двухцветного кожана, что обеспечивается повышенным уровнем нейтрофилов (р = 0.01) (табл. 2).
Межвидовых различий в лейкограммах исследуемых животных как по содержанию моноцитов (р = 0.38), так и по содержанию эозинофилов (р = 0.39) не выявлено, что свидетельствует об идентичности адаптивных механизмов исследуемых широкораспространенных видов рукокрылых уральской фауны. Известно, что моноциты, выполняя фагоцитарную роль, продуцируют эндогенные регуляторы иммунного ответа – провоспалительные цитокины [7, 9]. Эозинофилы, активно циркулирующие в крови у прудовой ночницы и у двухцветного кожана, обеспечивают противогельминтную иммунную защиту организма. Необходимо отметить, что у летучих мышей, как и у всех позвоночных, лейкоцитарные клетки периферической крови ответственны за проявление реакций врожденного (естественного) иммунитета, так и адаптивного (приобретенного) иммунного ответа [8, 9].
Показаны значимые межвидовые различия летучих мышей по содержанию гранулоцитов и агранулоцитов, отражающих взаимосвязь эффекторных механизмов иммунной системы животных. В лимфоцитарно-гранулоцитарном составе периферической крови прудовой ночницы преобладают агранулоциты (58.5%), обеспечивающие иммунный надзор и специфическую реактивность организма (адаптивный иммунитет). У мигрирующего двухцветного кожана преобладают гранулоциты (54.9%), формирующие неспецифическую линию защиты при активации естественного врожденного иммунитета. Именно эта врожденная иммунная система защиты быстрее и эффективнее реагирует на широкий спектр биотических и абиотических факторов среды обитания по сравнению с адаптивными приобретенными ответами. Мигрирующие двухцветные кожаны характеризуются более высоким уровнем врожденного иммунитета в сравнении с прудовой ночницей.
Таким образом, результаты проведенных исследований позволяют впервые оценить гематологические параметры двухцветного кожана и прудовой ночницы, иллюстрируя видовую специфику эффекторных механизмов иммунной системы животных, обусловленную в свою очередь эколого-физиологическими особенностями оседлых и перелетных видов летучих мышей из природных популяций Уральского региона.
Список литературы
Большаков В.Н., Орлов О.Л., Снитько В.П. Летучие мыши Урала. Екатеринбург, 2005.
Kovalchuk L., Mishchenko V., Chernaya L., et al. Haematological parameters of pond bats (Myotis dasycneme Boie, 1825, Chiroptera: Vespertilionidae) in the Ural Mountains // J. Zoology and Ecology. 2017. V. 27. № 2. P. 168–175.
Узенбаева Л.Б., Кижина А.Г., Илюха В.А., и др. Морфология и состав клеток периферической крови при спячке у летучих мышей (Chiroptera, Vespertilionidae) северо-запада России // Известия РАН. Серия Биологическая. 2019. № 4. С. 419–428.
Mishchenko V.A., Kovalchuk L.A., Bolshakov V.N., et al. Comparative Analysis of the Amino Acid Spectrum of Blood Plasma in Chiroptera (Vespertilio murinus L., 1758 and Myotis dasycneme B., 1825) in the Fauna of the Ural Mountains // Doklady Biological Sciences. 2018. V. 481. № 6. P. 157–159.
Yarri D. The Ethics of Animal Experimentation. Oxford: Oxford Univercity Press. 2005.
Chessel D., Dufour A.B., Thioulouse J. The ade 4 package-I: One-table methods // R News. 2004. № 4. P. 5–10.
Черешнев В.А., Шмагель К.В. Иммунология. М.: изд-во Центр стратегического партнерства, 2014.
Davis F.R., Maney D.L., Maers J.C. The use of leukocyte profiles to measure stress in vertebrates: a review for ecologists // Functional Ecology. 2008. V. 22. P. 760–772.
Coico R., Sunshine G., Benjamini E. Immunology. A Short Course. Hoboken, NJ: Wiley-Liss Publications. 2003.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


