Доклады Российской академии наук. Науки о жизни, 2021, T. 501, № 1, стр. 532-537
АКТИВНОСТЬ NA+/K+-АТФАЗЫ У СМОЛТОВ ГОРБУШИ ONCORHYNCHUS GORBUSCHA (WALBAUM, 1792) БАССЕЙНА БЕЛОГО МОРЯ ПРИ СОДЕРЖАНИИ В САДКАХ С ПРЕСНОЙ, ЭСТУАРНОЙ И МОРСКОЙ ВОДОЙ
Е. И. Кяйвяряйнен 1, Н. Л. Рендаков 1, *, Д. А. Ефремов 1, член-корреспондент РАН Н. Н. Немова 1
1 Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр Российской академии наук”
Петрозаводск, Россия
* E-mail: nlrend@mail.ru
Поступила в редакцию 10.08.2021
После доработки 30.08.2021
Принята к публикации 30.08.2021
Аннотация
В 10-дневном садковом эксперименте с пресной, эстуарной и морской водой получены данные об изменении активности Na+/K+-АТФазы (NKA) у сеголеток горбуши Oncorhynchus gorbuscha (интродуцированного в 1959 г. в реки Кольского полуострова вида лососевых рыб), отловленных во время покатной миграции в р. Индера бассейна Белого моря. Развитие устойчивости к повышенной солености среды у смолтов горбуши сопровождается активацией NKA. Так, в эстуарной воде с колебаниями солености (от пресной до морской) и в морской среде (28 ‰) активность NKA у мальков горбуши была достоверно выше, чем у особей, содержавшихся в садках с пресной водой. Полученные результаты, характеризующие гипоосморегуляторную способность мальков горбуши, указывают на то, что становление смолтификации у этого вида рыб наблюдается в раннем онтогенезе. Результаты изменения активности NKA свидетельствуют о готовности мигрирующих мальков горбуши к морской фазе жизненного цикла.
ВВЕДЕНИЕ
Жизненный цикл лососевых рыб начинается в пресной воде, причем у анадромных форм молодь рыб совершает покатную миграцию в морскую среду, проходя стадию смолтификации. Смолтификация – генетически запрограммированный процесс, в ходе которого молодь лососевых рыб, обитая еще в пресной воде, физиологически готовится к переходу в морскую среду, что предотвращает нарушения ионного обмена при жизни в гиперосмотической среде [1]. При этом у рыб происходят заметные поведенческие, морфологические и биохимические изменения. У различных представителей тихоокеанских лососей (род Oncorhynchus) смолтификация происходит в разном возрасте. Так, например, виды со сравнительно поздней смолтификацией, к которым относятся нерка (O. nerka), кижуч (O. kisutch) и чавыча (О. tshawytscha), после выклева могут провести в реке от одного года до нескольких лет и не совершают покатную миграцию, пока не достигнут размера 12–15 см [2]. У видов с ранней смолтификацией – у горбуши (O. gorbuscha) и кеты (O. keta) – личинки становятся устойчивыми к морской воде всего через несколько недель после вылупления [2], еще до полной резорбции желточного мешка [3], что позволяет им вскоре мигрировать в эстуарную зону. В отличие от лососевых с поздней смолтификацией покатная миграция у горбуши и кеты начинается при малых размерах (3–5 cм) [2]. Мальки горбуши могут задерживаться в эстуариях, чтобы снизить степень осмотического стресса и обеспечить таким образом постепенность адаптации к морской среде. Скатившиеся в море мальки горбуши обычно проводят в прибрежной зоне от нескольких недель до месяца [4].
Эксперименты показывают, что из всех представителей семейства лососевых только молодь горбуши и кеты обладает устойчивостью к резким изменениям солености. Так, в исследованиях Вейсбарта (Weisbart) [5], в которых проводили резкое перемещение мальков пяти видов тихоокеанских лососей (O. gorbuscha, O. keta, O. kisutch, O. tshawytscha, O. nerka) из пресной в морскую воду (31.8 ‰), показано, что регуляция ионного состава крови у молоди горбуши и кеты осуществляется лучше по сравнению с молодью других представителей рода Oncorhynchus. Более того, после резорбции желточного мешка мальки горбуши и кеты уже не погибают при длительном выдерживании в морской воде, т.е. проявляют эвригалинность. Это может быть связано с тем, что горбуша и кета часто нерестятся в низовьях рек, недалеко от моря [5, 6]. Поскольку горбуша и кета проводят в морской воде большую часть своего жизненного цикла, эти виды считают наиболее “морскими” (“marine-like”) видами лососей [7]. Это находит отражение и в их крайнем положении на “шкале анадромии” [2].
Известно, что в жабрах эвригалинных рыб после перемещения из пресной воды в морскую адаптивно увеличивается активность Na+/K+-АТФазы (NKA), фермента, участвующего в процессах осморегуляции [8]. В жабрах рыб NKA локализуется в основном в базолатеральных мембранах ионоцитов и состоит из субъединиц, по-разному реагирующих на осмотические изменения и акклимацию к солености [9, 10]. Так, субъединица α1a NKA лососевых преимущественно экспрессируется в пресной воде, а α1b – в морской [9, 11]. Подготовительная адаптация, приводящая к повышению устойчивости мигрирующих рыб к соленой воде, контролируется генетически [12]. В связи с этим повышение активности NKA в жабрах смолтов лососевых рыб происходит сезонно и синхронно с миграцией [2, 3]. После миграции в морскую среду активность NKA увеличивается повторно, что соответствует второй фазе смолтификации [3, 13].
Осморегуляторная роль NKA у разных видов рыб была в основном изучена у взрослых особей, тогда как в нашей работе рассматривается значение этого фермента при адаптации к эстуарной и морской воде бассейна Белого моря у мальков горбуши. Следует отметить, что исследования, проведенные на данном объекте, немногочисленны и выполнены в искусственных условиях выращивания [14]. В данной работе проведено сравнительное исследование изменения уровня активности NKA у совершающих покатную миграцию мальков (смолтов) горбуши при выдерживании в садках с пресной, эстуарной и морской водой (в условиях Белого моря). Кроме того, изучена устойчивость мальков горбуши к воздействию соленой воды в течение относительно длительного времени (10 сут).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
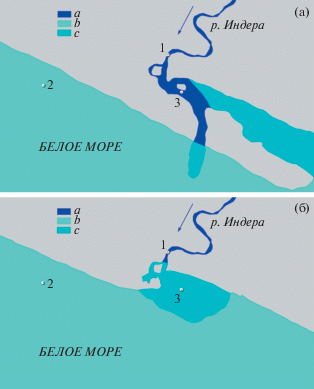
В середине июня 2019 г. в реке Индера (бассейн Белого моря) малой ловушкой мережного типа было отловлено 100 мальков горбуши (рис. 1). Эксперимент был проведен с мальками, имевшими серебристую окраску, без остатков желточного мешка, собранными во время покатной миграции. Мальки были разделены на 4 группы, по 25 особей в каждой.
Рис. 1.
Расположение экспериментальных садков в районе устья реки Индера. а – во время отлива, б – во время прилива.
Примечание: 1 – место отлова мальков и садок “река”; 2 – садок “море”; 3 – садок “эстуарий”; a – пресная вода; b – соленая вода; c – распресненная вода; серым цветом показана суша.
Особи первой (исходной) группы были сразу зафиксированы в жидком азоте.
Рыбы второй группы были помещены в русловой садок в пресной воде (садок “река”), который был на 60% погружен в воду (скорость течения – 0.3–0.4 м/с) при температуре 8.8°С. Этот садок был расположен рядом с местом отлова мальков.
Третью группу мальков в начале эксперимента поместили в садок, расположенный в эстуарии (садок “эстуарий”). Садок был погружен в воду на расстоянии 0.4–0.5 м от дна. В зависимости от направления ветра и локального течения вода в садке была или соленая, или распресненная. Цикл приливов и отливов имел околосуточную периодичность, при этом во время полного прилива садок находился в соленой воде (дважды в сутки), а во время полного отлива – в распресненной (тоже дважды в сутки). Во время прилива вода становилась холоднее, а во время отлива – теплее (амплитуда до 10°С), так как пресная вода прогревалась быстрее, а соленая – медленнее. Особи горбуши третьей группы были извлечены из садка во время отлива. При отливе садок находился в потоке пресной воды (скорость потока 0.3–0.4 м/с), погруженный в нее на 50%. Температура воды при размещении садка в воде – 8.8°С.
Четвертую группу мальков поместили в морской садок (садок “море”) с соленостью воды 28‰ (постоянная) и с температурой 3.9°С. Мальков предварительно выдерживали 1 ч в смеси пресной и морской воды (1:1) и еще 1 ч – в 100%-й морской воде. Это было сделано, чтобы имитировать естественный, плавный переход в морскую воду и тем самым облегчить адаптацию. Кроме того, содержание в первые 2 ч под наблюдением в гиперосмотической среде требовалось, чтобы проверить, не будет ли при этом немедленной гибели мальков. Морской садок находился на расстоянии 400 м от берега, где глубина моря достигала 4–5 м, на расстоянии 1 м от дна, на растяжках. Во время приливов и отливов садок был полностью погружен в воду. Температура воды, которая наблюдалась во время отбора мальков в каждой из групп, указана в таблице.
Садки имели кубическую форму, их размеры составляли 0.5 × 0.5 × 0.5 м3. Устройство садка: на каркас из нержавеющих прутов натянута сеть “дель хамсарос” с размером ячеи 5 мм. Для запуска и выпуска рыбы на одной из граней садка имеется рукав диаметром 10 см, снабженный синтетическим шнуром для затягивания. К четырем вершинам одной из граней садка прикреплены 4 шнура длиной по 2 м. К концам шнуров в качестве груза были привязаны камни.
Время содержания в садках для второй, третьей и четвертой групп составило около 10 дней (226 ч). Гибели мальков в ходе эксперимента не наблюдали. Все мальки были зафиксированы в жидком азоте (в первой группе – сразу, в остальных – по окончании эксперимента), а затем хранились в лаборатории при –80°С до начала биохимического анализа.
После разморозки особей перед началом проведения биохимических исследований производили их измерение и взвешивание. Размерно-весовые характеристики исследованных рыб представлены в табл. 1.
Таблица 1.
Длина и масса мальков горбуши в садковом эксперименте
| Группы | t воды в день взятия материала, оС | TL, см | m, г |
|---|---|---|---|
| Исходная | 8.8 | 3.35 ± 0.06 | 0.17 ± 0.01 |
| Садок “река” | 14.5 | 3.53 ± 0.03 | 0.16 ± 0.01 |
| Садок “эстуарий” | 18.1 | 3.51 ± 0.05 | 0.19 ± 0.01 |
| Садок “море” | 11.5 | 3.41 ± 0.02 | 0.17 ± 0.01 |
Активность Na+/K+-АТФазы (КФ 3.6.1.3) определяли согласно методике [15]. В нашем эксперименте были исследованы цельные особи мальков, которые характеризовались сравнительно небольшой массой тела (<0.2 г.), резорбированным желточным мешком и жабрами. Ионо- и осморегуляция у взрослых рыб осуществляется в жабрах, почках и кишечнике, при этом у взрослых рыб – в основном в жабрах, которые непосредственно контактируют с внешней средой и обеспечивают большую часть трансэпителиального ионного обмена [16]. Окончательная дифференцировка жабр горбуши происходит в раннем онтогенезе между выклевом и завершением резорбции желточного мешка [14].
РЕЗУЛЬТАТЫ
Исследования были проведены в естественных условиях без моделирования конкретных показателей, таких как температура и соленость, влияющих на активность NKA. Активность данного фермента у мальков горбуши, отобранных из разных садков, возрастает в соответствии с ростом солености воды в ряду “река” → “эстуарий” → “море” (рис. 2). В ходе эксперимента в различных садках температура по-разному изменялась относительно исходного значения 8.8°C (табл. 1).
Рис. 2.
Активность NKA у смолтов горбуши в садковом эксперименте. Время экспозиции в отдельных садках – 10 сут. Межгрупповые различия оценивали с помощью критерия Вилкоксона−Манна−Уитни. ♦ – p < 0.05 при сравнении с исходной группой, ♦♦ – p < 0.01 при сравнении с исходной группой, * – p < 0.05 при сравнении с группой садок “река”, ** – p < 0.01 при сравнении с группой садок “река”, ○ – p < 0.05 при сравнении с группой садок “эстуарий”.
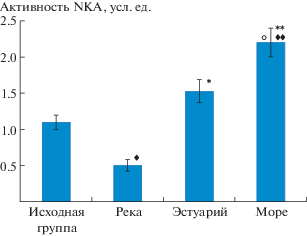
После выдерживания в течение 10 сут в садке “река” активность NKA у мальков горбуши была вдвое ниже, чем у рыб в исходной группе, отловленных из реки Индера. В садке “эстуарий” отмечены значительные периодические колебания как температуры (от 8.8°C до 18.1°С), так и солености воды (от морской до пресной). Содержание мальков в садке “эстуарий” привело к увеличению активности NKA в 3 раза по сравнению с таковой в садке “река” и в 1.4 раза по сравнению с исходной группой.
Выдерживание горбуши в садке “море” привело к еще более значительному увеличению активности NKA, при этом данный показатель увеличился в 2 раза по сравнению с исходными данными, более чем в 4 раза по сравнению с таковым у смолтов, содержавшихся в садке “река”, и в 1.5 раза по сравнению с уровнем активности NKA у смолтов из садка “эстуарий”.
ОБСУЖДЕНИЕ
Ранее на личинках горбуши из нативных популяций Северной Америки было показано, что при завершении резорбции желточного мешка сеголетки-личинки горбуши становятся смолтами [3, 14]. Такие сопутствующие признаки, как отсутствие желточного мешка, приобретение серебристой окраски, а также достижение размера 3 см позволяют предполагать, что исследованные нами личинки горбуши являются смолтами.
В дикой природе одними из важнейших факторов, определяющих рост и развитие смолтов, являются соленость и температура внешней среды. Изменение активности NKA в обсуждаемом эксперименте, по-видимому, обусловлено обоими указанными факторами. Активность NKA в жабрах обычно увеличивается после акклимации к низкой температуре [12]. Именно этим может объясняться снижение активности NKA по сравнению с исходными данными у смолтов горбуши через 10 сут после выдерживания в садке “река” в условиях увеличения температуры и неизменной солености. Стимулируемое холодом усиление активности NKA в осморегуляторных тканях может быть полезным для поддержания эффективной осморегуляции в термодинамически неблагоприятных условиях [17]. Влияние солености и температуры на активность NKA является разнонаправленным, и в комбинации экологических факторов “соленость–температура” в условиях дикой природы более сильное воздействие, по-видимому, оказывает соленость (рис. 2).
Обнаруженное в эксперименте повышение NKA у смолтов горбуши, отобранных в р. Индера и содержавшихся в садках с морской водой с соленостью 28 ‰ в течение 10 сут, вероятно, связано с тем, что в организме мальков происходит вторичное (в отличие от первичного, которое происходит еще в пресной воде после выхода рыб из гравийных нерестовых гнезд) увеличение активности NKA, соответствующее второй фазе смолтификации [3, 13]. Подобное повышение NKA в жабрах горбуши из тихоокеанского бассейна Канады наблюдали во время второй фазы адаптации смолтов к морской среде [13], при этом пик активности фермента был отмечен через 8 нед после переноса в морскую среду. У других эвригалинных рыб активность NKA также в большинстве случаев адаптивно увеличивается при повышении солености окружающей среды [8]. Уровень активности NKA у молоди лососевых может быть связан с дифференциальной экспрессией изоформ NKA [2]. Ранее было показано, что в морской воде у личинок горбуши с резорбированным желточным мешком активность NKA в жабрах повышалась в 1.5 раза, а соотношение экспрессии мРНК изоформ α1b/α1a (т.е. морской к пресноводной) увеличивалось в шесть раз [18]. Личинки горбуши, которые обычно скатываются в морскую воду во время выхода из гравийного гнезда и резорбции желточного мешка, адаптированы к обитанию в морской воде, однако непосредственное влияние морской воды приводит к усилению гипоосморегуляторной функции у смолтов горбуши [3, 13].
Полученные в нашем исследовании данные о повышении (по сравнению с особями из пресной и эстуарной воды) активности NKA у мальков горбуши, выдерживаемых в морской воде (рис. 2), согласуются с результатами, полученными в эксперименте на радужной форели [9], в котором было обнаружено увеличение активности NKA на 10-е сутки после переноса рыб в 80%-ную морскую воду, хотя после их переноса в разбавленную до 40% морскую воду изменений в активности фермента не наблюдали.
Разбавленная морская вода может обеспечить некоторую, хотя и не полную, защиту смолтов горбуши от сильного осмотического стресса в морской среде. Смолты горбуши могут использовать зону эстуария в устье реки, задерживаясь в ней, чтобы уменьшить осморегуляторную нагрузку в морской среде и тем самым предотвратить резкое изменение физиологического состояния. Кроме того, зона эстуария важна для смолтов как область кормодобывания, быстрого роста и защиты от хищников [6]. В воде эстуария наблюдаются периодические колебания солености воды. Вследствие этого мальки горбуши, обитающие в данной среде, должны быть готовы как к увеличению солености воды (во время приливов), так и к ее снижению (во время отливов). Поэтому обнаруженные в исследовании промежуточные (между таковыми, характерными для морской и пресной воды) значения активности NKA у смолтов горбуши из эстуария отражают адаптивные изменения, направленные на сведение к минимуму осмотического воздействия высоких (“морских”) концентраций соли, что способствует благополучной миграции горбуши через эстуарий в море. Следует отметить, что в проведенных экспериментах по воздействию на смолтов горбуши воды различной солености (пресной, эстуарной, морской) гибели мальков не было отмечено, что также дает основание полагать, что они хорошо адаптированы к резким изменениям солености.
Таким образом, результаты исследования на мальках горбуши, интродуцированной в реки Кольского полуострова, а также данные, полученные другими авторами на горбуше из прибрежных вод западной Канады [3, 13], указывают на то, что устойчивость мальков горбуши в естественных условиях к изменению экологических факторов (солености и температуры) при переносе из пресной воды в эстуарную и морскую связана с изменением активности NKA, что обеспечивает эффективное поддержание водно-солевого обмена и 100%-ю выживаемость. Для сравнения следует заметить, например, что резкое перемещение в морскую воду пестряток-годовиков кумжи (вида с поздней смолтификацией) приводит к их гибели из-за осмотического стресса [2]. Можно полагать, что в комбинации экологических факторов “соленость-температура” в условиях дикой природы более сильное воздействие на активность NKA оказывает соленость. Данные об осморегуляторной адаптации с участием NKA у молоди горбуши в 10-суточном садковом эксперименте свидетельствуют о том, что смолтификация у нее наблюдается в раннем онтогенезе, при переходе в стадию мальков.
Список литературы
McCormick S.D., Hansen L.P., Quinn T.P., et al. Movement, migration, and smolting of Atlantic salmon (Salmo salar) // Can. J. Fish. Aquat. Sci. 1998. V. 55. № S1. P. 77–92.
McCormick S.D. Smolt physiology and endocrinology // Euryhaline fishes. Elsevier: Academic Press, 2013. P. 199–251.
Gallagher Z.S., Bystriansky J.S., Farrell A.P., et al. A novel pattern of smoltification in the most anadromous salmonid: pink salmon (Oncorhynchus gorbuscha) // Can. J. Fish. Aquat. Sci. / ed. Jonsson B. 2013. V. 70. № 3. P. 349–357.
Алтухов Ю.П., Салменкова Е.А., Омельченко В.Т. Популяционная генетика лососевых рыб. Москва: Наука, 1997. 288 с.
Weisbart M. Osmotic and ionic regulation in embryos, alevins, and fry of the five species of Pacific salmon // Can. J. Zool. 1968. V. 46. № 3. P. 385–397.
Thorpe J.E. Salmonid fishes and the estuarine environment // Estuaries. 1994. V. 17. № 1. P. 76–93.
Nelson J.S., Grande T.C., Wilson M.V.H. Fishes of the World. Hoboken, NJ, USA: John Wiley & Sons, Inc, 2016. 707 p.
Judd S. Na+/K+-ATPase isoform regulation in three-spine stickleback (Gasterosteus aculeatus) during salinity acclimation // A Thesis Degree Master Sci. DePaul University, Chicago, Illinois, 2012. 91 p.
Richards J.G., Semple J.W., Bystriansky J.S., et al. Na+/K+-ATPase α-isoform switching in gills of rainbow trout (Oncorhynchus mykiss) during salinity transfer // J. Exp. Biol. 2003. V. 206. Pt. 24. P. 4475–4486.
Madsen S.S., Kiilerich P., Tipsmark C.K. Multiplicity of expression of Na+,K+-ATPase α-subunit isoforms in the gill of Atlantic salmon (Salmo salar): cellular localisation and absolute quantification in response to salinity change // J. Exp. Biol. 2009. V. 212. № 1. P. 78–88.
McCormick S.D., Regish A.M., Christensen A.K. Distinct freshwater and seawater isoforms of Na+/K+-ATPase in gill chloride cells of Atlantic salmon // J. Exp. Biol. 2009. V. 212. № 24. P. 3994–4001.
McCormick S.D. Hormonal control of gill Na+,K+-ATPase and chloride cell function // Cell. Mol. Approaches to Fish Ion. Regul. San Diego: Academic Press, 1995. P. 285–315.
Grant A., Gardner M., Nendick L., et al. Growth and ionoregulatory ontogeny of wild and hatchery-raised juvenile pink salmon (Oncorhynchus gorbuscha) // Can. J. Zool. 2009. V. 87. № 3. P. 221–228.
Sullivan C.V., Brewer S.D., Johnston G.P., et al. Plasma thyroid-hormone concentrations and gill (Na+K)-ATPase activities in postemergent pink salmon // Trans. Am. Fish. Soc. 1983. V. 112. № 6. P. 825–829.
Кяйвяряйнен Е.И., Немова Н.Н. Активность Na+/K+-АТФазы в различных органах стерляди (Acipenser ruthenus) при изменении факторов среды // Труды КарНЦ РАН. 2019. № 6. С. 27.
Yan J.-J., Hwang P.-P. Novel discoveries in acid-base regulation and osmoregulation: A review of selected hormonal actions in zebrafish and medaka // Gen. Comp. Endocrinol. 2019. V. 277. P. 20–29.
Ventrella V., Pagliarani A., Pirini M., et al. Lipid composition and microsomal ATPase activities in gills and kidneys of warm- and cold-acclimated sea bass (Dicentrarchus labrax L.) // Fish Physiol. Biochem. 1993. V. 12. № 4. P. 293–304.
Sackville M., Wilson J.M., Farrell A.P., et al. Water balance trumps ion balance for early marine survival of juvenile pink salmon (Oncorhynchus gorbuscha) // J. Comp. Physiol. B. 2012. V. 182. № 6. P. 781–792.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


