Доклады Российской академии наук. Науки о жизни, 2021, T. 501, № 1, стр. 528-531
ГЕН PIRAGUA НЕ ЯВЛЯЕТСЯ ВАЖНЫМ ДЛЯ РАЗВИТИЯ ДРОЗОФИЛЫ
В. В. Соколов 1, *, академик РАН П. Г. Георгиев 1, О. В. Кырчанова 1
1 Федеральное государственное бюджетное учреждение науки Институт биологии гена Российской академии наук (ИБГ РАН)
Москва, Россия
* E-mail: vladimir.sokolov.v.93@gmail.com
Поступила в редакцию 30.07.2021
После доработки 03.09.2021
Принята к публикации 03.09.2021
Аннотация
Белки с кластерами доменов цинковых пальцев С2Н2-типа (С2Н2-белки) являются наиболее обширным классом транскрипционных факторов высших эукариот. На N-конце большой группы С2Н2-белков членистоногих были найдены домены ZAD (zinc finger-associated domain), основной функцией которых является формирование гомодимеров. Одним из таких белков является белок Fu2, кодируемый геном piragua. С помощью метода CRISPR/Cas9 была получена делеция гена, не имеющая фенотипического проявления. С помощью φC31-зависимой attP/attB сайт-специфической интеграции была получена трансгенная линия, экспрессирующая белок Fu2 с НА эпитопом, что позволит в дальнейшем провести детальное исследование распределения сайтов связывания и функций белка.
ДНК-связывающие белки с кластерами доменов цинковые пальцы типа Cys2His2 (ZF-С2Н2) являются самой распространенной группой транскрипционных факторов у высших эукариот [1]. К этой группе относится хорошо описанный C2H2-белок млекопитающих, СTCF, который выполняет ключевую роль в формировании архитектуры хромосом [2]. У дрозофилы был описан его гомолог, dCTCF, а также ряд других С2Н2-белков, названных архитектурными, которые участвуют в формировании регуляторных элементов, и могут поддерживать специфичные дистанционные взаимодействия между ними [2, 3]. Обычно для специфичного связывания с мотивами из 12–15 пн архитектурные белки используют 4–5 ZF-С2Н2 [2]. У членистоногих значительная часть С2Н2-белков содержит на N-конце ZAD-домен, который обеспечивает гомодимеризацию [4, 5]. Белки с ZAD-доменами составляют примерно одну треть от общего числа С2Н2-белков и одну десятую часть от всех ТФ в геноме D. melanogaster [6]. К настоящему моменту изучены функции только небольшой части белков ZAD-С2Н2, большинство из которых экспрессируются в процессе оогенеза и в раннем эмбриогенезе [4].
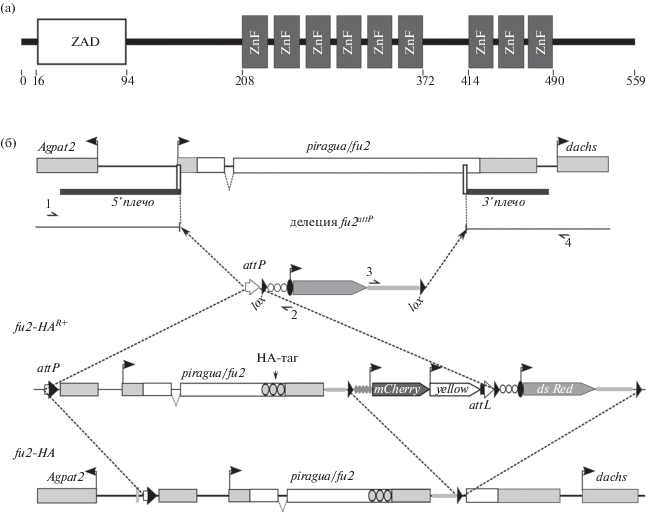
Ген piragua (другое название fu2, CG9233) кодирует ДНК-связывающий транскрипционный фактор Fu2, который содержит N-концевой ZAD-домен и два кластера доменов из 6 и 3 ZF-С2Н2, разделенных 40 аминокислотами [7] (рис. 1а).
Рис. 1.
Стратегия замены гена piragua на его тагированную копию. (a) Структура белка Fu2. ZAD-домен обозначен белым прямоугольником, цинковые пальцы типа С2Н2 (ZF) обозначены черными прямоугольниками. Цифрами обозначены координаты доменов в аминокислотах. (б) Схема геномного локуса piragua и получения линий fu2attPR+и fu2-HA. Кодирующие участки гена piragua обозначены белыми прямоугольниками, серыми прямоугольниками отмечены некодирующие участки генов. Черными флажками обозначены промоторы генов. Узкими вертикальными белыми прямоугольниками отмечены CRISPR-мишени. Черными горизонтальными прямоугольниками обозначены фрагменты, использованные в качестве плеч для гомологичной рекомбинации. Черным овалом обозначен промотор hsp70. Три белых кружка обозначают сайты связывания pax6. Белой, серой и темно-серой пятиугольной стрелкой обозначены соответственно маркерные гены yellow, dsRed и mCherry. Серой горизонтальной полоской обозначен терминатор SV40. Черными треугольниками обозначены lox-сайты. Белой горизонтальной стрелкой обозначен attP-сайт, комбинации белой и черной стрелок соответствуют рекомбинантным attP/attB. Серыми кругами обозначен промотор glass. Серыми кругами с черным контуром обозначен HA-таг. Черными полустрелками обозначены праймеры, использованные для проверки делеции: 1 – Fu2GRdir, 2 – H70rev, 3 – Sv40RT, 4 – Fu2GRr.
По структуре Fu2 можно отнести к классу архитектурных белков. Ранее с помощью мутагенеза, опосредованного мобилизацией Р-элемента, были получены мутации piragua, которые значительно снижали количество белка Fu2 и приводили к летальности на разных стадиях развития от эмбриогенеза до 1–2 стадии личинки [7]. Был сделан вывод, что Fu2 нужен в процессе формирования имагинальных дисков и кутикулы. Данные, полученные методом РНК-интерференции [8], указывают на роль данного белка в клеточной конкуренции, опосредованной flower. РНК-интерференция под контролем драйвера pnr приводила к нехватке щетинок, дефектам пигментации и куколочной смерти [9].
Основной целью настоящего исследования является делеция гена piragua, что позволит исследовать роль белка Fu2 in vivo и тагировать (т.е., получить линию мух, экспрессирующую белок, слитый с удобным для исследователя эпитопом) Fu2 для картирования его сайтов связывания. С этой целью был использован подход, который включает удаление гена piragua с заменой его на сайт attP с помощью системы CRISPR/Cas9 [11] и последующей φC31-зависимой attP/attB сайт-специфической интеграцией тагированной копии гена [12]. Гидовые РНК были выбраны с использованием “CRISPR optimal target finder” [12] таким образом, чтобы удалить последовательности всего гена, не затрагивая регуляторные области окружающих генов: 5' tcgatactatcgtggtagat – 2 пн от точки старта транскрипции гена piragua, и 3' ctgccgagggacgcactagc – в 94 пн (32 кодонах) ниже стоп-кодона (рис. 1б). Гидовые последовательности клонировали в плазмиду pCFD4-U6:1_U6:3tandemgRNAsplasmid (Addgene # 49411). В качестве основы для клонирования плазмиды-донора использовали вектор pHD-DsRed, полученный от K. O’Connor-Giles (Addgene no. 51434). Данный вектор содержит сайт attP и репортерный ген dsRed, фланкированный lox-сайтами. dsRed, кодирующий красный флуоресцентный белок, находится под минимальным промотором hsp70, усиленным тремя сайтами связывания белка pax6, который активирует промотор в глазах. После репортерного гена расположен терминатор SV40. В вектор были клонированы плечи для гомологической рекомбинации, которые амплифицировались путем ПЦР с геномной ДНК линии 58492 (Bloomington Drosophila Stock Center) с использованием следующих праймеров: Fu2 5'dir aagagctcgcagcatctgcagtgcaataaa – Fu2 5'rev cacgatagtatcgatatgtcg (734 п.н. фрагмент), и Fu2 3'dir aactcgaggaactgtcgttctacagcaac – Fu2 3'rev aagggccccttcttcgtatcggacaacgt (500 п.н. фрагмент) (рис. 1б).
Плазмиду для рекомбинации вместе с плазмидой, экспрессирующей гидовые РНК, инъецировали в эмбрионы линии 58492 из Bloomington Drosophila Stock Center. Развившихся мух скрещивали с линией y1w1; CyO/If. В потомстве были отобраны мухи по флуоресценции dsRed в глазах, их скрещивали с линией y1w1; CyO/If. В результате была получена линия с делецией размером 1770 пн, имеющей координаты: 2L:8464499..8466269 (6.40). Всего была получена 1 линия с сигналом dsRed. Полученную делецию, fu2attPR+, проверяли методом ПЦР с праймеров Fu2GRdir (ctgcgtaggcgtaacagttg) – H70rev (cgcttgtttatttgcttagc), и Fu2GRr (cgtacggggcgaactcaa) – sv40RT_2 (agccataccacatttgtagag) (рис. 1б). Делеция гена не влияет на пигментацию кутикулы, расположение и размер щетинок и волосков, форму тергитов и стернитов, размер и строение глаз и крыльев, фертильность и жизнеспособность самцов и самок. Это противоречит фенотипу мутации, полученной путем ремобилизации транспозонов [7], а также результатам, наблюдавшимся при РНК-интерференции под драйвером pnr [9]. Мы полагаем, что наблюдавшиеся авторами этих статей фенотипы являются артефактами использованных ими методов.
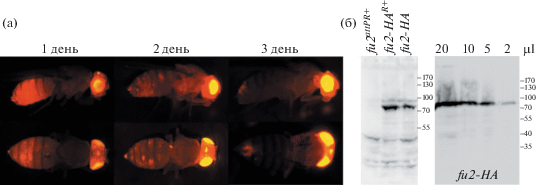
Так как экспрессия dsRed в полученной линии находится под контролем регуляторных элементов piragua, то сигнал dsRed должен отражать локализацию экспрессии piragua в организме. Оказалось, что репортер помимо глаз преимущественно активируется в задних брюшных сегментах (А2–А6), причем экспрессия затухает у взрослых мух в течение 3 дней (рис. 2а).
Рис. 2.
(а) Флуоресценция мух линии fu2attPR+. У молодых мух наблюдается интенсивная флуоресценция в 4 и следующих брюшных сегментах. Со временем она угасает, и остается слабая флуоресценция участка в 6–7 сегменте брюшка. Снимки получены на микроскопе Leica. (б) Экспрессия тагированного белка Fu2-HA. Слева показан вестерн-блот белковых экстрактов, выделенных из мух линий fu2attPR+, fu2-HAR+, fu2-HA, справа – вестерн-блот белкового экстракта, выделенного из эмбрионов линии fu2-HA.
Для тагирования Fu2 геномная область кодирующей части гена piragua была амплифицирована с праймеров Fu2 5'f Nhe tgtgctagctagggataacagggtaataggcctgcagtgcaataaattccactaaac – Fu2 5'r Xho aaactcgagctcgggacgagtctcgctgtag – для поднятия фрагмента, включающего промоторную и всю кодирующую область, и Fu2 3'Ud ggtctagaacaacatatttacatgtttaataag – Fu2 3'Ur gtgcggccgctgttggtctgagacgactgc – для поднятия 3'UTR. В рамку считывания гена piragua на 3'-конец перед 3'UTR был клонирован HA-таг. Для интеграции в геном полученной тагированной копии гена использовали описанный ранее вектор attB-glass-mCherry- mini-yellow [13]. Полученная плазмида была инъецирована в эмбрионы линии fu2attPR+ вместе со вспомогательной плазмидой, экспрессирующей интегразу φC31 [12]. Неожиданно оказалось, что репортер mini-yellow в геномном районе piragua не экспрессируется. Вследствие этого успешные интеграции отбирали на основе экспрессии репортера mCherry в глазах.
Успешность интеграции подтверждали ПЦР. Было отобрано 4 линии, fu2-HAR+. С помощью Cre-опосредованной рекомбинации по lox-сайтам все репортерные гены были удалены и получена линия fu2-HA (рис. 1б). Для подтверждения экспрессии тагированного белка были произведены вестерн-блоты с антителами к HA-тагу с лизатом из взрослых самок и из эмбрионов линии fu2-HA (рис. 2б). Белок преимущественно присутствует в эмбрионах, что соответствует доступным данным относительно экспрессии гена piragua [FlyBase, modENCODE Development RNA-Seq].
Таким образом, получена делеция гена piragua, fu2attPR+, которая не имеет мутантного фенотипа. Эти результаты предполагают, что функции белка Fu2 компенсируются другими архитектурными белками. Экспрессия dsRed в линии fu2attPR+ в задних брюшных сегментах молодых мух может указывать на сегмент-специфичную экспрессию данного белка и предполагает его функционирование в процессе формирования задних брюшных сегментов дрозофилы. Полученная платформа fu2attPR+ может быть использована в дальнейшем для изучения свойств белка Fu2 и его отдельных доменов. В настоящей работе была получена трансгенная линия, которая экспрессирует Fu2-HA, что позволит исследовать распределение сайтов связывания белка в эмбрионах дрозофилы и определить мотив, с которым связывается белок.
Список литературы
Федотова А.А., Бончук А.Н., Могила В.A., и др. Белки с цинковыми пальцами типа С2Н2 – самый многочисленный и наименее изученный класс транскрипционных факторов высших эукариот // Acta Naturae. 2017. Т. 9. № 2 (33). С. 50–61.
Maksimenko O.G., Fursenko D.V., Belova E.V. et al. CTCF As an Example of DNA-Binding Transcription Factors Containing Clusters of C2H2-Type Zinc Fingers // Acta Naturae. 2021. V. 13. № 1. P. 31–46.
Kyrchanova O., Georgiev P. Mechanisms of Enhancer-Promoter Interactions in Higher Eukaryotes // Int. J. Mol Sci. 2021. V. 22. № 2. C. 671.
Chung H.R., Lohr U., Jackle H. Lineage-specific expansion of the zinc finger associated domain ZAD // Mol. Biol. Evol. 2007. V. 24. № 9. P. 1934–1943.
Bonchuk A., Boyko K., Fedotova A., et al. Structural basis of diversity and homodimerization specificity of zinc-finger-associated domains in Drosophila. // Nucleic Acids Res 2021. V. 49. № 4. P. 2375–2389.
Chung H.R., Schafer U., Jackle H., et al. Genomic expansion and clustering of ZAD-containing C2H2 zinc-finger genes in Drosophila // EMBO Repts. 2002. V. 3. № 12. P. 1158–1162.
Nazario-Yepiz N.O., Riesgo-Escovar J.R. piragua encodes a zinc finger protein required for development in Drosophila // Mechanisms of Development. 2017. V. 144. № Pt B. P. 171–181.
Rhiner C., López-Gay J.M., Soldini D. et al. Flower forms an extracellular code that reveals the fitness of a cell to its neighbors in Drosophila // Developmental Cell. 2010. V. 18. P. 985–998.
Mummery-Widmer J.L., Yamazaki M., Stoeger T., et al. Genome-wide analysis of Notch signalling in Drosophila by transgenic RNAi // Nature. 2009. V. 458. № 7241. P. 987–992.
Zhang X., Koolhaas W.H., Schnorrer F. A versatile two-step CRISPR- and RMCE-based strategy for efficient genome engineering in Drosophila // G3 (Bethesda). 2014. V. 4. № 12. P. 2409–2418.
Bischof J., Maeda R.K., Hediger M., et al. An optimized transgenesis system for Drosophila using germ-line-specific φC31 integrases // PNAS. 2007. V. 104. № 9. P. 3312–3317.
Gratz S.J., Ukken F.P., Rubinstein C.D. et al., Highly specific and efficient CRISPR/Cas9-catalyzed homology-directed repair in Drosophila // Genetics. 2014. V. 196. № 4. P. 961–971.
Postika N., Schedl P., Georgiev P., et al. Mapping of functional elements of the Fab-6 boundary involved in the regulation of the Abd-B hox gene in Drosophila melanogaster // Scientific Reports. 2021. V. 11. № 1. P. 4156.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


