Доклады Российской академии наук. Науки о жизни, 2021, T. 501, № 1, стр. 580-585
АДАПТАЦИЯ К АНТИМИКРОБНЫМ ПРЕПАРАТАМ И ПАТОГЕННОСТЬ МИКОПЛАЗМ: РАЗВИТИЕ УСТОЙЧИВОСТИ К ЦИПРОФЛОКСАЦИНУ И ЭВОЛЮЦИЯ ВИРУЛЕНТНОСТИ У ACHOLEPLASMA LAIDLAWII
Е. С. Медведева 1, А. А. Музыкантов 1, *, В. В. Костенко 1, 2, Н. Б. Баранова 1, М. И. Маркелова 1, 2, Р. Г. Сабуни 1, 2, Д. Р. Хуснутдинова 1, 2, О. А. Чернова 1, В. М. Чернов 1
1 Казанский институт биохимии и биофизики – обособленное структурное подразделение Федерального государственного бюджетного учреждения науки “Федеральный исследовательский центр “Казанский научный центр Российской академии наук”
Казань, Россия
2 ФГАУ ВПО “Казанский (Приволжский) федеральный университет”
Казань, Россия
* E-mail: muzaleksei@mail.ru
Поступила в редакцию 10.08.2021
После доработки 02.09.2021
Принята к публикации 03.09.2021
Аннотация
Впервые показано, что развитие устойчивости к ципрофлоксацину in vitro у A. laidlawii – широко распространенной микоплазмы, являющейся основным контаминантом клеточных культур и вакцин, ассоциирует с различными траекториями эволюции вирулентности: вирулом, а также вирулентность существенно различаются у ципрофлоксацин-устойчивых штаммов, в том числе штаммов с одинаковым уровнем резистентности к антимикробному препарату.
Эволюция вирулентности у микроорганизмов в условиях селективного давления биотических и абиотических стрессоров, в том числе антимикробных препаратов – серьезная проблема, на решение которой направлены усилия исследователей и фундаментальных и прикладных наук [1]. С выяснением молекулярной машинерии модуляции вирулентности микроорганизмов и определением сигнатур высоковирулентных штаммов связывают перспективы создания эффективной системы контроля эмерджентных инфекций [2]. Особый аспект этой проблемы – возможность стремительного изменения вирулентности у тахителичных (гипермутабильных) бактерий. К таким бактериям относятся микоплазмы (здесь и далее – собирательное название представителей класса Mollicutes) – мельчайшие из способных к самостоятельному существованию прокариоты. Они широко распространены как комменсалы высших эукариот; некоторые являются патогенами человека и животных, основными контаминантами клеточных культур и вакцинных препаратов. Инцидент внезапного расширения спектра инфицируемых видов, произошедшего у Mycoplasma gallisepticum – патогена домашней птицы, вследствие которого погибли миллионы диких птиц [3], существенно интенсифицировал исследования адаптации микоплазм к стрессорам, в результате которых был получен массив данных, свидетельствующих, что мельчайшие прокариоты далеко не так примитивны, как считалось ранее. При этом было установлено, что: 1) значительный вклад в адаптацию микоплазм к стрессорам и реализацию вирулентности вносят внеклеточные везикулы микоплазм; 2) антибиотикорезистентность не всегда ассоциирована с мутациями в генах мишеней антимикробных препаратов, но сопровождается множественными изменениями в первичной структуре и экспрессии сотен генов, участвующих в фундаментальных клеточных процессах и реализации вирулентности; 3) селективное давление антимикробных препаратов может индуцировать крупномасштабные перестройки геномов в популяции микоплазмы по неканоническим механизмам, определяющим возможность появления множества линий с различными вариантами фенотипов и вирулентности [4, 5]. Полученные данные свидетельствуют о значительном арсенале средств адаптации у мельчайших прокариот, их высокой пластичности, и позволяют предполагать, что адаптация микоплазмы даже к одному антибиотику может ассоциировать с разнообразными траекториями эволюции вирулентности. Однако публикации в отношении проверки соответствующей гипотезы пока отсутствуют. Сравнительный анализ профилей геномов и везикулярных протеомов, а также вирулентности штаммов Acholeplasma laidlawii (убиквитарная микоплазма, инфицирующая человека, животных, растения, являющаяся основным контаминантом клеточных культур и вакцинных препаратов), проявляющих высокий уровень устойчивости к ципрофлоксацину, явился задачей нашего исследования, в результате выполнения которого впервые показано, что развитие устойчивости к ципрофлоксацину in vitro у A. laidlawii ассоциирует с различными траекториями эволюции вирулентности: вирулом, а также вирулентность существенно различаются у ципрофлоксацин-устойчивых штаммов, в том числе штаммов с одинаковым уровнем резистентности к антимикробному препарату.
В работе использовали штамм Acholeplasma laidlawii PG8B из коллекции микроорганизмов ФГБУ “ФНИЦЭМ им. Н.Ф. Гамалеи” Минздрава России (Москва). Резистентный к ципрофлоксацину штамм A. laidlawii PG8R10 (МПК 20 мкг/мл) был получен нами из клона штамма PG8B (МПК 0.5 мкг/мл), а резистентные к ципрофлоксацину штаммы PG8r3 и PG8r1 с одинаковым показателем МПК (10 мкг/мл) – в результате пошаговой селекции изолятов одного клона PG8B при совместном культивировании с везикулами PG8R10 и без добавления везикул микоплазмы соответственно [6]. Культивирование микоплазмы, выделение, очистку внеклеточных везикул штаммов и контроль чистоты препаратов (отсутствие клеток микоплазмы в образцах везикул) осуществляли, как описано [7].
Секвенирование геномов штаммов A. laidlawii проводили на секвенаторе MiSeq (“Illumina”, США). Для анализа нуклеотидных последовательностей использовали программу Sequencing Analysis 5.3.1 (“Applied Biosystems”, США), а также базу данных NCBI (National Center for Biotechnology Information); для выравнивания нуклеотидных последовательностей – Bowtie2 (http:// bowtie-bio.sourceforge.net/bowtie2/index.shtml), для поиска и аннотации однонуклеотидных полиморфизмов (SNP) – Samtools (http://samtools. sourceforge.net/mpileup.shtml) и SnpEff (http://snpeff.sourceforge.net/SnpEff.html) соответственно.
Протеомное профилирование внеклеточных везикул A. laidlawii проводили с помощью хромато-масс-спектрометрии, как описано [7]. Для поиска белков, ассоциированных с бактериальной вирулентностью, использовали базу данных VFDB (http://www.mgc.ac.cn/VFs/main.htm). Анализ вирулентности штаммов микоплазмы проводили на модельном организме Drosophila melanogaster (линия Canton-S). Мух выращивали на стандартной сахарно-дрожжевой среде; для инфицирования клетками штаммов A. laidlawii получали синхронные кладки эмбрионов, которые переносили на питательную среду с добавлением 106–107 клеток бактерии. Клетки штаммов A. laidlawii предварительно отмывали от культуральной среды и суспендировали в фосфатно-солевом буфере. В качестве контроля использовали мух, выращенных на среде, не содержащей A. laidlawii. Контроль инфицирования дрозофил микоплазмой осуществляли с помощью ПЦР со специфичными праймерами [6]. Для оценки вирулентности штаммов A. laidlawii использовали стандартные показатели репродукции и жизнеспособности особей (количество отложенных яиц и выживших эмбрионов [8, 9]). Для оценки поврежденности ДНК в энтероцитах мух применяли вариант метода “ДНК-комет” (“DNA-comet assay”), позволяющий определять однонитевые разрывы ДНК в клетках [10]. Для визуализации и ранжировки “ДНК-комет” использовали флуоресцентный микроскоп (Carl Zeiss Axio Imager M2, Германия).
Метагеномное профилирование микробного сообщества кишечника инфицированных и не инфицированных микоплазмой дрозофил проводили с помощью секвенирования 16S рРНК, как описано [11]. Для оценки таксономического разнообразия микробиоты кишечника мух использовали индекс Шеннона. Метагеномные данные анализировали с помощью программного пакета QIIME v1.9.
Статистическую обработку данных выполняли с помощью программного обеспечения Statistica 12.0. Эксперименты проводили в трех повторностях. Для каждого показателя вычисляли среднее арифметическое, его ошибку и стандартное отклонение. Статистически значимые различия между исследуемыми группами оценивали с использованием post-hoc теста с применением критерия Фишера. В тесте ДНК-комет статистически значимые различия определяли с помощью t-критерия Стьюдента (p < 0.05).
В результате анализа данных полногеномного секвенирования штаммов A. laidlawii с дифференциальной чувствительностью к ципрофлоксацину нами было установлено, что развитие резистентности к антимикробному препарату во всех случаях сопровождается множественными изменениями в первичной структуре генома микоплазмы. Мутации регистрируются в генах, вовлеченных не только в адаптацию к фторхинолонам, но также фундаментальные клеточные процессы. При этом адаптация A. laidlawii к ципрофлоксацину сопровождается изменениями в вируломе – мутации обнаруживаются в генах факторов/регуляторов бактериальной вирулентности, но профиль мутантных генов у штаммов существенно различается (рис. 1).
Рис. 1.
Локализация генов, ассоциированных с развитием резистентности Acholeplasma laidlawii к ципрофлоксацину, на геномной карте референсного штамма A. laidlawii PG-8А. Данные представлены для штаммов A. laidlawii PG8r1 (■, ▲), A. laidlawii PG8r3 ($\square $, Δ) и A. laidlawii PG8R10 (◊, $\nabla $). ■, $\square $, ◊ – гены, в первичной структуре которых обнаружены мутации у штаммов (относительно A. laidlawii PG8B); ▲, Δ, $\nabla $ – гены, кодирующие белки, выявленные во внеклеточных везикулах штаммов; V – гены, кодирующие факторы бактериальной вирулентности; Vr – гены, кодирующие белки, регулирующие бактериальную вирулентность. Графическое изображение хромосомы получено с помощью программы Proksee (https://beta.proksee.ca/).
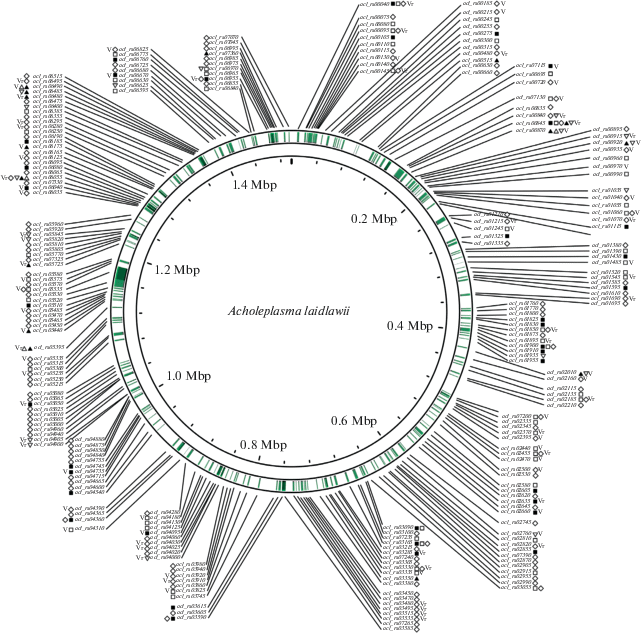
Обнаружены только четыре гена, мутации в которых есть у всех резистентных штаммов микоплазмы – acl_rs00040, acl_rs00845, acl_rs01900 и acl_rs03165, кодирующих: 1) ДНК-гиразу (субъединица А); 2) ДНК-зависимую РНК-полимеразу (субъединица бета'); 3) ДНК топоизомеразу IV (субъединица А) и 4) белок семейства McrC соответственно. Однако профиль мутаций этих генов у штаммов не совпадает. Таким образом, генетическая сигнатура вирулома, характерная для всех исследованных ципрофлоксацин-устойчивых штаммов A. laidlawii, отсутствует.
Развитие антибиотикоустойчивости у A. laidlawii связано с изменением секреции сотен белков, ассоциированной с везикулами микоплазмы, опосредующими межклеточные взаимодействия и патогенез. При этом профили везикулярных белков разных штаммов, резистентных к ципрофлоксацину, существенно различаются. Эти различия касаются и факторов/регуляторов вирулентности (рис. 1). Единственный общий фактор вирулентности в везикулах штаммов – бифункциональная ацетальдегид-CoA/алкогольдегидрогеназа, но специфичным маркером вирулентности ципрофлоксацин-устойчивых штаммов микоплазмы этот белок не является, поскольку присутствует также в везикулах ципрофлоксацин-чувствительного штамма A. laidlawii PG8B [7], что может определять его перспективы как мишени-кандидата для контроля микоплазмы.
Различия профилей геномов и везикулярных протеомов у A. laidlawii PG8R10, PG8r1 и PG8r3, ассоциированные с факторами/регуляторами вирулентности, позволяют предполагать дифференциальный потенциал вирулентности у соответствующих штаммов микоплазмы. Для проверки этого предположения нами выполнен анализ вирулентности штаммов A. laidlawii in vivo на модельном организме D. melanogaster, по отношению к которому микоплазмы могут быть комменсалами и патогенами [12]. Согласно полученным данным, инфицирование D. melanogaster клетками штаммов A. laidlawii может оказывать негативное влияние на жизнеспособность и репродукцию дрозофилы, структуру ДНК энтероцитов (рис. 2) и состав микробиоты кишечника мух (рис. 3; нуклеотидные последовательности 16S рРНК депонированы в базу данных Sequence Read Archive, номер PRJNA751047, https:// www.ncbi.nlm.nih.gov/sra/PRJNA751047), в том числе в отношении представленности рода Lactobacillus, изменения которой могут приводить к значимым изменениям геномного профиля в популяциях D. melanogaster за короткое время – в течение пяти генераций [13].
Рис. 2.
Вирулентность штаммов A. laidlawii в отношении D. melanogaster.
1 – мухи, не инфицированные A. laidlawii; 2–5 – мухи, инфицированные штаммами A. laidlawii PG8B, PG8R10, PG8r1, PG8r3 соответственно. Данные представлены в виде среднего арифметического значения ± стандартное отклонение.
 ,
,  ,
,  – количество отложенных яиц, погибших особей, энтероцитов с однонитевыми разрывами
ДНК (цифры указывают индекс повреждения ДНК) соответственно. * – достоверные (p < 0.05) отличия по сравнению с неинфицированными мухами; • – достоверные (p < 0.05) отличия по сравнению с мухами, инфицированными A. laidlawii PG8B; ◊, Δ, $\nabla $ – достоверные (p < 0.05) отличия между мухами, инфицированными штаммами A. laidlawii PG8R10 и PG8r1, PG8R10 и PG8r3, PG8r1 и PG8r3 соответственно.
– количество отложенных яиц, погибших особей, энтероцитов с однонитевыми разрывами
ДНК (цифры указывают индекс повреждения ДНК) соответственно. * – достоверные (p < 0.05) отличия по сравнению с неинфицированными мухами; • – достоверные (p < 0.05) отличия по сравнению с мухами, инфицированными A. laidlawii PG8B; ◊, Δ, $\nabla $ – достоверные (p < 0.05) отличия между мухами, инфицированными штаммами A. laidlawii PG8R10 и PG8r1, PG8R10 и PG8r3, PG8r1 и PG8r3 соответственно.

Рис. 3.
Особенности изменений таксономического разнообразия (а) и относительной представленности бактериальных отделов (б) в микробном сообществе кишечника у D. melanogaster при инфицировании штаммами A. laidlawii.
1 – мухи, не инфицированные A. laidlawii; 2–4 – мухи, инфицированные штаммами A. laidlawii PG8B, PG8R10 и PG8r3 соответственно.
 Actinobacteria, □ Bacteroidetes,
Actinobacteria, □ Bacteroidetes,  Firmicutes,
Firmicutes,  род Lactobacillus),
род Lactobacillus),  Proteobacteria,
Proteobacteria,  другие.
другие.
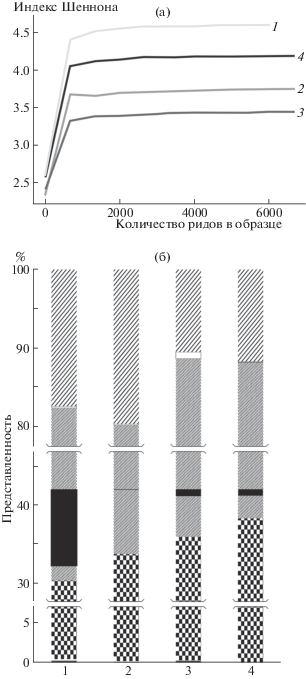
Выраженность негативного эффекта штаммов микоплазмы в отношении структуры ДНК энтероцитов и состава микробиоты кишечника D. melanogaster совпадает – чем ниже оказывается таксономическое разнообразие кишечной микробиоты у мух, тем выше уровень ДНК-повреждений в клетках их кишечника. Различия между ципрофлоксацин-устойчивыми штаммами в отношении повреждений ДНК энтероцитов в основном незначимы – достигают достоверности только у PG8R10 и PG8r1, штаммов с разным уровнем резистентности. В случае других параметров достоверные различия обнаруживаются и у штаммов с одинаковым уровнем резистентности.
Таким образом, в результате наших исследований впервые показано, что развитие устойчивости к ципрофлоксацину in vitro у A. laidlawii ассоциирует с различными траекториями эволюции вирулентности микоплазмы: вирулом, а также вирулентность существенно различается у ципрофлоксацин-устойчивых штаммов, в том числе штаммов с одинаковым уровнем резистентности к антимикробному препарату. Полученные данные определяют необходимость проведения всесторонних исследований механизмов эволюции вирулентности тахителичных бактерий in vivo на модельных организмах при селективном давлении антимикробных препаратов для выяснения потенциала клональной диверсификации в бактериальной популяции [14] в отношении модуляции вирулентности, определения маркеров высоковирулентных штаммов и коррекции стратегии контроля микоплазм.
Список литературы
Turner W.C., Kamath P.L., van Heerden H., et al. // R Soc Open Sci. 2021. V. 8. P. 210088.
Pan Y., Zeng J., Li L., et al. // mSystems. 2020. V. 5. № 3. P. e00821-19.
Hochachka W.M., Dhondt A.A., Dobson A., et al. // Proc Biol Sci. 2013. V. 280. P. 20131068.
Faucher M., Nouvel L.-X., Dordet-Frisoni E., et al. // PLoS Genet. 2019. V. 15. № 1. P. e1007910.
Chernova O.A., Chernov V.M., Mouzykantov A.A., et al. // Int J Antimicrob Agents. 2021. V. 57. P. 106253.
Mouzykantov A.A., Medvedeva E.S., Baranova N.B., et al. // Data in Brief. 2020. V. 33:106412.
Chernov V.M., Mouzykantov A.A., Baranova N.B., et al. // J. Proteomics. 2014. V. 110. P. 117–128.
Qiao H., Keesey I.W., Hansson B.S., Knaden M. // J Exp Biol. 2019 Mar 1;222(Pt 5):jeb192500.
Sullivan W., Ashburner M., Hawley E.S. Drosophila protocols. 2000. New York: Cold Spring Harbour Press. 728 p.
Mukhopadhyay I., Chowdhuri D.K., Bajpayee M., et al. // Mutagenesis. 2004. V.19. P. 85–90.
Kang D., Douglas A.E. // Biol Lett. 2020. V. 16. № 2. P. 20190803.
Ventura I.M., Martins A.B., Lyra M.L., et al. // Microb Ecol. 2012. V. 64. P. 794–801.
Rudman S.M., Greenblum S., Hughes R.C., et al. // Proc Natl Acad Sci U S A. 2019. V. 116. P. 20025–20032.
Rakovskaya I.V., Ermolaeva S.A., Levina G.A., et al. // J Med Microbiol. 2019. V. 68. P. 1747–1758.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


