Доклады Российской академии наук. Науки о жизни, 2022, T. 502, № 1, стр. 32-36
СРАВНЕНИЕ ЗАЩИТНЫХ РЕАКЦИЙ РАСТЕНИЙ РАПСА НА ХЛОРИДНОЕ ЗАСОЛЕНИЕ ПРИ ВОЗДЕЙСТВИИ ЭПИБРАССИНОЛИДА ДО ИЛИ ВО ВРЕМЯ СОЛЕВОГО СТРЕССА
Л. В. Коломейчук 1, *, В. А. Хрипач 2, член-корреспондент РАН В. В. Кузнецов 1, 3, М. В. Ефимова 1
1 Национальный исследовательский Томский государственный университет
Томск, Россия
2 Институт биоорганической химии НАН Беларуси
Минск, Беларусь
3 Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: kolomeychuklil@mail.ru
Поступила в редакцию 10.09.2021
После доработки 04.10.2021
Принята к публикации 04.10.2021
- EDN: AFBKKV
- DOI: 10.31857/S2686738922010127
Аннотация
Сравнили защитные реакции растений рапса в ответ на обработку 24-эпибрассинолидом (10 нМ, ЭБЛ) до начала действия солевого стресса (этап предадаптации) или в условиях хлоридного засоления (150 мМ NaCl). Показали, что солевой стресс на 30–35% ингибирует некоторые ростовые показатели. ЭБЛ вне зависимости от способа обработки растений проявлял выраженный протекторный эффект, прежде всего на уровне ассимилирующей поверхности, основных фотосинтетических пигментов и фотохимической активности фотосистемы II. Впервые установлено, что предобработка растений ЭБЛ с последующим солевым стрессом сопровождается подавлением NaCl-индуцированного накопления пролина и повышением активности супероксиддисмутазы, тогда как добавление гормона при солевом стрессе увеличивает содержание каротиноидов, что приводит к снижению уровня перекисного окисления липидов.
За последние полвека в два раза снизилась доступность пахотных земель в результате увеличения скорости урбанизации и деградации почв [1]. Одним из основных факторов загрязнения почв является их избыточное засоление, которое имеет как природное, так и техногенное происхождение. По данным продовольственной и сельскохозяйственной организация ООН (ФАО), в той или иной степени засоленные почвы занимают огромные площади и составляют около 25% всей поверхности суши [2].
Избыточное засоление приводит к нарушению осмотического и ионного статуса растений, следствием чего являются возникновение ионного дисбаланса, генерация активных форм кислорода (АФК) и развитие окислительного стресса [3]. АФК приводят к инактивации ферментов, повреждению белков и нуклеиновых кислот, нарушению функционирования мембран. Инициация и развитие осмотического и окислительного стрессов вызывают повреждение структуры фотосинтетического аппарата и, как следствие, снижение продуктивности растений [4].
Данная экологическая проблема усложняется тем, что предотвращение поступления техногенных солей в почву крайне затруднено. Самоочищение почвы представляет собой невероятно длительный процесс, а существующие технологии очистки почв характеризуются высокой энергоемкостью, малой эффективностью и низкой экологической безопасностью [5, 6]. По этой причине использование засоленных почвенных ресурсов в интересах аграрного производства нуждается в повышении солеустойчивости хозяйственно ценных сортов растений. Подобная ситуация предполагает изучение физиологических механизмов адаптации растений к засоленным местообитаниям.
Ключевую роль в повышении солеустойчивости растений играют факторы гормональной природы, прежде всего, брассиностероиды, которые характеризуются экологической безопасностью и способностью вызывать биологические эффекты в крайне низких, по сравнению с другими гормонами, концентрациях. Брассиностероиды, как и другие фитогормоны, потенциально могут реализовать свое защитное действие на разных этапах адаптации, регулируя формирование и функционирование защитных систем и тем самым повышая устойчивость растений [7, 8]. При этом продолжительность гормонального воздействия также может сильно варьировать [9–11]. В настоящее время обычно изучают протекторный эффект гормонов при его совместном действии с повреждающим фактором, в то время как остается слабо исследованным защитный эффект гормонов, действующих на других этапах стрессорного ответа. Решение этого вопроса имеет не только фундаментальный интерес, но и важное значение для разработки эффективных технологий использования биорегуляторов в интересах агропромышленного комплекса.
Цель нашей работы заключалась в том, чтобы выяснить, на каком этапе стрессорного ответа проявляется протекторное действие брассиностероида – до начала засоления (этап предадаптации) или во время солевого стресса, а также понять, в чем в этих условиях проявляется специфика защитного ответа растения на избыточное засоление.
Исследования проводили на растениях рапса (Brassica napus L.) сорта Вестар канадской селекции. Семена проращивали в перлите на дистиллированной воде в течение 7 сут, после чего проростки переносили на жидкую питательную среду Хогланда-Снайдера (ХС) для дальнейшего культивирования под люминесцентными лампами L36W/77 Fluora (“Osram”, Германия) при плотности потока квантов ФАР 100 мкмоль м–2 с–1 в фитотроне с 16-часовым фотопериодом и температурой 23 ± 0.5°C (при освещении) и 20 ± 0.5°C (ночью). После 2-недельного роста на гидропонной установке в среде ХС часть растений переносили на ту же среду с добавлением 24-эпибрассинолида (ЭБЛ) в концентрации 10 нМ на 4 ч. В дальнейшем растения помещали на 6 сут на питательную среду ХС (без ЭБЛ) со 150 мМ NaCl. Другую часть растений переносили на питательную среду ХС со 150 мМ NaCl и 10 нМ ЭБЛ. Контрольные растения росли на стандартной среде ХС в течение всего эксперимента. Через 6 сут растительный материал фиксировали в жидком азоте и использовали для проведения анализов. Концентрации ЭБЛ и NaCl и продолжительность воздействия гормона и соли были подобраны в предварительных экспериментах. Весовым методом оценивали площадь листовой поверхности, сырую и сухую биомассы растений. Интенсивность окислительного стресса оценивали в образцах растений по уровню перекисного окисления липидов (ПОЛ), критерием которого служило содержание ТБК-реагирующих продуктов [12]. Определение активности ключевых антиоксидантных ферментов супероксиддисмутазы (СОД) проводили по методу Beauchamp и Fridovich [13], гваяколовой пероксидазы согласно методу, предложенному Shevyakova [14]. Определение содержания растворимого белка проводили по методу Esen [15]. Содержание пролина оценивали по методу Bates [16]. Содержание хлорофилла а, хлорофилла b и каротиноидов определяли согласно Lichtenthaler [17]. Фотохимическую активность фотосинтетического аппарата растений оценивали на PAM-флуориметре (Mini-PAM II, “Heinz-Walz”, Germany).
Полученные данные показали, что 150 мМ NaCl снижал площадь ассимилирующей поверхности (на 30–35%) и сырую биомассу растений (на 20–25%) относительно контроля. Экзогенный ЭБЛ частично снимал негативный эффект соли на ростовые параметры рапса, за исключением сырой массы надземной части в варианте добавления гормона на этапе стресса (табл. 1).
Таблица 1.
Влияние 24-эпибрассинолида (10 нМ, ЭБЛ) и NaCl (150 мМ) на ростовые параметры растений рапса
| Варианты обработок | Площадь листовой поверхности, см2 | Надземная часть | Подземная часть | |||
|---|---|---|---|---|---|---|
| 4 ч | 6 сут | сырая масса, г | сухая масса, г | сырая масса, г | сухая масса, г | |
| ХС | ХС | 83.84 ± 5.39 | 3.49 ± 0.36 | 0.36 ± 0.04 | 0.49 ± 0.03 | 0.050 ± 0.006 |
| ХС | +NaCl | 52.19 ± 4.83* | 2.73 ± 0.26* | 0.31 ± 0.03 | 0.43 ± 0.04 | 0.035 ± 0.005* |
| +ЭБЛ | +NaCl | 68.38 ± 5.07*,# | 3.07 ± 0.35 | 0.34 ± 0.03 | 0.54 ± 0.04# | 0.042 ± 0.004 |
| XC | +NaCl | 59.96 ± 3.12* | 2.63 ± 0.35* | 0.33 ± 0.03 | 0.51 ± 0.05 | 0.044 ± 0.004 |
| +ЭБЛ | ||||||
Интегральным показателем реакции растения на стресс является оценка эффективности функционирования фотосистемы II. Полученные данные свидетельствуют о том, что в условиях солевого стресса наблюдаются падение показателей максимального (Fv/Fm) и эффективного (Y(II)) квантовых выходов фотосистемы II на 55 и 65% и увеличение квантового выхода нерегулируемой диссипации энергии (Y(NO)) в 2 раза относительно контроля (рис. 1а–1в).
Рис. 1.
Влияние 24-эпибрассинолида (10 нМ, ЭБЛ) и NaCl (150 мМ) на флуоресцентные параметры фотосистемы II: максимальная фотохимическая эффективность – Fv/Fm (а), эффективный квантовый выход Y(II) (б), квантовый выход нерегулируемой диссипации световой энергии Y(NO) (в) и содержание основных фотосинтетических пигментов в листьях рапса (г). Обозначения: 1 – контроль, 2 – 150 мM NaCl, 3 – 10 нМ ЭБЛ (4 ч), затем 150 мМ NaCl (6 сут), 4 – 10 нМ ЭБЛ + 150 мМ NaCl (6 сут). *p < 0.05 при сравнении с контрольным значением; #p < 0.05 при сравнении с NaCl.

Вне зависимости от способа обработки ЭБЛ оказывает выраженный протекторный эффект на фотохимическую активность фотосистемы II, поддерживая исследуемые показатели на уровне контрольных значений.
Одной из возможных причин поддержания функциональной активности фотосистемы II при стрессе может быть задержка гормоном деградации основных фотосинтетических пигментов. Хлоридное засоление снижало содержание хлорофиллов и каротиноидов в листьях на 35 и 20% соответственно относительно контроля (рис. 1г). Вне зависимости от способа обработки растений ЭБЛ способствовал частичному или полному снятию отрицательного действия соли на содержание пигментов. Кроме того, добавление ЭБЛ на этапе стресса, но не на этапе предадаптации, приводило к увеличению содержания каротиноидов в листьях на 20% относительно контроля, что может повышать клеточный антиоксидантный потенциал, понижая тем самым интенсивность окислительного стресса при засолении (рис. 1г).
Одним из негативных последствий действия засоления на растения является окислительный стресс, связанный, прежде всего, с нарушениями процессов фотосинтеза и дыхания. В ответ на хлоридное засоление в листьях растений ПОЛ усиливалось на 30% (рис. 2а). Предобработка растений ЭБЛ до действия соли достоверно не влияла на уровень окислительного стресса, хотя ЭБЛ, добавленный в условиях солевого стресса, полностью снимал NaCl-зависимый окислительный стресс в листьях растений.
Рис. 2.
Влияние 24-эпибрассинолида (10 нМ, ЭБЛ) и NaCl (150 мМ) на содержание ТБК-реагирующих продуктов (а), пролина (б), активность супероксиддисмутазы (в) и пероксидазы (г) в листьях растений рапса. Обозначения: 1 – контроль, 2 – 150 мM NaCl, 3 – 10 нМ ЭБЛ (4 ч), затем 150 мМ NaCl (6 сут), 4 – 10 нМ ЭБЛ + 150 мМ NaCl (6 сут).
*p < 0.05 при сравнении с контрольным значением; #p < 0.05 при сравнении с NaCl.
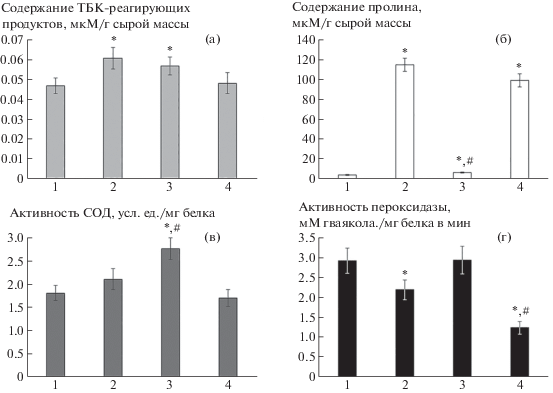
Для поддержания водного гомеостаза между основными внутриклеточными компартментами в условиях засоления, важная роль принадлежит совместимым осмолитам, одним из которых является пролин. Хлоридное засоление повышало уровень пролина в листьях в 31 раз по сравнению с контрольным вариантом (рис. 2б). Обработка растений ЭБЛ снижала накопление пролина; при этом интенсивность влияния определялась способом воздействия гормона. Обработка растений ЭБЛ до солевого стресса практически полностью блокировала NaCl-индуцированную аккумуляцию пролина, что свидетельствует о регуляции гормоном осмотического статуса, возможно, за счет синтеза органических осмолитов иной природы. Действие ЭБЛ при солевом стрессе не обладало столь выраженным ингибирующим эффектом на накопление пролина при хлоридном засолении.
Для снижения негативного влияния окислительного стресса в растениях активируются антиоксидантные защитные системы, действие которых направлено на гашение активных форм кислорода. Солевой стресс достоверно не влиял на активность СОД и понижал активность ПО на 25%, относительно контроля, в листьях растений рапса (рис. 2в, 2г). Предобработка растений ЭБЛ способствовала повышению активности СОД на 50%, относительно контрольных значений (рис. 2в). Внесение гормона на этапе стресса усиливало солевое понижение активности ПО – подавление составило 57%, относительно контроля (рис. 2г).
Таким образом, нами было впервые показано, что ЭБЛ оказывает солепротекторный эффект на некоторые интегральные ростовые показатели рапса и фотохимическую активность фотосистемы II вне зависимости от способа гормональной обработки. Защитное действие ЭБЛ проявляется в повышении максимального (Fv/Fm) и эффективного (Y(II)) квантовых выходов, и снижении квантового выхода нерегулируемой диссипации энергии (Y(NO)) фотосистемы II. В основе этого эффекта могут лежать антиоксидантные свойства ЭБЛ и его способность защищать основные фотосинтетические пигменты при солевом стрессе. Впервые установлено, что предобработка растений ЭБЛ с последующим солевым стрессом сопровождается подавлением NaCl-индуцированного накопления пролина и повышением активности супероксиддисмутазы, тогда как добавление гормона при солевом стрессе увеличивает содержание каротиноидов, которые, как известно, нейтрализуют синглетный кислород и подавляют образование свободных радикалов, что, в итоге, приводило к снижению уровня перекисного окисления липидов в листьях растений.
Список литературы
Liu M., Pan T., Allakhverdiev S.I., et al. // Trends Plant Sci. 2020. V. 25. P. 630–634.
FAO. Management of salt affected soils: 'soil management' under 'FAO SOILS PORTAL’ Food and Agriculture Organization’ of the 'United Nations’. 2021. http://www.fao.org/soils-portal/soil-management/management-of-some-problem-soils/salt-affected-soils/more-information-on-salt-affected-soils/en/, Accessed 25th Jun 2021
Agarwal P.K., Shukla P.S., Gupta K., et al. // Mol. Biotechnol. 2013. V. 54. P. 102–123.
Gao H.J., Yang H.Y., Bai J.P., et al. // Frontiers in plant science. 2015. V. 5. P. 787.
Farraji H., Zaman H.Q., Tajuddin R.M. // Int. J. Environ. Sci. Technol. 2016. V. 2. P. 69–75.
Liu L., Li W., Song W., et al. // Sci. Total Environ. 2018. V. 633. P. 206–219.
Kolomeichuk L.V., Efimova M.V., Zlobin I.E., et al. // Photosynthesis Research. 2020. V. 146. P. 151–163.
Wang X., Gao Y., Wang Q., et al. // Plant Physiology and Biochemistry. 2019. V. 135. P. 30–40.
Tadaiesky L.B., Silva B.R., Batista B.L., et al. // Physiol. Plantarum. 2021. V. 171. P. 371–387.
Efimova M.V., Khripach V.A., Boiko E.V., et al. // Doklady Biological Sciences. 2018. V. 478. P. 33–36.
Kolomeichuk L.V., Danilova E.D., Khripach V.A., et al. // Russian Journal of Plant Physiology. 2021. V. 68. № 3. P. 499–509.
Buege J.A., Aust S.D. // Methods Enzymol. 1978. V. 52. P. 302–310.
Beauchamp Ch., Fridovich I. // Anal Biochem. 1971. V. 44. P. 276–287.
Shevyakova N.I., Stetsenko L.A., Meshcheryakov A.B. et al. // Russian Journal of Plant Physiology. 2002. V. 49. P. 598–604.
Esen A. // Anal Biochem. 1978. V. 89. P. 264−273.
Bates L.S., Waldren R.P., Teare I.D. // Plant and Soil. 1973. V. 39. P. 205–207.
Lichtenthaler H.K. // Methods Enzymol. 1987. V. 148. P. 350–382.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


