Доклады Российской академии наук. Науки о жизни, 2022, T. 503, № 1, стр. 144-151
Получение фторсодержащих аналогов пуриновых дезоксинуклеозидов: оптимизация условий ферментативного трансгликозилирования
М. С. Дреничев 1, Е. О. Доринова 1, И. В. Варижук 1, В. Е. Ословский 1, М. А. Варга 1, Р. С. Есипов 2, Д. Д. Лыкошин 2, К. С. Алексеев 1, *, **
1 Институт молекулярной биологии
им. В.А. Энгельгардта Российской академии наук
Москва, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Москва, Россия
* E-mail: room517@eimb.ru
** E-mail: micelle@mail.ru
Поступила в редакцию 27.10.2021
После доработки 01.12.2021
Принята к публикации 01.12.2021
- EDN: IXHLBU
- DOI: 10.31857/S268673892202007X
Аннотация
В работе проведен сравнительный анализ условий трансгликозилирования, катализируемого нуклеозидфосфорилазами E. coli, и определены оптимальные условия образования различных нуклеозидов. В условиях реакции трансгликозилирования, исходя из рибонуклеозидов, получены фторсодержащие производные N6-бензил-2'-дезоксиаденозина – потенциальные ингибиторы репликации энтеровирусов в клетке.
ВВЕДЕНИЕ
Методы ферментативного трансгликозилирования широко применяются для получения лекарственных веществ на основе нуклеозидов и их аналогов и основаны на реакции переноса углеводного остатка с одного гетероциклического основания на другое [1–3]. В качестве катализаторов данных реакций выступают нуклеозидфосфорилазы (НФ), которые осуществляют обратимый фосфоролиз рибонуклеозидов/2'-дезоксирибонуклеозидов с образованием соответствующего гетероциклического основания и α-D-(2-дезокси)рибофуранозо-1-фосфата ((d)Rib-P). Равновесие реакции фосфоролиза сдвинуто в сторону образования нуклеозидов, причем в случае пуриновых более значительно [1–6]. Обычно используют сопряженные реакции фосфоролиза – нуклеозида-донора углеводной части и нуклеозида, содержащего гетероциклическое основание-акцептор (рис. 1). Эта общая схема позволяет получать новые модифицированные нуклеозиды в зависимости от набора используемых исходных соединений и субстратной специфичности НФ.
Рис. 1.
Реакция трансгликозилирования. НФ – нуклеозидфосфорилазы, Nuc-1 – нуклеозид-донор, Nuc-2 – целевой нуклеозид, B1 и B2 – гетероциклические основания, Pi – фосфат-анион, X=H или OH. Условия реакций: НФ – ПНФ E. сoli, УрФ E. сoli, ТФ E. сoli, 50 мМ Tris-HCl буфер (pH 7.5), 20°С. Составлено по материалам работы [6].

Ранее в лаборатории дизайна и синтеза биологически активных соединений (ДиСБАС) ИМБ РАН были изучены подходы к оптимизации реакции трансгликозлирования c использованием 7-метил-2'-дезоксигуанозина в качестве исходного субстрата для получения α-D-2-дезоксирибозо-1-фосфата (dRib-1-P), 5-замещенных производных 2'-дезоксиуридина, кладрибина и аллопуринол-рибозида [5, 7], была предложена математическая модель процесса трансгликозилирования, которая может применяться для количественной оценки влияния начальных условий на результат трансгликозилирования [8]. Настоящая работа является продолжением ранее начатых исследований, целью которых являются расширение знаний о субстратной специфичности НФ и получение модифицированных аналогов природных нуклеозидов методом ферментативного трансгликозилирования.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ходе работы был проведен сравнительный анализ реакции трансгликозилирования с участием пуриновых (ПНФ) и пиримидиновых (УрФ, ТФ) нуклеозидфосфорилаз E. coli (табл. 1). Выбор ферментов бактериального происхождения в качестве катализаторов был обусловлен их широкой субстратной специфичностью, оптимумом рН в нейтральной/слабощелочной средах и достаточно широким рабочим интервалом температур, что позволяет проводить реакцию в мягких условиях без заметного неспецифического расщепления N-гликозидной связи с выходами целевых продуктов, близкими к теоретически предсказываемым [8–13].
Таблица 1.
Сравнительный анализ условий трансгликозилирования, катализируемого нуклеозидфосфорилазами E. coli.1
| № | Гликозил- донор (Д) | Основание (О) | Продукт | Д: О: Pi (моль) | Фермент | Выход (по данным ВЭЖХ) | Конверсия основания О в нуклеозид (по данным ВЭЖХ) |
|---|---|---|---|---|---|---|---|
| 1 | Urd | Ade | Ado | 1:1.5:1 | УрФ/ПНФ | 77% | 51% |
| 2 | Urd | Ade | Ado | 1.5:1:1 | УрФ/ПНФ | 88% | 88% |
| 3 | Urd | Ade | Ado | 3:1:2 | УрФ/ПНФ | 94% | 94% |
| 4 | Ado | Ura | Urd | 1:1.5:1 | ПНФ/УрФ | 22% | 13% |
| 5 | Ado | Ura | Urd | 1.5:1:1 | ПНФ/УрФ | 22% | 22% |
| 6 | Ado | Ura | Urd | 3:1:0.5 | ПНФ/УрФ | 27% | 27% |
| 7 | Ado | Hyp | Ino | 1:1.5:1 | ПНФ | 53% | 35% |
| 8 | Ino | Ade | Ado | 1:1.5:1 | ПНФ | 76% | 53% |
| 9 | 7-Me-Guo | Ura | Urd | 1:1.5:1 | ПНФ/УрФ | 63% | 42% |
| 10 | 7-Me-Guo | Ura | Urd | 1.5:1:1 | ПНФ/УрФ | 80% | 80% |
| 11 | 7-Me-Guo | Ade | Ado | 1:1.5:1 | ПНФ | 79% | 52% |
| 12 | 7-Me-Guo | Ade | Ado | 1.5:1:1 | ПНФ | 94% | 94% |
| 13 | 7-Me-Guo | Ade | Ado | 3:1:2 | ПНФ | 100% | 99% |
| 14 | Rib-P | Ade | Ado | 1:1.5 | ПНФ | 98% | 66% |
| 15 | Thd | 5-Et-Ura | 5-Et-Urd | 5:1:0.5 | ТФ | 80% | 80% |
| 16 | 7-Me-dGuo | PFPh-Ade | PFPh-dAdo | 1.5:1:1 | ПНФ | 89% | 89% |
| 1.5:1:0.5 | 95% | 95% | |||||
| 1.5:1:0.25 | 97% | 97% | |||||
| 17 | 7-Me-dGuo | TFMBn-Ade | TFMBn-dAdo | 1.5:1:1 | ПНФ | 96% | 96% |
| 1.5:1:0.5 | 98% | 98% | |||||
| 1.5:1:0.25 | 100% | 100% |
1 Условия реакции: Реакции проводились в пластиковых пробирках 1.5 мл, объем реакционной смеси 1 мл в 50 мМ Tris-HCl (pH 7.5) буфере, концентрации субстратов Д: О: Pi в диапазоне 0.01–1 мМ, 0.35 ед. ПНФ E. coli, 0.34 ед. УФ E. coli.1Условия анализа: линейный градиент 2–12% CH3CN в 0.08% водном растворе ТФУ за 10 мин, колонка 4.6 × 150 mm Luna C18(2) (строки 1–6, 9–15); 0.5–3% CH3CN в 0.08% водном растворе ТФУ за 15 мин, колонка 4.6 × 150 mm Luna C18(2) (строки 7, 8); 2–60% CH3CN в 10 мМ водном растворе ацетата натрия за 25 мин, колонка 4.6 × 250 mm Nucleosil C18 (строки 16, 17).
Согласно рис. 1, реакция трансгликозилирования протекает через стадию образования α-D-рибозо-1-фосфата (Rib-1-P) или α-D-2-дезоксирибозо-1-фосфата (dRib-1-P). В синтезе пуриновых нуклеозидов из пиримидиновых и наоборот требуется участие двух ферментов: ПНФ и УрФ (или ТФ). Константы равновесия фосфоролиза природных пиримидиновых нуклеозидов в присутствии УрФ и ТФ выше, чем константы равновесия фосфоролиза природных пуриновых нуклеозидов в присутствии ПНФ [2, 5, 8, 11, 14], поэтому более целесообразно использование в качестве доноров Rib-1-P и dRib-1-P пиримидиновых нуклеозидов, а не пуриновых [8, 15, 16].
Хорошо подтверждают эту целесообразность экспериментальные данные, приведенные в табл. 1.
При получении аденозина из уридина реакция протекала с высоким выходом, который определяли как отношение равновесной концентрации продукта к начальной концентрации исходного основания или гликозил-донора в зависимости от того, что было взято в недостатке (табл. 1, строки 1–3, 77–94% по данным ВЭЖХ). При получении уридина из аденозина выход реакции значительно снижался (табл. 1, строки 4–6, 22–27% по данным ВЭЖХ). В ряду пуриновых нуклеозидов инозин выступал в качестве более продуктивного гликозил-донора, чем аденозин, поэтому реакция получения аденозина из инозина протекала с более высоким выходом (табл. 1, строка 8, 76% по данным ВЭЖХ), чем обратная реакция (табл. 1, строка 7, 53% по данным ВЭЖХ). С повышением количества нуклеозида-донора в реакционной смеси закономерно удается повысить выход целевого нуклеозида (и, соответственно, конверсию основания), но при этом также увеличивается количество непрореагировавших компонентов, что увеличивает трудоемкость последующей обработки реакционной смеси и ее очистку (табл. 1, строки 3, 6, 13, 15).
Упрощение реакции трансгликозилирования может быть проведено двумя путями:
1) исключение стадии фосфоролиза нуклеозида, выступающего в качестве гликозил-донора в реакции трансгликозилирования (рис. 1, стадия 1), введением в реакцию готового Rib-1-P или dRib-1-P [7];
2) превращение стадии 1 в необратимую, используя в качестве источника рибозного остатка 7-метил-(2'-дезокси)гуанозина (7-Me(d)Guo) за счет его практически необратимого фосфоролиза [17, 18].
Использование (d)Rib-1-P уменьшает число компонентов в составе реакционной смеси, облегчает выделение целевых соединений и позволяет существенно сместить равновесие реакции гликозилирования в сторону образования нуклеозидов (табл. 1, строка 14, 98% по данным ВЭЖХ, выход рассчитывался по реагенту, взятому в недостатке – Rib-1-P). Замена (d)Rib-1-P на более доступный 7-Me(d)Guo приводит к сравнимым выходам продуктов реакции (табл. 1).
ПНФ E. coli была применена для получения из коммерчески более доступных рибонуклеозидов менее доступных дезоксирибонуклеозидов: N6-пентафторфенилметил-2'-дезоксиаденозина (PFPh-dAdo, 5b) и N6-(3-трифторметилбензил)-2'-дезоксиаденозина (TFMBn-dAdo, 5a) (рис. 2) – потенциальных ингибиторов репликации энтеровирусов в клетке [19].
Рис. 2.
Синтез фторсодержащих 2'-дезоксирибонуклеозидов из рибонуклеозидов. Реагенты и условия: (1) 1а–b (0.212–0.235 ммоль), ПНФ E. coli (0.25 единиц), KH2AsO4 (0.212–0.235 ммоль), 50 мМ Tris-HCl-буфер (рН 7.5, 10 мл), 50°С, 20 ч – 2a (91%), 2b (85%). (2–3). 2а (20 мг, 0.068 ммоль), 2b (20 мг, 0.064 ммоль), 3 (0.102 ммоль), ПНФ E. coli (0.98 единиц), КH2PO4 (0.064–0.068 ммоль), 50 мМ Tris-HCl-буфер (рН 7.5, 63 мл) – ДМСО (10%, 7 мл), 20°С, 24 ч – 86% (5а), 47% (5b).
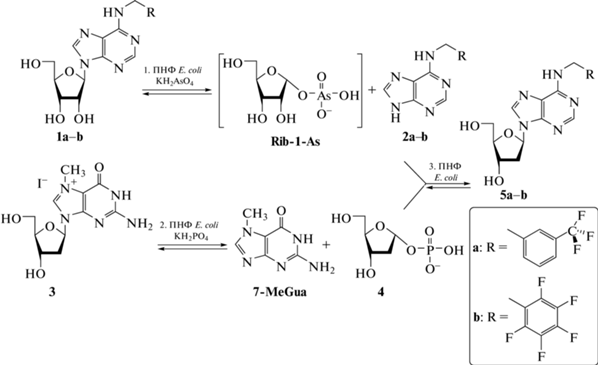
Метод синтеза состоял из трех раздельных стадий, протекание каждой стадии катализировалось ПНФ E. coli. Исходные основания N6-(3-трифторметилбензил)аденин (TFMBn-Ade, 2a) и N6-пентафторфенилметиладенин (PFPh-Ade, 2b) были получены из рибонуклеозидов в условиях ферментативного арсенолиза (рис. 2, стадия 1). В основе ферментативного арсенолиза лежит расщепление рибонуклеозида в присутствии дигидроортоарсената калия (KH2AsO4) на пуриновое основание и высоко лабильный α-D-рибофуранозо-1-арсенат (Rib-1-As), который необратимо гидролизуется, что смещает равновесие расщепления рибонуклеозида в сторону образования основания [20]. К смещению равновесия также приводит плохая растворимость гетероциклических оснований 2a и 2b в воде и в Tris-HCl буфере. Для предотвращения образования смеси рибо- и дезоксирибонуклеозидов в ходе дальнейших стадий стадия 1 должна проводиться в отдельной колбе. Далее основания 2a и 2b отфильтровывали и вводили в реакцию трансгликозилирования с 7-Me-dGuo в присутствии дигидроортофосфата калия и ПНФ E. coli (рис. 2, стадии 2–3). В реакционной смеси 7-Me-dGuo превращался в dRib-1-P (рис. 2, стадия 2), который далее вступал в реакцию с фторсодержащим основанием (рис. 2, стадия 3). Стадии 2 и 3 проводились в одной колбе. Для увеличения растворимости основания реакцию проводили в буферном растворе с добавлением 10% (об.) диметилсульфоксида.
Концентрация диметилсульфоксида в реакционной смеси не влияла существенным образом на ферментативную активность ПНФ, что согласуется с литературными данными [18]. Реакцию трансгликозилирования проводили при разных соотношениях гликозил-донор: основание : фосфат (табл. 1). Проведение реакции с небольшим избытком гликозил-донора в присутствии эквимолярного количества фосфата (1.5: 1: 1) или его недостатка (1.5: 1: 0.5, 1.5: 1: 0.25) приводило к высоким выходам целевых нуклеозидных продуктов при незначительном падении скорости реакции по сравнению со скоростью реакции в присутствии эквимолярных количеств фосфата. С повышением количества фосфата в реакционной смеси (начиная с эквимолярного количества и выше) возрастает скорость образования dRib-1-P, гидролиз которого может снижать выходы целевых нуклеозидов (табл. 1, строки 16–17), поэтому наибольшие выходы были достигнуты при соотношении гликозил-донор: основание: фосфат – 1.5:1:0.25 (табл. 2). Выход препаративного метода получения продукта 5а составил 100% по ВЭЖХ (86% после очистки методом обращенно-фазной хроматографии на силикагеле-С18), продукта 5b – 92% по данным ВЭЖХ (47% после аналогичной очистки, низкий выход обусловлен сорбцией вещества на силикагеле-С18).
Таблица 2.
ВЭЖХ-анализ реакции образования нуклеозида 5a из основания 2а и 7Me-dGuo (3) в присутствии ПНФ E. coli
 |
| A (tinitial): 1 – 7Me-dGuo (3); 2 – TFMBn-Ade (2a) |
 |
| B (35 мин): 2 – 7Me-dGuo (3); 3 – 7-MeGua; 4 – TFMBn-dAdo (5a), 5 – TFMBn-Ade (2a) |
 |
| C (tequilibrium): 1–7-MeGua, 2 – TFMBn-dAdo (5a) |
Структура полученных соединений была подтверждена методами ЯМР-спектроскопии. В 13С-ЯМР спектре трифторметилзамещенного дезоксинуклеозида 5а присутствовал резонансный сигнал трифторметильной группы в виде квартета низкой интенсивности с константой спин-спинового взаимодействия (КССВ) 1JC–F = 31 Гц. В 13С-ЯМР спектре пентафторзамещенного дезоксинуклеозида 5b присутствовали резонансные сигналы ядер 13С фенильной группы в виде трех широких дублетов с КССВ 1JC–F порядка 250 Гц. В 19F-ЯМР спектре сигнал трифторметильной группы соединения 5а был разрешен в виде синглета с химическим сдвигом δ = 61.4 м.д. 19F-ЯМР спектр пентафторзамещенного нуклеозида 5b показывает сложное спин-спиновое взаимодействие: дублет дублетов для ядер 19F в орто-положении фенильного заместителя с КССВ 3JF–F = 22 Гц, 4JF–F = 6 Гц, триплет дублетов для ядер 19F в мета-положении с КССВ 3JF–F = 22 Гц, 4JF–F = 6 Гц и триплет для ядер 19F в пара-положении фенильного кольца с КССВ 3JF–F = 22 Гц. Наличие пентафторзамещенного фрагмента в составе структуры 5b подтверждалось также спектром 1Н-ЯМР, в котором не наблюдались резонансные сигналы протонов фенильной группы.
В настоящее время проводится изучение противовирусной активности полученных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для проведения реакций и выделения веществ использовались коммерчески доступные реагенты и растворители. Ход реакции контролировали с помощью ВЭЖХ-анализа на приборе Стайер-М (Аквилон, Россия). Условия ВЭЖХ анализа: колонка 4.6 × 250 мм (Nucleosil 100-5 C18, 5 мкм, Macherey-Nagel GmbH&Co. KG) линейный градиент ацетонитрила в 10 мМ растворе ацетата натрия в деионизированной воде от 2 до 60% в течение 25 мин (с дальнейшей промывкой в системе 60–80% ацетонитрил/10 мМ NaOAc в H2O за 25–25.1 мин, затем 80–2% за 25.1–25.9 мин) при скорости потока 1 мл/мин, УФ детекция производилась при 265 нм, объем пробы 20 мкл. ЯМР-спектры регистрировали на приборе Bruker AMX 400 (Германия). Величины констант спин – спинового взаимодействия (КССВ, J) измерены в герцах (Гц). При описании спектров ЯМР приняты следующие сокращения: с – синглет, ус – уширенный синглет, д – дублет, дд – дублет дублетов, ддд – дублет дублетов дублетов, т – триплет, дт – дублет триплетов, м – мультиплет. Калибровку спектров 1Н- и 13С-ЯМР проводили по остаточному сигналу растворителя DMSO-d6 (2.50 и 39.52 м.д).
Получение N6-(2,3,4,5,6-пентафторбензил)аденина (2b)
К смеси N6-(2,3,4,5,6-пентафторбензил)аденозина 1b (95 мг, 0.212 ммоль) и KH2AsO4 (38 мг, 0.212 ммоль, 1 экв) в 50 мМ трис-HCl буфере pH 7.5 (10 мл) добавляли ПНФ (0.050 мл, 5 единиц активности) и выдерживали смесь при 50°C в течение 20 ч. В ходе реакции наблюдались растворение исходного нуклеозида и кристаллизация продукта. Через 20 ч реакционную смесь остужали до комнатной температуры и выдерживали 24 ч при +4°C. Выпавший осадок фильтровали, промывали водой (5 × 5 мл) и сушили в вакуумном эксикаторе над P2O5 в течение суток. Выход 57 мг (85%) в виде белого порошка. Rf = 0.4 (CH2Cl2: EtOH-95: 5 ${v}{\text{/}}{v}$). 1H–ЯМР (300 МГц, DMSO-d6): δ = 12.96 (уш с, 1H, N9H), 8.21 (с, 1H, H2-Ade), 8.15 (уш с, 1H, N6H), 8.11 (с, 1H, H8-Ade), 4.83 (уш с, 1H, N6CH2). 19F-ЯМР (282 МГц, DМSO-d6): δ = –142.50 (дд, 3JF–F = 24.0 Гц, 4JF–F = 7.9 Гц), –156.85 (т, 3JC–F = = 22.1), –163.68 (тд, 3JF–F = 23.1 Гц, 4JF–F = 7.8 Гц).
Получение N6-(3-трифторметилбензил)аденина (2a)
Методика аналогична получению N6-(2,3,4,5,6–пентафторбензил)аденина (2b), исходя из N6-(3-трифторметилбензил)аденозина (1a) (100 мг, 0.235 ммоль). Выход 2а 63 мг (91%) в виде белого порошка. Rf = 0.42 (CH2Cl2:EtOH – 95:5 ${v}{\text{/}}{v}$). 1H–ЯМР (300 МГц, DMSO-d6): δ = 12.95 (уш с, 1H, N9H), 8.29 (уш с, 1H, N6H), 8.17 (с, 1H, H2–Ade), 8.12 (с, 1H, H8-Ade), 8.0–7.4 (м, 4H, Ph), 4.81 (уш с, 1H, N6CH2). 19F-ЯМР (282 МГц, DМSO-d6): δ = = –61.00.
Получение N6-(3-трифторметилбензил)- 2'-дезоксиаденозина (5a)
К 70 мл раствора 7-метил-2'-дезоксигуанозина (41.82 мг, 0.102 ммоль), мета-трифторметилбензиладенина (20.00 мг, 0.068 ммоль) и дигидрофосфата калия (2.32 мг, 0.017 ммоль) в 50 мМ Трис-HCl-буфере (pH 7.5) с добавлением 10% (об.) ДМСО при комнатной температуре добавляли 0.98 ед. ПНФ E. coli (10 мкл раствора 1.0 мг/мл-Sigma с концентрацией 98 ед/мл), аккуратно перемешивали 5 мин и оставляли при комнатной температуре на 24 ч. Выпавший осадок 7-метилгуанина отфильтровывали через нейлоновую мембрану Phenomenex (диаметр 47 мм, размер пор 0.2 мкм). Отфильтрованный прозрачный раствор упаривали в вакууме до объема ~7 мл, разбавляли водой (7 мл) и наносили на колонку с обращенно-фазным сорбентом C18. Выход: 99% (ВЭЖХ, количественный). Колонку промывали смесью вода : этанол с градиентом концентрации этанола 0–20%. Продукт элюировали в системе вода : этанол-60: 40. Фракции, содержащие продукт, объединяли, упаривали в вакууме, соупаривали с этанолом. Выход после выделения и очистки составил 26 мг (86%) в виде пены. 1H-ЯМР (400 МГц, DMSO-d6): δ = 8.51 (уш с, 1H, N6H-Ade), 8.38 (с, 1H, H2-Ade), 8.21 (с, 1H, H8-Ade), 7.71 c (1H, о-Н, Ph), 7.65 д (1Н, 3J = 7.2, p-H, Ph), 7.60–7.49 м (2H, Ph), 6.36 дд (1H, J1'2'a= 7.6, J1'2'b = 6.2, H-1'), 5.32 уш с (1H, 3'-OH), 5.19 уш.с (1H, 5'-OH), 4.79 уш с (2H, CH2), 4.46–4.38 м (1H, H-3'), 3.89 тд (1Н, J4'5'а = J4'3' = 4.2, J4'5'b = 2.6, H-4'), 3.62 уш.д. (1Н, J5'а5'b = –11.7, H-5'a), 3.52 уш.д. (1Н, J5'b5'a = –11.7, H-5'b), 2.73 ддд (1Н, J2'а2'b= –13.3, J2'а1'= 7.6, J2'b3' = = 5.9, H-2'а), 2.27 ддд (1Н, J2'b2'a= –13.3, J2'b1'= 6.2, J2'b3' = 2.6, H-2'b). 13-C-ЯМР (150 МГц, DMSO-d6): 154.37 (C-2), 152.32 (C-4), 141.59 (C-6), 139.74 (C-8), 131.33 (Ph), 129.29 (Ph), 128.90 q (1JC–F = 31.4, CF3), 123.65 q (3JC–F = 3.8, Ph), 123.43 q (3JC–F = 3.7, Ph), 119.68 (C-5), 88.03 (C-1'), 83.97 (C-3'), 70.94 (C-4'), 61.87 (C-5'), 42.62 (CH2), 39.47 (C-2'). 19F-ЯМР (282 МГц, DМSO-d6): δ = ‒61.04.
Получение N6-(2,3,4,5,6-пентафторфенил-1-метил)-2'-дезоксиаденозина (5b)
Методика аналогична предыдущей, исходя из N6-(2,3,4,5,6-пентафторбензил)аденина (20.00 мг, 0.064 ммоль). Очистку проводили на колонке с обращенно-фазным сорбентом С18 с использованием в качестве подвижной фазы смеси вода : этанол с градиентом концентрации этанола 0–20%. Выход 13 мг (47%) в виде белой серебристой пены. 1H-ЯМР (400 МГц, DMSO-d6): δ = 8.37 (с, 1H, H2-Ade), 8.35 (уш с, 1H, N6H-Ade), 8.25 (с, 1H, H8-Ade), 6.35 дд (1H, J1'2'a= 7.6, J1'2'b = 6.2, H-1'), 5.30 уш с (1H, 3'-OH), 5.14 уш.т (1H, J5'OH = 4.2, 5'-OH), 4.82 уш с (2H, CH2), 4.45–4.37 м (1H, H-3'), 3.87 тд (1Н, J4'5'а = J4'3' = 4.3, J4'5'b = 2.8, H-4'), 3.62 уш.д. (1Н, J5'а5'b = –11.7, H-5'a), 3.55–3.45 м (1Н, H-5'b), 2.72 ддд (1Н, J2'а2'b= –13.3, J2'а1'= 7.7, J2'b3' = 5.8, H-2'а), 2.27 ддд (1Н, J2'b2'a= –13.3, J2'b1'= 6.1, J2'b3' = 2.8, H-2'b). 13C-ЯМР (150 МГц, DMSO-d6): 153.85 (C-2), 152.14 (C-4), 148.57 (C-6), 145.10 дддд (1JC–F = = 245.8, 2JC–F = 13.2, 2JC–F = 9.1, 3JC–F = 3.9, орто-С6F5), 139.79 (C-8), 139.68 дддд (1JC–F = 250.5, 2JC–F = = 13.7, 2JC–F = 12.4, 3JC–F = 5.6, мета-С6F5), 136.69 дтт (1JC–F = 248.8, 2JC–F = 12.6, 3JC–F = 3.9, пара-С6F5), 119.65 (C-5), 113.01 т (2JC–F = 17.6, C-1-C6F5), 87.98 (C-1'), 83.88 (C-3'), 70.88 (C-4'), 61.81 (C-5'), 39.42 (C-2'), 32.22 (CH2). 19F-ЯМР (282 МГц, DМSO-d6): δ = –142.50 дд (3JF–F = 22 Гц, 4JF–F = 6 Гц), ‒156.74 т (3JF–F = 22 Гц), –163.65 тд (3JF–F = 22 Гц, 4JF–F = 6 Гц).
ВЫВОДЫ
В ходе работы был проведен сравнительный анализ условий трансгликозилирования в присутствии нуклеозидфосфорилаз E. coli, который позволил оптимизировать условия ферментативного синтеза N6-пентафторфенилметил-2'-дезоксиаденозина и N6-(3-трифторметилбензил)-2'-дезоксиаденозина, потенциальных нуклеозидных ингибиторов репликации энтеровирусов в клетке.
Список литературы
Mikhailopulo I.A., Miroshnikov A.I. Biologically important nucleosides: modern trends in biotechnology and application // Mendeleev CoмMun. 2011. V. 21. № 2. P. 57–68.
Mikhailopulo I.A., Miroshnikov A.I. New trends in nucleoside biotechnology // Acta Naturae. 2010. V. 2. № 5. P. 36–56.
Iglesias L.E., Lewkowicz E.S., Medici R., Bianchi P., Iribarren A.M. Biocatalytic approaches applied to the synthesis of nucleoside prodrugs. // Biotechnol. Adv., 2015. V. 33. № 5. P. 412–434.
Parker W.B. Enzymology of purine and pyrimidine antimetabolites used in the treatment of cancer. // Chem. Rev. 2009. V. 109. № 7. P. 2880–2893.
Goldberg R.N., Tewari Y.B., Bhat T.N. Thermodynamics of enzyme-catalyzed reactions – a database for quantitative biochemistry. // Bioinformatics. 2004. V. 20. P. 2874–2877.
Drenichev M.S., Alexeev C.S., Kurochkin N.N. et al. Use of nucleoside phosphorylases for the preparation of purine and pyrimidine 2'-deoxynucleosides. // Adv. Synth. Catal. 2018. V. 360. P. 305–312.
Kulikova I.V., Drenichev M.S., Solyev P.N., Alexeev C.S. and Mikhailov S.N. Enzymatic Synthesis of 2-Deoxyribose 1-Phosphate and Ribose 1 Phosphate and Subsequent Preparation of Nucleosides. // Eur. J. Org. Chem. 2019. P. 6999–7004.
Alexeev C.S., Kulikova I.V., Gavryushov S. et al. Quantitative prediction of yield in transglycosylation reaction catalyzed by nucleoside phosphorylases. // Adv. Synth. Catal. 2018. V. 360. P. 3090–3096.
Ubiali D., Rocchietti S., Scaramozzino F., Terreni M., Albertini A.M., Fernandez-Lafuente R., Guisa J.M., Pregnolato M. Synthesis of 2’-Deoxynucleosides by Transglycosylation with New Immobilized and Stabilized Uridine Phosphorylase and Purine Nucleoside Phosphorylase. //Adv. Synth. Catal. 2004. V. 346. P. 1361–1366.
Gordon G.E.R., Visser D.F., Brady D., Raseroka N., Moira L., Bode M.L. Defining a process operating window for the synthesis of 5-methyluridine by transglycosylation of guanosine and thymine. // Journal of Biotechnology. 2011. V. 151. P. 108–113.
Serra I., Bavaro T., Cecchinia D.A., Daly S., Albertini A.M., Terrenia M., Ubiali D. A comparison between immobilized pyrimidine nucleoside phosphorylase from Bacillus subtilis and thymidine phosphorylase from Escherichia coli in the synthesis of 5-substituted pyrimidine 2-deoxyribonucleosides. // Journal of Molecular Catalysis B: Enzymatic. 2013. V. 95. P. 16–22.
Cattaneo G., Rabuffetti M., Speranza G., Kupfer T., Peters B., Massolini G., Ubiali D., Calleri E. Synthesis of Adenine Nucleosides by Transglycosylation using Two Sequential Nucleoside Phosphorylase-Based Bioreactors with On-Line Reaction Monitoring by using HPLC. // ChemCatChem. 2017. V. 9. P. 4614–4620.
Bzowska A., Kulikowska E., Shugar D. Properties of Purine Nucleoside Phosphorylase (PNP) of Mammalian and Bacterial Origin. // Zeitschrift für Naturforschung C. A Journal of Biosciences. 1990. V. 45. P. 59–70.
Alexeev C.S., Drenichev M.S., Dorinova E.O., Esipov R.S., Kulikova I.V., Mikhailov S.N. Use of nucleoside phosphorylases for the preparation of 5-modified pyrimidine ribonucleosides. // Biochimica et Biophysica Acta (BBA) – Proteins and Proteomics. V. 1868. P. 140292.
Roivainen J., Elizarova T., Lapinjoki S., Mikhailopulo I.A., Esipov R.S., Miroshnikov A.I. An Enzymatic Transglycosylation of Purine Bases. // Nucleosides, Nucleotides and Nucleic Acids. 2007. P. 905–909.
Zuffi G., Ghisotti D., Oliva I., Capra E., Frascotti G., Tonon G., Orsini G. Immobilized Biocatalysts for the Production of Nucleosides and Nucleoside Analogues by Enzymatic Transglycosylation Reactions. // Biocatalysis and Biotransformation. 2004. V. 22. P. 25–33.
Kulikowska E., Bzowska A., Wierzchowski J., Shugar D. Properties of two unusual, and fluorescent, substrates of purine-nucleoside phosphorylase: 7-methylguanosine and 7-methylinosine. // Biochim. Biophys. Acta. 1986. V. 874. P. 355–363.
Rabuffetti M., Bavaro T., Semproli R., Cattaneo G., Massone M., Morelli C.F., Speranza G., Ubiali D. Synthesis of ribavirin, tecadenoson, and cladribine by enzymatic transglycosylation. // Catalysts. 2019. V. 9. P. 355.
Oslovsky V.E., Drenichev M.S., Sun L., Kurochkin N.N., Kunetsky V.E., Mirabelli C., Neyts J., Leyssen P., Mikhailov S.N. Fluorination of naturally occurring N6-benzyladenosine remarkably increased its antiviral activity and selectivity. // Molecules. 2017. V. 22. № 7. P. 1219.
Kline P.C., Schramm V.L. Purine nucleoside phosphorylase. Catalytic mechanism and transition-state analysis of the arsenolysis reaction. // Biochemistry. 1993. V. 32. № 48. P. 13212–13219.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


