Доклады Российской академии наук. Науки о жизни, 2022, T. 503, № 1, стр. 138-143
Синтетические аналоги 6-бромогипафорина, природного агониста никотиновых холинорецепторов, уменьшают реперфузионное повреждение сердца в модели ишемии миокарда у крыс
Э. Р. Шайхутдинова 1, А. Е. Кондрахина 1, И. А. Иванов 2, Д. С. Кудрявцев 2, И. А. Дьяченко 1, А. Н. Мурашев 1, член-корреспондент РАН В. И. Цетлин 2, Ю. Н. Уткин 2, *
1 Филиал ФГБУН Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова
Пущино, Россия
2 ФГБУН Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова
Москва, Россия
* E-mail: utkin@ibch.ru
Поступила в редакцию 10.11.2021
После доработки 25.11.2021
Принята к публикации 25.11.2021
- EDN: EJOFWX
- DOI: 10.31857/S2686738922020184
Аннотация
Имеющиеся к настоящему времени данные свидетельствуют о том, что активация никотиновых холинорецепторов (нХР) типа α7 может уменьшать повреждения сердца, возникающие в результате ишемии и последующей реперфузии. Нами проведено исследование двух новых синтетических D-аналогов 6-бромогипафорина, являющихся избирательными агонистами α7 нХР, на модели ишемии миокарда у крыс. Острый инфаркт миокарда у животных вызывали путем окклюзии левой коронарной артерии с ее последующей реперфузией при искусственной вентиляции легких. Обнаружено, что один из аналогов оказался более активным и его введение на первой минуте реперфузии приводило к статистически достоверному снижению размера инфаркта. Этот аналог также предотвращал изменение концентрации ионов калия и натрия в крови, характерное для окклюзионно-реперфузионного повреждения. Полученные данные свидетельствуют о перспективности аналогов гипафорина для разработки препаратов, уменьшающих неблагоприятные последствия инфаркта миокарда.
Проблема повышения устойчивости сердца к действию ишемии и реперфузии является одной из наиболее важных задач современной кардиологии, патофизиологии, экспериментальной и клинической фармакологии. Следует отметить, что ишемия длительностью более 10–15 мин сопровождается необратимыми изменениями в кардиомиоцитах и, как следствие, их гибелью, даже в случае возобновления нормальной оксигенации. Постишемическое восстановление кровотока после длительной (30–60 мин) ишемии не только не возвращает метаболические процессы на доишемический уровень, но и усугубляет гипоксическое повреждение отдельных кардиомиоцитов [1, 2]. Учитывая вышесказанное, вполне очевидным является поиск препаратов, предупреждающих развитие ишемических и реперфузионных повреждений при инфаркте миокарда.
Ранее было показано, что повышенная активность блуждающего нерва оказывает кардиопротективное действие против реперфузионного повреждения миокарда, а ацетилхолин (ACh), основной нейротрансмиттер блуждающего нерва в сердце, воспроизводит кардиопротективные эффекты. Активация нейронных или не-нейронных холинергических путей, уменьшающих ишемическое повреждение, происходит посредством двух видов холинорецепторов – мускариновых и никотиновых [3–5]. Мускариновые холинорецепторы относятся к семейству рецепторов, связанных с G-белком (GPCRs – G protein-coupled receptors), а никотиновые к семейству лиганд-управляемых ионных каналов, и оба вида холинорецепторов присутствуют в сердце [6]. В зависимости от субъединичного состава существует несколько типов никотиновых холинорецепторов (нХР). Установлено, что активация нХР миокарда, в частности, нХР типа α7, во время ишемического повреждения может обеспечить терапевтическую защиту, улучшая сократительную функцию сердца и ограничивая размер инфаркта [7].
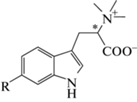
Ранее мы показали, что L-6-бромогипафорин (рис. 1), бром-содержащий аналог индола, является избирательным агонистом нХР типа α7 [8]. Нами получен ряд синтетических аналогов D-6-бромогипафирина, в которых атом брома заменен на другие электронакцепторные заместители (синтез и физико-химические характеристики будут опубликованы отдельно). Некоторые из полученных соединений, в частности аналоги 6ND и 6ID, продемонстрировали более высокую активность как агонисты нХР типа α7, чем природный L-6-бромогипафорин. В данной работе нами проведено исследование двух синтетических аналогов D-6-бромогипафорина (6ND и 6ID) с целью выявления их терапевтического потенциала для уменьшения реперфузионного повреждения после перенесенной ишемии миокарда у экспериментальных животных.
Рис. 1.
Структурная формула 6-бромогипафорина (R = Br) и аналогов 6ND и 6ID (R – электроноакцепторный заместитель). * – асимметрический атом углерода, имеющий L-конфигурацию в 6-бромогипафорине и D-конфигурацию в аналогах 6ND и 6ID.
В опытах использовали самцов крыс аутбредной линии Sprague-Dawley (НПП Питомник лабораторных животных ФИБХ РАН) возрастом 9–11 нед и массой 220–280 г. Все процедуры были одобрены комиссией ФИБХ РАН по контролю над содержанием и использованием лабораторных животных (протокол-заявка №766/20). Для наркотизации использовали уретан (1.5 г/кг внутрибрюшинно). Животным воспроизводили острый инфаркт миокарда путем окклюзии левой коронарной артерии (ЛКА) с ее последующей реперфузией при искусственной вентиляции легких с частотой дыхания 60–65 в минуту и дыхательным объемом 10 мл на 1 кг массы тела (Rodent Ventilator UGO BASILE 7025). Для введения тестируемых веществ и метиленового синего имплантировали катетер в яремную вену, для сбора крови – в правую сонную артерию. Доступ к коронарному сосуду производили путем торакотомии в четвертом межреберье слева. Вскрывали перикард, определяли локализацию общего ствола левой коронарной артерии (ЛКА), под который с помощью атравматической иглы подводили тонкую полиамидную нить (ETHILON 6–0). Для создания обратимой ишемии миокарда из полиэтиленовой трубки РЕ-10 формировали окклюдер [9]. Во время проведения эксперимента поддерживали температуру тела животных на уровне 37 ± 1°C с помощью термостатируемой поверхности.
Для оценки кардиопротективных свойств агонистов α7 нХР животных подвергали 30-минутной окклюзии ЛКА с последующей 90-минутной реперфузией. В момент снятия окклюдера, на первой минуте реперфузии крысам вводили внутривенно 6ND (n = 8) или 6ID (n = 7) в дозах 0.05 мг/кг. Проведенные ранее в лаборатории биологических испытаний ФИБХ РАН исследования показали, что оба соединения в такой дозе снижали воспаление у экспериментальных животных (полученные результаты будут опубликованы отдельно). Объем введения составлял 1 мл на кг веса животного. Контролем (n = 5) служили животные, которым вводился физиологический раствор в эквивалентном объеме. Определение размеров анатомической зоны риска и зоны инфаркта производили с помощью методики “двойного окрашивания” 2% метиленовым синим и 1% хлоридом трифенилтетразолия (ТТХ) [10]. После окончания реперфузии вокруг коронарной артерии вновь затягивали лигатуру и внутривенно вводили раствор метиленового синего до визуализации границы между кровоснабжаемыми и ишемизированными отделами. Далее сердце быстро удаляли, отмывали в физиологическом растворе и разрезали в поперечном направлении на пять срезов одинаковой толщины. Полученные срезы инкубировали в течение 15 мин в растворе ТТХ при температуре 37°C и рН 7.4, затем фиксировали 5 мин в 10% формалине. Окрашенные срезы сканировали на сканере HP Laser Jet 3055 и обрабатывали полученные изображения с использованием программы Image TOOL. В каждом срезе подсчитывались зона инфаркта (неокрашенная ТТХ, находящаяся в пределах зоны риска), зона риска (окрашенная ТТХ) и площадь среза левого желудочка (для определения площади анатомической зоны риска). Общую площадь зоны инфаркта вычисляли по пяти срезам и представляли в процентном отношении от общей площади зоны риска. Затем таким же способом, как и в случае зоны инфаркта, вычисляли долю площади анатомической зоны риска от общей площади левого желудочка для данного сердца.
Кровь в объеме 0.5 мл собирали из артериального катетера до момента окклюзии (исходные значения), а также в конце реперфузионного периода (после окклюзии-реперфузии). Анализ ионов (K+, Na+) выполняли с помощью анализатора электролитов EX-D фирмы JOKOH CO, LTD.
Статистическую обработку данных проводили с использованием пакета программ Statistica 7 for Windows. Данные представляли в виде “среднее ± ± стандартное отклонение”, изменения исследуемых показателей считали статистически значимыми при p < 0.05.
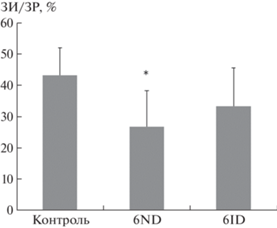
Определение анатомической зоны риска (ЗР) у трех групп животных, контрольных и получавших 6ND или 6ID, не выявило отличий, ее размеры составили 33.7 ± 7.1, 35.6 ± 5.6 и 30.8 ± 11.4%, соответственно, от общей площади левого желудочка, что свидетельствует об одинаковом объеме миокарда, подвергшегося ишемии. В то же время размер зоны инфаркта (ЗИ) различался в контрольной группе и группах, которым вводили исследуемые аналоги 6-бромогипафорина (рис. 2). Так, введение 6ND на первой минуте реперфузии приводило к статистически достоверному снижению размера инфаркта до 26.8 ± 11.5% от зоны риска по сравнению с контролем, в котором эта величина составила 43.2 ± 8.8% (рис. 3). Введение 6ID также оказывало инфаркт-лимитирующее действие (33.3 ± 12.3%), однако менее эффективно.
Рис. 2.
Примеры послойных срезов левого желудочка крыс из контрольной и экспериментальных групп. Бледно-желтые участки зоны инфаркта (не окрашенные ТТХ) находятся в пределах зоны риска, окрашенной ТТХ в ярко кирпичный цвет. Неишемизированный миокард окрашен в темно-синий цвет.

Рис. 3.
Размер зоны инфаркта (ЗИ), выраженный в процентах от зоны риска (ЗР) в экспериментальных группах. * p < 0.05 относительно группы “Контроль” согласно t-тесту Стьюдента для независимых выборок.
Определение содержания электролитов в крови животных выявило изменение концентрации ионов калия и натрия после окклюзионно-реперфузионного повреждения (рис. 4). Так, в контрольной группе наблюдались повышение уровня ионов калия на 19% относительно исходных значений и компенсаторное снижение ионов натрия на 4%, однако это изменение не было статистически значимым. Подобные изменения концентраций наблюдались в группе, получавшей 6ID, тогда как при введении 6ND изменения концентраций ионов были минимальными (снижение концентрации ионов натрия на 0.4%, рис. 3), что свидетельствует о защитном действии соединения 6ND.
Рис. 4.
Изменения концентраций ионов натрия (а) и калия (б) после окллюзионно-реперфузионного повреждения. * p < 0.05 относительно группы “Контроль в конце реперфузии” согласно t-тесту Стьюдента для несвязанных выборок. ** p < 0.05 относительно исходных значений согласно t-тесту Стьюдента для cвязанных выборок.

Имеющиеся данные свидетельствуют о том, что активация нХР ведет к усилению клеточной пролиферации и выживаемости клеток [11, 12]. Тот факт, что активация нХР способствует клеточной пролиферации, позволяет предположить, что агонисты этих рецепторов могли бы применяться для улучшения регенерации тканей и защиты от клеточной гибели. Действительно, никотин и другие агонисты нХР оказывали защитный эффект в отношении нейронов при нейродегенеративных расстройствах [13, 14]. Особый интерес представляют нХР типа α7, так как эти рецепторы экспрессируются различными типами клеток, включая, в частности, иммунные клетки [15] и нейроны [16, 17]. Кроме того, эти рецепторы являются высокопроницаемыми для ионов кальция, что подразумевает их значительную роль в активации внутриклеточных процессов. Ранее было установлено, что активация α7 нХР на макрофагах приводит к снижению выброса ими провоспалительных цитокинов за счет ингибирования сигнального каскада с участием ядерного фактора κB (NF-κB) [18]. С другой стороны, в экспериментах на различных клетках активация нХР вызывала снижение концентрации активных форм кислорода. Возможно, ответственным за этот эффект является путь, включающий активацию α7 типа нХР и гемоксигеназы-1 – фермента, обусловливающего сильный антиоксидантный и антивоспалительный эффект [19]. Как уже отмечалось, активация нХР типа α7 во время ишемического повреждения ограничивает размер инфаркта [7]. Наши данные подтверждают кардиопротекторный эффект активации α7 нХР и показывают наличие такой активности у новых синтетических аналогов 6-бромогипафорина, являющихся селективными агонистами этого типа нХР.
При моделировании острого инфаркта миокарда у экспериментальных животных развиваются повреждения не только наружной клеточной мембраны, но и мембранных структур клеточных органелл, что ведет к мышечной слабости и дисфункции миокарда с последующей фибрилляцией или асистолией желудочков [20]. Выявленная гиперкалиемия у контрольных животных подтверждает аномальный выход ионов во внеклеточное пространство вследствие гибели кардиомиоцитов. Введение 6ND предотвращало развитие этого процесса, снижая, по-видимому, активацию апоптических путей. Также в реперфузионном периоде происходит активация натрий-зависимых регуляторных механизмов – Na+/H+ обменника и Na+/HCO3– котранспортера, приводящая к возрастанию внутриклеточной концентрации ионов натрия. Нами было обнаружено незначительное повышение (0.4%) концентрации ионов натрия при введении соединения 6ND; в контрольной группе и группе, получавшей 6ID, сывороточный уровень натрия снижался на 4%. Эти данные свидетельствуют о положительном эффекте соединения 6ND.
Таким образом, результаты наших исследований позволяют сделать вывод, что введение агониста α7 нХР 6ND в раннем реперфузионном периоде уменьшает размер инфаркта миокарда, повышая резистентность кардиомиоцитов к ишемическим/реперфузионным повреждениям.
Список литературы
Yellon D.M., Hausenloy D.J. Myocardial reperfusion injury // N. Engl. J. Med. 2007. V. 357. P. 1121–1135.
Gunata M., Parlakpinar H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment // Cell Biochem. Funct. 2021. V. 39. № 2. P. 190–217.
La Croix C., Freeling J., Giles A., et al. Deficiency of M-2 muscarinic acetylcholine receptors increases susceptibility of ventricular function to chronic adrenergic stress // Am. J. Physiol.-Heart C. 2008. V. 294. P. 810–820.
Lara A., Damasceno D.D., Pireset R., et al. Dysautonomia due to reduced cholinergic neurotransmission causes cardiac remodeling and heart failure // Mol. Cell. Biol. 2010. V. 30. P. 1746–1756.
Intachai K.C., Chattipakorn S., Chattipakorn N., et al. Revisiting the Cardioprotective Effects of Acetylcholine Receptor Activation against Myocardial Ischemia/Reperfusion Injury // Int. J. Mol. Sci. 2018 V. 19. № 9. P. 2466.
Li D.L., Liu B.H., Sun L., et al. Alterations of muscarinic acetylcholine receptors-2, 4 and α7-nicotinic acetylcholine receptor expression after ischaemia / reperfusion in the rat isolated heart // Clin. Exp. Pharmacol. Physiol. 2010. V. 37. № 12. P. 1114–1119.
Mavropoulos S.A., Khan S.N., Levy A.C.J., et al. Nicotinic Acetylcholine Receptor–Mediated Protection of the Rat Heart Exposed to Ischemia Reperfusion // Mol. Med. 2017. V. 23. P. 120–133.
Kasheverov I.E., Shelukhina I.V., Kudryavtsev D.S., et al. 6-Bromohypaphorine from Marine Nudibranch Mollusk Hermissenda crassicornis is an Agonist of Human α7 Nicotinic Acetylcholine Receptor // Mar. Drugs. 2015. V. 13. P. 1255–1266.
Zhang Y., Gu E., Zhang J., et al. Role of p38 mitogen activated protein kinases in cardioprotection of morphine preconditioning // Chinese Medical Journal. 2007. V. 120. P. 777–781.
Schwarz E.R., Somoano Y., Hale S.L., et al. What is the required reperfusion period for assessment of myocardial infarction size using triphenyltetrazolium chloride staining in the rat // J. Thromb. Thrombolysis 2000. V. 10. P. 181–187.
Kaneko N., Okano H., Sawamoto K. Role of the cholinergic system in regulating survival of newborn neurons in the adult mouse dentate gyrus and olfactory bulb // Genes Cells. 2006. V. 11. № 10. P. 1145–1159.
Mashimo M., Iwasaki Y., Inoue S., et al. Acetylcholine released from T cells regulates intracellular Ca2+, IL-2 secretion and T cell proliferation through nicotinic acetylcholine receptor // Life Sci. 2017. V. 172. P. 13–18.
Picciotto M.R., Zoli M. Neuroprotection via nAChRs: the role of nAChRs in neurodegenerative disorders such as Alzheimer’s and Parkinson’s disease // Front. Biosci. 2008. V. 13. P. 492–504.
Echeverria V., Yarkov A., Aliev G. Positive modulators of the α7 nicotinic receptor against neuroinflammation and cognitive impairment in Alzheimer’s disease // Prog. Neurobiol. 2016. V. 144. P. 142–157.
Shen J.X., Yakel J.L. Functional alpha7 nicotinic ACh receptors on astrocytes in rat hippocampal CA1 slices // J. Mol. Neurosci. 2012. V. 48. P. 14–21.
Corradi J., Bouzat C. Understanding the Bases of Function and Modulation of α7 Nicotinic Receptors: Implications for Drug Discovery // Mol. Pharmacol. 2016. V. 90. P. 288–299.
Levin E.D. α7-Nicotinic receptors and cognition // Curr. Drug Targets. 2012. V. 13. P. 602–606.
Yue Y., Liu R., Cheng W., et al. GTS-21 attenuates lipopolysaccharide-induced inflammatory cytokine production in vitro by modulating the Akt and NF-κB signaling pathway through the α7 nicotinic acetylcholine receptor // Int. Immunopharmacol. 2015. V. 29. № 2. P. 504–512.
Egea J., Buendia I., Parada E., et al. Anti-inflammatory role of microglial alpha7 nAChRs and its role in neuroprotection // Biochem. Pharmacol. 2015. V. 97. P. 463–472.
Moens A.L., Clayes M.J., Timmermans J.P. Myocardial ischemia/reperfusion-injury, a clinical view on a complex pathophysiological process // Int. J. Cardiol. 2005. V. 100. P. 179–190.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


