Доклады Российской академии наук. Науки о жизни, 2022, T. 503, № 1, стр. 152-160
Антимикробная активность липидных экстрактов иглокожих залива Нячанг (Южно-Китайское море)
Е. С. Обухова 1, 2, *, А. М. Рожина 2, В. П. Воронин 1, П. Ю. Дгебуадзе 3, С. А. Мурзина 1, **
1 Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр Российской академии наук”
Петрозаводск, Россия
2 Петрозаводский государственный университет, Медицинский институт
Петрозаводск, Россия
3 Институт проблем экологии и эволюции
им. А.Н. Северцова Российской академии наук
Москва, Россия
* E-mail: Obyhova_elena@mail.ru
** E-mail: murzina.svetlana@gmail.com
Поступила в редакцию 22.10.2021
После доработки 01.12.2021
Принята к публикации 01.12.2021
- EDN: NQGONI
- DOI: 10.31857/S2686738922020160
Аннотация
Представлены результаты изучения антимикробной активности липидных экстрактов тканей морских звезд Linckia laevigata и Culcita novaeguineae и морского ежа Diadema setosum залива Нячанг (Южно-Китайское море) в отношении нозокомиальных штаммов Klebsiella pneumoniae, Enterococcus faecium, Escherichia coli, Pseudomonas aeruginosa, Candida sp., Streptococcus pyogenes, Staphylococcus aureus. Определено действие исследуемых экстрактов на грамположительные, грамотрицательные микроорганизмы, а также дрожжеподобные грибы рода Candida. Установлено, что липидные экстракты иглокожих залива Нячанг обладают наибольшей антимикробной активностью в отношении грамположительных микроорганизмов, а именно – Streptococcus pyogenes.
Открытие антибиотиков ознаменовало новую эру в медицине, однако спустя десятилетия бактериальные инфекции остаются глобальной угрозой для здравоохранения, ввиду увеличивающейся антибиотикорезистентности микроорганизмов [1, 2], поэтому необходим поиск новых биологически активных соединений, обладающих антимикробными свойствами [3].
Наряду с перспективностью изучения антимикробных пептидов, механизм действия которых связан с нарушением структуры бактериальной плазматической мембраны [4], в качестве потенциальных антимикробных агентов в настоящее время рассматриваются вещества липидной природы. Помимо хорошо известной значимости полиненасыщенных жирных кислот омега-3 (ω-3 ПНЖК) для питания и здоровья человека, для этой группы соединений установлена противовоспалительная и антиоксидантная активность [5]. Механизмы антибактериальных свойств ПНЖК определяются их воздействием на цитоплазматическую и наружную мембраны бактериальных клеток и включают нарушение цепи переноса электронов, разобщение окислительного фосфорилирования, ингибирование активности ферментов, нарушение транспорта питательных веществ и перекисное окисление, впоследствии приводящие к гибели бактериальной клетки [6].
Альтернативными и сравнительно безопасными источниками “морских” липидов, перспективных с точки зрения их антибактериальной активности, могут выступать иглокожие, широко распространенные в тропических экосистемах, многие из которых являются популярными объектами аквакультуры региона Индо-Вест Пацифики.
В настоящей работе изучена антимикробная активность липидных экстрактов тканей (печень и гонады) морских звезд – Linckia laevigata (Linnaeus, 1758) и Culcita novaeguineae Müller & Troschel, 1842, а также морского ежа Diadema setosum (Leske, 1778) – массово встречающихся видов в заливе Нячанг (Южно-Китайское море).
Выделение общих липидов из тканей исследуемых видов иглокожих: L. laevigata и C. novaeguineae – печень (n = 15), D. setosum (n = 15) проводили методом Дж. Фолча [7]. Анализ отдельных липидных классов проводили методом высокоэффективной тонкослойной хроматографии (ВЭТСХ), индивидуальные фракции фосфолипидов анализировали методом высокоэффективной жидкостной хроматографии (ВЭЖХ), а также проведено полное жирнокислотное профилирование общих липидов методом газовой хроматографии (ГХ) [8]. В исследовании использовано научное оборудование ЦКП КарНЦ РАН. Полученные данные о составе липидов и жирных кислот исследуемых тканей сопоставляли с результатами антимикробной активности. Для чего после удаления хлороформ-метанольной смеси к липидным экстрактам добавляли диметилсульфоксид (ДМСО) в концентрациях 30, 50 и 90%. Разные концентрации ДМСО были взяты в связи с тем, что ДМСО является антимикробным агентом и в медицинской практике используется для лечения инфекционных заболеваний в разных концентрациях в зависимости от типа инфекции. ДМСО добавляли к экстрактам для создания эмульсии, которая позволяет капельно наносить экстракты на чашки Петри с микроорганизмами.
Скрининг противомикробной активности липидных экстрактов исследуемых тканей иглокожих осуществляли в отношении нозокомиальных штаммов Klebsiella pneumoniae, Enterococcus faecium, Escherichia coli, Pseudomonas aeruginosa, Streptococcus pyogenes, Staphylococcus aureus, Candida sp., выделенных из многопрофильного стационара г. Петрозаводска. Исследуемым материалом для выделения культур служили раневое отделяемое (E. coli, E. faecalis), моча (Str. pyogenes, Ps. aeruginosa), мокрота (Kl. pneumoniae, Candida sp., S. aureus). В отношении всех изолированных микроорганизмов предварительно была определена чувствительность к антимикробным препаратам в соответствии со стандартными методиками (табл. 1).
Таблица 1.
Чувствительность микроорганизмов к антибиотикам
| Микроорганизм | Профиль чувствительности к антибиотикам | Профиль резистентности к антибиотикам |
|---|---|---|
| E. coli | ЦОС, ЛЕВ, АС, CZA | ЦРО, ЦТК, ЦПМ, ЦИП, ЦФЛ, ЦОМ, АМП, ПИП, ЦАЗ, АТМ, ТС, АКК |
| Kl. pneumoniae | МПН, ИМ, CZA | ГЕН, АН, ЦРО, ЦТК, ЦПМ, ЦИП, ЦОС, ЦФЛ, ЦОМ, АМП, ПИП, ЛЕВ, ЦАЗ, АТМ, ТС, АКК, АС |
| Candida sp. | ФКН, AMB, KCA, MCL | |
| Ps. aeruginosa | ЦПМ, ЦАЗ, CZA, ИМ, МПН, АТМ, ЦИП, АН | |
| S. aureus | ОКС, ЛЗД, ЦОС, ЦИП, АН, ТС | ПЕН, ЛЕВ |
| Str. pyogenes | ПЕН, ВА, ТС, ЛЗД | ЛЕВ, ЭРИ |
| E. faecalis | АМП, ВА, ИМ | ЛЗД |
Примечание: AMB – Амфотерицин В, KCA – Кетоконазол, MCL – Миконазол, ГЕН – Гентамицин, МПН – Меропенем, ИМ – Имипенем, АН – Амикацин, ЦРО – Цефтриаксон, ЦТК-Цефотаксим, ЦПМ – Цефепим, ЦИП – Ципрофлоксацин, ЦОС – Цефокситин, ЦФЛ – Цефалексин, ЦОМ – Цефуроксим, АМП – Ампициллин, ПИП – Пиперациллин, ЛЕВ – Левомицитин, ЦАЗ – Цефтазидим, АТМ – Азтреонам, ТС – Триметоприм/сульфометоксазол, АКК – Амоксициллин/клавулановая кислота, АС – Ампициллин/сульбактам, CZA – Цефтазидим/авибактам, ЛЗД – Линезолид, ОКС – Оксациллин, ПЕН – Бензилпенициллин, ФКН – Флуконазол, ВА – Ванкомицин, ЭРИ – Эритромицин.
Для приготовления инокулюма использовали суточные культуры бактерий, выросшие на плотной питательной среде, которые суспендировали в стерильном физиологическом растворе до получения микробной взвези плотностью 0.5 по стандарту МакФарланда. Бактериальную суспензию стерильным ватным тампоном сеяли газоном на агар Мюллер-Хинтона.
Засеянную микроорганизмами чашку Петри делили на 6 секторов, в 5 секторов вносили по 50 мкл липидных экстрактов, которые предварительно были растворены в ДМСО 30, 50 или 90% концентрации, в 6-й сектор вносили только ДМСО 30, 50 или 90% концентрации, соответственно, в качестве контроля. Посевы инкубировали при 37° C в течение 24 ч, Candida sp. – 48 ч.
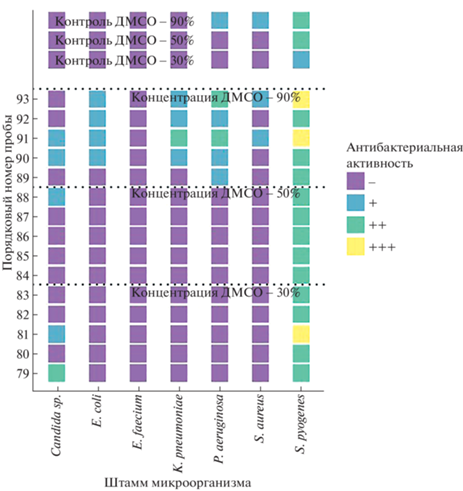
Зону задержки роста определяли визуально по следующей шкале: “–” – отсутствие действия, зона задержки роста отсутствует; “+” – бактериостатическое действие, отмечается подавление роста; “++” – неполное бактерицидное действие, отмечается подавление роста, визуализируются единичные колонии; “+++” – полное бактерицидное действие, полное подавление роста. На рис. 1, 2 представлены результаты качественного эксперимента, построенного по принципу наличия/отсутствия эффекта бактерицидного действия. Каждая проба была нанесена в 3-повторностях, полученный результат посева оценен по “шкале бактериостатического действия” по сравнению с контрольной пробой и усреднен. Для каждого штамма микроорганизма был проведен частотный анализ для выявления максимальной антимикробной активности при разных концентрациях ДМСО в липидных экстрактах иглокожих. В ходе эксперимента было обследовано 189 чашек Петри.
Установлено, что липидные экстракты иглокожих залива Нячанг проявляют наибольшее антимикробное действие в отношении S. pyogenes (рис. 3–5). Так, на рис. 3 показано, что липидные экстракты морской звезды C. novaeguineae образец № 81 (совместно с ДМСО в концентрации 30%) и образцы № 91 и № 93 (концентрация ДМСО 90%) проявляли полное бактерицидное действие в отношении S. pyogenes, в то время как в контроле отмечали бактериостатическое действие раствора ДМСО 30% и неполное бактерицидное действие раствора ДМСО 90%. Действие экстрактов иглокожих D. setosum и L. laevigata в концентрации ДМСО 30% на изучаемый микроорганизм варьировало от неполного до полного бактерицидного эффекта, в то время как в контроле фиксировали либо отсутствие, либо бактериостатическое действие образцов (рис. 4, 5). Ряд экстрактов D. setosum в концентрациях ДМСО 30 и 50% бактериостатически действовал на изоляты S. aureus и Candida sp. при отсутствии действия в контрольных пробах (рис. 4). При изучении антибактериального действия липидных экстрактов на грамотрицательные микроорганизмы K. pneumoniae, E. coli и P. aeruginosa обнаружен бактериостатический и неполный бактерицидный эффект некоторых экстрактов C. novaeguineae в концентрации ДМСО 90%, в то время как в контрольных пробах фиксировали отсутствие действия (рис. 3). Экстракты D. setosum бактериостатически действовали на P. aeruginosa и E. coli при концентрации ДМСО 90% (рис. 4) аналогичное действие на P. aeruginosa установлено для липидных экстрактов морской звезды L. laevigata (рис. 5). В отношении E. faecium антимикробное действие липидных экстрактов L. laevigata, D. setosum и C. novaeguineae не установлено (рис. 3–5).
Исследованные виды иглокожих различались содержанием общих липидов (ОЛ) и количественным составом липидных классов (табл. 2). Так, наибольшее количество ОЛ показано для морского ежа D. setosum (25% сухого вещества) за счет, преимущественно, неполярных липидов – триацилглицеринов (5.87%), которые, как известно, практически не проявляют антимикробного действия. Для морских звезд L. laevigata и C. novaeguineae содержание ОЛ составило 14.2 и 13.8% соответственно. Доминирующими классами липидов у морских звезд являлись свободные жирные кислоты, фосфолипиды и холестерин, антимикробные свойства которых достаточно выражены. Так, свободные жирные кислоты участвуют в метаболических процессах, приводящих к подавлению передачи сигналов от клетки к клетке, препятствуя их адгезии и формированию бактериальной пленки [9]. Жирнокислотный профиль общих липидов морских звезд характеризовался доминированием полиненасыщенных ЖК, ПНЖК, (45% суммы ЖК – C. novaeguineae и 52% – L. laevigata) за счет превалирования n-6ПНЖК (20 и 16% соответственно), в которых основной являлась арахидоновая ЖК, 20:4(n-6), содержание мононенасыщенных ЖК, МНЖК, варьировало от 30 до 34% за счет 20:1(n-11), 18:1(n-9), 18:1(n-7), количество насыщенных ЖК, НЖК составило от 18 до 21% с доминированием 18:0, 16:0 и 20:0. Обнаружено, что ЖК-профиль морского ежа отличался от такового у морских звезд доминированием НЖК (42% суммы ЖК) за счет 16: 0 и 14:0 (24 и 8% соответственно), затем в количественном отношении следовали ПНЖК (31.5%), где n-6ПНЖК составляли 18% за счет 20: 4(n-6), содержание МНЖК – 26% за счет доминирования 16: 1(n-7) (табл. 3). Имеются сведения о том, что ненасыщенные ЖК в большей степени активны в отношении грамположительных бактерий и антимикробные свойства ЖК повышаются с увеличением их ненасыщенности и связаны с положением двойной связи [10]. Следует упомянуть, что выраженные антимикробные свойства арахидоновой кислоты и ее производных – эйкозаноидов, а также эйкозапентаеновой и докозагексаеновой кислот, выделенных из разных источников, хорошо известны, при этом механизм их действия достаточно широк и многофакторен [11].
Таблица 2.
Содержание общих липидов и липидных классов (фосфолипиды, триацилглицерины, диацил-глицерины, эфиры холестерина, холестерин, свободные жирные кислоты) (% сухого вещества) в исследованных тканях некоторых видов иглокожих (Linckia laevigata, Diadema setosum, Culcita novaeguineae)
| Вид | Linckia laevigata | Diadema setosum | Culcita novaeguineae |
|---|---|---|---|
| n | 15 | 15 | 15 |
| ОЛ | 14.20 ± 0.90 | 24.98 ± 1.02 | 13.80 ± 0.53 |
| ФЛ | 3.26 ± 0.26 | 3.38 ± 0.21 | 3.10 ± 0.12 |
| МАГ | 1.35 ± 0.11 | 1.42 ± 0.14 | 1.36 ± 0.04 |
| ДАГ | 0.40 ± 0.03 | 3.18 ± 0.26 | 0.51 ± 0.06 |
| ХС | 3.37 ± 0.24 | 4.21 ± 0.23 | 3.53 ± 0.10 |
| СЖК | 3.80 ± 0.31 | 5.53 ± 0.46 | 3.26 ± 0.23 |
| ТАГ | 0.31 ± 0.09 | 5.87 ± 1.12 | 0.75 ± 0.15 |
| ЭХС | 1.70 ± 0.14 | 1.38 ± 0.19 | 1.29 ± 0.05 |
Таблица 3.
Жирнокислотный состав (% от суммы) в исследованных тканях некоторых видов иглокожих (Linckia laevigata, Diadema setosum, Culcita novaeguineae)
| Вид | Linckia laevigata | Diadema setosum | Culcita novaeguineae |
|---|---|---|---|
| n | 5 | 5 | 5 |
| 14:0 | 0.65 ± 0.09 | 8.43 ± 1.10 | 0.46 ± 0.04 |
| 16:0 | 3.82 ± 0.16 | 24.33 ± 0.69 | 4.30 ± 0.64 |
| 17:0 | 1.05 ± 0.07 | 0.95 ± 0.14 | 0.87 ± 0.07 |
| 18:0 | 8.27 ± 0.13 | 5.02 ± 0.13 | 10.10 ± 1.04 |
| 20:0 | 2.67 ± 0.27 | 1.93 ± 0.10 | 3.37 ± 0.29 |
| Σ НЖК | 18.01 ± 0.30 | 42.12 ± 1.03 | 21.25 ± 2.15 |
| 18:1(n-9) | 8.72 ± 0.47 | 3.56 ± 0.78 | 5.23 ± 0.72 |
| 18:1(n-7) | 3.46 ± 0.07 | 3.61 ± 0.16 | 4.49 ± 0.47 |
| 20:1(n-11) | 10.49 ± 0.39 | 3.08 ± 0.21 | 10.73 ± 0.43 |
| 20:1(n-9) | 0.62 ± 0.06 | 3.62 ± 0.22 | 1.19 ± 0.16 |
| Σ МНЖК | 29.98 ± 0.72 | 26.35 ± 0.72 | 33.67 ± 3.20 |
| 14:2(n-9) | 0.65 ± 0.09 | 0.47 ± 0.05 | 0.30 ± 0.04 |
| 16:2(n-9) | 0.73 ± 0.05 | 0.36 ± 0.02 | 0.40 ± 0.07 |
| 18:2(n-9) | 0 | 0 | 1.27 ± 0.31 |
| 20:3(n-9) | 6.16 ± 0.51 | 0.14 ± 0.03 | 0.23 ± 0.04 |
| Σ (n-9)ПНЖК | 8.03 ± 0.42 | 1.32 ± 0.07 | 2.61 ± 0.50 |
| 18:2(n-7) | 4.15 ± 0.22 | 0.06 ± 0.01 | 0.39 ± 0.14 |
| Σ (n-7)ПНЖК | 4.95 ± 0.22 | 0.36 ± 0.01 | 0.97 ± 0.20 |
| 18:2(n-6) | 1.10 ± 0.10 | 1.79 ± 0.12 | 0.67 ± 0.08 |
| 20:4(n-6) | 12.93 ± 0.88 | 12.28 ± 0.29 | 17.90 ± 1.46 |
| Σ (n-6)ПНЖК | 15.91 ± 0.90 | 18.10 ± 0.63 | 19.98 ± 1.37 |
| 18:2(n-4) | 6.68 ± 0.39 | 0.11 ± 0.02 | 0.70 ± 0.21 |
| 18:3(n-4) | 1.52 ± 0.69 | 0.04 ± 0.02 | 2.21 ± 0.30 |
| Σ (n-4)ПНЖК | 10.45 ± 0.89 | 0.86 ± 0.13 | 6.24 ± 0.51 |
| 18:3(n-3) | 0 | 0.89 ± 0.08 | 0.73 ± 0.27 |
| 18:4(n-3) | 2.48 ± 0.20 | 1.73 ± 0.17 | 0 |
| 20:5(n-3) | 6.24 ± 0.15 | 5.01 ± 0.30 | 8.76 ± 0.70 |
| 22:5(n-3) | 0.45 ± 0.21 | 0.27 ± 0.02 | 0.88 ± 0.54 |
| 22:6(n-3) | 0.83 ± 0.04 | 1.25 ± 0.05 | 1.35 ± 0.51 |
| Σ (n-3)ПНЖК | 12.67 ± 0.19 | 10.85 ± 0.51 | 14.78 ± 0.97 |
| Σ ПНЖК | 52.01 ± 0.53 | 31.5 ± 0.73 | 45.08 ± 1.23 |
Результаты проведенных исследований свидетельствуют о том, что липидные экстракты иглокожих залива Нячанг обладают наибольшей антимикробной активностью в отношении грамположительных бактерий, а именно – S. pyogenes.
Показано, что исследуемые гидробионты различались как качественным, так и количественным составом липидов и жирных кислот, при этом проявляя схожее противомикробное действие. Так, липидный профиль морских звезд был схож и характеризовался исключительным доминированием ФЛ, ХС и СЖК, далее следовали ЭХС и МАГ, минорными классами являлись ТАГ и ДАГ. Другой состав липидов отличал морского ежа, который характеризовался доминированием ТАГ, СЖК, затем следовал ХС, далее общие ФЛ и меньше всего было МАГ и ЭХС. При этом количественные различия по содержанию исследованных липидов у морского ежа более ровные по сравнению с морскими звездами: количество ФЛ, ХС и СЖК в 2.8 раза выше, чем ЭХС и МАГ. Установленное антимикробное действие исследованных видов морских звезд, вероятно, обусловлено повышенным содержанием свободных жирных кислот и фосфолипидов, а также ПНЖК (от 45 до 52% суммы ЖК), в частности “омега-6” ПНЖК, которые доминировали в ЖК-профиле этих гидробионтов.
Интересно, что при изучении антибактериального действия экстрактов морского ежа установлено его действие на S. pyogenes, при этом доминирующими классами липидов являлись ТАГ и метаболически лабильными СЖК, что превышает таковое у морских звезд. Жирнокислотный профиль общих липидов отличался доминированием НЖК (42% суммы ЖК) за счет пальмитиновой кислоты, 16: 0, антимикробные свойства которой широко известны [12], далее следовали в значимом количестве ПНЖК (31.5% суммы ЖК), в которых также доминировали (n-6) ПНЖК.
Согласно современным представлениям ПНЖК оказывают значимое антимикробное действие на многие организмы, включая бактерии, вирусы, грибы и некоторые паразиты. При этом есть данные, что ПНЖК обладают также иммуномодулирующим действием в отношении организма человека и способны усиливать как клеточный, так и гуморальный иммунный ответ [11].
Свободные жирные кислоты также принимают участие в формировании противоопухолевого иммунитета за счет увеличения продукции свободных радикалов в опухолевых клетках [13]. Кроме того, в других исследованиях было выявлено, что жирные кислоты оказывают противовоспалительный и ранозаживляющий эффект [14–16].
Антибактериальные и иммуномодулирующие свойства ПНЖК, содержащихся в липидных экстрактах иглокожих, делают их перспективными объектами для создания антимикробных средств для лечения инфекций разной локализации. При этом вероятным способом применения подобных средств будет являться наружный способ ввиду возможных процессов биотрансформации экстрактов при инъекционном или пероральном применении. В работе Л.Ю. Лаженцевой представлены результаты клинических испытаний нового антимикробного препарата из липидов морских рыб в качестве наружного антисептика в комплексной терапии местных гнойно-воспалительнх заболеваний кожи, мягких тканей и слизистых оболочек, показана эффективность препарата при гнойно-воспалительных раневых процессах, урогенитальных заболеваниях и микробной экземе [17].
Результаты исследования антимикробной активности иглокожих залива Нячанг представляют интерес с точки зрения изучения механизмов действия данных экстрактов, а также поиска различных композиций липидов и их жирнокислотных компонентов, обладающих антибактериальным действием, в том числе в отношении антибиотикорезистентных штаммов микроорганизмов.
Список литературы
Hiltunen T., Virta M., Laine A.L. Antibiotic resistance in the wild: an eco-evolutionary perspective // Philosophical Transactions of the Royal Society B: Biological. 2017. V. 372. № 1712. P. 1–7.
Данилов А.И., Жаркова Л.П. Антибиотикорезистентность: аргументы и факты // Клиническая фармакология и терапия. 2017. Т. 26. № 5. С. 6–9.
Reygaert W.C. An overview of the antimicrobial resistance mechanisms of bacteria //AIMS Microbiology. 2018. V. 4. № 3. P. 482–501.
Mwangi J., Hao X., Lai R., et al. Antimicrobial peptides: new hope in the war against multidrug resistance // Zoological Research. 2019. V. 40. № 6. P. 488–505.
Coraça-Huber D.C., Steixner S., Wurm A., et al. Antibacterial and Anti-Biofilm Activity of Omega-3 Polyunsaturated Fatty Acids against Periprosthetic Joint Infections-Isolated Multi-Drug Resistant Strains // Biomedicines. 2021.V. 9. № 4. P. 334.
Desbois A.P., Smith V.J. Antibacterial free fatty acids: activities, mechanisms of action and biotechnological potential // Appl Microbiol Biotechnol. 2010. V. 85. № 6. P. 1629–1642.
Folch J., Lees M., Sloan-Syanley G.H. A simple method for the isolation and purification of total lipids from animal tissue (for brain, liver and muscle) // J. Biol. Chem. 1957. V. 226. P. 497–509.
Nemova N.N., Nefedova Z.A., Pekkoeva S.N., et al. The Effect of the Photoperiod on the Fatty Acid Profile and Weight in Hatchery-Reared Underyearlings and Yearlings of Atlantic Salmon Salmo salar L. // Biomolecules. 2020. V. 10. № 6. P. 845.
Inguglia L., Chiaramonte M., Di Stefano V., et al. Salmo salar fish waste oil: fatty acids composition and antibacterial activity // PeerJ. 2020. V. 8. P. 9299.
Рыбин В.Г., Блинова Ю.Г. Антимикробные свойства липидов // Известия Тихоокеанского научно-исследовательского рыбохозяйственного центра. 2001. Т. 129. С. 179–196.
Das U.N. Arachidonic acid and other unsaturated fatty acids and some of their metabolites function as endogenous antimicrobial molecules: a review // Journal of Advanced Research. 2018. V. 11. P. 57–66.
Casillas-Vargas G., Ocasio-Malavé C., Medina S., et al. Antibacterial fatty acids: An update of possible mechanisms of action and implications in the development of the next-generation of antibacterial agents // Prog Lipid Res. 2021. V. 82. P. 101093.
Ramesh G., Das U.N. Effect of cis-unsaturated fatty acids on Meth-A ascitic tumour cells in vitro and in vivo // Cancer Letters. 1998. V. 123. № 2. P. 207–214.
Nakatsuji T., Kao M.C., Fang J.Y. et al. Antimicrobial property of lauric acid against Propionibacterium acnes: its therapeutic potential for inflammatory acne vulgaris // J. Invest. Dermatol. 2009. V. 129. № 10. P. 2480–8.
Yang H., Chen J., Rathod J. et al. Lauric acid is an inhibitor of Clostridium difficile growth in vitro and reduces inflammation in a mouse infection model // Front Microbiol. 2017. V. 8. P. 2635.
Zhang Z., Wang S., Diao Y. et al. Fatty acid extracts from Lucilia sericata larvae promote murine cutaneous wound healing by angiogenic activity // Lipids Health Dis. 2010. V. 9. P. 24.
Лаженцева Л.Ю. Влияние антимикробного препарата из липидов морских рыб на возбудителей гнойно-воспалительных заболеваний: Дис. … канд. биол. наук. Владивосток; 2000. Доступно по: https://www.dissercat.com/content/vliyanie-antimikrobnogo-preparata-iz-lipidov-morskikh-ryb-na-vozbuditelei-gnoino-vospaliteln. Ссылка активна на 1 декабря 2021.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни