Доклады Российской академии наук. Науки о жизни, 2022, T. 505, № 1, стр. 303-309
ПЕРВЫЙ ДИПЕПТИДНЫЙ МИМЕТИК НЕЙРОТРОФИНА-3: ДИЗАЙН И ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Член-корреспондент РАН Т. А. Гудашева 1, *, Н. М. Сазонова 1, А. В. Тарасюк 1, И. О. Логвинов 1, Т. А. Антипова 1, Д. М. Никифоров 1, П. Ю. Поварнина 1, академик РАН С. Б. Середенин 1
1 Федеральное государственное бюджетное
научное учреждение “НИИ фанрмакологии
имени В.В. Закусова”
Москва, Россия
* E-mail: tata-sosnovka@mail.ru
Поступила в редакцию 02.04.2022
После доработки 04.05.2022
Принята к публикации 04.05.2022
- EDN: HYVEYB
- DOI: 10.31857/S2686738922040059
Аннотация
На основе структуры экспонированного участка 4-й петли нейротрофина-3 создан его димерный дипептидный миметик, гексаметилендиамид бис-(N-моносукцинил-L-аспарагинил-L-аспарагина) (ГТС-301). Новое соединение сходно с полноразмерным нейротрофином, активировало рецепторы TrkC и TrkB. У ГТС-301 выявлена нейропротекторная активность в экспериментах на клетках гиппокампа мыши НТ-22 в условиях окислительного стресса и глутаматной токсичности в концентрациях 10–12 и 10–8 М соответственно и антидепрессантоподобная активность в тесте вынужденного плавания на мышах при 7-дневном внутрибрюшинном введении в дозах 10–40 мг/кг.
Нейротрофин-3 (NT-3), наряду с фактором роста нервов (NGF) и мозговым нейротрофическим фактором (BDNF), играет важную роль в регуляции пролиферации, дифференцировки, миелинизации, поддержании жизнеспособности и фенотипической стабильности нейронов. В отличие от других нейротрофинов, NT-3 взаимодействует со всеми типами Trk рецепторов, активируя преимущественно TrkC, с меньшей аффинностью TrkB и с еще более низкой – TrkA [1]. Многочисленные экспериментальные данные свидетельствуют о высоком терапевтическом потенциале NT-3 для лечения неврологических и психических нарушений, таких как церебральная ишемия, тревожные расстройства, шизофрения, депрессия и др. [2, 3]. В частности, антидепрессантоподобные эффекты NT-3 при введении в зубчатую извилину гиппокампа крыс выявлены в тестах выученной беспомощности и вынужденного плавания [4]. Однако разработка фармакологических препаратов на основе полноразмерных нейротрофинов ограничена в связи с их макромолекулярной белковой природой, плохим проникновением через гематоэнцефалический барьер и низкой устойчивостью в биологических средах. Поэтому альтернативой является создание низкомолекулярных миметиков нейротрофинов.
Целью данной работы было создание фармакологически активного дипептидного миметика NT-3.
По сравнению с NGF и BDNF, число низкомолекулярных миметиков NT-3, известных к настоящему времени, невелико. Так, канадской группой исследователей под руководством Бёрджесса (K. Burgess) и Сарагови (U.H. Saragovi) получены моновалентные миметики-частичные агонисты NT-3 на основе гетероциклических бета-поворотных шаблонов, включающих в себя дипептидные последовательности из первичной структуры NT-3 [5, 6]. Ими же синтезирован ряд бивалентных миметиков NT-3, содержащих в своей структуре фрагменты боковых радикалов аминокислотных остатков (а.к.о.), входящих в состав β-изгибов NT-3 [7, 8]. Поворотная конформация в этих соединениях закреплена с помощью триазольного кольца. Эти миметики активировали TrkC и проявляли нейропротекторный эффект in vitro [6, 8].
Однако в доступной литературе мы не обнаружили данных о фармакологических эффектах низкомолекулярных миметиков NT-3 in vivo.
Ранее в НИИ фармакологии им. В.В. Закусова в целях создания фармакологических средств, обладающих свойствами NGF и BDNF, была предложена стратегия поиска димерных дипептидных миметиков нейротрофинов [9, 10], основная идея которой заключается в конструировании N-ацилдипептидных миметиков бета-поворотных фрагментов петель нейротрофина со стабилизацией поворотной конформации с помощью внутримолекулярной водородной связи между карбонилом N-ацильной группы и NH-группой С-концевого амида. При этом N-ацильная группа представляла собой биоизостер предшествующего а.к.о. Димерная структура нейротрофина имитировалась путем димеризации дипептида олигометилендиамином по С-концу.
Для дизайна миметика NT-3 использовали пространственную информацию из его кристаллической структуры (pdb ID: 1NT3) (рис. 1). Подобно другим членам нейротрофинового семейства NT-3 представляет собой симметричный гомодимер, мономерные единицы которого содержат 7 бета-тяжей, образующих три антипараллельных β-листа. β-Тяжи связаны четырьмя экспонированными наружу нерегулярными участками, называемыми петлями: 1-я (остатки 29–33), 2-я (42–47), 3-я (остатки 58–75) и 4-я (91–97). Наиболее экспонированной является 4-я петля, фрагмент которой –Ser91–Glu92–Asn93–Asn94–Lys95–Leu96– содержит в своей структуре серию поворотных участков. Для конструирования миметика нами был выбран фрагмент –Glu92–Asn93–Asn94– как наиболее экспонированный и поэтому предположительно занимающий геометрически наиболее выгодное для взаимодействия с рецептором положение. При конструировании мы сохраняли дипептидный фрагмент –Asn93–Asn94– как центральный фрагмент бета-поворот-подобного участка, а предшествующий а.к.о. Glu92 заменяли на его биоизостер – остаток янтарной кислоты. Димерную структуру нейротрофина воспроизводили с помощью гексаметилендиаминового спейсера. Таким образом, на основе структуры 4-й петли был сконструирован димерный дипептидный миметик NT-3, гексаметилендиамыид бис-(N-моносукцинил-L-аспарагинил-L-аспарагина) (ГТС-301) (рис. 1).
ГТС-301 синтезировали методами классического пептидного синтеза в растворе с использованием Boc-стратегии защитных групп и метода активированных пентафторфениловых эфиров, пептидную цепь наращивали с С-конца. Очистку проводили ОФ ВЭЖХ (Luna C18 50 × 250 мм, градиент 0–6% изопропанола в 0.1 М уксусной кислоте, 210 нм). Пептид ГТС-301 был хроматографически гомогенным по данным ТСХ и ОФ ВЭЖХ. Структура подтверждена 1Н- и 13С-ЯМР-спектроскопией и электроспрей-ионизационной масс-спектрометрией. Найдено, m/z: 773.34 [M + H] +; m/z: 771.33 [M – H] –. C30H48N10O14. Рассчитано, m/z: 772.77. Диастереомерная чистота дипептида ГТС-301 по данным ЯМР составила не менее 98%.
Для выявления потенциала ГТС-301 как миметика NT-3, анализировали нейропротекторную активность соединения in vitro, способность активировать Trk рецепторы и антидепрессантоподобные свойства на экспериментальной модели in vivo.
Нейропротекторную активность ГТС-301 определяли в условиях окислительного стресса и глутаматной токсичности на клетках гиппокампа мыши HT-22 как описано ранее [11]. NT-3 (100 нг/мл, 3.4 ⋅ 10–9 M) либо ГТС-301 (10–13–10–5 M) вносили в среду за 24 ч до повреждения. Жизне-способность клеток определяли с помощью МТТ-теста.
На модели окислительного стресса ГТС-301 статистически значимо увеличивал жизнеспособность клеток в интервале концентраций 10–5–10–12 М, при моделировании глутаматной токсичности – в диапазоне концентраций 10–5–10–8 М (табл. 1). В обоих опытах максимальный эффект ГТС-301 в 66–68% от наблюдаемого для NT-3 зарегистрирован в концентрации 10–6 М.
Таблица 1.
Нейропротекторная активность ГТС-301 в экспериментах in vitro (клетки линии HT-22)
| Соединение | Концен- трация, М | Оптическая плотность (единицы оптической плотности) | Активность, % от максимально возможного эффекта1 |
|---|---|---|---|
| Модель окислительного стресса | |||
| – (контроль) | – | 0.194 ± 0.004 | – |
| H2O2 | 1.5 ⋅ 10–3 | 0.098 ± 0.009* | – |
| NT-3 | 10–9 (100 нг/мл) | 0.146 ± 0.014^ | 50 |
| ГТС-301 | 10–5 | 0.128 ± 0.008^ | 31 |
| 10–6 | 0.130 ± 0.007^ | 33 | |
| 10–7 | 0.128 ± 0.009^ | 31 | |
| 10–8 | 0.124 ± 0.005^ | 27 | |
| 10–9 | 0.129 ± 0.008^ | 32 | |
| 10–10 | 0.128 ± 0.003^ | 31 | |
| 10–11 | 0.123 ± 0.009^ | 26 | |
| 10–12 | 0.120 ± 0.012^ | 23 | |
| 10–13 | 0.112 ± 0.010 | 15 | |
| Модель глутаматной токсичности | |||
| – (контроль) | – | 0.197 ± 0.009 | – |
| глутаминовая кислота | 5⋅10–3 | 0.155 ± 0.012* | – |
| NT-3 | 10–9 (100 нг/мл) | 0.186 ± 0.006^ | 74 |
| ГТС-301 | 10–5 | 0.171 ± 0.005^ | 38 |
| 10–6 | 0.176 ± 0.010^ | 50 | |
| 10–7 | 0.166 ± 0.006^ | 26 | |
| 10–8 | 0.167 ± 0.006^ | 29 | |
| 10–9 | – | – | |
Данные представлены в виде средних и стандартных отклонений (M±SD).
1 Активность рассчитывалась по формуле А(%) = (Dэксп – Dак)/(Dконтр – Dак) × 100%, где Dэксп – оптическое поглощение раствора в опыте, Dак – оптическое поглощение раствора активного контроля (с повреждением), Dконтр – оптическое поглощение в пассивном контроле (без повреждения).
Достоверность отличий * p ≤ 0.05 – от контроля: ^p ≤ 0.05 – от повреждения (по критерию Краскела–Уоллиса с последующим тестом по Данну).
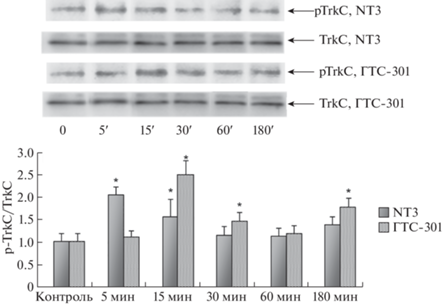
Способность ГТС-301 активировать разные Trk рецепторы изучена методом Вестерн-блот анализа на культуре клеток HT-22 с использованием моноклональных антител к фосфорилированным формам pTrkA(Y490), pTrkB(Y515) и pTrkC(Y516). Выбор антител основан на литературных данных о механизмах активации пострецепторных сигнальных путей PI3K/AKT и MEK/MAPK/ERK [12]. В качестве контроля использовали антитела к нефосфорилированным TrkA, TrkB и TrkC. Пробы лизировали через 5, 15, 30, 60 и 180 мин после внесения NT-3 (100 нг/мл) или ГТС-301 (10–6 М). Временные интервалы выбраны исходя из результатов экспериментов по фосфорилированию Trk дипептидными миметиками NGF и BDNF [13].
Активация TrkC, наиболее предпочтительного для NT-3, выявлена через 15, 30 и 180 мин инкубации с ГТС-301, и через 5 и 15 мин инкубации с NT-3, при этом через 15 мин наблюдали сходные эффекты миметика и полноразмерного нейротрофина (рис. 2).
Рис. 2.
Активация TrkC рецептора после внесения NT-3 100 (нг/мл) и ГТС-301 (10–6 М) в культуру клеток гиппокампа мыши линии HT-22. На рис. 2, 3 и 4 представлены оригинальные вестерн-блоты и результаты их денситометрии. Данные представлены в виде средних и стандартных отклонений (M±SD). Представленные данные являются средними значениями из трех независимых экспериментов. Достоверность отличий * p ≤ 0,05 – от контроля (U-тест Манна–Уитни).
Влияние ГТС-301 на TrkB было выявлено только в одной временной точке – через 180 мин, тогда как для NT-3 – через 5, 15, 60 и 180 мин после внесения. При этом выраженность активирующего влияния оказалась ниже, чем в случае TrkC рецепторов (рис. 3).
Рис. 3.
Активация TrkB рецептора после внесения NT-3 (100 нг/мл) и ГТС-301 (10–6 М) в культуру клеток гиппокампа мыши линии HT-22.

NT-3 активировал TrkA рецептор через 180 мин, а ГТС-301 в этих условиях был неэффективен (рис. 4).
Рис. 4.
Сравнение активации TrkA рецептора после внесения NT-3 (100 нг/мл) и ГТС-301 (10–6 М) в культуру клеток гиппокампа мыши линии HT-22.

Таким образом, ГТС-301 активирует более эффективно TrkC и, в меньшей степени, TrkB. Спектр активации Trk рецепторов миметиком ГТС-301 в целом повторяет таковой для полноразмерного NT-3. Полученная нами картина активации нейротрофином-3 тирозинкиназных рецепторов соответствует литературным данным [14].
Возможные антидепрессантоподобные эффекты ГТС-301 были изучены в тесте вынужденного плавания на мышах BALB/c. Тест проводили в модифицированной конфигурации с двумя посадками мышей в цилиндры с водой [15]. ГТС-301 в дозах 0.5–40 мг/кг вводили мышам субхронически (7 дней) внутрибрюшинно (в/б) в виде суспензии в растворе 1% Tween 80. В качестве положительного контроля использовали Амитриптилин (10 мг/кг, в/б, в физ. растворе). Контрольные мыши получали 1% раствор Tween 80. Спустя 24 ч после последнего введения препаратов проводили предварительную посадку мышей в цилиндры с водой на 10 мин, спустя еще 24 ч – 5-минутную тестовую посадку, в течение которой регистрировали время иммобильности.
Установлено, что в дозах 10–40 мг/кг ГТС-301 статистически значимо снижал время иммобильности мышей, что свидетельствует об антидепрессантоподобном эффекте дипептида (табл. 2). Выраженность эффекта ГТС-301 в дозах 20 и 40 мг/кг была такая же, как у классического антидепрессанта Амитриптилина.
Таблица 2.
Эффекты ГТС-301 и Амитриптилина на время иммобильности мышей в тесте вынужденного плавания
| Группа (n = 9–11) | Время иммобильности, с | Время иммобильности, % от контрольной группы |
|---|---|---|
| Эксперимент 1 | ||
| Контроль | 199.9 ± 7.8 | |
| ГТС-301 (0.5 мг/кг) | 207.5 ± 15.5 | 103 |
| ГТС-301 (1.0 мг/кг) | 179.5 ± 9.8 | 90 |
| ГТС-301 (5.0 мг/кг) | 189.5 ± 11.8 | 95 |
| ГТС-301 (10.0 мг/кг) | 155.5 ± 9.6* (p = 0.026) | 78* |
| Амитриптилин (10.0 мг/кг) | 148.0 ± 10.4** (p = 0.001) | 74** |
| Эксперимент 2 | ||
| Контроль | 213.6 ± 10.9 | |
| ГТС-301 (20.0 мг/кг) | 159.3 ± 12.7** (p = 0.004) | 74** |
| ГТС-301 (40.0 мг/кг) | 156.4 ± 9.0** (p = 0.003) | 73** |
| Амитриптилин (10.0 мг/кг) | 155.6 ± 10.7** (p = 0.002) | 73** |
Данные представлены в виде средних и стандартных ошибок среднего. Статистическую оценку межгрупповых различий проводили с помощью однофакторного дисперсионного анализа (ANOVA) с последующими попарными межгрупповыми сравнениями с помощью теста Даннета. (*) p < 0.05, (**) p < 0.01 по сравнению с контролем.
Таким образом, сконструирован и синтезирован ГТС-301, димерный дипептидный миметик нейротрофина-3, активирующий преимущественно TrkC рецептор, проявляющий нейропротекторную активность в экспериментах in vitro в пикомолярных концентрациях и обладающий антидепрессантоподобной активностью при системном введении. ГТС-301, помимо вероятной практической значимости, может служить молекулярным инструментом для изучения рецепторных взаимодействий, сопряжения активации TrkC рецептора с сигнальными путями и фармакологических эффектов как для полноразмерного NT-3, так и для малых молекул, имитирующих влияние этого нейротрофина.
Список литературы
Bothwell M. NGF, BDNF, NT-3, and NT4. // Handbook of Experimental Pharmacology. 2014. V. 220. P. 3–15.
de Miranda A.S., de Barros JLVM, Teixeira A.L. Is neurotrophin-3 (NT-3): a potential therapeutic target for depression and anxiety? // Expert Opinion on Therapeutic Targets. 2020. V.24. № 12. P. 1225–1238.
Duricki D.A., Drndarski S., Bernanos M., et al. Stroke Recovery in Rats after 24-Hour-Delayed Intramuscular Neurotrophin-3 Infusion. // Annals of Neurology. 2019. V. 85. № 1. P. 32–46.
Shirayama Y., Chen A.C.-H., Nakagawa S., et al. Brain-derived neurotrophic factor produces antidepressant effects in behavioral models of depression. // J Neurosci. 2002. V. 22. № 8. P. 3251–3261.
Pattarawarapan M., Zaccaro M.C., Saragovi U.H., et al. New templates for syntheses of ring-fused, C(10) beta-turn peptidomimetics leading to the first reported small-molecule mimic of neurotrophin-3. // Journal of Medicinal Chemistry. 2002. V. 45. № 20. P. 4387–4390.
Kempfle J.S., Duro M.V., Zhang A., et al. A Novel Small Molecule Neurotrophin-3 Analogue Promotes Inner Ear Neurite Outgrowth and Synaptogenesis In vitro. // Frontiers in Cellular Neuroscience. 2021. V. 15. P. 666706.
Zaccaro M.C., Lee H.B., Pattarawarapan M., et al. Selective small molecule peptidomimetic ligands of TrkC and TrkA receptors afford discrete or complete neurotrophic activities. // Chemistry & Biology. 2005. V. 12. № 9. P. 1015–1028.
Chen D., Brahimi F., Angell Y., et al. Bivalent peptidomimetic ligands of TrkC are biased agonists and selectively induce neuritogenesis or potentiate neurotrophin-3 trophic signals. // ACS Chemical Biology. 2009. V. 18. № 4(9). P. 769–781.
Gudasheva T.A., Ostrovskaya R.U., Seredenin S.B. Novel Technologies for Dipeptide Drugs Design and their Implantation. // Curr Pharm Des. 2018. V. 24. № 26. P. 3020–3027.
Gudasheva T.A., Povarnina P.Y., Tarasiuk A.V., Seredenin S.B. Low-molecular mimetics of nerve growth factor and brain-derived neurotrophic factor: Design and pharmacological properties. // Med Res Rev. 2021. V. 41. № 5. P. 2746–2774.
Логвинов И.О., Антипова Т.А., Гудашева Т.А. и др. Нейропротективные свойства дипептидного миметика мозгового нейротрофического фактора ГСБ-106 в экспериментах in vitro. // Бюллетень экспериментальной биологии и медицины. 2013. Т. 155, № 3. С. 319–322.
Reichardt L.F. Neurotrophin-regulated signalling pathways. // Philosophical Transactions of the Royal Society B: Biological Sciences. 2006. V. 361. № 1473. P. 1545–1564.
Gudasheva T.A., Povarnina P.Y., Antipova T.A., Firsova Y.N., Konstantinopolsky M.A, Seredenin S.B. Dimeric dipeptide mimetics of the nerve growth factor Loop 4 and Loop 1 activate TRKA with different patterns of intracellular signal transduction. // J. Biomed. Sci. 2015. V. 8. № 22. P. 106.
Ip N.Y., Stitt T.N., Tapley P., et al. Similarities and differences in the way neurotrophins interact with the Trk receptors in neuronal and nonneuronal cells. // Neuron. 1993. V. 10. № 2. P. 137–149.
Angoa-Pérez M., Kane M.J., Briggs D.I., et al. Mice genetically depleted of brain serotonin do not display a depression-like behavioral phenotype. // ACS Chemical Neuroscience. 2014. V. 5. № 10. P. 908–919.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни



