Доклады Российской академии наук. Науки о жизни, 2022, T. 505, № 1, стр. 310-313
СТРОЕНИЕ МОЗГА МЕЛЬЧАЙШЕГО ЖЕСТКОКРЫЛОГО
А. А. Макарова 1, *, А. А. Полилов 1
1 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: amkrva@gmail.com
Поступила в редакцию 20.04.2022
После доработки 09.05.2022
Принята к публикации 09.05.2022
- EDN: RYCBHY
- DOI: 10.31857/S2686738922040102
Аннотация
Впервые описано строение мозга мельчайшего жесткокрылого Scydosella musawasensis Hall, 1999. Как и у других мельчайших жесткокрылых, мозг S. musawasensis несет признаки миниатюризации: смещение в грудной отдел, компактизация, малое число и размер нейронов. Показано, что несмотря на близость в размерном классе к миниатюрному перепончатокрылому Megaphragma, обладающему практически безъядерной нервной системой, строение мозга изученного мельчайшего жука сходно с таковым у крупных представителей отряда и характеризуется высоким числом ядер в мозге и значительным объемом клеточной корой. Нейропиль S. musawasensis занимает 60% от объема мозга, подтверждая правило нейропилярной константы.
Размер тела – важная характеристика, во многом определяющая морфологию, физиологию и биологию вида [1]. Наибольших успехов в миниатюризации достигли Panarthropoda [2–6]. Показано, что экстремальное уменьшение размера тела у насекомых критически отражается на анатомии: способствуя значительным изменению или трансформации всех, или почти всех систем органов [4]. Несмотря на высокую степень консервативности [7], миниатюризация нервной системы у насекомых сопровождается олигомеризацией и концентрацией ганглиев, асимметрией, значительным уменьшением числа и размера нейронов [4, 8]. В экстремальных случаях миниатюризации наблюдаются клеточные редукции [4].
Явление энуклеации клеточных ядер – редкое явление в животном мире. Наиболее известными безъядерными клетками являются эритроциты человека [9], энуклеация также описана и для клеток крови млекопитающих [10], саламандр [11], рыб [12] и насекомых [13]. Безъядерные клетки также были обнаружены в составе большинства систем органов половозрелых карликовых самцов циклиофор [14]. Однако безъядерные нейроны впервые были описаны для трех видов рода Megaphragma [15, 16]. После появления данных о явлении лизиса более 97% ядер нейронов на последних стадиях куколочного развития у представителей рода Megaphragma возник вопрос о наличии этого явления в других группах мельчайших насекомых.
Аллометрический анализ отношения объема нейропиля к объему мозга показал, что у большинства насекомых относительный объем нейропиля изменяется строго изометрически [17]. На основе этого анализа было сформулировано правило нейропилярной константы, согласно которому относительный объем нейропиля мозга насекомых составляет в среднем 60% и остается постоянным независимо от размера тела. Это правило подтверждается на большинстве насекомых, за исключением мельчайшей Megaphragma, у которой отсутствует клеточная кора, в классическом понимании. Возник вопрос, сохраняется ли нейропилярная константа у мельчайших жесткокрылых?
В данной работе впервые описано строение мозга мельчайшего жесткокрылого насекомого Scydosella musawasensis Hall, 1999. Размер тела этих жуков составляет всего 325 мкм и на сегодняшний день они являются мельчайшими свободно живущими насекомыми в мире [18].
Материалом для работы послужили имаго Scydosella musawasensis Hall, 1999 (Ptiliidae), собранные в Национальном парке Чикаке, Колумбии в 2015 г. [18]. Длина тела 325–352 мкм. Изучение строения мозга проведено как описано ранее [16]. На базе полной серии гистологических срезов были выполнены трехмерные реконструкции мозга с использованием программ Bitplane Imaris и Blender. На основе трехмерных моделей были вычислены объемы тела, мозга, нейропиля и клеточной коры. Линейные размеры тел клеток были посчитаны исходя из площади клеточной коры и числа ядер на десяти равноудаленных срезах, равномерно охватывающих весь мозг. Число клеток вычислено на основе объема клеточной коры и среднего размера тел клеток.
Мозг S. musawasensis имеет вытянутую форму, в отличие от мозга родственной Nanosella sp., который имеет округлую и компактную форму [8], отмечается легкая асимметрия задних протоцеребральных долей. Задняя протоцеребральная часть мозга представлена исключительно клеточной корой, и, подобно строению мозга у других микрожесткокрылых, смещена в переднегрудной отдел [8] (рис. 1). Оптические доли представлены четырьмя нейропилями: ламина (lamina ganglionaris), медулла (medulla externa), лобула (lobula) и лобулярная пластинка (lobula plate) (рис. 2). Медулла крупная, вытянутая в переднезадней плоскости, образует длинные выступы передней части мозга (рис. 1), по объему превышает все остальные оптические нейропили. Антеннальные доли крупные, вытянутые, имеют выраженную гломерулярную структуру. В области центрального комплекса идентифицируются вееровидное и эллипсоидное тела. В виду малого размера объекта идентификация протоцеребрального моста и грибовидных тел затруднена.
Рис. 1.
Строения мозга Scydosella musawasensis (Ptiliidae), трехмерная реконструкция: (а), (г) – вид сверху; (б), (д) – вид спереди; (в), (е) – вид сбоку. (а) – (в) – общая топография мозга; (г) – (е) – соотношение клеточной коры и нейропиля. АН – антеннальный нерв; АНТ – антенны; КК – клеточная кора; МО – мозг; НМ – нейропиль мозга; ОД – выступающие оптические доли мозга; ПГ – переднегрудь; ПД – задние протоцеребральные доли мозга; СГ – сложные глаза.

Рис. 2.
Строение мозга Scydosella musawasensis (Ptiliidae), гистология: (а) – поперечный срез через сложные глаза; (б) – поперечный срез задней части головной капсулы. КК – клеточная кора; ЛА – ламина; ME – медулла; ЛО – лобула; ЛП – лобулярная пластинка; ПГ – подглоточный ганглий; СГ – сложные глаза.
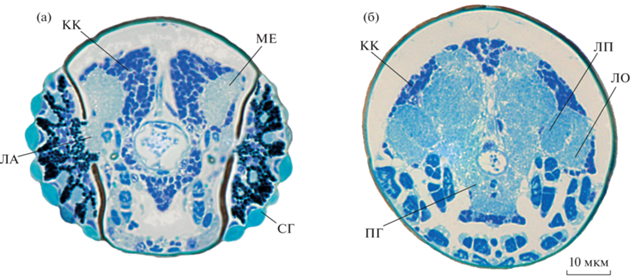
Абсолютный объем мозга составляет 0.045 нл, что в 2–3 раза меньше, чем у самых мелких из ранее изученных жуков [17] и сходно с объемом мозга одного из мельчайших насекомых, Megaphragma amalphitanum (0.041 нл). Несмотря на сходный c M. amalphitanum размер тела и абсолютного объема мозга, S. musawasensis имеет значительный объем клеточной коры (рис. 2), составляющий около 42% от общего объема мозга. Таким образом, подтверждается правило нейропилярной константы, согласно которому у насекомых постоянное соотношение объемов нейропиля (60% от объема мозга) и клеточной коры (40% от объема мозга) [17]. При сравнимых размерах тела у S. musawasensis присутствует значительный объем клеточной коры, в то время как для имаго M. amalphitanum характерна почти полная утрата до 97% ядер нейронов на поздних стадиях куколочного развития. Вероятно, что явление лизиса ядер нейронов, объясняющее нарушение нейропилярной константы в случае с Megaphragma, отсутствует у миниатюрных жесткокрылых.
Число клеток в мозге S. musawasensis составляет примерно 9500, при среднем диаметре около 1.25 мкм. Сходное число нейронов в мозге отмечено для мельчайшего из ранее изученных жесткокрылых Nanosella sp. (длина тела около 400 мкм, около 8000 клеток в мозге) [4].
Несмотря на малое число и размер нейронов, S. musawasensis обладают большим относительным объемом мозга, как и большинство других микронасекомых, за исключением отдельных линий Trichogramma [19] и Nasonia [20]. Относительный объем мозга S. musawasensis существенно больше, чем у крупных жесткокрылых [4], и составляет около 4%.
Таким образом, миниатюризация в разных группах насекомых по-разному влияет на строение мозга. У жесткокрылых и трипсов имеется широкая шея, что делает голову менее подвижной, а также позволяет мозгу не ограничиваться головной капсулой и частично смещаться в грудной отдел [4]. У перепончатокрылых, напротив, благодаря тонкой и узкой шее, голова более подвижная, а мозг оказывается строго ограничен головной капсулой и крайне компактизован [4]. Крайняя миниатюризация у Megaphragma привела к экстремальным адаптациям – редукциям ядер и тел нейронов, однако не отразилась на клеточном строении мозга у мельчайшей Scydosella.
Несмотря на крайнюю консервативность строения мозга, морфологические адаптации к миниатюризации могут существенно отличаться у насекомых с экстремально малым размером тела.
Список литературы
Hanken J. Miniaturization and its effects on cranial morphology in plethodontid salamanders, genus Thorius (Amphibia, Plethodontidae): II. The fate of the brain and sense organs and their role in skull morphogenesis and evolution // Journal of Morphology. 1983. V. 177. P. 255–268.
Dunlop J.A. Miniaturisation in Chelicerata // Arthropod Structure and Development. 2019. V. 48. P. 20–43.
Gross V., Treffkorn S., Reichelt J., et al. Miniaturization of tardigrades (water bears): Morphological and genomic perspectives // Arthropod Structure and Development. 2019. V. 48. P. 12–19.
Polilov A.A. At the size limit – effects of miniaturization in insects. Dwmand: Springer; 2016.
Minelli A., Fusco G. No limits: Breaking constraints in insect miniaturization // Structure and Development. 2019. V. 48. P. 4–11.
Eberhard W.G. Miniaturized orb-weaving spiders: Behavioural precision is not limited by small size // Proceedings of the Royal Society B: Biological Sciences. 2007. V. 274. P. 2203–2209.
Niven J.E., Farris S.M. Miniaturization of nervous systems and neurons // Current Biology. 2012. V. 22. P. R323–R329.
Макарова А.А., Полилов А.А. Особенности строения и ультраструктуры головного мозга насекомых, связанные с миниатюризацией. I. Мельчайшие жесткокрылые – жуки-перокрылки (Coleoptera, Ptiliidae) // Зоологический журнал. 2013. Т. 92, С. 523–533.
Migliaccio A.R. Erythroblast enucleation // Haematologica. 2010. V. 95. P. 1985–1988.
Moras M., Lefevre S.D., Ostuni M.A. From erythroblasts to mature red blood cells: Organelle clearance in mammals // Frontiers in Physiology. 2017. V. 8. P. 1076.
Mueller R.L., Gregory T.R., Gregory S.M., et al. Genome size, cell size, and the evolution of enucleated erythrocytes in attenuate salamanders // Zoology. 2008. V. 111. P. 218–230.
Niimi G., Imada H. Observation of non-nucleated erythrocytesin the peripheral blood of medaka, Oryzias latipes // Okajimas Folia Anatomica Japonica. 2008. V. 85. P. 1–3.
Bozler J., Kacsoh B.Z., Bosco G. Nematocytes: Discovery and characterization of a novel anculeate hemocyte in Drosophila falleni and Drosophila phalerata // PLoS One. 2017. V. 12. P. e0188133.
Neves R.C., Reichert H. Microanatomy and development of the dwarf male of Symbion pandora (phylum Cycliophora): New insights from ultrastructural investigation based on serial section electron microscopy // PLoS One. 2015. V. 10. P. e0122364.
Polilov A.A. First record of Megaphragma (Hymenoptera, Trichogrammatidae) in Columbia, and third animal species known to have anucleate neurons // Journal of Hymenoptera Research. 2017. V. 60. P. 181–185.
Polilov A.A. Anatomy of adult Megaphragma (Hymenoptera: Trichogrammatidae), one of the smallest insects, and new insight into insect miniaturization // PLoS One. 2017. V. 12. P. e0175566.
Polilov A.A., Makarova A.A. Constant neuropilar ratio in the insect brain // Scientific Reports. 2020. V. 10. P. 21426.
Polilov A.A. How small is the smallest? New record and remeasuring of Scydosella musawasensis Hall, 1999 (Coleoptera, Ptiliidae), the smallest known free-living insect // Zookeys. 2015. V. 526. P. 61–64.
van der Woude E., Smid H.M., Chittka L., et al. Breaking Haller’s rule: Brain-body size isometry in a minute parasitic wasp // Brain, Behavior and Evolution. 2013. V. 81. P. 86–92.
Groothuis J., Smid H.M. Nasonia Parasitic wasps escape from Haller’s rule by diphasic, partially isometric brain-body size scaling and selective neuropil adaptations // Brain, Behavior and Evolution. 2017. V. 90. P. 243–254.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


