Доклады Российской академии наук. Науки о жизни, 2022, T. 505, № 1, стр. 318-321
ВАРИАБЕЛЬНЫЙ САЙТ CTCF ИЗ ИНТРОНА ГЕНА UBX DROSOPHILA MELANOGASTER ЯВЛЯЕТСЯ ИЗБЫТОЧНЫМ И НЕ ИМЕЕТ ИНСУЛЯТОРНОЙ АКТИВНОСТИ
А. Н. Ибрагимов 1, *, О. В. Былино 1, О. В. Кырчанова 1, Ю. В. Шидловский 1, R. White 2, P. Schedl 3, академик РАН П. Г. Георгиев 1
1 Федеральное государственное бюджетное учреждение науки Институт биологии гена Российской академии наук
Москва, Российская Федерация
2 Кембриджский университет
Кембридж, Великобритания
3 Принстонский университет
Принстон, США
* E-mail: airat.ibra@gmail.com
Поступила в редакцию 30.04.2022
После доработки 09.05.2022
Принята к публикации 09.05.2022
- EDN: KJXKKY
- DOI: 10.31857/S2686738922040060
Аннотация
CTCF является наиболее изученным и консервативным архитектурным белком хроматина, который был найден у дрозофилы и млекопитающих. CTCF преимущественно связывается с промоторами и инсуляторами и может участвовать в формировании хроматиновых петель. В группе сайтов, названных вариабельными, связывание CTCF зависит от эпигенетического статуса окружающего хроматина. Так, вариабельный сайт CTCF (vCTCF), обнаруженный в интроне гена Ubx, находится в непосредственной близости к энхансерам BRE, abx. CTCF связывается с вариабельным сайтом только в тканях, в которых ген Ubx активен, что дало основание предполагать роль vCTCF в формировании контактов между Ubx промотором и энхансерами BRE, abx. С помощью метода CRISPR/Cas9 и attP/attB сайт-специфической интеграции мы исследовали функциональную роль vCTCF и показали, что его отсутствие не приводит к дефектам развития. Также фрагмент 2161 п.н., содержащий vCTCF, не является эффективным инсулятором на месте границы Fab-7 локуса BX-C. Таким образом, vCTCF имеет избыточные функции в регуляции экспрессии Ubx.
Парасегмент-специфичная экспрессия трех гомеозисных генов Ubx, abd-A и Abd-B комплекса Bithorax (BX-C) Drosophila melanogaster регулируется девятью автономными регуляторными доменами, которые разделены специальными регуляторными элементами, названными границами [1]. Границы обеспечивают автономность путем блокировки контактов между регуляторными элементами из соседних доменов. Кроме того, границы также могут предотвращать взаимодействие энхансеров с промотором [2–4]. Помимо инсуляторной активности границы обладают способностью специфично взаимодействовать с целевыми генами BX-C, позволяя энхансерам, расположенным в регуляторных доменах, стимулировать соответствующие промоторы [5]. Эти свойства границ обеспечивает правильную экспрессию BX-C генов в соответствующих парасегментах и определенные временные интервалы развития дрозофилы. Так, было показано, что границы Fab-6, Fab-7 и Fab-8 специфично взаимодействуют с предпромоторной областью Abd-B, чем, вероятно, и обусловливают правильное позиционирование соответствующих доменов (iab5–iab7) в парасегментах 10–12 [6].
Большая часть границ регуляторных доменов BX-C содержат сайты связывания для дрозофилиного гомолога белка CTCF (dCTCF), которые определяют инсуляторную активность границ (рис. 1) [7]. В интроне гена Ubx был обнаружен вариабельный сайт связывания dCTCF (vCTCF), который находится на расстоянии 30 тпн ниже промотора (рис. 1) [8]. dCTCF не связывается с этим сайтом в тканях, в которых Ubx неактивен (имагинальные диски первый пары ног), но связывается с ним в транскрипционно активном локусе Ubx (имагинальные диски третьей пары ног). Было показано, что связывание dCTCF с vCTCF сайтом сопряжено с изменениями в топологии abx/bx регуляторного домена: в тканях, в которых Ubx активен, наблюдается увеличение частоты контактов vCTCF сайта с промотором Ubx [8]. Была предложена модель, в соответствии с которой связывание dCTCF c vCTCF стимулирует тканеспецифичное взаимодействие энхансеров abx и BRE с промотором [9, 10]. Целью данной работы была проверка этой гипотезы.
Рис. 1.
Схема организации генов и регуляторных доменов в BX-C. Показаны abx/bx, bxd/pbx и iab-2 – iab-8 домены, ответственные за регуляцию генов Ubx, abd-A и Abd-B и за развитие парасегментов 5-13/сегментов T3-A8. Эмбриональные энхансеры Ubx представлены в виде фиолетовых прямоугольников. Поперечные линии с цветными кружками обозначают границы. Сайты связывания исуляторных белков dCTCF, Pita и Su(Hw) на границах обозначены красными, голубым и желтыми кружками. В нижней части рисунка изображены схемы регуляторного района, содержащего вариабельный сайт dCTCF и границы Fab-7, а также их делеции. Для Fab-7 cайты гиперчувствительности HS*, HS1, HS2, HS3 изображены как черные прямоугольники на линии координат. Сайт гиперчувствительности bx PRE изображен как зеленый прямоугольник, а сайты для белков Pho и GAGA-фактора как оранжевые и синие овалы. Сайты attP, lox и frt, использованные для генетических манипуляций, обозначены как белые, серые и синие треугольники.
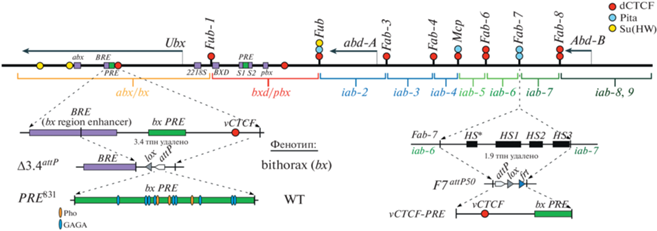
Для изучения функции vCTCF сайта в энхансер-промоторных взаимодействиях с помощью метода CRISPR/Cas9 мы создали платформу Δ3.4attP, в которой фрагмент размером 3408 пн (3R:16701239..16704646), включающий в себя vCTCF сайт и bx PRE (polycomb response element) (рис. 1), был удален и замещен сайтом attP. Мы показали, что делеция имеет слабый вариабельный фенотип потери функции (loss-of-function, LOF)). Этот фенотип имеет название bithorax (bx) и выражается в частичной трансформации T3 сегмента в Т2 [11, 12]. Так, у полученных нами мух на третьей паре ног появляется щетинка, характерная для второй пары, также у них часто наблюдается увеличение А1 сегмента, а у ~10% мух между Т3 и А1 сегментами образуется метанотальная ткань (рис. 2).
Рис. 2.
(а) Сравнение фенотипов тергитов сегментов Т3-А1 мух дикого типа (wt), Δ3.4attP и PRE831. Δ3.4attP имеет вариабельный фенотип, ~10% мух имеют увеличенный А1 сегмент. Красная стрелка указывает на очаг формирования метанотальной ткани. Интеграция PRE831 восстанавливает мутантный фенотип до дикого типа. (б) Сравнение фенотипов ног Т3 сегмента мух wt, Δ3.4attP и PRE831. У мух дикого типа на паре ног Т2 сегмента имеется пара длинных щетинок, которые отсутствуют на паре ног сегмента Т3. У мух линии Δ3.4attP на Т3 ноге развивается одна длинная щетинка (отмечена красной стрелкой), что свидетельствует о частичной трансформации в Т2. У мух PRE831 она не развивается. (в) Снимки кутикулы абдоминальных сегментов самцов линий wt, Fab-7attP50, vCTCF+PRE в светлом и темном поле. У самцов wt сегмент А7 отсутствует, стернит А6 изогнутый и лишен щетинок, а стернит А5 прямоугольный и покрыт щетинками. Тергит А5 полностью покрыт трихомами, а А6 покрыт ими только по переднему и вентральному краям (см. темное поле). У самцов Fab-7attP50 из-за слияния регуляторных доменов iab-6 и iab-7 сегмент А6 трансформируется в А7 (не развивается). У самцов vCTCF+PRE А6 сегмент так же не развивается.

Данные трансформации объясняются нарушением взаимодействия энхансеров, находящихся ниже вариабельного сайта dCTCF, с промотором Ubx. Полученная делеция Δ3.4attP перекрывается с описанной ранее делецией bx34e-prv размером 9.5 тпн, которая так же имеет вариабельный bx фенотип, вызванный уменьшением экспрессии Ubx в имагинальных дисках Т3 сегмента [11].
Далее мы использовали описанную выше линию Δ3.4attP в качестве платформы для поиска минимального элемента, который бы спасал мутантный фенотип. Мы провели attP-attB зависимую интеграцию фрагмента bx PRE размером 831 пн (PRE831, 3R:16702487..16703317) в линию Δ3.4attP и обнаружили, что он полностью восстанавливает bx фенотип до дикого типа. Это свидетельствует о том, что данный элемент способствует взаимодействию энхансеров с промотором Ubx, в то время как вариабельный сайт dCTCF является избыточным.
Для того чтобы проверить, имеет ли вариабельный сайт dCTCF инсуляторную активность, мы провели его интеграцию в платформу Fab-7attp50 (рис. 1). В данной платформе удалена граница Fab-7, в результате чего регуляторные домены iab-6 и iab-7 сливаются, и происходит преждевременная активация iab-7, что приводит к лизису шестого сегмента у самцов [13–15]. Ранее было показано, что PRE часто располагаются в непосредственной близости от инсуляторов и вносят вклад в формирование функциональной границы [16, 17]. Поэтому для тестирования был использован фрагмент содержащего в себе bx PRE и вариабельный сайт dCTCF в обратной ориентации – vCTCF+PRE (2161 п.н., 3R:16702487..16704647). У самцов полученной линии мух полностью отсутствовал шестой сегмент, что свидетельствует об отсутствии у vCTCF+PRE инсуляторной активности.
Таким образом, полученные данные не подтверждают модель, согласно которой vCTCF является необходимым медиатором энхансер-промоторных взаимодействий в домене abx/bx. Более того, данные указывают, что эту роль, вероятно, выполняет bx PRE. Дальнейшие исследования необходимы для изучения функции bx PRE. Поскольку потеря bx PRE приводит лишь к слабому фенотипу потери функции, можно предположить, что, в отличие от регуляторных доменов гена Abd-B, энхансеры Ubx гораздо более автономны и в меньшей степени зависят от других регуляторных элементов при формировании контакта с промотором.
Список литературы
Maeda R.K., Karch F. The open for business model of the bithorax complex in Drosophila // Chromosoma. V. 124. № 3. P. 293–307, Sep. 2015.
Özdemir I., Gambetta M.C. The Role of Insulation in Patterning Gene Expression // Genes (Basel). 2019. V. 10. № 10. P. 767.
Valenzuela L., Kamakaka R.T. Chromatin Insulators // Annual Review of Genetics. 2006. V. 40. № 1. P. 107–138.
West A.G., Gaszner M., Felsenfeld G. Insulators: many functions, many mechanisms // Genes Dev. 2002. V. 16. № 3. P. 271–288.
Kyrchanova O. et al. The boundary paradox in the Bithorax complex // Mechanisms of Development. 2015. V. 138. P. 122–132.
Kyrchanova O., Ivlieva T., Toshchakov S., Parshikov A., Maksimenko O., Georgiev P. Selective interactions of boundaries with upstream region of Abd-B promoter in Drosophila bithorax complex and role of dCTCF in this process // Nucleic Acids Res. 2011. V. 39. № 8. P. 3042–3052.
Bowman S.K. et al. H3K27 modifications define segmental regulatory domains in the Drosophila bithorax complex // eLife. 2014. V. 3. P. e02833.
Magbanua J.P., Runneburger E., Russell S., White R. A Variably Occupied CTCF Binding Site in the Ultrabithorax Gene in the Drosophila Bithorax Complex // Mol Cell Biol. 2015. V. 35. № 1. P. 318–330.
Qian S., Capovilla M., Pirrotta V. The bx region enhancer, a distant cis-control element of the Drosophila Ubx gene and its regulation by hunchback and other segmentation genes. // EMBO J. 1991. V. 10. № 6. P. 1415–1425.
Simon J., Peifer M., Bender W., O’Connor M. Regulatory elements of the bithorax complex that control expression along the anterior-posterior axis // EMBO J. 1990. V. 9. № 12. P. 3945–3956.
Peifer M., Bender W. The anterobithorax and bithorax mutations of the bithorax complex. // EMBO J. 1986. V. 5. № 9. P. 2293–2303.
Bender W. et al. Molecular Genetics of the Bithorax Complex in Drosophila melanogaster // Science. 1983. V. 221. № 4605. P. 23–29.
Hagstrom K., Muller M., Schedl P. Fab-7 functions as a chromatin domain boundary to ensure proper segment specification by the Drosophila bithorax complex. // Genes Dev. 1996. V. 10. № 24. P. 3202–3215.
Mihaly J. et al. Chromatin domain boundaries in the Bithorax complex // Cell Mol Life Sci. 1998. V. 54. № 1. P. 60–70.
Mateo L.J., Murphy S.E., Hafner A., Cinquini I.S., Walker C.A., Boettiger A.N. Visualizing DNA folding and RNA in embryos at single-cell resolution // Nature. 2019. V. 568. № 7750. P. 49–54.
Kyrchanova O. et al. The insulator functions of the Drosophila polydactyl C2H2 zinc finger protein CTCF: Necessity versus sufficiency // Sci Adv. 2020. V. 6. № 13. P. eaaz3152.
Mihaly J., Hogga I., Gausz J., Gyurkovics H., Karch F. In situ dissection of the Fab-7 region of the bithorax complex into a chromatin domain boundary and a Polycomb-response element // Development. 1997. V. 124. № 9. P. 1809–1820.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


