Доклады Российской академии наук. Науки о жизни, 2022, T. 506, № 1, стр. 343-348
ВЛИЯНИЕ КСИЛАЗИН-ЗОЛЕТИЛОВОЙ АНЕСТЕЗИИ НА РАДИОЧУВСТВИТЕЛЬНОСТЬ МЫШЕЙ ПРИ ТОТАЛЬНОМ ОБЛУЧЕНИИ РЕНТГЕНОВСКИМ ИЗЛУЧЕНИЕМ, ПРОТОНАМИ И ИОНАМИ УГЛЕРОДА
Член-корреспондент РАН В. Е. Балакин 1, *, О. М. Розанова 2, Е. Н. Смирнова 2, Т. А. Белякова 1, Н. С. Стрельникова 1
1 Филиал “Физико-технический центр” Федерального государственного бюджетного учреждения науки Физического института им. П.Н. Лебедева Российской академии наук
Протвино, Россия
2 Федеральное государственное бюджетное учреждение науки Институт теоретической и экспериментальной биофизики Российской академии наук
Пущино, Россия
* E-mail: balakin@ftcfian.ru
Поступила в редакцию 06.04.2022
После доработки 20.05.2022
Принята к публикации 20.05.2022
- EDN: XFFPZA
- DOI: 10.31857/S2686738922050043
Аннотация
Изучено влияние ксилазин-золетиловой анестезии на радиочувствительность мышей при облучении протонами, ионами углерода в двух областях кривой Брэгга и рентгеновским излучением по критериям 30-дневной выживаемости, динамики гибели, средней продолжительности жизни погибших мышей. Максимальное влияние анестезии в 3.3 раза наблюдали по снижению гибели животных при облучении ионами углерода в пике Брэгга, при облучении до пика это влияние составляло 1.2 раза. При облучении протонами в пике Брэгга защитное действие анестезии в 1.7 раза наблюдалось только в дозе 8.5 Гр. При облучении мышей рентгеновским излучением в дозах 6.0–8.5 Гр коэффициент влияния анестезии составлял 1.7–2. С помощью метода 30-дневной выживаемости показано, что применение ксилазин-золетил смеси существенно изменяет радиочувствительность мышей в зависимости от дозы облучения и качества источника излучения.
В последнее время в связи с использованием ускоренных заряженных частиц для терапии рака, требующей высокоточного контроля позиционирования пациентов, возникает необходимость использования анестезии [1]. Анестезия оказывает действие на многие физиологические параметры, которые влияют как на результат лечения, так и на радиочувствительность организма. Наблюдаемые эффекты зависят от состава анестезирующей смеси, концентрации, режима введения, вида и возраста животных, критерия регистрации поражения, диапазона доз при тотальном или локальном облучении. Основная часть исследований проведена с использованием фотонных излучений с низкими значениями линейной потери энергии (ЛПЭ) [2], тогда как ускоренные заряженные частицы характеризуются высокими значениями ЛПЭ особенно в пике Брэгга, где происходит максимальное выделение энергии в конце пробега частиц. Биологическое действие протонов и ионов углерода, которые чаще всего используются в адронной терапии, в значительной степени зависит не только от дозы, но и от ЛПЭ [3, 4], поэтому для решения практических задач новых видов радиотерапии необходимо исследование радиочувствительности объектов в разных областях кривой Брэгга, которая характеризуется изменением ЛПЭ в зависимости от расстояния, пройденного через вещество. Актуальным является также поиск новых безопасных способов иммобилизации животных не только для точного позиционирования в определенных координатах, но и для снижения движений, связанных с дыханием [5].
Другой областью, для которой исследование биологического действия заряженных частиц имеет важное значение, является освоение дальнего космоса. Наиболее опасными для человека являются галактические космические лучи, состоящие примерно из 87% протонов высокой энергии, 12% альфа-частиц и 1% более тяжелых ионов. До сих пор оценка радиационного риска для космонавтов почти полностью основывается на экстраполяции данных, полученных от излучений с низкой ЛПЭ [6, 7].
Целью нашей работы являлось исследование влияния анестезии на радиочувствительность мышей по тесту 30-суточной выживаемости при тотальном облучении мышей пучками протонов и ионов углерода in vivo до и в пике Брэгга, а также рентгеновским излучением.
Эксперименты проводили в соответствии с международными требованиями на 2-месячных самцах мышей колонии SHK (30–35 г), которых содержали в стандартных условиях вивария [8], а план экспериментов был одобрен Комиссией ИТЭБ РАН по биологической безопасности и биоэтике (протокол № 26/2021 от 09.02.2021). В работе было использовано 405 мышей. Животные были разделены на две группы для облучения с анестезией и без. Каждую из групп делили на подгруппы (n = 10–15) для облучения разными видами излучения и дозами. По отдельным экспериментальным точкам проведено 2–3 независимых эксперимента.
Животных облучали тотально в индивидуальных хорошо вентилируемых контейнерах. Мышей анестезировали за 10 мин до облучения комбинацией селективных препаратов ксилазина (Interchemie, Нидерланды) в дозировке 0.7 мг/кг и золетила 100 (Virbac, Франция) – 3.4 мг/кг. Препараты и дозы были подобраны на основе литературных данных о составе и механизмах действия соединений, а также биомедицинских результатах, полученных на мышах [9, 10]. Золетил 100 представляет собой смесь золазепама и тилетамина, обладающую противотревожным, седативным, вызывает миорелаксацию и полностью устраняет болевую чувствительность. Ксилазин – агонист центральных α2-адренорецепторов, оказывает седативное, анальгезирующее, анестезирующее, миорелаксирующее действие, а также обладает синергетическим эффектом в отношении золетила, что позволяет значительно уменьшить дозу препарата. Ксилазин характеризуется выраженным гипотензивным эффектом, что приводит к снижению частоты дыхания и гипоксии тканей [11], и может влиять на радиочувствительность мышей. Ранее нами при исследовании действия различных доз протонов и ионов углерода было показано отсутствие влияния данного наркоза на уровень цитогенетических повреждений в клетках костного мозга, состояние тимуса и селезенки, а также на поведение у необлученных и облученных мышей в короткие и отдаленные сроки после облучения [12, 13]. Глубину наркоза оценивали визуально по отсутствию некоординированных движений у мыши и отрицательной реакции на болевой раздражитель в виде зажатия хвоста пинцетом. Выбранная схема анестезии обеспечивала обездвиживание мышей во время укладки и облучения, а также 100% выход мышей из наркоза без введения дополнительных антагонистических препаратов и отсутствие гибели животных.
В качестве излучения с низким значением ЛПЭ применяли рентгеновское излучение (РИ). Мышей облучали РИ в диапазоне доз 6.0–8.5 Гр на установке РУТ (200 кВ, 1 Гр/мин, 2 кэВ/мкм) в Центре коллективного пользования “Источники излучения” (ИБК, Пущино).
Облучение животных протонами проводили на комплексе протонной терапии ФТЦ ФИАН (Протвино) тонким сканирующим пучком с одного направления в импульсном режиме (длительность импульса 200 мс, 1 импульс в 2 с) и сигмой пучка – 2.8–3.6 мм в двух областях кривой Брэгга дозами 6.5–8.5 Гр. Верификацию положения мышей проводили лазерной системой позиционирования. При облучении до пика Брэгга протонами с энергией частиц 150 МэВ ЛПЭ, рассчитанная по программе планирования, составляла 0.7 ± 0.04 кэВ/мкм, а в пике Брэгга энергия частиц на выходе из ускорителя составляла 91–123 МэВ при среднем значении ЛПЭ 2.5 ± ± 0.7 кэВ/мкм. Контроль дозы проводили дозиметром PTW UNIDOS (Германия) и дозиметрической пленкой (EBT3, США) с погрешностью поглощенной дозы ~5%.
Облучение мышей моноэнергетическим пучком ионов углерода с энергией 450 МэВ/нуклон в дозе 6.5 Гр осуществлялось на установке “Радиобиологический стенд на углеродном пучке У-70” НИЦ “Курчатовский институт” – ИФВЭ (Протвино) в условиях, описанных ранее [14]. Расчетная величина ЛПЭ ионов углерода при позиционировании мышей до пика Брэгга равнялась 15 КэВ/мкм, а в модифицированном пике Брэгга – 39 КэВ/мкм. Дозиметрию проводили по показаниям монитора, ТЛД дозиметров типа ММТ. Профили пучка и равномерность поперечного облучения контролировали с помощью радиохромной пленки ЕВТ-3 (CafChromic, США).
После облучения в течение 30 сут ежедневно учитывали и взвешивали мышей. Влияние анестезии оценивали по динамике гибели, средней продолжительности жизни (СПЖ) погибших животных и изменению массы тела.
Показатели выживаемости мышей сравнивали с помощью непараметрических критериев: Гехана-Вилкоксона для оценки продолжительности жизни погибших от облучения животных и логрангового критерия для сравнения 30-суточной выживаемости. Различия считали статистически значимыми при p ≤ 0.05.
На рис. 1 представлены кривые выживаемости мышей, облученных сублетальными и летальными дозами РИ. Облучение мышей РИ в присутствии анестезии приводит к значительному повышению 30-суточной выживаемости (p ≤ 0.01) при всех дозах. СПЖ погибших мышей, облученных в дозе 6.0 Гр с анестезией, составила 20 ± 5 сут, а без анестезии – 13 ± 3 сут. СПЖ мышей, облученных в дозах 6.5 и 8.5 Гр, не зависела от наличия анестезии и в среднем равнялась 13 ± 5 и 6 ± 3 сут соответственно.
Рис. 1.
Динамика гибели мышей, облученных РИ в диапазоне доз 6.5–8.5 Гр: (–) – без анестезии; (+) – с анестезией, *p ≤ 0.01 по сравнению с не анестезированными мышами.
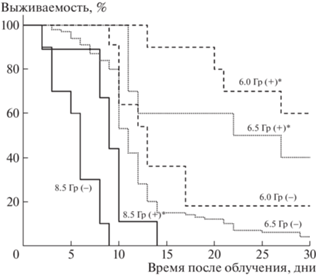
Во всех группах животных наблюдалось снижение массы тела. У мышей, облученных в дозе 6.0 Гр, снижение веса не зависело от применения анестезии, и максимальная 20% потеря массы тела наблюдалась на 13-е сутки после облучения. При облучении в дозе 6.5 Гр в первые сутки масса тела мышей снижалась одинаково на 5%. Максимальная потеря веса на 30%, характеризующая острую стадию лучевой болезни, при которой гибнут животные, в подгруппе без анестезии происходила на 9-е сутки, а в подгруппе анестезированных мышей только к 13-м суткам. При облучении в дозе 8.5 Гр снижение веса на 30% наблюдалось на 9-е сутки после облучения РИ и не зависело от наличия анестезии.
Как видно из данных на рис. 2а, анестезия не влияла на выживаемость мышей при облучении протонами в пике Брэгга в дозах 6.5 и 7.5 Гр. При облучении анестезированных мышей в дозе 8.5 Гр наблюдалось значительное повышение выживаемости: к 30-м суткам выжило 43% животных по сравнению с не анестезированными мышами, где этот показатель был всего 7%.
Рис. 2.
Динамика гибели мышей, облученных протонами (а) в пике Брэгга и (б) до пика Брэгга в диапазоне доз 6.5–8.5 Гр: (–) – без анестезии; (+) – с анестезией, *p ≤ 0.01 по сравнению с не анестезированными мышами.

Во всех группах не зависимо от величины дозы и наличия анестезии наблюдалась максимальная потеря веса мышей до 25–30 % на 12–14-е сутки после облучения протонами. СПЖ погибших животных составила для групп 6.5 Гр – 20 ± 5 сут; 7.5 Гр – 13 ± 4 сут; 8.5 Гр – 13 ± 5 сут.
Облучение мышей протонами в этом же диапазоне доз до пика Брэгга имитирует облучение тканей, находящихся до опухоли, и моделирует действие галактического излучения на организм. Это положение на кривой Брэгга характеризуется более низким значением ЛПЭ протонов по сравнению с облучением в пике Брэгга или РИ. Как видно из результатов на рис. 2б, анестезия не влияла на динамику гибели мышей, характер течения лучевой болезни и СПЖ погибших животных после облучения протонами до пика Брэгга.
Для количественного определения действия анестезии при облучении РИ и протонов мы рассчитывали фактор изменения дозы (ФИД) как отношение полулетальных доз (ЛД50/30) при введении модифицирующего вещества и без него. Для определения ЛД50/30, при которой выживает 50% животных в течение месяца, использовали пробит-анализ в качестве метода преобразования кривых смертности. Для РИ ФИД = 1.13, что свидетельствует о слабом защитном эффекте анестезии в исследованном диапазоне доз. Для протонов в пике Брэгга ФИД = 0.94, а до пика ФИД = 0.95, т.е. не выявлено влияния анестезии на радиочувствительность мышей.
В отличие от протонов влияние анестезии на 30-суточную выживаемость мышей при облучении ионами углерода в дозе 6.5 Гр оказалось значимым, как в положении до пика, так и в пике Брэгга (рис. 3). После облучения мышей без анестезии в пике Брэгга к 7-м суткам наблюдалась 100%-ная гибель, а при использовании анестезии 30% животных доживало до 30 сут, основная гибель наблюдалась в течение 10 сут с потерей веса до 30%, а СПЖ погибших животных не отличались. При облучении мышей ионами углерода до пика Брэгга 30-суточная выживаемость в экспериментальных группах резко различалась: без анестезии составляла 30%, а с анестезией – 76%. СПЖ погибших животных не отличалась и в среднем составляла 18 ± 7 сут. Максимальное снижение веса животных фиксировалось на 16-е сутки после облучения: в подгруппе с анестезией – на 15–20%, а в подгруппе без анестезии – на 25–30%.
Рис. 3.
Динамика гибели мышей, облученных ионами углерода до и в пике Брэгга в дозе 6.5 Гр: (–) – без анестезии; (+) – с анестезией, *p ≤ 0.01 по сравнению с не анестезированными мышами; **p ≤ 0.05 по сравнению с не анестезированными мышами.

Таким образом, как при облучении РИ, так и ускоренными ионами углерода, резко отличающимися значениями ЛПЭ и спецификой взаимодействия с живой материей, мы наблюдали одинаковое снижение потери массы тела в присутствии анестезии у животных, что указывает на реализацию защиты в наиболее критической первой стадии лучевой болезни. Возможно, защитное действие анестезирующих веществ происходит за счет расслабления гладкой мускулатуры и гипоксии в активно делящихся чувствительных клетках кишечного эпителия [9]. Это наблюдение является неожиданным, поскольку в многочисленных работах на клеточных и организменных моделях, в том числе и нами было показано, что ионы углерода обладают гораздо более повреждающим воздействием по сравнению с фотонными излучениями, и эффект слабо зависит от содержания кислорода в тканях [15, 16].
Влияние анестезии на радиационное поражение оценивали также по значениям площади под кривыми, отражающими динамику гибели мышей в течение 30 сут после воздействия излучений в зависимости от ЛПЭ (табл. 1).
Таблица 1.
Результаты определения площади под кривыми выживаемости мышей после облучения в разных дозах излучениями с различной ЛПЭ
| Вид излучения | ЛПЭ, кэВ/мкм | Доза, Гр | Площадь под кривой, усл. ед. | Отношение показателей (I/II) | |
|---|---|---|---|---|---|
| без анестезии (I) | с анестезией (II) | ||||
| Рентгеновское | 2.0 | 6.0 | 1551 | 2610 | 0.6:1 |
| 6.5 | 1325 | 2410 | 0.5:1 | ||
| 8.5 | 560 | 889 | 0.6:1 | ||
| Протоны до пика Брэгга | 0.7 | 6.5 | 2676 | 2606 | 1.0:1 |
| 7.5 | 2500 | 2600 | 1.0:1 | ||
| 8.5 | 1708 | 1704 | 1.0:1 | ||
| Протоны в пике Брэгга | 2.5 | 6.5 | 2650 | 2571 | 1.0:1 |
| 7.5 | 2060 | 2176 | 0.9:1 | ||
| 8.5 | 1354 | 2085 | 0.6:1 | ||
| Ионы углерода до пика Брэгга | 15 | 6.5 | 2240 | 2700 | 0.8:1 |
| Ионы углерода в пике Брэгга | 39 | 6.5 | 590 | 1447 | 0.4:1 |
Максимальный защитный эффект анестезии в 3.3 раза проявлялся при облучении мышей ионами углерода в пике Брэгга в дозе 6.5 Гр, а при облучении до пика в той же дозе влияние уменьшалось до 1.2. При облучении протонами в дозах 6.5 и 7.5 Гр как до, так и в пике Брэгга влияние анестезии на радиочувствительность мышей незначительно, но при облучении в пике Брэгга самой высокой дозой 8.5 Гр наблюдался защитный эффект: выживаемость возрастала в 1.7 раза. Значительное защитное действие анестезии по этому критерию показано и при действии РИ: в 1.7 раза для доз 6.0 и 8.5 Гр и в 2 раза для дозы 6.5 Гр. Полученные результаты показывают, что для объяснения наблюдаемых эффектов при использовании данной анестезии, обладающей гипоксическим действием, недостаточно классических представлений, согласно которым плотноионизирующее излучение в отличие от рентгеновского имеет слабую зависимость от кислородного эффекта. В литературе существуют указания на то, что уменьшение нарушений функций нервной системы с помощью седативных веществ, которые входят в исследованную нами комбинацию анестезии, помогают уменьшить негативные последствия облучения [17]. Отдельным важным вопросом, требующим дальнейшего изучения и обсуждения, является участие ингибирования или стимулирования различных клеточных рецепторов в формировании системного ответа организма на облучение, поскольку известно, что используемая в нашей работе комбинация препаратов содержит соединения с хорошо изученным действием на NMDA-рецепторы и α2-адренорецепторы [18].
Таким образом, нами было показано, что применение ксилазин-золетиловой анестезии существенно снижает гибель животных при действии РИ и ионов углерода при облучении до и в пике Брэгга, при облучении протонами такого влияния не выявлено. Эти факты еще раз указывают на многообразие сигнальных путей клеточного и тканевого взаимодействия в отдаленной реализации начальных повреждений при действии ускоренных частиц с различными ЛПЭ при облучении in vivo. В связи с тем, что состав анестезии, использованный в нашей работе, применяется только для животных, полученные данные прежде всего имеют практическое значение при внедрении новых методов радиотерапии в ветеринарии, разработке адекватных моделей для биомедицины, доклинических испытаний новых источников излучения, а также исследования механизмов сочетанного действия фармакологических веществ и радиации с высокими значениями ЛПЭ.
Список литературы
Li L.W., Chua G.W., Wenjun K., et al. Anaesthesia for radiotherapy in paediatric oncology-a retrospective observational study in an Asian population // Chin. Clin. Oncol. 2021. V. 10. № 3.
Гугушвили Б.С., Джанджгава И.М., Кахиани Э.Д., и др. Радиопротекторы (справочник). Тбилиси: Мец- ниерева; 1987.
Vanderwaeren L., Dok R., Verstrepen K., et al. Clinical progress in proton radiotherapy: biological unknowns // Cancers (Basel). 2021. V. 13. № 4.
Durante M., Debus J., Loeffler J.S. Physics and biomedical challenges of cancer therapy with accelerated heavy ions // Nat. Rev. Phys. 2021. V. 3. № 12. P. 777–790.
Yang R., Duan C., Yuan L., et al. Inhibitors of HIF-1α and CXCR4 mitigate the development of radiation necrosis in mouse brain // Int. J. Radiat. Oncol. Biol. Phys. 2018. V. 100. № 4. P. 1016–1025.
Cucinotta F. (NASA Lyndon B. Johnson Space Center Houston, Texas,), Kim MH., Chappell L. (U.S.R.A., Division of Space Life Sciences Houston, Texas). Space radiation cancer risk projections and uncertainties – 2012. NASA Technical Publication; 2013 Report No.: TP-2013–0217375. Houston: NASA.
Simpson J.A. Elemental and isotopic composition of the galactic cosmic-rays // Annu. Rev. Nucl. Particle. Sci. 1983. V. 33. P. 323–381.
Smith J., van den Broek F., Martorell J., et al. Principles and practice in ethical review of animal experiments across Europe: summary of the report of the FELASA working group on ethical evaluation of animal experiments // Laboratory Animals. 2007. V. 41. № 2. P. 143–160.
Огнева Н.С., Савченко Е.С., Табоякова Л.А. Анестезия самок мышей при хирургической трансплантации эмбрионов // Биомедицина. 2021. Т. 17. № 3Е. С. 64–69.
Zhang Y.M., Yu D.X., Yin B.S., et al. Xylazine regulates the release of glycine and aspartic acid in rat brain // J. Vet. Res. 2018. V. 62. № 1. P. 121–128.
Старокожева Я.К., Климов П.В. Оценка клинических эффектов агонистов альфа2-адренорецепторов-медетомидина и ксилазина в рандомизированном двойном слепом исследовании // Вопросы нормативно-правового регулирования в ветеринарии. 2017. № 4. С. 105–108.
Balakin V.E., Rozanova O.M., Smirnova E.N., et al. The effect of low and medium doses of proton pencil scanning beam on the blood-forming organs during total irradiation of mice // Dokl. Biochem. Biophys. 2020. V. 494. P. 231–234.
Sorokina S.S., Zaichkina S.I., Rozanova O.M., et al. The early delayed effect of accelerated carbon ions and protons on the cognitive functions of mice // Biol. Bull. Russ. Acad. Sci. 2020. V. 47. P. 1651–1658.
Заичкина С.И., Розанова О.М., Смирнова Е.Н. и др. Оценка биологической эффективности ускоренных ионов углерода с энергией 450 МэВ/нуклон в ускорительном комплексе У-70 по критерию выживаемости мышей // Биофизика. 2019. Т. 64, № 6. С. 1208–1215.
Wang L., Frank S.J. Principles of radiobiology. In: Frank SJ., Zhu XR., editors. Proton Therapy Indications Techniques and Outcomes. New York: Elsevier; 2020. P. 2–13.
Tinganelli W., Durante M. Carbon Ion Radiobiology // Cancers (Basel). 2020. V. 12. № 10.
Свердлов А.Г. Биологическое действие нейтронов и химическая защита. Л: Наука, 1974.
Шарапов М.Г., Гудков С.В., Ланкин В.З. и др. Роль глутатионпероксидаз и пероксиредоксинов при свободнорадикальных патологиях // Биохимия. 2021. Т. 86. № 11. С. 1635–1653.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


