Доклады Российской академии наук. Науки о жизни, 2022, T. 506, № 1, стр. 349-353
ВЛИЯНИЕ НАНОЧАСТИЦ КРЕМНИЯ НА АКТИВНОСТЬ АНТИОКСИДАНТНЫХ ФЕРМЕНТОВ В КОРНЯХ ТОМАТОВ ПРИ ИНВАЗИИ ГАЛЛОВОЙ НЕМАТОДОЙ MELOIDOGYNE INCOGNITA (KOFOID ET WHITE, 1919) CHITWOOD, 1949
Ж. В. Удалова 1, С. В. Зиновьева 1, *
1 Федеральное государственное бюджетное учреждение науки Институт проблем экологии и эволюции
им. А.Н. Северцова Российской академии наук
Москва, Россия
* E-mail: zinovievas@mail.ru
Поступила в редакцию 24.04.2022
После доработки 27.05.2022
Принята к публикации 02.06.2022
- EDN: IOBJSV
- DOI: 10.31857/S2686738922050304
Аннотация
Проведено исследование активности перекисного окисления липидов, каталазы, супероксиддисмутазы и пероксидазы в корнях растений томатов при экзогенной обработке нанокремнием в концентрации 1.0 мкг/мл при заражении Meloidogyne incognita. Показано, что в обработанных Si–НЧ растениях на ранних стадиях паразитирования наблюдается низкая активность ПО и СОД, а также и повышенный уровень ПОЛ, что указывает на образование свободных радикалов (АФК), способных ингибировать жизнедеятельность нематод, а также ограничить формирование гигантских клеток. Во время седентарной стадии, на этапах питания, развития и продуцирования яиц в корнях обработанных растений наблюдалась повышенная активность ПО, КАТ и СОД, а также низкая активность ПОЛ по сравнению с инвазированными необработанными растениями. Это позволяет поддерживать баланс между образованием и обезвреживанием АФК, и имеет значение не только в защите растительных тканей от окислительных процессов, но также и для сохранения гигантских клеток, питающих паразита. Представленные данные впервые показывают механизм действия Si–НЧ в развитии устойчивости и адаптации растений к биогенному стрессу, связанный с влиянием на различные компоненты антиоксидантной системы и их функциональным взаимодействием.
Проблема повышения устойчивости растений (иммунного статуса) к фитопатогенам путем индукции природных защитных механизмов разрабатывается уже многие годы. Это направление особенно актуально в защите растений от нематод – опасных паразитов корневой системы, ущерб от которых исчисляется миллионами долларов, а эффективные способы борьбы отсутствуют. Индуцированную устойчивость (ИУ) вызывают факторы биотической и абиотической природы, названные индукторами или элиситорами, способные активизировать сложную интегрированную систему защитных механизмов и тем самым максимально реализовать естественный иммунный потенциал растений. Среди множества индукторов биогенной и абиогенной природы, способных влиять на иммунный статус растений, научный и практический интерес представляют микроэлементы, особенно в наноразмерных формах. В последнее время большое внимание стало уделяться исследованию наночастиц кремния (Si–НЧ), которые обладают низкой токсичностью, антибактериальными свойствами и пролонгированным действием [1, 2]. Благодаря уникальным физическим и химическим свойствам, Si–НЧ могут легко проникать в клетки растений и вызывать морфологические и физиологические изменения, способствующие повышению устойчивости к болезням, вызванным грибами, бактериями и нематодами [3–5]. Механизм действия Si–НЧ практически не исследован. Немногочисленные данные свидетельствуют о его воздействии на генерацию активных форм кислорода (АФК) – раннюю реакцию клеток на стрессоры различной природы [6, 7].
АФК в клетках растений образуются в обычных условиях и принимают участие в метаболизме. Нарушение про- и антиоксидантного равновесия ведет к их избыточному накоплению, усилению процессов перекисного окисления липидов (ПОЛ), повреждению макромолекул и гибели клетки. Растения обладают эффективными механизмами для противодействия АФК. Антиоксидантные ферменты, такие как супероксиддисмутазы (СОД), пероксидазы (ПО) и каталазы (КАТ) считаются основными ферментами, участвующими в удалении свободных радикалов и активных форм кислорода. Несмотря на то что интерес к изучению антиоксидантной системы защиты (АОС) уже многие годы не ослабевает, целый ряд особенностей ее функционирования, в частности, в условиях действия на растения биогенного стресса, вызванного паразитическими нематодами, остается до конца не выясненным. Имеющиеся в литературе данные об изменении окислительного гомеостаза, нарушенного нематодами, немногочисленны и достаточно противоречивы [8, 9]. Недостаточно полно изучена работа АОС у различных по нематодоустойчивости растений, хотя существует мнение, что устойчивые растения обладают более высокой антиоксидантной активностью по сравнению с восприимчивыми [8]. Отсутствуют данные о динамике изменений различных компонентов антиоксидантной ферментной системы (КАТ, СОД, ПО), а также об их функциональном взаимодействии на различных этапах развития паразитов, которые необходимы для установления роли АФК в развитии взаимоотношений в системе нематоды–растения. В последние годы становится понятно, что компоненты этой системы пребывают в сложном функциональном взаимодействии друг с другом, которое может быть аддитивным, синергическим и антагонистическим [10].
Цель работы – исследовать влияние препарата Si–НЧ на процесс ПОЛ и антиоксидантной системы защиты клеток, в растениях томатов Lycopersicon esculentum Mill при инвазии их галловой нематодой Meloidogyne incognita (Kofoid et White, 1919) Chitwood, 1949, на протяжении развития нематод в корнях растений и тем самым показать возможную роль про/антиоксидантной системы растений в системной устойчивости растений к нематодам, опосредованной Si–НЧ.
Исследования проводили на восприимчивом к галловой нематоде гибриде томатов F1 Гамаюн (ИУ 30%). Семена поверхностно стерилизованных томатов перед высадкой в грунт замачивали в 2 мл 1.0 мкг/мл препарата Si–НЧ течение 2 ч. Через 3 нед после прорастания часть растений инвазировали нематодой (3000 личинок/растение) и опрыскивали растворами препарата в тех же концентрациях, которыми обрабатывали семена (10 мл/растение). Контрольные семена и растения обрабатывали водой. Контролем были здоровые растения. Растительные пробы для анализов отбирали на ключевых этапах жизнедеятельности нематоды: 1-е сутки – внедрение в корни, межклеточная миграция; 3-и сутки – прекращение миграции, индукция и формирование мест питания – гигантских клеток (клеток сосудистой системы корня, метаболизм которых был направленно изменен секреторной деятельностью личинок); 5–7-е сутки – потеря подвижности, питание, развитие; 20-е сутки – питание, формирование яйцевого мешка, откладка яиц, завершение жизненного цикла. Анализы проводили в 3-кратной повторности.
Для работы был использован препарат водного коллоидного раствора Si–НЧ, полученного методом лазерной абляции [11]. Средний размер частиц составлял 65.3 ± 1.6 нм, рН раствора – 4.92, дзета-потенциал равен 12.3 мВ, исходная концентрация – 10 мкг/мл. Работу проводили с препаратом в концентрации 1.0 мкг/мл, поскольку в этой концентрации проявлялось наибольшее индуцирование устойчивости томатов к галловой нематоде, что было установлено нами ранее [5].
Об уровне оксидативного стресса судили по содержанию малондиальдегида (МДА) – конечного продукта перекисного окисления липидов, которое определяли по образованию окрашенных комплексов с 2-тиобарбитуровой кислотой. Общее содержание белка определяли по методу Бредфорда [12].
Активность ферментов измеряли спектрофотометрически [12]: активность СОД (СОД, КФ.1.15.1.1) определяли по способности фермента ингибировать фотохимическое восстановление нитросинего тетразолия; активность ПО (ПО, КФ.1.11.1.7) – реакцией окисления бензидина; активность КАТ (КАТ, КФ.1.11.1.6) – по количеству разложенной перекиси водорода. Данные обрабатывали общепринятыми методами вариационной статистики. На рисунках приведены средние арифметические значения и их стандартные ошибки.
Полученные результаты показали, что в корнях томатов, которые не были обработаны Si–НЧ (контроль), в период межклеточной миграции и на этапе образования мест питания (1–3-и сутки после инвазии), активность ПОЛ была ниже, чем в здоровых растениях в пределах 20%. С переходом на седентарный образ жизни, в период активной жизнедеятельности и продуцирования яиц, содержание МДА было на уровне здоровых растений (рис. 1 а).
Рис. 1.
Активность антиоксидантных ферментов в корнях здоровых растений томатов (К); при заражении галловой нематодой (Н); обработанных препаратом нанокремния (Н+Si) при заражении галловой нематодой. а – активность перекисного окисления липидов (содержание малондиальдегида – МДА); б – активность пероксидазы (ПО); в – активность супероксиддисмутазы (СОД); Г– активность каталазы (КАТ). Данные по оси ординат – дни после инокуляции растений. M ± m; n = 3; * – статистически достоверное отличие от контроля (p ≤ 0.05).
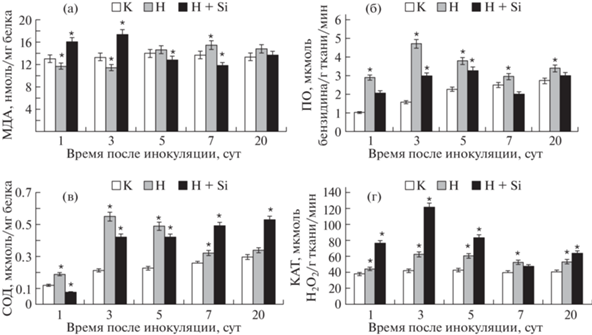
Активность ПО, СОД и КАТ в корнях контрольных растений (без обработки) на ранних стадиях паразитирования, связанных с проникновением и миграцией в корне, возрастала с максимумом на 3-и сутки (ПО в 2.9 раза, СОД в 2.6 раза, КАТ в 1.5 раза). Затем активность ферментов немного снизилась, но оставалась выше, чем в корнях здоровых растений (рис. 1 б, в, г).
Согласно нашим результатам, в корнях растений на протяжении всего периода развития нематод наблюдается повышенная активность антиоксидантных ферментов. Это позволяет поддерживать в активном состоянии защиту от окислительного стресса, о чем свидетельствует низкий уровень МДА – маркер оксидативного стресса. Таким образом, в восприимчивых растениях складываются благоприятные условия для формирования гигантских клеток, активного питания и успешного прохождения паразитом стадий жизненного цикла.
Обработка растений Si–НЧ вызвала изменение исследуемых показателей в корнях растений по сравнению с необработанными. Активность ПО и СОД корнях инвазированных растений, обработанных Si–НЧ, в первые 3 сут после инвазии (в период миграции и создания зоны питания – гигантских клеток) была значительно ниже (в 2–3 раза), чем в инвазированных без обработки (рис. 1 б, в). В этот же период уровень МДА в корнях был заметно выше (в 1.3–1.4 раза), чем в корнях необработанных растений (рис. 1 а). Низкая активность этих ферментов и повышенный уровень ПОЛ указывают на образование свободных радикалов (АФК), что может вызвать локальный некроз в области внедрившихся личинок, ингибировать их жизнедеятельность, а также ограничить формирование гигантских клеток.
Как известно, количество свободных радикалов в клетке строго регулируется при участии КАТ как основного компонента антиоксидантной системы, которая, кроме этого, лимитирует продолжительность жизни АФК, предохраняя клетку от их вредоносного воздействия [13]. В первые три дня после инвазии активность КАТ была выше (в 1.7–1.8 раза), чем в корнях необработанных растений (рис. 1 г). Возможно, высокая активность КАТ на этапе, связанного с индукцией и образованием гигантских клеток, способствовала частичному обезвреживанию АФК, которые токсичны не только для патогена, но и для самого растения, и была направлена на сохранение функционирования клеток хозяина, нарушенного деятельностью АФК, образовавшихся в этот период.
Во время седентарной стадии, начиная с 5-х суток после инвазии, на этапах питания, развития и продуцирования яиц в корнях обработанных растений наблюдалась повышенная активность ПО, КАТ и СОД по сравнению с инвазированными необработанными растениями, а также низкая активность ПОЛ (рис. 1 а, б, в, г). Это позволяет поддерживать баланс между образованием и обезвреживанием АФК, и имеет значение не только в защите растительных тканей от окислительных процессов, но также и для сохранения гигантских клеток, питающих паразита. Эти клетки, несмотря на возможное их ингибирование продуктами АФК на этапе их образования (низкий уровень активности СОД и ПО, повышенное содержание токсичных МДА), продолжают исполнять свою функцию, обеспечивая жизнедеятельность нематод и сохранность популяции в обработанных Si–НЧ растениях, хотя и в значительно меньших масштабах, как было показано нами ранее [5].
Следует отметить, что наблюдаемое изменение активности антиоксидантных ферментов на различных этапах жизненного цикла паразита может быть обусловлено не только реакцией растения-хозяина, но и вмешательством в этот процесс самих паразитов. Паразитические нематоды разработали сложную систему защиты от окислительного стресса, включающую антиоксидантные ферменты, выделяемые в апопласт растений, которые способны удалять из растения продукты АФК [14]. Показана высокая активность КАТ у мигрирующих личинок галловой нематоды; известно также, что галловые нематоды продуцируют и выделяют в апопласт по меньшей мере четыре эффектора, которые препятствуют образованию АФК. Недавно было сообщено о прямом взаимодействии лектина C-типа и КАТ, выделяемых личинками галловых нематод в апопласт, что указывает на возможную манипуляцию нематодой процессом образования АФК [15]. Возможно, обратимое изменение активности КАТ и других ферментов, наблюдаемое в корнях инвазированных растений, является результатом саморегуляции и адаптации партнеров, в зависимости от изменения условий существования, в том числе под воздействием Si–НЧ.
Полученные данные о действии Si–НЧ дополняют результаты ранее проведенных нами исследований. На системе томаты – галловая нематода Meloidogyne incognita было показано, что Si–НЧ стимулируют ростовые процессы растений, снижают зараженность корневой системы нематодами и оказывают ингибирующее влияние на морфо-физиологические показатели нематод. При этом было отмечено возрастание содержания фотосинтетических пигментов и ряда биогенных элементов в инвазированных растениях, свидетельствующих об улучшении их физиологического состояния [5].
Представленные результаты показали, что одним из механизмов действия нанокремния, позволяющего рассматривать его в качестве индуктора системной устойчивости томатов к галловой нематоде растений, является его влияние на активность компонентов АОС. Смещение прооксидантно-антиоксидантного равновесия, наблюдаемое в растениях при действии Si–НЧ на ранних этапах паразитирования, может создать условия, неблагоприятные для жизнедеятельности нематод и их развития. Это подтверждается данными о нарушении репродуктивной функции нематод (снижение количества формируемых яиц и личинок с резко сниженной жизнеспособностью) при развитии на корнях обработанных растений, что в итоге приводит к снижению численности их популяции и является показателем устойчивости растений [5].
Безусловно, индуцирующее действие Si–НЧ основано на многих, еще неисследованных механизмах. Свойства Si–НЧ позволяют им непосредственно проникать в клетки растений и взаимодействовать с белками и другими биомолекулами. Такое прямое действие Si–НЧ может способствовать быстрой передаче клеточных сигналов и проявлять биологическую эффективность в отношении фитопатогенов (синтез низкомолекулярных соединений, обладающих биоцидными свойствами (фитоалексины, фенолы), активацию сигнальной системы растений и индукцию защитных белков). Исследование этих механизмов может открыть новые возможности как для регуляции устойчивости растений к стрессам, так и для предотвращения потерь при хранении урожая.
Список литературы
Kandhol N., Singh V.P., Peralta-Videa J., et al. Silica nanoparticles: the rising star in plant disease protection // Trends Plant Sci. 2022. V. 27. № 1. P. 7–9.
Zellner W., Tubana B., Rodrigues R.A., et al. Silicon’s role in plant stress reduction and why this element is not used routinely for managing plant health // Plant Dis. 2021. V. 105. № 8. P. 2033–2049.
Rajput V.D., Minkina T., Feizi, et al. Effects of silicon and silicon-based nanoparticles on rhizosphere microbiome, plant stress and growth // Biology 2021. V. 10. 791.
Wang L., Ning C., Pan T., et al. Role of silica nanoparticles in abiotic and biotic stress tolerance in plants: A review // Int. J. Mol. Sci. 2022. 23. 1947.
Udalova Zh.V., Folmanis G.E., Fedotov M.A., et al. Effects of silicon nanoparticles on photosynthetic pigments and biogenic elements in tomato plants infected with root-knot nematode Meloidogyne incognita // Dokl. Bioch. Bioph. 2020. V. 495. P. 329–333.
Khan M.R., Siddiqui Z.A. Use of silicon dioxide nanoparticles for the management of Meloidogyne incognita, Pectobacterium betavasculorum and Rhizoctonia solani disease complex of beetroot (Beta vulgaris) // Sci. Horticult. 2020. V. 265. 109211.
El-Shetehy M., Moradi A., Maceroni M., et al. Silica nanoparticles enhance disease resistance in Arabidopsis plants // Nat. Nanotechnol. 2021. V. 16 № 3. P. 344–353.
Melillo M.T., Leonetti P., Bongiovanni M., et al. Modulation of ROS activities and H2O2 accumulation during compatible and incompatible tomato/root-knot nematode interactions // New Phytol. 2006. 170. P. 501–512.
Leonetti P., Molinari S. Epigenetic and metabolic changes in root-knot nematode-plant interactions // Int. J. Mol. Sci. 2020. V. 21. 7759.
Колупаев Ю.Е., Карпец Ю.В. Активные формы кислорода, антиоксиданты и устойчивость растений к действию стрессоров. 2019. Киев: Логос, 2019. 277 с.
Roldugin V.I., Fedotov M.A., Folmanis G.E., et al. Formation of aqueous colloidal solutions of selenium and silicon by laser ablation // Dokl. Phys. Chem. 2015. V. 463. № 1. P. 161–164.
Кузнецов Вл.В., Кузнецов В.В., Романов Г.А. Молекулярно-генетические и биохимические методы в современной биологии растений. М. БИНОМ. Лаборатория знаний. 2012. 487 с.
Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа. Гилем. 2001.160 с. ISBN 5-75-01-0215-7.
Jagdale S., Rao U., Giri A.P. Effectors of root-knot nematodes: an arsenal for successful parasitism // Front. Plant Sci. 2021. V. 12. 800030.
Zhao J., Sun Q., Quentin M., et al. A Meloidogyne incognita C-type lectin effector targets plant catalases to promote parasitism // New Phytol. 2021. V. 232. P. 2124–2137.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


