Доклады Российской академии наук. Науки о жизни, 2022, T. 506, № 1, стр. 361-365
ГЕЛДАНАМИЦИН УСИЛИВАЕТ РАДИОЗАЩИТНОЕ ДЕЙСТВИЕ ПЕРОКСИРЕДОКСИНА 6 В ОБЛУЧЕННЫХ 3Т3 ФИБРОБЛАСТАХ
Е. Г. Новосёлова 1, *, О. В. Глушкова 1, М. Г. Шарапов 1, М. О. Хренов 1, С. Б. Парфенюк 1, С. М. Лунин 1, Т. В. Новосёлова 1, Э. К. Мубаракшина 1, Р. Н. Гончаров 1, член-корреспондент РАН Е. Е. Фесенко 1
1 Институт биофизики клетки Российской академии наук – обособленное подразделение Федерального государственного бюджетного учреждения науки Федеральный исследовательский центр Пущинский научный центр биологических исследований Российской академии наук
Пущино, Московская обл., Россия
* E-mail: elenanov_06@mail.ru
Поступила в редакцию 05.05.2022
После доработки 26.06.2022
Принята к публикации 28.06.2022
- EDN: KNSSEH
- DOI: 10.31857/S2686738922050213
Аннотация
Целью исследования была оценка возможности повышения радиозащитного потенциала пероксиредоксина 6 (Prdx6) и его мутантной формы S32A путем их совместного использования с гелданамицином (GA) для фибробластов 3T3, облученных рентгеновским излучением с дозой 6 Гр.
Мутантный фермент S32A, не обладающий фосфолипазной активностью, при его сочетанном применении с GA проявляет более выраженную радиозащитную активность. Использование такой комбинации противолучевых препаратов полностью снимает пик активности NF-κB в облученных 3Т3 клетках. Другой фактор транскрипции, р53, являющийся показателем уровня апоптоза клетки и увеличивающийся при облучении, также снижается под действием S32A в сочетании с GA. Низкомолекулярный белок р21, являющийся маркером сенесценции клеток, продукция которого возрастает при облучении, также нормализуется при использовании S32A в сочетании с GA. Кроме того, использование этой комбинации радиозащитных препаратов заметно снижает стрессовый ответ клеток 3Т3 на рентгеновское облучение.
Известно, что в клетках, выживших после рентгеновского облучения, обычно наблюдаются изменения уровней экспрессии генов, связанных с репарацией ДНК, клеточным циклом, воспалением и иммунным ответом [1]. Ранее было установлено, что ионизирующая радиация (IR) является причиной клеточного стресса и нарушения активности клеток, вызываемой либо путем прямого повреждения ДНК, либо непрямого воздействия на ДНК через образование активных форм кислорода (ROS) [2]. По этой причине в течение многих лет проводятся исследования, направленные на поиск новых радиозащитных препаратов. Недавно мы показали, что фермент–антиоксидант пероксиредоксин 6 (Prdx6) увеличивает выживаемость облученных 3Т3 фибробластов, стимулирует их пролиферацию, подавляет апоптоз, некроз и сенесценцию этих клеток, вызванных сублетальной дозой рентгеновского облучения [3]. На основании наших исследований был сделан вывод о целесообразности исследования разных форм пероксиредоксина 6 в качестве радиопротекторных агентов.
Целью настоящей работы было изучение возможности усиления радиозащитного действия белка Prdx6 и его мутантной формы S32A путем их использования совместно с известным блокатором белка теплового шока HSP90, гелданамицином (GA), обладающим радиозащитным и сенолитическим действием [4, 5].
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали линию 3Т3 фибробластов мыши из 5–10 пассажей и две формы пероксиредоксина 6: нормальный Prdx6, обладающий пероксидазной и фосфолипазной активностями, а также белок с мутацией (S32A) в фосфолипазном активном центре, обладающий только пероксидазной активностью. Мутагенез гена PRDX6 проводили по методике перекрывающихся праймеров, с использованием высокоточной ДНК полимеразы Tersus (Евроген, Россия), праймеров несущих точечную замену (S32A-F 5'-CTGGGAGACGCATGGGGCAT-3'; S32A-R 5'-ATGCCCCATGCGTCTCCCAG-3') и фланкирующих праймеров (Prx6-F 5'-TTTTTCATATGCCCGGAGGTCTGCTT-3'(NdeI), Prx6-R 5'-AATTCTCGAGAGGCTGGGGTGTGTA-3'(XhoI)). Условия ПЦР и этапы клонирования в вектор pET23b были подробно описаны ранее на примере другого мутанта Prdx6 [6]. Конструкцию, кодирующую мутантную форму Prdx6-S32A, проверяли секвенированием по Сэнгеру, с помощью компании Евроген.
Важно отметить, что Prdx6 и его мутантная форма S32A и ингибитор стрессового белка, GA, добавлялись к 3Т3 клеткам через 4 ч после рентгеновского облучения в дозе 6 Гр. После этих процедур клетки культивировали в течение 5 сут. Уровни цитокинов определяли с использованием иммуноферментного анализа, количество других белков оценивали, применяя вестерн блот анализ, как было описано ранее [3].
В работе проводили комплексное исследование клеточных ответов на радиационные повреждения, связанные с изменением неспецифического иммунитета, с процессами репарации, с апоптозом и старением (сенесценцией) клеток, с уровнем стрессового ответа 3Т3 фибробластов. Подобно другим стрессорам, ионизирующее излучение усиливало синтез различных иммуностимулирующих и модулирующих молекул, таких как белки теплового шока (HSP), цитокины, факторы транскрипции (p53, NF-κB), что было показано авторами c использованием облученных 3Т3 клеток [3].
В настоящей работе, оценивая эффекты облучения на показатели иммунного статуса 3Т3 клеток, мы показали, что рентгеновское облучение в дозе 6 Гр вызывает повышение продукции про-воспалительных цитокинов IL-6, TNF-alpha и антивоспалительного цитокина IL-10 (рис. 1).
Рис. 1.
Продукция цитокинов в 3Т3 фибробластах после рентгеновского облучения в дозе 6 Гр и использования радиозащитных препаратов. Использовали первичные кроличьи антитела к IL-6, TNF-α и IL-10 компании Peprotech (USA). В качестве вторичных использовали козьи антитела к Ig G кролика компании Имтек (Россия). Каждое значение – среднее от 3 независимых экспериментов с использованием в каждом случае клеток из разных пассажей. * – достоверное отличие от контроля; # – достоверное отличие от группы 6 Гр.

Интересно, что добавление к клеткам ингибитора белка теплового шока HSP90 также снижало продукцию IL-6, но не IL-10. Результаты показали, что мутантный фермент-антиоксидант, не обладающий фосфолипазной активностью (S32A), в отношении продукции провоспалительных цитокинов проявляет наиболее выраженную радиозащитную активность, особенно при его сочетанном применении с GA.
Для исследования механизмов влияния рекомбинантных белков на основе Prdx6 и ингибитора HSP90 на облученные 3Т3 клетки мы изучали ключевые звенья регуляции клеточных процессов. Среди этих звеньев ядерный фактор транскрипции каппа B (NF-κB) признан ключевым фактором регуляции активности клеточного метаболизма для большинства типов клеток, при этом NF-κB является центральным фактором транскрипции в иммунной системе и регулирует выживание клеток. Более того, индукция радиорезистентности опосредуется несколькими генами, которые регулируются NF-κB [7]. Было показано, что в облученных клетках уровень фосфорилирования NF-κB по Ser 536 достоверно увеличивается, а использование Prdx6 и его мутантной формы S32A в сочетании с GA полностью снимает пик активности NF-κB в облученных 3Т3 клетках, при этом более эффективной оказалась мутантная форма S32A (рис. 2). Выживаемость облученных 3Т3 клеток определяли с использованием Crystal Violet, как было описано ранее [3]. Показали, что добавление Prdx6 и особенно его мутантной формы S32A увеличивает процент выживших клеток, при этом защита белками-антиоксидантами не возрастает в присутствии GA (табл. 1).
Рис. 2.
Продукция сигнальных и стрессовых белков в 3Т3 фибробластах после облучения в дозе 6 Гр и использования радиозащитных препаратов. Для определения всех белков использовали наборы компании CellSignalling (USA). Показаны фотографии Вестерн блот анализа для одного из 3 независимых экспериментов, цифры под полосками – среднее значение количества белка после денситометрии блотов от трех экспериментов, показатели нормировали к соответствующему контролю нагрузки (GAPDH) и выражали в относительных единицах. Статистический анализ проводили с использованием t-критерия Стьюдента. *Достоверное отличие от контроля; # – достоверное отличие от группы 6 Гр.
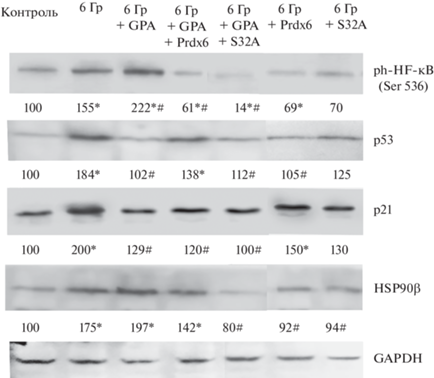
Таблица 1.
Жизнеспособность клеток Balb/3T3, в % от контроля ±SE
| контроль | 6 Гр | 6 Гр + GA | 6 Гр + GA + Prdx6 | 6 Гр + GA + S32A | 6 Гр + Prdx6 | 6 Гр + S32A | |
|---|---|---|---|---|---|---|---|
| Жизнеспособность клеток | 100 ± 8.2 | 61.8 ± 7.2* | 84.7 ± 9.1# | 70 ± 6.9 | 72 ± 7.1 | 88 ± 8.8# | 92 ± 9.4# |
Известно, что р53 играет важную роль в регуляции клеточного цикла, репарации ДНК и апоптоза [8]. По этой причине оценивали в 3Т3 клетках продукцию белка р53, причем измеряя и фосфорилированные формы этого белка php53 (S46) и php53 (S15), которые имеют различные функции в клетке. Ранее мы показали, что ионизирующая радиация в дозе 6 Гр достоверно увеличивает уровень р53 в клетке, а также увеличивает уровень фосфорилирования php53 (S46) и php53 (S15) [3]. На этом фоне добавление после облучения двух форм пероксиредоксина 6 к клеткам в сочетании с GA показывает очевидный защитный эффект, нормализуя уровень р53, а также способствуя выживанию клеток (рис. 2).
Одним из важных регуляторов клеточной активности является низкомолекулярный белок p21, продукт гена CDKN1A, впервые идентифицированный как циклонезависимый регулятор киназы (CDK) и играющий важную роль в контроле развития клеточного цикла. Белок p21 останавливает клеточный цикл во время G1 и S-фазы через связывание и ингибирование циклин-CDK1,2,4,6 комплексов [9]. Кроме того, оценка уровня р21 является важным показателем в качестве маркера сенесценции клеток.
Результаты показали, что рентгеновское облучение в сублетальной дозе увеличивает продукцию р21 в клетках, а GA, в сочетании с Prdx6 и, особенно, с его мутантной формой S32A полностью нормализует пролиферацию и снижает уровень сенесценции облученных 3Т3 фибробластов (рис. 2). Кроме того, когда-то считалось, что белок p21 действует как опухолевый супрессор, главным образом, ограничивая клеточный цикл, что приводит к подавлению опухолевого роста. При углубленных исследованиях роли этого белка было обнаружено, что p21 регулирует радиационные ответы клеток за счет участия во множестве клеточных процессов, включая остановку клеточного цикла, апоптоз, репарацию ДНК, старение и аутофагию [10]. Действительно, мы показали, что рентгеновское облучение в дозе 6 Гр значительно повышает продукцию р21, а присутствие GA в среде культивирования облученных фибробластов нормализует пролиферацию 3Т3 клеток в присутствии Prdx6, при этом более эффективным оказалось использование белка-антиоксиданта S32A (рис. 2).
Известно, что прямыми показателями клеточного стресса являются активация продукции белков теплового шока HSP90α и HSP90β, уровень продукции которых влияет на радиочувствительность клеток [11]. Мы обнаружили, что облучение 3Т3 фибробластов приводит к достоверному увеличению конститутивной формы белка теплового шока HSP90, HSP90β. При этом присутствие Prdx6 в среде культивирования клеток в сочетании с GA заметно снижает стрессовый ответ клеток 3Т3 на рентгеновское облучение. Важно отметить, что и в этом случае более эффективным было использование мутантной формы S32A в сочетании с GA (рис. 2). Следует отметить, что приведенные результаты не противоречат тому факту, что защитное действие Prdx6 в отношении фибробластов, подвергнутых воздействию ДНК-повреждающих агентов, было обнаружено почти 20 лет назад [12].
Важность разработки новых противолучевых средств связана не только с защитой при инцидентах радиоактивного загрязнения, но и при использовании лучевой терапии [13]. В настоящее время лучевая терапия является одним из основных методов лечения рака, при этом, несмотря на многие преимущества этого лечения, такие как неинвазивность, сохранение целостности органов и точность при нацеливании на опухоль, оно может привести к осложнениям в облученных здоровых тканях. По этой причине использование радиозащитных средств может в значительной степени снизить вероятность радиационно-индуцированных осложнений.
Список литературы
McKelvey K.J., Hudson A.L., Back M., et al. Radiation, inflammation and the immune response in cancer // Mammalian Genome. 2018. V. 29. P. 843–865.
Cadet J., Douki T., Ravanat J.-L. Oxidatively generated base damage to cellular DNA // Free Radical Biology and Medicine. 2010. V. 49. P. 9–21.
Novoselova E.G., Sharapov M.G., Lunin S.M., et al. Peroxiredoxin 6 applied after exposure attenuates damaging effects of X-ray radiation in 3T3 mouse fibroblasts // Antioxidants. 2021. V. 10. № 12. P. 1951.
Li L., Wang L., You Q.D., et al. Heat shock protein 90 inhibitors: An update on achievements, challenges, and future directions //J. Med. Chem. 2020. V. 12. № 63 (5). P. 1798–1822.
Stankova K., Savova G., Nikolov V., et al. HSP90 inhibitor geldanamycin as a radiation response modificator in human blood cells // Dose-response. 2015. V. 13. № 1. eCollection Jan-Mar 2015.
Sharapov M.G., Novoselov V.I., Fesenko E.E., et al. The role of peroxiredoxin 6 in neutralization of X-ray mediated oxidative stress: effects on gene expression, preservation of radiosensitive tissues and postradiation survival of animals // Free radical research. 2017. V. 51. № 2. P. 148–166.
Bai M., Ma X., Li X., et al. The accomplices of NF-κB lead to radioresistance //Review Curr. Protein. Pep.t Sci. 2015. V. 16. № 4. P. 279–294.
Pei D., ZhangY., Zheng J. Regulation of p53: a collaboration between Mdm2 and Mdmx // Oncotarget. 2012. V. 3. P. 228–235.
Georgakilas A.G., Martin O.A., Bonner W.M. p21: a two-faced genome guardian trends // Mol. Med. 2017. V. 23. P. 310–319.
Kuang Y., Kang J., Li H., et al. Multiple functions of p21 in cancer radiotherapy // Journal of Cancer Research and Clinical Oncology. 2021. V. 147. P. 987–1006.
Schilling D., Kühnel A., Konrad S., et al. Sensitizing tumor cells to radiation by targeting the heat shock response // Cancer Lett. 2015. V. 1. № 360 (2). P. 294–301.
Dierick J.-F., Wenders F., Chainiaux F., et al. Retrovirally mediated overexpression of peroxiredoxin VI increases the survival of WI-38 human diploid fibroblasts exposed to cytotoxic doses of tert-butylhydroperoxide and UVB. // Biogerontology. 2003. V. 4. № 3. P. 125–131.
Sheikholeslami S., Khodaverdian S., Dorri-Givb M., et al. The radioprotective effects of alpha-lipoic acid on radiotherapy-induced toxicities: A systematic review // International Immunopharmacology. 2021. V. 96. P. 107741.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


