Доклады Российской академии наук. Науки о жизни, 2022, T. 506, № 1, стр. 377-382
ПОВЫШЕНИЕ ЭФФЕКТИВНОСТИ ЭЛЕКТРОКАТАЛИЗА ЦИТОХРОМА Р450 3А4 С ПОМОЩЬЮ МОДИФИКАЦИИ ЭЛЕКТРОДА ПРОСТРАНСТВЕННО-УПОРЯДОЧЕННЫМИ НАНОСТРУКТУРАМИ НА ОСНОВЕ АНОДНОГО ОКСИДА АЛЮМИНИЯ ДЛЯ ИССЛЕДОВАНИЯ МЕТАБОЛИЧЕСКИХ ПРЕВРАЩЕНИЙ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
В. В. Шумянцева 1, 2, *, П. И. Королева 1, А. А. Гилеп 1, 3, К. С. Напольский 4, Ю. Д. Иванов 1, С. Л. Канашенко 1, академик РАН А. И. Арчаков 1, 2
1 Федеральное государственное бюджетное научное учреждение “Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича”
Москва, Россия
2 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
3 Институт биоорганической химии НАН Беларуси
Минск, Беларусь
4 Химический факультет Московского государственного университета имени М.В. Ломоносова
Москва, Россия
* E-mail: viktoria.shumyantseva@ibmc.msk.ru
Поступила в редакцию 15.06.2022
После доработки 06.07.2022
Принята к публикации 11.07.2022
- EDN: WBCLVD
- DOI: 10.31857/S2686738922050298
Аннотация
Предложен новый подход для модификации электродов с использованием пористых мембран на основе анодного оксида алюминия, содержащих сонаправленные поры диаметром 0.1 и 0.2 мкм и мембраноподобного вещества дидодецилдиметиламмония бромида (ДДАБ) для исследования электрокаталитической эффективности системы. Такой подход позволяет увеличить каталитическую эффективность цитохрома P450 3А4 в реакции N-деметилирования эритромицина на 132% при использовании мембраны с порами 0.1 мкм и на 32% при использовании аналогичной мембраны с размером пор 0.2 мкм. Модификация электродов с помощью пористых мембран смещает потенциал электрохимического восстановления и катализа цитохрома P450 3А4 в анодную область на 0.070–0.050 В, что свидетельствует о термодинамически более выгодном процессе электронного транспорта и ферментативного электрокатализа.
Ферменты играют важную роль в исследовании биохимии метаболических путей и патологических процессов, в медицинской диагностике, в синтезе лекарственных препаратов (антибиотиков, стероидных гормонов, прекурсоров), в фармакологии в качестве лекарственных препаратов, в разработке (био)сенсорных и диагностических систем, в агротехнике, в промышленном химическом синтезе, в пищевой промышленности [1].
Среди ферментных систем цитохромы Р450 активно исследуются вследствие высокой функциональной и медицинской значимости. Цитохромы P450 – гем-тиолатные монооксигеназы, катализирующие большое число различных типов химических реакций, и присутствующие во всех классах живых организмов. Широкая субстратная специфичность цитохромов P450 позволяет использовать их для получения фармакологически значимых препаратов [2, 3]. Главным ограничением в реализации такого биотехнологического подхода является использование дополнительных редокс-партнерных белков и НАДФН в качестве источника электронов для реконструируемых систем. В электрохимических системах донором электронов является электрод. Для создания эффективных электрохимических цитохром Р450-систем были разработаны различные типы электродов и материалы для их модификации, основной задачей которых является сохранение нативной структуры фермента и его каталитической активности [4, 5]. Иммобилизация белка на рабочей поверхности электрода необходима для эффективного электронного транспорта и обмена реакционной среды. Однако при этом существует проблема взаимодействия белка с “твердыми” двумерными (2D) поверхностями, что может приводить к денатурации белка [6]. Ключевым моментом электроанализа является обоснованный выбор типа электродов для наиболее эффективного процесса переноса электронов и регистрации молекулы, биохимического события, каталитического тока как индикатора электрокатализа [5, 7]. При работе с “твердыми” электродами модификация рабочей поверхности (например, мембраноподобными, поверхностно-активными соединениями) не только способствует более эффективному электронному транспорту, но может приводить к стабилизации третичной структуры белка. Новизной подхода, предложенного в данной работе, является включение фермента в трехмерную структуру пористой мембраны, помещенной на рабочий электрод. При этом осуществляется переход от 2D к 3D типу электрода, что может способствовать стабилизации структуры белка и повышению его удельной каталитической активности.
В качестве трехмерного пористого материала (3D) нами были использованы мембраны из анодного оксида алюминия, содержащие сонаправленные поры диаметром 0.1 мкм (Anodisc 13, Whatman 0.1 µm, cat No. 6809-7013) и 0.2 мкм (Anodisc 13, Whatman 0.2 µm, cat No. 6809-7023). Дизайн электрохимического эксперимента позволяет включить фермент в 3D-нанопоры на плоском электроде, осуществить 2D → 3D переход матрицы и эффективно исследовать каталитическую активность цитохрома Р450 3А4 (схема 1). Главными преимуществами мембраны на основе анодного оксида алюминия являются химическая стабильность, высокоорганизованная и регулярная структура нанопор, а также коммерческая доступность. На рис. 1 приведены микрофотографии используемой мембраны с порами диаметром 0.1 мкм, полученные с помощью сканирующего электронного микроскопа. Мембрана имеет регулярное расположение пор для эффективного включения исследуемого белка. Средний размер мономеров цитохромов Р450 лежит в нанометровом диапазоне [8], что позволяет предположить возможность включения белка в поры.
Схема 1.
Модификация электрода с помощью высокоорганизованных и регулярных нанопор на основе анодного оксида алюминия (Anodisc).
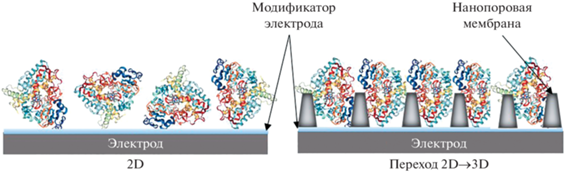
Рис. 1.
Микрофотографии пористой мембраны, полученные с помощью сканирующего электронного микроскопа Hitachi S 5500 при различных увеличениях 2 мкм (а) и 500 нм (б).

Электрохимические измерения проводили с помощью потенциостата AUTOLAB 302 N (Metrohm Autolab, Нидерланды), снабженного программным обеспечением NOVA (версия 2.0). В работе использовали трехконтактные электроды с графитовыми рабочим и вспомогательным электродами и хлоридсеребряным электродом сравнения (ПГЭ – печатный графитовый электрод), полученные методом трафаретной печати, (ColorElectronics, Россия). Диаметр рабочего электрода 2 мм. Для изготовления мембраны соответствующего диаметра анодный оксид алюминия нарезали на круги с помощью волоконного лазера “МиниМаркер 2”. В экспериментах по регистрации электрокаталитической активности цитохрома Р450 3А4 использовали циклическую вольтамперометрию (ЦВА) и горизонтальное расположение электродов. Все электрохимические измерения проводили при комнатной температуре в 100 мМ калий-фосфатном буфере с 50 мМ NaCl в качестве фонового электролита, рН 7.4.
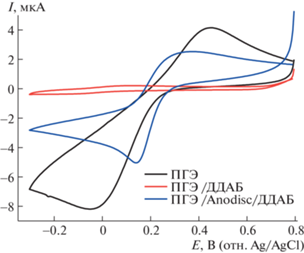
Электроактивная площадь ПГЭ и модифицированных электродов была рассчитана по уравнению Рэндлса-Шевчика [9, 10] с использованием внешнего электролита 5 мМ раствора гексацианоферрата калия. Было зарегистрировано увеличение электроактивной площади электрода при модификации мембранами из анодного оксида алюминия (Anodisc 0.1 мкм) и ДДАБ по сравнению с немодифицированным электродом и электродом, модифицированным только ДДАБ (рис. 2). Электроаналитические характеристики электродов, модифицированных мембранами из анодного оксида алюминия (Anodisc 0.1 мкм) и ДДАБ, продемонстрировали существенное увеличение электроактивной площади модифицированных электродов (в 2.5 и 103 раза соответственно) по сравнению с немодифицированным электродом и электродом, модифицированным ДДАБ, что говорит об эффективности использования мембраны с порами субмикронного размера (0.0014, 0.000034 и 0.0035 см2 для ПГЭ, ПГЭ/ ДДАБ и ПГЭ/Anodisc 0.1 мкм/ ДДАБ соответственно).
Рис. 2.
Циклические вольтамперограммы ПГЭ и ПГЭ/ДДАБ и ПГЭ/Anodisc 0.1 мкм/ ДДАБ при скорости развертки потенциала 0.05 В/с. Измерения проводили в горизонтальном режиме, в 100 мкл 5 мМ раствора гексацианоферрата калия. Диапазон потенциалов –0.3–+1 В.
Электроды с иммобилизованными рекомбинантными изоформами цитохромов Р450 являются эффективными инструментами при поиске новых субстратов, ингибиторов, активаторов этого класса гемопротеинов [11–14]. Антибиотик из группы макролидов эритромицин (ЭР) является субстратом цитохрома Р450 3А4 (CYP3A4) и используется для сравнительного анализа каталитической активности этой изоформы [14]. Для анализа электрохимического восстановления цитохрома Р450 3А4, иммобилизованного на электроде как источнике электронов, на поверхность рабочего электрода помещали мембрану из анодного оксида алюминия соответствующего диаметра, содержащую поры со средним диаметром 0.1 или 0.2 мкм, затем наносили 2 мкл 0.1 М ДДАБ в хлороформе, после испарения хлороформа (10 мин) наносили 1 мкл 142 мкМ цитохрома P450 3A4. На рис. 3А и 3Б приведены сравнительные ЦВА цитохрома Р450 3А4 в диапазоне потенциалов –0.1–0.6 В. При вычитании фоновой ЦВА электрода без фермента (ПГЭ/ДДАБ) получены более четкие вольтамперограммы, демонстрирующие смещение потенциала восстановления гемопротеина при использовании пористой мембраны в анодную область потенциалов, что свидетельствует о термодинамически более выгодном процессе электрохимического восстановления иона железа гема цитохрома Р450 3А4 [15] в соответствии со схемой Fe(III) + ē ⇄ Fe(II) + + О2 → Fe(II)О2 [3, 11, 14].
Рис. 3.
(а) Циклические вольтамперограммы (ЦВА) цитохрома Р450 3А4 иммобилизованного на ПГЭ/ДДАБ (–), ПГЭ/Anodisc 0.1 мкм/ДДАБ (–) и ПГЭ/Anodisc 0.2 мкм/ДДАБ (–). (б) Циклические вольтамперограммы цитохрома Р450 3А4, иммо-билизованного на ПГЭ/ДДАБ (–), ПГЭ/Anodisc 0.1 мкм/ДДАБ (–) и ПГЭ/Anodisc 0.2 мкм/ДДАБ (–), с вычитанием соответствующей фоновой кривой. Скорость сканирования 0.1 В/с.

Рис. 4.
(а) Циклические вольтамперограммы цитохрома Р450 3А4, иммобилизованного на ПГЭ/Anodisc 0.1 мкм/ДДАБ (–), при добавлении субстрата эритромицина (–), ПГЭ/ДДАБ (–). (б) Циклические вольтамперограммы цитохрома Р450 3А4, иммобилизованного на ПГЭ/Anodisc 0.1 мкм/ДДАБ (–) при добавлении субстрата эритромицина (–), с вычитанием фоновой кривой ПГЭ/ДДАБ. Скорость сканирования 0.1 В/с.
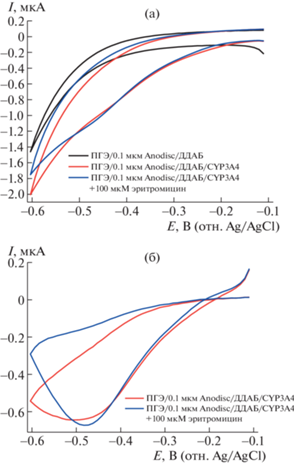
Эффективность электрокатализа оценивали по накоплению продукта цитохром P450 3A4 реакции N-деметилирования эритромицина – формальдегида [16].
Как следует из табл. 1, использование мембран из анодного оксида алюминия (Anodisc 0.1 и 0.2 мкм) для модификации электрода позволяет сместить потенциал восстановления цитохрома Р450 3А4 и потенциал катализа эритромицина в анодную область, что способствует процессу переноса электронов между электродом и активным центром фермента и делает его термодинамически более выгодным [4, 15]. Несмотря на меньшее количество электроактивного белка на ПГЭ/Anodisc 0.1/ДДАБ/CYP3A4, (параметр Г0, моль/см2) каталитическая активность такой системы существенно превышает ПГЭ/ДДАБ/CYP3A4 (232%). Этот эффект может отражать сохранение каталитической активности фермента в порах пространственно-упорядоченных структур на основе анодного оксида алюминия.
Таблица 1.
Электрохимические характеристики и сравнение каталитической активности цитохрома Р450 3А4
| Электрод | Ered, В | Ecat, В | Г0, моль/см2 | Icat/ Ired | Относительная эффективность катализа, % |
|---|---|---|---|---|---|
| ПГЭ/ДДАБ/ CYP3A4 | –0.432 ± 0.008 | –0.450 ± 0.005 | 3.94 ± 0.69 × 10–11 | 0.99 ± 0.21 | 100 ± 9 |
| ПГЭ/Anodisc 0.1/ДДАБ/CYP3A4 | –0.368 ± 0.005 | –0.385 ± 0.021 | 7.11 ± 4.79 × 10–12 | 1.12 ± 0.8 | 232 ± 4 |
| ПГЭ/Anodisc 0.2/ДДАБ/CYP3A4 | –0.355 ± 0.025 | –0.402 ± 0.017 | 6.78 ± 2.97 × 10–12 | 0.77 ± 0.17 | 132 ± 5 |
Включение фермента в поры анодного оксида алюминия с диаметром 0.1 и 0.2 мкм позволило повысить эффективность электрокатализа за счет перехода от двумерной поверхности планарного электрода к трехмерной объемной структуре рабочего электрода с субмикронным диаметром пор.
Таким образом, нами был разработан новый подход к повышению каталитической активности цитохрома Р450 3А4 с помощью модификации электродной поверхности, позволяющий перевести процесс переноса электронов в цитохром Р450 3А4-электрохимических системах в термодинамически более выгодный режим и существенно увеличить (более чем в 2 раза) каталитическую активность цитохрома P450 3A4 в электрокаталитической реакции N-деметилирования макролидного антибиотика эритромицина.
Список литературы
Singh R.S., Singh T., Singh A.K. Enzymes as Diagnostic Tools. In: Singh R.S., Singhania R.R., Pandey A., Larroche C. editors. Biomass, Biofuels, Biochemicals // Advances in Enzyme Technology. Amsredam: Elsevier. 2019. P. 225–271.
Bernhardt R., Urlacher V.B. Cytochromes P450 as promising catalysts for biotechnological application: chances and limitations // Appl Microbiol Biotechnol. 2014. V. 98. P. 6185–6203.
Guengerich F.P. Human cytochrome P450 enzymes. In: Ortiz de Montellano P.R. editor. Cytochrome P450: Structure, Mechanism, and Biochemistry. 4th ed. New York: Springer. 2015. P. 523–785.
Schneider E., Clark D.S. Cytochrome P450 (CYP) enzymes and the development of CYP biosensors // Biosensors and Bioelectronics. 2013. V. 39. № 1. P. 1–13.
Шумянцева В.В., Агафонова Л.Е., Булко Т.В., и др. Электроанализ биомолекул: обоснованный выбор сенсорных конструкций // Успехи биологической химии. 2021. Т. 61. С. 295–316.
Gray J.J. The interaction of proteins with solid surfaces // Curr. Opin. Structur. Biol. 2004. V. 14. № 1. P. 110–115.
Kuzikov A.V., Bulko T.V., Koroleva P.I., et al. Electroanalytical and electrocatalytical characteristics of cytochrome P450 3A4 using electrodes modified with nanocomposite carbon nanomaterials // Biomedical Chemistry. V. 66. № 1. 2020. P. 64–70.
Tempel W., Grabovec I., MacKenzie F. et al. Structural characterization of human cholesterol 7α‑hydroxylase // J Lipid Res. 2014. V. 55. № 9. P. 1925–1932.
Randles J.E.B. A cathode-ray polarograph. Part II – The current-voltage curves // Trans Faraday Soc. 1948. V. 44. P. 327.
Chen H.C., Chang C.C., Yang K.H. et al. Polypyrrole electrode with a greater electroactive surface electrochemically polymerized in plasmon-activated water // Journal of the Taiwan Institute of Chemical Engineers. 2018. V. 82. P. 252–260.
Shumyantseva V.V., Bulko T.V., Archakov A.I. Electrochemical reduction of cytochrome P450 as an approach to the construction of biosensors and bioreactors // J. Inorg. Biochem. 2005. V. 99. № 5. P. 1051–1063.
Johnson D.L., Lewis B.C., Elliot D.J., et al. Electrochemical characterization of the human cytochrome P450 CYP2C9 // Biochem. Pharmacol. 2005. V. 69. № 10. P. 1533–1541.
Lu J., Cui D., Li H., et al. Cytochrome P450 bienzymes assembled on Au/chitosan/reduced grapheme oxide nanosheets for electrochemically-driven drug cascade metabolism // Electrochim. Acta. 2015. V. 165. P. 36–44.
Panicco P., Castrignanò S., Sadeghi S.J., et al. Engineered human CYP2C9 and its main polymorphic variants for bioelectrochemical measurements of catalytic response // Bioelectrochemistry. 2021. V. 138. Art. num. 107729.
Rusling J.F., Wang B., Yun S. Electrochemistry of redox enzymes. In: Bartlett P.N. editor. Bioelectrochemistry: Fundametals, Experimental Techniques and Applications. New Jersey: John Wiley & Sons, Ltd.; 2008. P. 39–85.
Nash T. The colorimetric estimation of formaldehyde by means of the Hantzsch reaction // Biochem J. 1953. V. 55. № 3. P. 416–421.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


