Доклады Российской академии наук. Науки о жизни, 2022, T. 507, № 1, стр. 445-448
ИЗМЕНЕНИЕ УРОВНЯ СЫВОРОТОЧНОГО АМИЛОИДА А У ДОМАШНИХ КОШЕК В ПЕРИОД БЕРЕМЕННОСТИ
Член-корреспондент РАН С. В. Найденко 1, *, Г. С. Алексеева 1, П. С. Ключникова 1, М. Н. Ерофеева 1
1 Институт проблем экологии и эволюции
им. А.Н. Северцова Российской академии наук
Москва, Россия
* E-mail: snaidenko@mail.ru
Поступила в редакцию 13.07.2022
После доработки 18.07.2022
Принята к публикации 20.07.2022
- EDN: GWILKF
- DOI: 10.31857/S268673892206021X
Аннотация
Воспроизводство редких видов в неволе – актуальная проблема для сохранения и восстановления биоразнообразия. Для млекопитающих, в том числе кошачьих, оценка и контроль протекания беременности являются основополагающим моментом для успешного разведения. Впервые проведена оценка изменений концентраций сывороточного амилоида А (SAA), основного белка острой фазы воспаления у кошачьих, в период беременности у домашней кошки. Выявлено, что изменения концентраций SAA у беременных самок носят закономерный характер: увеличение к середине беременности (30-й день) и снижение к 60-му дню. После родов наблюдается значительное увеличение концентраций SAA в крови кошек. Существенное влияние на динамику концентраций SAA в ходе исследования оказывал размер выводка, в частности после родов увеличение его уровня было существенно выше у самок, родивших большие выводки (от 4 до 7 котят).
Кошачьи – семейство хищных млекопитающих, включающее 39 видов [1]. Численность большинства из них снижается. Особенно катастрофична ситуация с некоторыми крупными представителями семейства (тигр (Panthera tigris), лев (P. leo), ягуар (P. onca)). В частности, численность тигра в ХХ в. сократилась более чем в 30 раз [2]. Даже при успешном восстановлении вида во всех доступных местообитаниях численность его никогда не сможет достигнуть описанной к началу ХХ в., восстановление ареала в исторических границах также невозможно.
При нарушении и фрагментации ареала все более важным становится сохранение генофонда диких кошачьих. Основными подходами являются создание криобанков и воспроизводство животных ex-situ. При сохранении генетического материала кошачьих путем криоконсервации в первую очередь сохраняют сперматозоиды и ооциты, реже эмбрионы и соматические клетки [3]. Очевидный плюс этого подхода – длительность хранения проб и низкая стоимость поддержания коллекции. Воспроизводство животных в зоопарках и питомниках, несмотря на относительно высокую стоимость процесса, имеет свои преимущества. Одно из них – сохранение видоспецифичных паттернов поведения, формирующихся в процессе онтогенеза при взаимодействиях с матерью и однопометниками [4].
Таким образом, воспроизводство редких видов кошачьих ex-situ остается актуальным и необходимым. Однако их размножение в неволе – сложный процесс, требующий учета особенностей поведения [5], предпочтения брачных партнеров [6], физиологии размножения [7], факторов, влияющих на качество спермы и репродуктивный успех самцов [8], характера протекания беременности, в том числе и при различных репродуктивных стратегиях. Последнее – одна из важнейших составляющих успеха размножения диких кошачьих в неволе. Повышенный уровень глюкокортикоидов (стресса животных) может вести к прохолостованию животных, снижению размера выводка [9], а свободный выбор брачного партнера – к снижению эмбриональных потерь [8].
Существует ряд подходов к оценке физиологического состояния животных, одним из которых является определение концентраций белков острой фазы воспаления [10], что может выявлять отклонения в протекании беременности [11] и позволяет принять своевременные меры для сохранения потомства. У кошек основным таким белком является сывороточный амилоид А (serum amyloid A, SAA) [12]. Для отдельных видов кошачьих, в том числе гепарда и леопарда, его концентрацию оценивали [12], однако никогда не прослеживали динамику на протяжении беременности. Целью настоящего исследования было оценить закономерности изменения уровня SAA у модельного вида кошачьих (домашней кошки) в период беременности.
Работу проводили на научно-экспериментальной базе “Черноголовка” ИПЭЭ РАН в 2018–2021 гг. Кошек в течение года содержали в вольерах при естественном световом и температурном режиме. Условия содержания животных детально описаны ранее [6, 9]. В работе использовали 35 кошек, которые в марте-апреле спаривались с самцами. Выводки (от 1 до 7 котят, средний размер выводка 3.9 ± 0.4) принесли 23 кошки, остальные 12 – не родили. За 1–15 сут до спариваний (точка 0), на 15-е, 30-е, 45-е и 60-е сутки после спариваний и через сутки после родов у кошек собирали кровь (до 3 мл) из паховой вены. Кровь центрифугировали 15 мин при 3000 об/мин, сыворотку отделяли и замораживали при –18°С до проведения анализа. Концентрацию SAA определяли с использованием ИФА-наборов (Tridelta Development Ltd, Ирландия, Cat. № TP802). Различия концентраций SAA в группах родившие/неродившие оценивали с помощью метода ANOVA для повторных измерений (A), в течение беременности в каждой группе – методом Фридман-ANOVA (F-A). Пост-хок анализ проводили с помощью критериев Манна–Уитни (M-W) (между группами) и Вилкоксона (W) для сопряженных пар (разный срок беременности для одних и тех же животных). Результаты представлены на графиках в виде среднего ±SE.
Концентрации SAA варьировали от 0.2 до 100.1 мкг/мл. Средний уровень составил от 2.2 до 10.2 мкг/мл у родивших самок и от 1.2 до 11.1 мкг/мл – у неродивших. Достоверных различий в уровне SAA между родившими и неродившими кошками не выявлено (A:F = 1.43; df = 6; p = 0.24) (рис. 1). Ни в одной из контрольных точек также не выявлено достоверных различий в уровне SAA между родившими и впоследствии неродившими самками (M-W:Z = 0.30–1.86; n1 = 12; n2 = 22–23; p = 0.062–0.770).
Рис. 1.
Средний уровень SAA у родивших и неродивших самок на разных сроках после спаривания (точка 67 соответствует забору крови после родов).
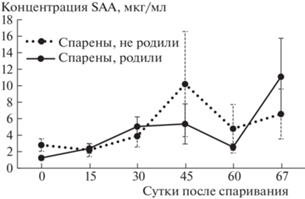
У самок, спаривавшихся с самцом, но впоследствии неродивших, не выявлено достоверных изменений в уровне SAA во время всего периода исследований (F-A:N = 12; df = 5; χ2 = 2.13; p = 0.83). Максимальные значения в такой группе были отмечены на 45-е сутки после спаривания животных. Две особи из 12 в этот период показывали очень высокие концентрации SAA – 36.4 и 72.4 мкг/мл. В отличие от неродивших самок, родившие показывали в ходе беременности закономерные изменения уровня SAA (F-A:N = 22; df = 5; χ2 = 28.35, p = 0.00003). Минимальной концентрация SAA была в точке 0 (до спаривания), уже к 15-м суткам после спаривания она несколько возрастала (в среднем в 1.9 раза), а впоследствии в течение всей беременности (и после родов) оставалась достоверно более высокой, чем до спаривания (W:Z = 2.55–3.78; n = 21–23; p = 0.0002–0.0108). Через 15 сут после спаривания уровень SAA был достоверно ниже, чем на 30-е сутки после спаривания и после родов (W:Z = 2.73 и 2.29; n = 23 и 22; p = 0.006 и 0.022). На 30-й день беременности уровень SAA был достоверно выше, чем на 60-й (W:Z = 2.06; n = 22; p = 0.039). Наиболее высокими концентрации были через сутки после родов, хотя именно в этот период разброс значений был максимален. Таким образом, повышение уровня SAA у беременных самок отмечалось к 15–30-м суткам беременности, затем он снижался к 60-м суткам и резко возрастал после родов.
Размер выводка оказывал достоверное влияние на уровень SAA у домашних кошек в период беременности (A:F = 3.63; df = 6; p = 0.020) (рис. 2).
Рис. 2.
Средний уровень SAA у самок с маленькими (1–3) и большими (4–7) выводками на разных сроках после спаривания (точка 67 соответствует забору крови после родов).
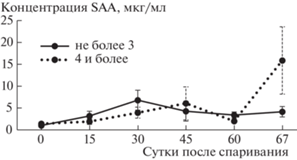
Сравнение проводили для выводков маленького (от 1 до 3 котят) и большого (от 4 до 7 котят) размера (детали см. [9]). В целом в первые 30 сут беременности уровень SAA возрастал значительнее у самок, вынашивающих маленькие выводки, но уже к 45-м сут он существенно снижался. У самок, вынашивающих крупные выводки, это снижение отмечали позже, хотя на сроке 45 сут у них обнаружена значительная индивидуальная изменчивость этого показателя. После родов уровень SAA существенно возрастал только у самок с большими выводками. Вместе с тем достоверных различий в концентрации SAA у самок, вынашивающих большие и маленькие выводки, выявлено не было ни в одной из контрольных точек.
У беременных самок домашней кошки выявлены достоверные закономерности в изменении уровня SAA: увеличение его концентраций в течение первого месяца беременности, падение к 60-м суткам и увеличение после родов. Последнее, по-видимому, объясняется тем, что роды сопровождаются разрывом кровеносных сосудов при отделении плаценты, и, соответственно, развитием в той или иной степени воспалительного процесса как ответной реакции на “повреждение” организма. Это объяснение хорошо соотносится с тем, что самки, родившие большие выводки, демонстрируют более высокие уровни SAA.
У кошачьих уровень SAA является одним из основных маркеров протекания воспалительных реакций, это основной белок острой фазы воспаления [12, 13]. В определенной степени этим можно объяснить его практически двукратное увеличение в организме кошек к 15 сут беременности, которые соответствуют имплантации эмбрионов (12–14 сут) и, соответственно, “проникновению” в организм самки чужеродных антигенов. Сходство процесса имплантации и воспаления неоднократно отмечалось [14]. Учитывая, что основной функцией SAA в организме является защита тканей от интенсивного повреждения, вызванного медиаторами воспаления, объяснимо увеличение его уровня в период формирования плаценты.
Увеличение уровня SAA к середине беременности (точнее к 30-м суткам) может быть связано с дальнейшим развитием плаценты. В литературе нам не удалось найти описания сроков окончания формирования плаценты у домашних кошек; общеизвестно, что у человека этот процесс заканчивается почти в середине беременности (на 16-й неделе из 40). У кошки общая продолжительность беременности – 64–66 сут [15]. Снижение уровня SAA к 60-м суткам беременности (а у самок, вынашивающих небольшие выводки, уже к 45-м суткам) может быть связано с произошедшим окончанием формирования плаценты.
Несмотря на закономерные изменения уровня SAA в ходе беременности, этот показатель не позволяет дифференцировать беременных кошек и кошек, впоследствии неродивших. Вместе с тем отсутствие детенышей у неродивших кошек не исключало возможности, что у этих кошек (или отдельных животных) не произошла имплантация, а эмбрионы впоследствии были резорбированы или произошел выкидыш. Для четкого понимания закономерностей изменений концентраций SAA требуется его анализ у контрольных самок, которые не спаривались с самцами, что позволило бы получить более полное представление об изменении уровня белков острой фазы воспаления у кошачьих в период беременности.
Список литературы
Kitchener A.C., Breitenmoser-Würsten C., Eizirik E., et al. Cat News. 2017. № 11. P. 1–80.
Dinerstein E., Loucks C., Wikramanayake E., et al. BioScience. 2007. V. 57. № 6. P. 508–514.
Amstislavsky S., Brusentsev E., Kizilova E., et al. Reprod. Dom. Anim. 2018. V. 53. № 5. P. 1219–1226.
Guardini G., Bowen J., Mariti C., et al. Animals. 2017. V. 7. № 93.
Wielebnowski N.C., Fletchall N., Carlstead K., et al. Zoo biol. 2002. V. 21. P. 77–98.
Erofeeva M.N., Alekseeva G.S., Kim M.D., et al. Animals. 2022. V. 12. № 2: 165.
Jewgenow K., Goritz F., Neubauer K., et al. J. Europ. Wildl. Res. 2006. V. 52. P. 34–38.
Naidenko S., Erofeeva M., Goeritz F., et al. Acta zool. Sin. 2007. V. 53. P. 408–416.
Alekseeva G.S., Loshchagina J.A., Erofeeva M.N., et al. Animals. 2020. V. 10. 903.
Jain S., Gautam V., Naseem S. J. Pharm. Bioallied Sc. 2011. V. 3. № (1). P. 118–127.
Ulutas P.A., Musal B., Kiral F., et al. Res. Vet. Sc. 2008. V. 86. № 3. P. 373–376.
Heinrich S.K., Hofer H., Courtiol A., et al. Sc. reports. 2017. V. 7. № 1. P. 1–11.
He R., Shepard L.W., Chen J., et al. J. Immunol. 2006. V. 177. № 6. P. 4072–4079.
Chavan A.R., Griffith O.W., Stadtmauer D.J., et al. Mol. Biol. Evol. 2020. V. 38. № 3. P. 1060–1074.
Prescott C.W. Austral. Vet. J. 1973. V. 49. P. 126–129.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


