Доклады Российской академии наук. Науки о жизни, 2022, T. 507, № 1, стр. 455-459
СВОЙСТВА И АКТИВНОСТЬ ПЕПТИДОВ НА ОСНОВЕ КЛЕТОЧНОГО РЕЦЕПТОРА АСЕ2 И ИХ ВЗАИМОДЕЙСТВИЕ С РЕЦЕПТОР-СВЯЗЫВАЮЩИМ ДОМЕНОМ БЕЛКА S ВИРУСА SARS-COV-2
М. В. Сидорова 1, Р. Ш. Бибилашвили 1, Д. В. Авдеев 1, У. С. Кожокарь 1, М. Е. Палькеева 1, М. В. Овчинников 1, А. С. Молокоедов 1, Д. А. Широков 2, 3, А. В. Семенова 2, В. И. Уварова 4, П. О. Куляев 5, Е. В. Хватов 4, А. А. Игнатова 6, А. В. Феофанов 7, Д. И. Осолодкин 4, 8, Ю. Б. Порозов 5, 8, Л. И. Козловская 4, 8, *, академик РАН А. А. Ишмухаметов 4, 8, член-корреспондент РАН Е. В. Парфёнова 1, академик РАН А. М. Егоров 4, 7
1 Национальный медицинский исследовательский центр кардиологии им. академика Е.И. Чазова
Москва, Россия
2 Федеральный научно-клинический центр физико-химической медицины Федерального медико-биологического агентства
Москва, Россия
3 Московская государственная академия ветеринарной медицины и биотехнологии им. К.И. Скрябина
Москва, Россия
4 Федеральный научный центр исследований и разработки иммунобиологических препаратов
им. М.П. Чумакова Российской академии наук (Институт полиомиелита)
Москва, Россия
5 Научно-технологический университет “Сириус”
Сочи, Россия
6 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
Москва, Россия
7 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
8 Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский университет)
Москва, Россия
* E-mail: kozlovskaya_li@chumakovs.su
Поступила в редакцию 11.07.2022
После доработки 15.07.2022
Принята к публикации 18.07.2022
- EDN: MJKHZH
- DOI: 10.31857/S2686738922060336
Аннотация
Целью работы были дизайн и характеристика пептидов на основе α-спиралей h1 и h2 клеточного рецептора ACE2, формирующих интерфейс взаимодействия с рецептор-связывающим доменом (RBD) S-белка SARS-CoV-2. Синтезированы мономерные пептиды и гетеродимерные пептиды на их основе, соединенные дисульфидными связями по различным положениям. Исследованы растворимость, аффинность к RBD и степень спирализации пептидов, а также проведено моделирование молекулярной динамики в различных растворителях. Установлено, что сохранение спиральной конформации является необходимым условием связывания пептидов с RBD. Растворенные в воде пептиды имеют низкую степень спиральности и низкую аффинность к RBD. Димерные пептиды обладают более высокой степенью спиральности, чем мономерные, что может быть следствием взаимного влияния спиралей. Степень спиральности пептидов в трифторэтаноле была наиболее высокой, однако для проведения исследований in vitro наиболее подходящим растворителем является водно-спиртовая смесь.
Пандемия COVID-19 и появление новых вариантов ее этиологического агента – вируса SARS-CoV-2 – делает актуальными исследования по поиску эффективных средств профилактики и лечения этой инфекции. На начальных стадиях взаимодействия вируса с клеткой ключевую роль играет белок S, который формирует шипы на поверхности вирусной частицы. Рецептор-связывающий домен (RBD) белка S взаимодействует с интерфейсом клеточного рецептора ACE2, состоящим из α-спиралей h1 и h2, и запускает слияние клеточной и вирусной мембран для проникновения вирусного генома в цитоплазму клетки [1]. На настоящий момент для ингибирования этого взаимодействия разработаны и применяются в клинической практике моноклональные антитела с нейтрализующей активностью [2–4], которые в дальнейшем станут препаратом сравнения для новых соединений. Одним из подходов к дизайну молекул, способных по конкурентному механизму предотвращать связывание RBD SARS-CoV-2 и родственных ему вирусов с ACE2, является конструирование пептидов, имитирующих структуру и свойства клеточного рецептора АСЕ2. В 2020–2022 гг. изучено значительное количество пептидных молекул на основе последовательности АСЕ2 и нацеленных на взаимодействие с белком S [5] методами in silico, и только для некоторых из них эффективность ингибирования образования комплекса RBD-АCE2 и (или) противовирусная активность были исследованы in vitro. Более того, всего несколько синтезированных структур, проявивших высокую (наномолярную) аффинность связывания in silico [6] и in vitro [7, 8], проявили противовирусную активность на клеточных моделях или животных [9–12].
Для повышения эффективности связывания необходимо оптимизировать структуру пептида с целью создания молекулы, наиболее близко воссоздающей структуру АСЕ2, обеспечивающую высокоаффинное взаимодействие с RBD [13–15]. Нами были разработаны и синтезированы мономерные пептиды на основе аминокислотной последовательности антипараллельных α-спиралей h1 и h2 ACE2 с модифицированными остатками. Мономерные пептиды были соединены дисульфидными мостиками по различным положениям для получения гетеродимерных “химерных” пептидов X1-4 (табл. 1; синтез пептидов X1, X2 и их мономеров описан ранее [16]). Для этих пептидов проведены экспериментальные исследования растворимости, аффинности связывания с RBD и степени спирализации, а также моделирование молекулярной динамики в различных растворителях.
Таблица 1.
Структура и свойства изучаемых пептидов
| Код, комментарий | Последовательность | α-спираль- ность, %а | Kd связывания с RBD, µMб | |||
|---|---|---|---|---|---|---|
| H2O | ВСС | ТФЭ | H2O | ВСС | ||
| Спираль h1 | ||||||
| MTI–23 (SPB1, контроль) | IEEQAKTFLDKFNHEAEDLFYQS-NH2 | 6.0 | 44.4 | 79.8 | NB | 3.57 ± 1.78 |
| h1–D–Cys (21–42) h1 | cEEQAKTFLDKFNHEAEDLFYk | 6.2 | 39.2 | 72.5 | – | – |
| h1–Mpa (21–42) h1 | IEEQAKTFLDK[Mpa]FNHQAEDLFYk | 6.0 | 37.8 | 85.3 | NB | 1.07 ± 0.36 |
| 200h1 (21–44) h1 | IEEQAKTFLDKFNHEAEDLFYQCS | 3.9 | 40.3 | 52.4 | NB | 3.10 ± 1.03 |
| 900h1 (21–44) h1 | IEEQAKTFLDEFNEEAEDLFYQCS | NS* | 37.2 | 73.7 | NB | 3.45 ± 2.42 |
| Спираль h2 | ||||||
| h2 (67–89) h2 | DKWSAFLKEQSTIAQ-Nle-YPLQECI | 8.0 | 45.5 | 62.0 | 40 ± 8 | 2.58 ± 1.11 |
| h2–Cys (67-89) h2 | DKWSAFLKECSTIAQIYPLQEI | 6.9 | 38.2 | 70.2 | NB | 3.87 ± 1.94 |
| 900h2 (64–87) h2 | NCGDKWSAFLKEQSTLAQ-Nle-YPLQE | 7.2 | 51.6 | 65.2 | 1.7 ± 0.4 | 7.22 ± 3.61 |
| Димерные пептиды | ||||||
| X1 (h1–D–Cys – h2) | 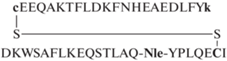 |
8.0 | 41.1 | 95.2 | 4.2 ± 0.5 | 7.39 ± 5.54 |
| X2 (h1–Mpa – h2–Cys) |  |
NS | 51.7 | 82.5 | 12 ± 5 | 0.929 ± 0.371 |
| X3 (200h1 – 900h2) Cys43(h1)–Cys65(h2) |
 |
NS | 55.0 | 98.0 | NB | – |
| Х4 (900h1 – 900h2) |  |
8.8 | 62.8 | 100.0 | NB | 0.882 ± 0.353 |
Исследование аффинности проводили методом микротермофореза [17], а исследование степени α-спиральности – с помощью спектроскопии кругового дихроизма (КД) [18] (табл. 1). Синтезированные пептиды обладают низкой растворимостью в воде. В водном растворе аффинность к RBD проявляли только два химерных пептида (Kd X1: 4 мкМ, X2: 12 мкМ) и два мономерных пептида на основе спирали h2 (константы диссоциации Kd составили h2: 40 мкМ, 900h2: 2 мкМ). Методом КД было установлено, что пептиды в водном растворе имеют низкую степень спиральности, что может являться причиной их низкой аффинности к RBD.
Стабилизация элементов вторичной структуры в пептидах и белках, в частности, α-спиралей, – это комплексный многофакторный процесс, в котором участвуют несколько различных механизмов. К индуцирующим спирализацию эффектам относят уменьшение энтропийного вклада молекул растворителя в сворачивание спиралей за счет разрушения сети водородных связей между ними и боковыми цепями аминокислотных остатков пептида.
Для повышения степени спирализации синтезированных пептидов были подобраны растворители, стабилизирующие их α-спиральную конформацию, а также пригодные для биологических экспериментов.
Наиболее подходящим для поддержания устойчивой спиральной конформации пептидов является трифторэтанол (ТФЭ) [19]. Степень спиральности пептидов в ТФЭ была наиболее высокой: от 50 до 100%. При этом димерные пептиды Х3 и Х4 в ТФЭ сохраняют полностью спиральную конформацию. Этот растворитель может быть использован для характеристики общей способности пептида к спирализации. Однако ТФЭ токсичен для культур клеток и в высокой концентрации непригоден для проведения исследований in vitro.
Методом КД была подтверждена более высокая степень спиральности пептидов в водно-спиртовой смеси (37–63%) по сравнению с водой. В водно-спиртовой смеси мономерные пептиды проявляют аффинность к RBD с константами диссоциации в диапазоне 1–4 и 2–8 мкМ для пептидов на основе последовательности α-спирали h1 и h2 соответственно. Объединение мономерных пептидов в гетеродимеры приводит к повышению аффинности при соединении “середина к середине” или “хвост к голове” (константы диссоциации дипептидов X2 и X4 <1 мкМ), однако не влияет на аффинность при соединении “голова к хвосту” (константа диссоциации дипептида X1 ~7 мкМ) (табл. 1). Кроме того, димерные пептиды обладают более высокой степенью спиральности, чем мономерные, что может быть следствием взаимного стабилизирующего влияния спиралей h1 и h2 друг на друга.
При моделировании молекулярной динамики (100–300 нс) в воде пептиды, особенно мономерные, проявляют склонность к дестабилизации структуры и потере спиральной конформации (рис. 1).
Рис. 1.
Репрезентативные структуры мономерных пептидов 200h1 (а) и 900h2 (б) и полученного из них химерного пептида X3 (в) по результатам моделирования молекулярной динамики. Структуры в воде, ВСС и ТФЭ окрашены голубым, красным и желтым цветом, соответственно, и совмещены по наибольшему структурному подобию. Наложение структур 200h1 оказывается невозможным в силу принципиального отличия конформаций.
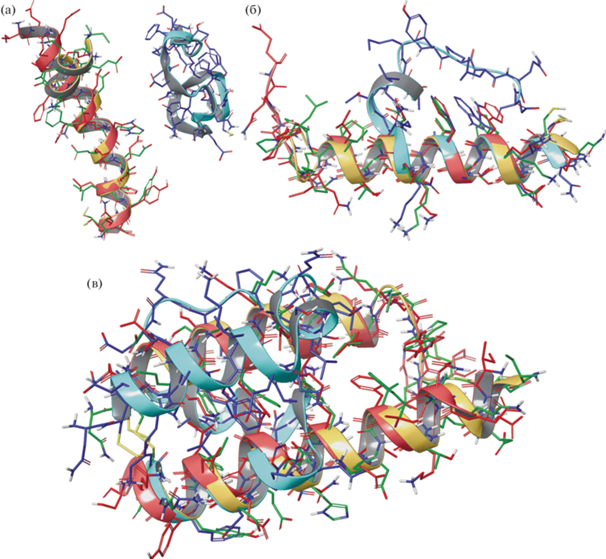
Степень спиральности и стабильности химерных пептидов в воде оказывается значительно выше, чем у мономерных, что поддерживает гипотезу о взаимной стабилизации спиралей в гетеродимерах. В водно-спиртовой смеси и в ТФЭ спиральная конформация остается достаточно стабильной в течение всего времени моделирования как для мономерных, так и химерных пептидов. Это указывает на возможность дополнительной стабилизиции cпиральной структуры за счет свойств этих растворителей, частично имитирующих особенности белкового окружения спиралей в структуре рецептора.
Предложенные димерные пептиды на основе спиралей h1 и h2 рецептора ACE2, соединенных дисульфидными мостиками, способны к связыванию с RBD S-белка SARS-CoV-2 с аффинностью в субмикромолярном диапазоне, превышающей аффинность индивидуальных мономеров. Образование спиральной структуры пептидов приводит к повышению эффективности связывания с RBD SARS-CoV-2: аффинность пептидов к RBD зависит от степени α-спиральности их вторичной структуры, и сохранность исходной спиральной структуры, присущей рецептору АСЕ2, необходима для успешного связывания с RBD S-белка SARS-CoV-2. Водно-спиртовая смесь (ВСС) поддерживает спиральность пептидов и может быть использована для проведения исследований in vitro. Дальнейшая стабилизация структуры пептидов и подбор оптимальной аминокислотной последовательности и растворителя позволят создать кандидатные молекулы для исследования взаимодействия SARS-CoV-2 и рецептора in vivo.
Список литературы
Yang J., Petitjean S.J.L., Koehler M., et al. Molecular interaction and inhibition of SARS-CoV-2 binding to the ACE2 receptor. // Nat. Commun. 2020. V. 11. P. 4541.
Guo Y., Huang L., Zhang G., et al. SARS-CoV-2 neutralizing antibody with extensive Spike binding coverage and modified for optimal therapeutic outcomes // Nat. Commun. 2021. V. 12. № 1. P. 2623.
Zhou X., Wang H., Ji Q., et al. Molecular deconvolution of the neutralizing antibodies induced by an inactivated SARS-CoV-2 virus vaccine // Protein Cell. 2021. V. 12. № 10. P. 818–823.
Chen D., Zhao Y., Li M., et al. A general Fc engineering platform for the next generation of antibody therapeutics // Theranostics. 2021. V. 11. № 4. P. 1901–1917.
Pomplun S. Targeting the SARS-CoV-2-spike protein: from antibodies to miniproteins and peptides // RSC Med. Chem. 2020 V. 12. № 2. P. 197–202.
Han Y., Král P. Computational Design of ACE2-Based Peptide Inhibitors of SARS-CoV-2 // ACS Nano. 2020. V. 14. № 4. P. 5143–5147.
Huang X., Pearce R., Zhang Y. De novo design of protein peptides to block association of the SARS-CoV-2 spike protein with human ACE2 // Aging (Albany NY). 2020. V. 12. № 12. P. 11263–11276.
Sadremomtaz A., Al-Dahmani Z.M., Ruiz-Moreno A.J., et al. Synthetic Peptides That Antagonize the Angiotensin-Converting Enzyme-2 (ACE-2) Interaction with SARS-CoV-2 Receptor Binding Spike Protein // J. Med. Chem. 2022. V. 65. № 4. P. 2836–2847.
Cao L., Goreshnik I., Coventry B., et al. De novo design of picomolar SARS-CoV-2 miniprotein inhibitors // Science. 2020. V. 370. № 6515. P. 426–431.
Curreli F., Victor S.M.B., Ahmed S., et al. Stapled Peptides Based on Human Angiotensin-Converting Enzyme 2 (ACE2) Potently Inhibit SARS-CoV-2 Infection In Vitro // mBio. 2020. V. 11. № 6. P. e02451–20.
Khatri B., Pramanick I., Malladi S.K., et al. A dimeric proteomimetic prevents SARS-CoV-2 infection by dimerizing the spike protein // Nat. Chem. Biol. 2022.
Linsky T.W., Vergara R., Codina N., et al. De novo design of potent and resilient hACE2 decoys to neutralize SARS-CoV-2 // Science. 2020. V. 370. № 6521. P. 1208–1214.
Muttenthaler M., King G.F., Adams D.J., Alewood P.F. Trends in peptide drug discovery. Nat Rev Drug Discov. 2021. V. 20. № 4. P. 309–325.
Maas M.N., Hintzen J.C.J., Löffler P.M.G., et al. Targeting SARS-CoV-2 spike protein by stapled hACE2 peptides // Chem. Commun. (Camb). 2021. V. 7. № 26. P. 3283–3286.
Morgan D.C., Morris C., Mahindra A., et al. Stapled ACE2 peptidomimetics designed to target the SARS-CoV-2 spike protein do not prevent virus internalization // Pept. Sci. (Hoboken). 2021. V. 8. P. e24217.
Бибилашвили Р.Ш., Сидорова М.В., Дудкина У.С. и др. Пептидные ингибиторы взаимодействия рецептор-связывающего домена вируса SARS-CoV-2 с клеточным рецептором ACE2 // Биомед. хим. 2021. Т. 67. № 3. С. 244–250.
Tsvetkov V., Varizhuk A., Kozlovskaya L., et al. EGCG as an anti-SARS-CoV-2 agent: Preventive versus therapeutic potential against original and mutant virus // Biochimie. 2021. № 191. P. 27–32.
Sreerama N.W. Estimation of Protein Secondary Structure from Circular Dichroism Spectra: Comparison of CONTIN, SELCON, and CDSSTR Methods with an Expanded Reference Set // Anal. Biochem. 2020. V. 287. № 2. P. 252–260.
Buck M. Trifluoroethanol and colleagues: cosolvents come of age. Recent studies with peptides and proteins // Q. Rev. Biophys. 1998. V. 31. № 3. P. 297–355.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


