Доклады Российской академии наук. Науки о жизни, 2023, T. 508, № 1, стр. 14-18
НОВАЯ ТЕХНОЛОГИЯ ВОССТАНОВЛЕНИЯ ЛОКОМОЦИИ У ПАЦИЕНТОВ ПОСЛЕ ИНСУЛЬТА
Т. Р. Мошонкина 1, *, Е. Н. Жарова 2, С. С. Ананьев 1, Н. Д. Шандыбина 1, Е. А. Вершинина 1, В. А. Ляховецкий 1, А. А. Гришин 1, академик РАН Е. В. Шляхто 2, член-корреспондент РАН Ю. П. Герасименко 1
1 Институт физиологии им. И.П. Павлова
Российской академии наук
Санкт-Петербург, Россия
2 Национальный медицинский исследовательский центр имени В.А. Алмазова МЗ РФ
Санкт-Петербург, Россия
* E-mail: moshonkina@infran.ru
Поступила в редакцию 22.09.2022
После доработки 03.10.2022
Принята к публикации 09.10.2022
- EDN: MNUEOU
- DOI: 10.31857/S2686738922600601
Аннотация
Нейронные сети спинного мозга могут генерировать шагательный паттерн и контролировать позу в отсутствие супраспинальных влияний. Создана технология с использованием чрескожной электрической стимуляции спинного мозга (ЧЭССМ). Во время ходьбы ЧЭССМ активировала спинальные локомоторные сети, а также моторные пулы сгибателей/разгибателей ног в фазах переноса/опоры соответственно. Предположили, что применение этой технологии у людей с нарушениями локомоции улучшит ходьбу. Исследованы пациенты с гемипарезом через 3–11 мес после инсульта, длительность курса – 2 нед. Пациенты основной и контрольной групп получали стандартную терапию и реабилитацию с использованием технологии, в контрольной группе применяли фиктивную ЧЭССМ. После курса в основной группе, в отличие от контрольной, достигнуты минимальные клинически значимые изменения показателей ходьбы. Разработанная технология является эффективным средством восстановления ходьбы у пациентов с гемипарезом.
ВВЕДЕНИЕ
Нейронные сети спинного мозга (СМ) млекопитающих участвуют в регуляции постуральных и локомоторных функций, они могут генерировать шагательный паттерн в отсутствие супраспинальных влияний и периферических афферентных входов. Показано, что у людей с полным моторным параличом вследствие травмы СМ электрическая эпидуральная стимуляция СМ на поясничном уровне в сочетании с активацией афферентов может восстановить произвольные движения нижних конечностей и способность стоять без внешней поддержки [1]. Также было показано, что парализованные люди восстанавливали способность самостоятельно ходить с помощью эпидуральной стимуляции СМ на уровне сегментов L1–S1, зависимой от фаз шага [2].
Мы разработали спинальный нейропротез – технологию фазозависимой чрескожной электрической стимуляции спинного мозга (ЧЭССМ) во время ходьбы, которая обеспечивает активацию локомоторных нейронных сетей СМ, а также моторных пулов сгибателей и разгибателей нижних конечностей в фазы переноса и опоры соответственно [3] (рис. 1, а).
Рис. 1.
(а) Принцип работы спинального нейропротеза, расположение катодов: 1 – ЧЭССМ по средней линии между позвонками T11–T12 во время ходьбы, 2 –стимуляция корешков СМ на стороне пареза на уровне T11 в фазе переноса ипсилатеральной ноги, 3 – стимуляция корешков СМ на стороне пареза на уровне L1 в фазе опоры ипсилатеральной ноги. (б) Расположение компонентов нейропротеза: 1 – катод между позвонками C5–C6, 2 – матрица электродов, показанных в части (а), 3 – стимулятор, 4 – датчик фаз шага. (в) Протокол реабилитационной процедуры.
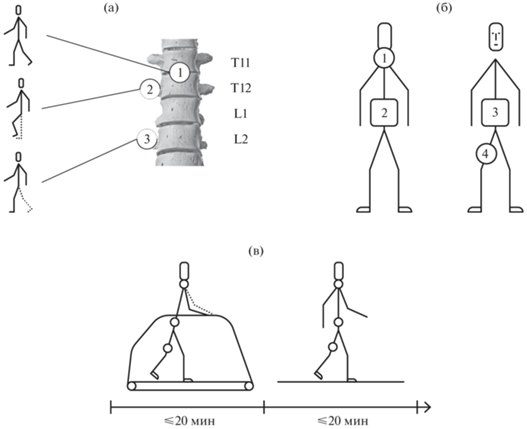
Результаты исследований на здоровых добровольцах показали, что эта технология может быть использована для регуляции локомоции [4]. Описан клинический случай восстановления самостоятельной ходьбы у пациента с полным моторным параличом вследствие травмы СМ после реабилитации с использованием этой технологии [5].
Систематические исследования демонстрируют, что частота инсульта и смертность после инсульта во всем мире имеют тенденцию к снижению в последние десятилетия, при этом абсолютное число людей, пострадавших от инсульта и оставшихся инвалидами, увеличивается во всех возрастных группах [6]. Нарушение походки является одним из факторов ухудшения качества жизни пациентов после инсульта; двигательные нарушения приводят к увеличению риска падения, дополнительной инвалидизации, страху потери равновесия и, в будущем, к социальной изоляции.
Цель работы – оценка эффективности спинального нейропротеза для регуляции ходьбы у пациентов с последствиями инсульта. Мы проверяли предположение о том, что применение спинального нейропротеза у людей с нарушениями локомоции после инсульта приведет к улучшению самостоятельной ходьбы.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено в Российском научно-исследовательском нейрохирургическом институте им. проф. А.Л. Поленова. В исследование включены пациенты, находившиеся в стационаре на реабилитации, перенесшие инсульт, верифицированный с помощью магнитно-резонансной или компьютерной томографии, в возрасте от 18 до 70 лет. Срок с момента инсульта 1–12 мес, клинические проявления инсульта в виде двигательных нарушений по типу гемипареза (2–4 балла), пациенты могли самостоятельно стоять и пройти по полу не менее 10 м (с опорой на трость или ходунки при необходимости). Реабилитационный курс состоял из 12 процедур, ежедневно. Тестирования проводили за 1–2 дня до начала реабилитационных процедур и на следующий день после окончания реабилитационного курса.
Первичная точка эффективности: улучшение показателей ходьбы в тесте 10-метровой ходьбы и в тесте 6-минутной ходьбы.
Вторичные точки эффективности: улучшение показателей в тестах по шкалам Фугл-Майера, силы мышц Британского совета медицинских исследований (Harrison scale), количественной оценки мышечной силы (Medical Research Council Weakness Scale), Берга (Berg Balance Scale), меры функциональной независимости, модифицированной шкале Ашворта, – а также по оценке пространственно-временных и кинематических параметров, полученным с применением биометрических сенсоров “Нейросенс” (ООО Нейрософт), по электрической активности мышц.
Спинальный нейропротез детектировал фазы шага и управлял ЧЭССМ так, что на стороне пареза в фазе переноса ноги активировали моторные пулы сгибателей этой ноги, а в фазе опоры – моторные пулы разгибателей (рис. 1а). Для того, чтобы увеличить возбудимость спинальных локомоторных сетей, проводили непрерывную ЧЭССМ в проекции поясничного и шейного утолщений СМ (рис. 1а, 1б). Для стимуляции на уровне позвонков С5–6 и Т11–12 использовали прямоугольные биполярные импульсы с частотой 30 Гц. При фазозависимой ЧЭССМ на уровне корешков Т11 и L1 – прямоугольные монополярные импульсы и частоты 30 Гц и 15 Гц соответственно. Все импульсы модулированы частотой 5 кГц. Стимулятор располагали на поясе на теле пациента, также в составе нейропротеза – датчик фаз шага, который фиксировали на бедре паретичной ноги (рис. 1б). Детально принцип работы спинального нейропротеза изложен в [7].
Интенсивность ЧЭССМ подбирали для каждого уровня стимуляции, ориентируясь на ответы пациента – ток должен был ощущаться, но не вызывать дискомфорт, не мешать ходьбе. Диапазон токов был 20–60 мА.
Реабилитационная процедура состояла из ходьбы со спинальным нейропротезом сначала по беговой дорожке, потом по полу (рис. 1в). Суммарная длительность ходьбы во время процедуры до 40 мин без учета перерывов на отдых.
Пациенты были распределены случайным образом на две группы, основную и контрольную (табл. 1). Все пациенты получали стандартную реабилитационную терапию по показаниям и реабилитацию с использованием нейропротеза. Пациенты контрольной группы на процедуре во время ходьбы получали фиктивную ЧЭССМ, при которой стимуляцию на каждом уровне начинали с ощутимой, заранее подобранной, интенсивности и уменьшали до 0 мА в течение 1 мин в соответствии с [8, 9].
Таблица 1.
Демографические и клинические параметры пациентов
| Группа | N | Пол (М/Ж) | Возраст (лет) | Тип инсульта (иш/гем*) | Период после инсульта (мес) | Число пациентов с ТСР** |
|---|---|---|---|---|---|---|
| Основная | 10 | 8/2 | 56.4 ± 9.0 | 9/1 | 7.1 ± 3.0 | 3 |
| Контрольная | 10 | 7/3 | 52.9 ± 10.8 | 8/2 | 6.9 ± 3.5 | 2 |
Статистические характеристики представлены средними значениями, стандартными отклонениями и ошибками средних. Парные сравнения проводили с использованием ранговых критериев Вилкоксона и Манна–Уитни. Статистические решения принимались при p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При проведении пробы 6-минутной ходьбы перед пациентом ставят задачу пройти как можно большую дистанцию за 6 мин в собственном темпе. В начале исследования пройденные дистанции значимо не отличались между группами, после курса пациенты основной группы проходили дистанцию больше, чем пациенты контрольной группы (табл. 2). В основной группе увеличение дистанции составило 56.6 ± 11.9 м и значимо отличается от нуля (p < 0.001), в контрольной – 17.9 ± 11.9 м, изменение незначимое (рис. 2а).
Таблица 2.
Результаты тестов 6-мин ходьбы и ходьбы на 10 м с комфортной скоростью
| Группа | 6 мин (м) | 10 м (м/сек) | ||
|---|---|---|---|---|
| До | После | До | После | |
| Основная | 236.8 ± 70.7 | 293.4 ± 90.1 | 0.890 ± 0.097 | 1.001 ± 0.099 |
| Контрольная | 248.4 ± 87.8 | 266.3 ± 71.3 | 0.887 ± 0.097 | 0.883 ± 0.099 |
Рис. 2.
Изменение после курса дистанции, пройденной в тесте 6-мин ходьбы (а), и скорости ходьбы в привычном темпе в тесте ходьбы на 10 м (б).
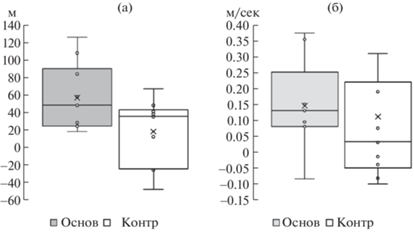
Минимальный клинически значимый показатель (minimal clinically important difference – MCID) в тесте 6-минутной ходьбы у пациентов, перенесших инсульт 2–6 мес назад, составляет 44 м [10]. У пациентов основной группы увеличение дистанции больше MCID на ~30%, что демонстрирует эффективность исследуемой технологии.
При проведении теста ходьбы на 10 м определяют скорости, с которыми пациент проходит дистанцию в режиме комфортной и максимально быстрой ходьбы. В начале курса значения скорости комфортной ходьбы у основной и контрольной групп практически совпадали, после курса значение скорости в основной группе заметно увеличилось, в контрольной – не изменилось (табл. 2, рис. 2б). Увеличение скорости комфортной ходьбы в основной группе составило 0.118 ± 0.043 м/с, в контрольной – 0.004 ± 0.043 м/с. Прирост скорости в основной группе значимо отличался от нуля (p = 0.013). Изменения скорости максимально быстрой ходьбы в основной группе показали аналогичную тенденцию, но были недостоверны (p = 0.119).
Увеличение комфортной скорости в тесте ходьбы на 10 м более, чем на 0.1 м/с, является клинически значимым (MCID составляет 0.10–0.17 м/с для пациентов с инсультом) [11]. Такое увеличение получено у пациентов основной группы.
По результатам остальных 6 из 7 неврологических тестов и физиологических исследований в основной группе получены статистически значимые улучшения показателей. В контрольной группе статистически значимые улучшения показателей получены в 4 тестах.
ЗАКЛЮЧЕНИЕ
Технология спинального нейропротеза основана на результатах фундаментальных исследований механизмов регуляции постуральных и локомоторных функций. Уникальность технологии заключается в ритмической активации сгибательных/разгибательных моторных пулов нижних конечностей в определенные фазы шагательного цикла в сочетании с непрерывной стимуляцией локомоторных нейронных сетей. Полученные данные свидетельствуют о том, что при использовании нейропротеза в реабилитации для достижения минимальных клинически значимых изменений показателей ходьбы достаточно двухнедельного курса. Это дает основание заключить, что новая технология является эффективным средством восстановления ходьбы у пациентов с гемипарезом в раннем и позднем восстановительном периоде после инсульта.
Список литературы
Angeli C., Edgerton V., Gerasimenko Y., et al. Altering spinal cord excitability enables voluntary movements after chronic complete paralysis in humans // Brain. 2014. V. 137. P. 1394–1409.
Wagner F., Mignardot J., Le Goff-Mignardot C., et al. Targeted neurotechnology restores walking in humans with spinal cord injury // Nature. 2018. V. 563. P. 65–71.
Moshonkina T., Grishin A., Bogacheva I., et al. Novel non-invasive strategy for spinal neuromodulation to control human locomotion // Front. Hum. Neurosci. 2021. V. 14. P. 622533.
Gorodnichev R., Pukhov A., Moiseev S., et al. Regulation of gait cycle phases during noninvasive electrical stimulation of the spinal cord // Hum. Physiol. 2021.V. 47. P. 60–69.
Siu R., Brown E., Mesbah S., et al. Novel noninvasive spinal neuromodulation strategy facilitates recovery of stepping after motor complete paraplegia // J. Clin. Med. 2022. V. 11. P. 3670.
Feigin V., Norrving B., Mensah G. Global burden of stroke // 2017. Circ. Res. V. 120. P. 439–448.
Grishin A., Bobrova E., Reshetnikova V., et al. A system for detecting stepping cycle phases and spinal cord stimulation as a tool for controlling human locomotion // Biomed. Eng. 2021. V. 54. P. 312–316.
Murray L., Tahayori B., Knikou M. Transspinal direct current stimulation produces persistent plasticity in human motor pathways // Sci. Rep. 2018. V. 8. P. 1–11.
Benavides F., Jo H., Lundell H., et al. Cortical and subcortical effects of transcutaneous spinal cord stimulation in humans with tetraplegia // J. Neurosci. 2020. V. 40. P. 2633–2643.
Fulk G., He Y. Minimal clinically important difference of the 6-minute walk test in people with stroke // J. Neurol. Phys. Ther. 2018. V. 42. P. 235–240.
Bohannon R., Glenney S. Minimal clinically important difference for change in comfortable gait speed of adults with pathology: a systematic review // J. Eval. Clin. Pract. 2014. V. 20. P. 295–300.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


