Доклады Российской академии наук. Науки о жизни, 2023, T. 508, № 1, стр. 19-22
УРОВЕНЬ КОРТИЗОЛА И АКТИВНОСТЬ Nа+/K+-АТФАЗЫ В ПРОЦЕССЕ РОСТА И РАЗВИТИЯ МОЛОДИ ЛЕПТОКЛИНА ПЯТНИСТОГО LEPTOCLINUS MACULATUS (FRIES, 1838) В АРКТИКЕ
Н. Л. Рендаков 1, *, Е. И. Кяйвяряйнен 1, С. Н. Пеккоева 1, С. А. Мурзина 1, К. М. Никерова 2
1 Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр
Российской академии наук”
Петрозаводск, Россия
2 Институт леса – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр
Российской академии наук”
Петрозаводск, Россия
* E-mail: nlrend@mail.ru
Поступила в редакцию 01.09.2022
После доработки 20.09.2022
Принята к публикации 22.09.2022
- EDN: MONCJB
- DOI: 10.31857/S2686738922600698
Аннотация
Исследована динамика уровня кортизола и активности Na+/K+-АТФазы (NKA), связанных с поддержанием ионного гомеостаза клеток, в скелетных мышцах молоди циркумполярной рыбы лептоклина пятнистого Leptoclinus maculatus (Fries, 1838), экологически значимого представителя ихтиофауны арктического архипелага Шпицберген. Установлено, что уровень кортизола и активность NKA снижаются в процессе развития молоди лептоклина от пелагической молоди стадии L2 к стадии L5, ведущей в основном придонный образ жизни. Полученные результаты позволяют предположить, что кортизол может участвовать в регуляции активности одного из основных осморегуляторных факторов – NKA. Это может иметь значение для роста и адаптации пелагической молоди лептоклина пятнистого к придонной среде обитания в процессе постэмбрионального развития в Арктике.
ВВЕДЕНИЕ
Лептоклин пятнистый (Leptoclinus maculatus Fries, 1838, семейство Стихеевые), встречается на глубинах от 2 до 488 м и является представителем костистых рыб, предпочитающим биотопы с повышенной соленостью [1]. Он широко распространен в морских экосистемах Арктики и Северной Атлантики [2, 3]. В постэмбриональном развитии L. maculatus выделяют несколько последовательно сменяющих друг друга стадий развития – от стадии L1 до L5 (ранняя ювенильная стадия). Зимний количественный учет в акватории Конгсфьорда (арх. Шпицберген) позволил выявить пелагическую (стадии L2 и L3) и придонную (стадия L5) экологические группы молоди L. maculatus [4]. В процессе длительного развития лептоклина происходит ряд морфологических и физиолого-биохимических изменений, и к стадии L5 (2–5 лет) L. maculatus начинает вести преимущественно придонный образ жизни [2, 4, 5].
В регуляции широкого спектра физиологических процессов (промежуточный метаболизм, рост, осморегуляция) и поведения принимает участие стероидный гормон кортизол [6]. В организме костистых рыб, в отличие от наземных позвоночных, кортизол выполняет не только глюкокортикоидные, но и минералокортикоидные функции [7].
Na+/K+-АТФаза (NKA) – мембранный фермент, осуществляющий активный транспорт ионов и экспрессирующийся во всех органах, в том числе в осморегуляторных [8] и в мышцах [9]. Имеется достаточно много работ о влиянии кортизола на активность NKA в жабрах взрослых костистых рыб [10]. При этом проблема регуляции ионного обмена в тканях рыб на ранних стадиях развития изучена недостаточно [11]. S. Varsamos и соавт. [12] показали, что активность NKA в тканях лаврака обыкновенного (Dicentrarchus labrax) наблюдается на ранних стадиях постэмбрионального развития.
В данной работе впервые исследовали динамику уровня кортизола и активности NKA в скелетных мышцах L. maculatus в онтогенезе (от пелагической стадии развития L2 до придонной стадии L5).
МАТЕРИАЛЫ И МЕТОДЫ
Молодь L. maculatus была собрана в ходе экспедиции на судне “Helmer Hanssen” (Норвегия, UiT) в акватории о. Западный Шпицберген в заливе Исфьорд. Как только биоматериал был извлечен из орудия лова, его подвергали глубокой заморозке (–80°С) и транспортировали для анализа в лабораторию. Стадии развития молоди определяли по классификации С. Meyer Ottesen и соавт. [2, 4]. Биохимические показатели определяли в дорсальной области больших продольных мышц.
Концентрацию кортизола определяли методом масс-спектрометрии по методике, описанной нами ранее [13]. Активность NКА определяли спектрофотометрически [13, 14]. Анализ уровня кортизола проведен на стадиях развития L2, L4, L5, активность NKA измеряли на стадиях L2–L5. Исследовали по 5–6 особей каждой стадии. Различия между стадиями развития по исследуемым биохимическим показателям оценивали с использованием непараметрического критерия Уилкоксона–Манна–Уитни.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Содержание кортизола в мышцах L. maculatus на стадии L2 составило 50.14 ± 10.20 нг/г и было вдвое выше (p < 0.05), чем у особей на стадиях L4 и L5 (рис. 1). Активность NKA в мышцах по мере развития от пелагических особей (L2–L4) к особям стадии L5 значительно снижается (рис. 2).
Рис. 1.
Концентрация кортизола у молоди L. maculatus.
Примечание: * – различия достоверны по сравнению со стадией L2 при р < 0.05.

Рис. 2.
Активность NKA в мышцах L. maculatus на стадиях развития L2–L5.
Примечание: * – различия достоверны по сравнению со стадией L2 при уровне значимости p < 0.05, ** – при уровне значимости p < 0.01.
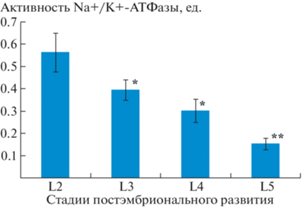
Высокие значения уровня кортизола в мышцах L. maculatus на стадии L2 (относительно последующих стадий развития) могут свидетельствовать о повышенной активности интерреналовой ткани в возрасте 1–2 лет. У японской камбалы (Paralichthys olivaceus) на личиночной стадии развития уровень кортизола достигает пика во время метаморфоза – примерно через месяц после вылупления [15].
Выявленные нами изменения уровня кортизола (рис. 1) могут быть связаны с различной скоростью роста L. maculatus и соответствующими метаболическими изменениями. От стадии L2 до стадии L4 у молоди лептоклина наблюдается усиленный рост [2, 4]. Известно, что личинки лептоклина со стадии L2 начинают питаться высококалорийным зоопланктоном рода Calanus [4, 5] и могут использовать продукты расщепления полученных с пищей липидов на процессы роста и развития. Показано, что запуск биосинтеза кортизола при переходе рыб на экзогенное питание может иметь большое значение для ассимиляции белков и углеводов пищи с целью обеспечения энергетических и ростовых процессов [16]. Известно, что повышенный уровень кортизола приводит к торможению роста рыб, что позволяет предположить наличие обратной зависимости между скоростью роста и уровнем кортизола [17].
Максимальная активность NKA на стадии L2 и последующее снижение ее уровня свидетельствуют о сходстве динамики этого показателя с таковой кортизола при развитии лептоклина до стадии L5. Возможно, что влияние кортизола на рост опосредуется его воздействием на активность NKA. Известно, что высокие дозы глюкокортикоидов стимулируют синтез NKA в скелетных мышцах [18]. Кроме того, кортизол участвует в осморегуляторных процессах при изменении солености среды и вызывает увеличение активности NKA в органах и тканях рыб [10, 12, 13]. Снижение активности NKA у рыб может приводить к сокращению энергетических расходов на процессы осморегуляции, что в свою очередь способствует ускорению роста [19 ] .
Таким образом, установлена динамика понижения уровня глюкокортикоидного гормона кортизола и активности NKA в процессе развития лептоклина от стадии L2 к стадии L5. По-видимому, снижение уровня кортизола и активности NKA может способствовать усилению роста молоди L. maculatus и, в дальнейшем, адаптации к придонному образу жизни в условиях Арктики.
Список литературы
Мурзина С.А. Роль липидов и их жирнокислотных компонентов в эколого-биохимических адаптациях рыб северных морей. Дис. … докт. биол. наук. Москва, 2019. Специальности 03.02.06 – “ихтиология” и 03.01.04. – “биохимия”. Дата защиты: 23.10.2019, дата утверждения: 27.02.2020. 376 с.
Meyer Ottesen C.A., Hop H., Christiansen J.S., et al. Early life history of the daubed shanny (Teleostei: Leptoclinus maculatus) in Svalbard waters // Mar. Biodivers. 2011. Vol. 41. № 3. P. 383–394.
Андрияшев А.П. Рыбы северных морей СССР. Москва, Ленинград: Издательство Академии наук СССР, 1954. 566 с.
Pekkoeva S.N., Murzina S.A., Ieshko E.P., et al. Ecological groups of the daubed shanny Leptoclinus maculatus (Fries, 1838), an Arcto-boreal species, regarding growth and early development // Russ. J. Ecol. 2018. V. 49. № 3. P. 253–259.
Murzina S.A., Pekkoeva S.N., Kondakova E.A., et al. Tiny but fatty: lipids and fatty acids in the daubed shanny (Leptoclinus maculatus), a small fish in Svalbard waters // Biomolecules. 2020. V. 10. № 3. P. 368.
Das C., Thraya M., Vijayan M.M. Nongenomic cortisol signaling in fish // Gen. Comp. Endocrinol. 2018. V. 265. P. 121–127.
Рендаков Н.Л. Некоторые аспекты стероидной регуляции у костистых рыб // Труды Карельского научного центра Российской академии наук. 2018. № 6. P. 3–21.
Zhu H., Liu Z., Gao F., et al. Characterization and expression of Na+/K+-ATPase in gills and kidneys of the Teleost fish Oreochromis mossambicus, Oreochromis urolepis hornorum and their hybrids in response to salinity challenge // Comp. Biochem. Physiol. Part A Mol. Integr. Physiol. 2018. V. 224. P. 1–10.
Doǧanli C., Kjaer-Sorensen K., Knoeckel C., et al. The α2Na+/K+-ATPase is critical for skeletal and heart muscle function in zebrafish // J. Cell Sci. 2012. V. 125. № Pt 24. P. 6166–6175.
Takei Y., McCormick S.D. Hormonal control of fish euryhalinity // Euryhaline Fishes. Elsevier: Academic Press, 2013. P. 69–123.
Schreiber A.M. Metamorphosis and early larval development of the flatfishes (Pleuronectiformes): an osmoregulatory perspective // Comp. Biochem. Physiol. Part B Biochem. Mol. Biol. 2001. V. 129. № 2–3. P. 587–595.
Varsamos S., Nebel C., Charmantier G. Ontogeny of osmoregulation in postembryonic fish: A review // Comp. Biochem. Physiol. Part A Mol. Integr. Physiol. 2005. V. 141. № 4. P. 401–429.
Nemova N.N., Kaivarainen E.I., Rendakov N.L., et al. Cortisol content and Na+/K+-ATPase activity under adaptation of juvenile pink salmon Oncorhynchus gorbuscha (Salmonidae) to salinity changes // J. Ichthyol. 2021. V. 61. № 5. P. 771–778.
Елаев Н.Р., Семенов Е.В. Изменение активности мембранных АТФаз мозга при воздействии холино- и адреномиметических веществ // Биохимия. 1974. V. 39. № 3. P. 636–640.
de Jesus E.G., Hirano T., Inui Y. Changes in cortisol and thyroid hormone concentrations during early development and metamorphosis in the Japanese flounder, Paralichthys olivaceus // Gen. Comp. Endocrinol. 1991. V. 82. № 3. P. 369–376.
Pavlidis M., Karantzali E., Fanouraki E., et al. Onset of the primary stress in European sea bass Dicentrarhus labrax, as indicated by whole body cortisol in relation to glucocorticoid receptor during early development // Aquaculture. 2011. V. 315. № 1–2. P. 125–130.
DiBattista J.D., Levesque H.M., Moon T.W., et al. Growth depression in socially subordinate rainbow trout Oncorhynchus mykiss : more than a fasting effect // Physiol. Biochem. Zool. 2006. V. 79. № 4. P. 675–687.
Pirkmajer S., Chibalin A.V. Na,K-ATPase regulation in skeletal muscle // Am. J. Physiol. Metab. 2016. V. 311. № 1. P. E1–E31.
Imsland A.K., Gunnarsson S., Foss A., et al. Gill Na+, K+-ATPase activity, plasma chloride and osmolality in juvenile turbot (Scophthalmus maximus) reared at different temperatures and salinities // Aquaculture. 2003. V. 218. № 1–4. P. 671–683.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


