Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 119-123
Исследование внутриклеточного распределения доксорубицина в клетках аденокарциномы молочной железы человека MCF-7 методом корреляционной сканирующей флуоресцентно-зондовой нанотомографии
О. И. Агапова 1, А. Е. Ефимов 1, К. Е. Мочалов 2, Д. О. Соловьева 2, А. М. Гилева 2, Е. А. Марквичева 2, Д. В. Яковлев 2, А. В. Люндуп 3, В. А. Олейников 2, 4, И. И. Агапов 1, *, академик РАН С. В. Готье 1, 5
1 Федеральное государственное бюджетное учреждение “Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова” Министерства здравоохранения Российской Федерации
Москва, Россия
2 Федеральное государственное бюджетное учреждение науки Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
Москва, Россия
3 Федеральное государственное автономное образова-тельное учреждение высшего образования “Российский университет дружбы народов” (РУДН)
Москва, Россия
4 Федеральное государственное автономное образовательное учреждение высшего образования “Национальный исследовательский ядерный университет “МИФИ”
Москва, Россия
5 Федеральное государственное автономное образовательное учреждение высшего образования “Первый Московский государственный медицинский университет имени И.М. Сеченова” Министерства здравоохранения Российской Федерации (Сеченовский университет)
Москва, Россия
* E-mail: igor_agapov@mail.ru
Поступила в редакцию 02.11.2022
После доработки 29.11.2022
Принята к публикации 01.12.2022
- EDN: NBSPZM
- DOI: 10.31857/S2686738923700178
Аннотация
Разработка технологий эффективной адресной доставки лекарств для задач онкотерапии требует развития новых методов для анализа особенностей микро- и наномасштабных распределений противоопухолевых препаратов в объеме клеток и тканей. В работе представлен новый подход к трехмерному анализу внутриклеточных распределений цитостатиков с использованием технологии флуоресцентной сканирующей оптическо-зондовой нанотомографии. Коррелятивный анализ наноструктуры и распределения введенного доксорубицина в исследуемых клетках аденокарциномы молочной железы человека MCF-7 позволил выявить особенности проникновения и накопления препарата в клетках. Разработанная технология с использованием принципов сканирующей оптическо-зондовой нанотомографии применима для исследования особенностей распределений различных флуоресцентных или флуоресцентно-маркированных препаратов в клетках и тканях.
Прорывные биомедицинские исследования требуют развития методик, позволяющих со сверхвысоким разрешением визуализировать и анализировать молекулярные и надмолекулярные структуры клеток для понимания молекулярных механизмов, ответственных за множество процессов, таких как механизмы возникновения патологий или адресной доставки лекарств. Многие из ныне разработанных аналитических методов, такие как электронная микроскопия (ЭМ) [1], сканирующая зондовая микроскопия (СЗМ) [2] и другие, позволяют исследовать ультраструктуру клеточных компонентов с разрешением от единиц до десятков нанометров. Каждый из подобных методов обладает значительным потенциалом, однако основным их недостатком является отсутствие возможности анализа распределения флуоресцентных маркеров в объеме образцов, которые предоставляют, например, методы флуоресцентной оптической микроспектроскопии (ФОМ), в том числе современные методы оптической микроскопии сверхвысокого разрешения [3]. Таким образом, становится очевидно, что наиболее перспективным направлением являются комбинирование и мультиплицирование разных модальностей ФОМ и различных методов визуализации ультраструктуры, с возможностью полноценного 3D-анализа образцов – корреляционная микроскопия [4].
Одними из важнейших практических приложений методик 3D микроспектроскопии являются биомедицинские исследования, направленные на изучение внутриклеточного трафика противоопухолевых препаратов. Актуальность таких исследований связана с тем, что ежегодно в мире тестируется около 10 000 прототипов противоопухолевых лекарств [5]. При этом только 7% от всех потенциальных противоопухолевых препаратов, вступивших в первую фазу клинических испытаний, впоследствии внедряется в клиническую практику [6]. Этот факт может свидетельствовать прежде всего о недостаточно высокой прогностической способности существующих методов тестирования. На первом этапе длительного пути лекарства в клинику для изучения цитотоксичности потенциальных терапевтических агентов и носителей для их доставки в большинстве лабораторий используют модели in vitro на основе различных опухолевых клеточных линий человека и животных. Понимание взаимодействия носителей лекарств с ультраструктурой клеток и влияния таких взаимодействий на поглощение носителей имеет первостепенное значение для разработки эффективных средств адресной доставки лекарств [7]. Важность этой информации обусловлена тем, что мишени для многих терапевтических препаратов против нескольких патологий локализованы в субклеточных компартментах. Кроме того, способ ввода лекарственного средства (прямой или посредством эндоцитоза) часто определяет эффективность, кинетику и конечный пункт назначения самого препарата. Несмотря на то что классические эндоцитарные пути, такие как фагоцитоз, макропиноцитоз, клатрин-опосредованные и кавеол-зависимые пути, достаточно хорошо изучены, непосредственное влияние ультраструктуры клеток на внутриклеточный транспорт фармацевтических препаратов по-прежнему остается неизвестным. Недостаток этой информации в первую очередь определяется отсутствием аналитических методик, которые могли бы картировать по спектральным, или другим характеристическим признакам трехмерное распределение лекарственных препаратов во внутриклеточном пространстве и оценивать функциональную колокализацию препарата с клеточными структурами.
Разработанная нами уникальная технология сканирующей оптическо-зондовой нанотомографии (СОЗНТ) позволяет объединить возможности СЗМ и ультрамикротома в рамках одного приборного комплекса в корреляции с методами ФОМ [8]. Применение данной технологии позволяет исследовать микро- и наноструктуру клеток и тканей методами СЗМ в сочетании с коррелятивным картированием распределений флуоресцентных агентов в объеме изучаемых образцов [9].
Однако исследования трехмерных распределений противоопухолевых препаратов в биологических клетках и тканях при помощи технологии СОЗНТ ранее не проводились.
Ниже представлены исследования внутриклеточного распределения цитостатического препарата в опухолевых клетках. В качестве исследуемого объекта использовались клетки аденокарциномы молочной железы человека MCF-7. Средний размер клеток составлял 18 ± 2 мкм. Клетки были загружены противоопухолевым препаратом – антрациклиновым антибиотиком доксорубицином (Doxorubicin hydrochloride, Sigma Aldrich).
Для подготовки образцов клетки MCF-7, культивированные в культуральной среде DMEM с добавлением 10% эмбриональной телячьей сыворотки (FBS), высаживали в 6-луночный планшет (300 тыс/лунка) и помещали в СО2-инкубатор. Через 24 ч в среду в лунках добавляли доксорубицин в концентрации 1 мг/мл и инкубировали в течение 1 ч. Открепление клеток от планшета проводили раствором трипсин-ЭДТА, затем переносили клетки в пробирку и центрифугировали 5 мин при 1000 об/мин. Надосадочную жидкость удаляли, а сухой остаток клеток ресуспендировали в 1 мл формалина (10%, PBS) или глутарового альдегида (2.5%, PBS) и инкубировали в течение 2 ч в темноте при +4°С. Затем проводили троекратную отмывку образцов центрифугированием (1000 об/мин) в натрий-фосфатном буфере по 10 мин.
Для исследований методами сканирующей зондовой и флуоресцентной нанотомографии образцы суспензии клеток были дегидратированы при помощи проводки по спиртам с увеличивающейся концентрацией и затем залиты в эпоксидную среду [9].
Сверхтонкие срезы образцов клеток были получены с использованием ультрамикротома Reichert-Jung Ultracut с алмазным ножом Diatome AFM 35 2.0 mm. Данный ультрамикротом входит в состав комбинированной уникальной научной установки СОЗНТ (http://ckp-rf.ru/usu/486825/), разработанной с участием авторов настоящей работы [8, 10].
Для демонстрации данной методики была выполнена серия измерений распределения доксорубицина в исследуемой клетке МСF-7 путем флуоресцентной микроскопии 20 последовательных срезов поверхности образца толщиной 120 нм. Флуоресцентные изображения были получены с использованием длиннофокусного объектива 50X Mitutoyo Plan Apo HR (Mitutoyo, Япония) с числовой апертурой 0.75 и набора флуоресцентных фильтров Texas Red (Olympus, Япония) с полосой возбуждения 542–582 нм и полосой эмиссии 604–644 нм. В качестве источника возбуждающего излучения использовалась ртутная лампа HB100 мощностью 100 Вт. После получения серии коррелятивных флуоресцентных изображений 3D структура фрагмента клетки была реконструирована при помощи программного пакета Image Pro Plus 6.0 3DConstructor (MediaCybernetics Inc.).
СЗМ-измерения на поверхности образца после среза проводились в полуконтактном режиме с использованием кремниевых зондов-кантилеверов Etalon HA_HR (Tipsnano, Эстония) с резонансной частотой 390 кГц и радиусом кривизны острия зонда менее 10 нм. При выполнении СЗМ-измерений поверхность образца сканировалась острием кремниевого зонда, вибрирующего на резонансной частоте балки кантилевера с амплитудой в несколько десятков нм. Отслеживание изменений амплитуды и фазы колебаний кантилевера, обусловленных взаимодействием зонда с поверхностью при сканировании, позволяет, с использованием соответствующих цепей обратной связи, получать информацию как о наномасштабной топографии поверхности, так и об ее локальных вязкоупругих свойствах [11]. Следует отметить, что, как показывают предыдущие исследования биологических образцов и различных наноматериалов, СЗМ-измерения на поверхности образцов после ультрамикротомии выявляют топографические особенности поверхности с диапазонами вариации высоты в единицы и десятки нм, ассоциируемые с ультраструктурой исследуемых объектов [12, 13]. Появление наномасштабных особенностей рельефа на поверхности неоднородного образца может быть связано с релаксацией внутренних напряжений поверхности после среза алмазным ножом ультрамикротома [14].
На рис. 1 показаны одно из полученных флуоресцентных изображений клетки МСF-7 и визуализация трехмерной реконструкции распределения доксорубицина в клетке на основе полученных данных. На трехмерной реконструкции выделяется связная структура распределения, что может служить критерием успешности использованного 3D-метода. Стоит отметить, что разрешение полученной реконструкции по координате Z (аксиальному направлению) соответствует толщине среза (120 нм), что значительно превосходит разрешение существующих методов конфокальной микроскопии.
Рис. 1.
Анализ образцов клеток аденокарциномы молочной железы человека MCF-7 с доксорубицином. а – СЗМ-изображение топографии поверхности среза клетки MCF-7, размер скана 13.8 × 9.5 мкм, диапазон вариации высоты 33.5 нм, стрелками указаны: 1 – клеточная мембрана, 2 – примеры различимых деталей ультраструктуры; б – флуоресцентное изображение среза той же области клетки MCF-7; в – трехмерная реконструкция распределения доксорубицина в объеме образца клетки MCF-7, 22.5 × 18.7 × 2.4 мкм, толщина среза 120 нм, размерный отрезок 5 мкм, представлена визуализация в двух ракурсах.
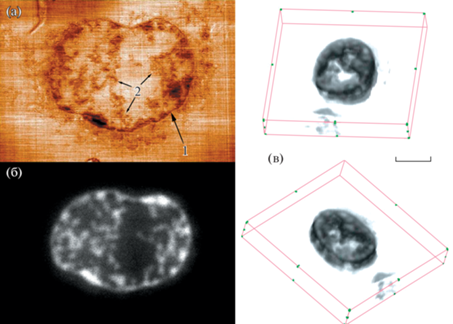
Корреляция полученных флуоресцентных и СЗМ-изображений клеток показывает, что в данном случае доксорубицин достаточно эффективно проходит сквозь клеточную мембрану в клетку и аккумулируется в ее объеме, хотя заметное количество препарата остается в клеточной мембране. Внутриклеточное распределение доксорубицина достаточно неравномерно и в значительной степени дискретно, на изображениях выделяются либо участки с высокой интенсивностью флуоресценции, либо области, где флуоресценция практически отсутствует. Полученные данные свидетельствуют о высокой степени пространственной корреляции деталей клеточной ультраструктуры, хорошо различимых на СЗМ-изображении (рис. 1), и зон накопления доксорубицина, что, по всей видимости, указывает на накопление доксорубицина в отдельных клеточных компартментах, функциональное значение которых будет являться предметом дополнительного исследования. При этом доксорубицин практически полностью отсутствует в большей части объема цитоплазмы. Данные детали внутриклеточного распределения препарата было бы затруднительно проанализировать обычными методами флуоресцентной микроскопии в силу их не достаточной разрешающей способности по оси Z.
Представленные результаты могут сыграть заметную роль в совершенствовании методов адресной доставки доксорубицина. Разработанная технология исследования трехмерных характеристик наномасштабных распределений доксорубицина в клетках с использованием принципов сканирующей оптическо-зондовой нанотомографии может быть использована для решения широкого спектра задач по исследованию особенностей взаимодействия флуоресцентных или флуоресцентно-маркированных препаратов и наноносителей с клетками и тканями различных типов.
Список литературы
Ross L.E., Dykstra M. Biological Electron Microscopy: Theory, Techniques, and Troubleshooting. 2nd Edition, Springer Science & Business Media. 2011. 534 p.
Deng X., Xiong F., Li X., et al. Application of atomic force microscopy in cancer research. // J Nanobiotechnol. 2018. V. 16. P. 102.
Hell S.W. Microscopy and its focal switch // Nature Methods. 2008. V. 6. № 1. P. 24–32.
Caplan J., Niethammer M., Taylor R.M.II, et al. The Power of Correlative Microscopy: Multi-modal, Multi-scale, Multi-dimensional // Curr Opin Struct Biol. 2011. V. 21 № 5. P. 686–693.
Narang A., Desai D. Anticancer Drug Development In: Pharmaceutical Perspectives of Cancer Therapeutics. Lu Y., Mahato R.I., Eds. Springer. 2009. P. 49–92.
Hay M., Thomas D.W., Craighead J.L., et al. Clinical development success rates for investigational drugs // Nat. Biotechnol. 2014. V. 32. P. 40–51.
Garnacho C. Intracellular Drug Delivery: Mechanisms for Cell Entry // Curr Pharm Des. 2016. V. 22. № 9. P. 1210–1226.
Efimov A.E., Agapov I.I., Agapova O.I., et al. A novel design of a scanning probe microscope integrated with an ultramicrotome for serial block-face nanotomog-raphy // Review of Scientific Instruments. 2017. V. 88. P. 023701.
Агапова О.И., Ефимов А.Е., Сафонова Л.А., и др. Сканирующая оптическо-зондовая нанотомография для исследования структуры биоматериалов и клеток // Доклады Российской академии наук. Науки о жизни. 2021. Т. 500. № 1. С. 483–487.
Mochalov K.E., Chistyakov A.A., Solovyeva D.O. et al. An instrumental approach to combining confocal microspectroscopy and 3D scanning probe nanotomography // Ultramicroscopy. 2017. V. 182. P. 118–123.
Hölscher H. AFM, Tapping Mode. In: Bhushan B. (eds.) Encyclopedia of Nanotechnology. Springer, Dordrecht. 2012. P. 99.
Zankel A., Wagner J., Poelt P. Serial sectioning methods for 3D investigations in materials science // Micron. 2014. V. 62. P. 66–78.
Efimov A.E., Agapova O.I., Safonova L.A. et al. 3D scanning probe nanotomography of tissue spheroid fibroblasts interacting with electrospun polyurethane scaffold. // Express Polymer Letters. 2019. V. 13(3). P. 632–641.
Matsko N., Mueller M. AFM of Biological Material Embedded in Epoxy Resin // J Struct Biol. 2004. V. 146. P. 334–343.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


