Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 191-195
Димеры хлорофилла а в составе водорастворимого белка BoWSCP фотосенсибилизируют восстановление цитохрома c
Ю. Н. Обухов 1, *, К. В. Неверов 1, Ю. В. Малеева 2, М. С. Крицкий 1
1 Институт биохимии имени А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
Москва, Россия
2 Биологический факультет Московского государственного университета
имени М.В. Ломоносова
Москва, Россия
* E-mail: y.u.r.a.o@mail.ru
Поступила в редакцию 24.10.2022
После доработки 20.11.2022
Принята к публикации 30.11.2022
- EDN: LZAHVX
- DOI: 10.31857/S2686738922600790
Аннотация
При связывании с водорастворимыми белками семейства WSCP молекулы хлорофилла формируют димеры, структурно сходные со “специальной парой” хлорофиллов (бактериохлорофиллов) в фотосинтетических реакционных центрах. Под воздействием красного света (λ ≥ 650 нм) в бескислородной среде димеры хлорофилла a в холобелке BoWSCP (из Brassica oleracea var. botrytis) сенсибилизировали восстановление цитохрома c. Согласно данным спектроскопии (абсорбционной и кругового дихроизма), фотохимический процесс не вызывал существенным образом деструкции молекул хлорофилла a и не влиял на структуру их димеров в составе белка BoWSCP. Добавление трис(гидроксиметил)аминометана в качестве донора электронов для ревосстановления хлорофилла стимулировало процесс фотовосстановления цитохрома с.
Хлорофилл-связывающие белки семейства WSCP (Water-Soluble Chlorophyll Binding Proteins) обнаружены в высших растениях у представителей порядков Caryophyllales (гвоздичноцветные), Polygonales (гречихоцветные) и Brassicales (капустоцветные) [1, 2]. Эти белки водорастворимы, они локализованы вне хлоропластов и не принимают участия в фотосинтетическом процессе, а их физиологические функции, предположительно, связаны с активностью антистрессовых систем клетки [1–5]. Белки семейства WSCP формируют гомотетрамеры с молекулярной массой 69–80 кДа, а каждый из гомотетрамеров нековалентно связывает до четырех молекул хлорофилла (Хл) [6–8].
Для тетрамерных ансамблей белков класса II семейства WSCP показано, что четыре молекулы Хл организованы в них в виде двух димеров с углом между плоскостями порфириновых колец пигментов в димере около 30 градусов [6, 7]. Эти димеры Хл в WSCP структурно сходны, хотя и не идентичны, димерам Хл (или бактериохлорофилла), образующим “специальную пару” в реакционных центрах фотосинтетических систем [9]. Именно “специальная пара” (бактерио)хлорофиллов при поглощении квантов света (либо в результате миграции энергии от пигментов антенны) участвует в ключевом этапе преобразования энергии – первичном разделении зарядов, выступая в роли донора электрона, транспорт которого по цепи переносчиков приводит к образованию богатых энергией молекул [9].
Задача настоящего исследования состояла в выяснении способности димера Хл в составе холобелка WSCP при возбуждении светом сенсибилизировать восстановление акцептора электрона, в качестве которого использовали цитохром c. Выявление такой фотохимической активности у Хл в холобелке WSCP важно для углубления физико-химической характеристики белков этой группы и для прояснения их физиологических функций.
В качестве объекта исследования был выбран белок BoWSCP из цветной капусты (Brassica oleracea var. botrytis), относящийся к подклассу WSCP IIA, представители которого связывают практически только Хл a [1, 5, 10]. Белки родственного подкласса WSCP IIB способны связывать также и Хл b, что делает их более сложными объектами из-за гетерогенного пигментного состава [1, 10, 11]. Белки WSCP филогенетически отдаленного класса I не рассматривались нами в качестве объектов исследования ввиду отсутствия достоверных сведений о димерной упаковке молекул Хл a в их составе. Кроме того, наличие у WSCP класса I фотоконверсии (фотоиндуцированного превращения Хл а в бактериохлорин-подобные продукты) делает невозможным контроль их пигментного состава [1, 12].
Препараты апобелка BoWSCP получали методом гетерологической экспрессии его структурного гена в штамме Escherichia coli BL 21 DE3. Хранение и выращивание клеток E. coli с плазмидами, несущими гены целевого белка, а также экспрессию этих генов и выделение препаратов апобелка проводили согласно методикам, представленным в [5, 11] с незначительными модификациями. Самосборку тетрамерных Хл-белковых комплексов (холоформ) проводили в растворе при комнатной температуре, инкубируя апобелки WSCP с препаратами свежевыделенных тилакоидов из листьев шпината. Полученные тетрамерные комплексы, благодаря наличию на C-концах апобелков шести гистидиновых остатков, очищали аффинной хроматографией на Ni-агарозе [5, 11, 13].
Раствор холобелка BoWSCP (концентрация по OD673 нм = 0.2), содержащий 10 или 30 мкМ цитохрома с из сердца лошади (Sigma-Aldrich, США) в 10 мМ Трис-HCl буфере (Serva, Germany), pH 8.0, облучали красным светом (светофильтр КС-15, λ ≥ 650 нм) при непрерывной продувке аргоном. В качестве источника света использовали галогеновую лампу (W = 150 Вт), имеющую сплошной спектр излучения в видимой и ИК-области. Дальнюю инфракрасную часть спектра отсекали водным фильтром (3 см); свет фокусировали на кювету с реакционной смесью линзой (F = 97 мм). Квантовую интенсивность излучения измеряли радиометром LI-250A (LiCOR, USA) с диапазоном чувствительности 400–710 нм. С помощью нейтральных светофильтров получали плотность потока квантов на уровне объекта от 250 до 1800 μE м–2 с–1. В пробу добавляли 150 мМ NaCl для предотвращения коагуляции WSCP и цитохрома.
Повышение пика поглощения при 550 нм в процессе облучения указывало на восстановление цитохрома с (рис. 1). Без облучения восстановление происходило в несколько раз медленнее: за 15 мин инкубации OD550 монотонно возрастала до величины, не превышающей 0.003 ед. При отсутствии в пробе BoWSCP фотовосстановления цитохрома с не наблюдали. Можно заключить, что возбуждение светом Хл a в составе BoWSCP сенсибилизировало восстановление цитохрома с. Таким образом, молекулы Хл a, организованные в димерные структуры в составе белка из семейства WSCP, подобно Хл “специальной пары” фотосинтетических реакционных центров, сенсибилизировали фотовосстановление акцепторов электрона.
Рис. 1.
Фотосенсибилизированное холоформой белка BoWSCP восстановление цитохрома c. (а) Спектр поглощения смеси BoWSCP (OD673 = 0.2), 10 мкМ цитохрома c и 150 мМ NaCl в 10 мМ Трис-HCl буфере, pH 8.0, до облучения (красная линия) и спустя 2, 4, 6, 10 и 15 мин (фиолетовая линия) инкубации на свету (λ ≥ 650 нм, 700 μE м–2 с–1) в атмосфере аргона. На врезке: Пик поглощения восстановленной формы цитохрома c (увеличено). (б) – Разностной спектр “темнота минус свет” (с обратным знаком) из того же опыта. Цветовое обозначение кривых такое же, как на панели А. Значения оптической плотности в пробах, не подвергавшихся облучению, отражены в тексте.
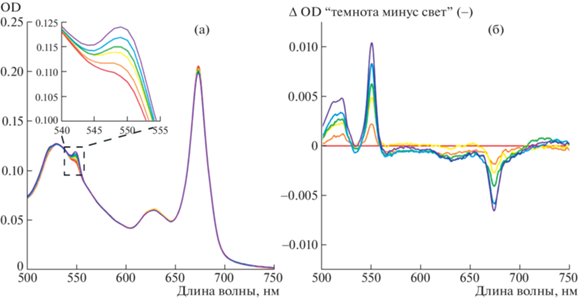
Скорость фотовосстановления цитохрома c снижалась при интенсивности света, превышающей 1000 μE м–2 с–1 (рис. 2а). Возможно, это свидетельствует о наличии диффузионного ограничения, понижающего эффективность прямого взаимодействия макромолекул цитохрома c и WSCP в условиях низкого времени жизни возбужденного состояния Хл, инициирующего фотохимическую реакцию.
Рис. 2.
Фотовосстановление цитохрома с и фотодеструкция Хл при облучении экспериментальной смеси светом разной интенсивности. Состав смеси и условия эксперимента, как на рис. 1а. (а) – Изменение оптической плотности в пике поглощения цитохрома c при 550 нм при облучении светом 250 μE м–2 с–1 (1), 420 μE м–2 с–1 (2), 700 μE м–2 с–1 (3), 1080 μE м–2 с–1 (4), 1800 μE м–2 с–1 (5) и без облучения светом (6). (б) – Изменение поглощения Хл в максимуме 673 нм в пробах при облучении. Интенсивности света – как на панели а.
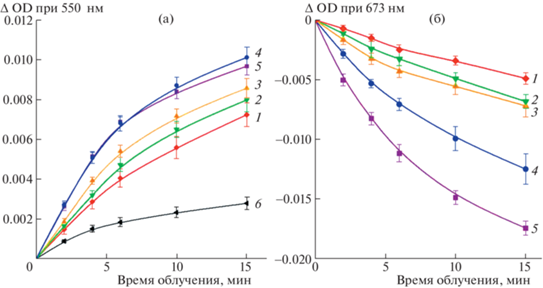
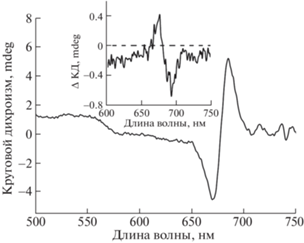
Облучение растворов BoWSCP приводило к незначительной деструкции Хл a и нарушению димерной организации его молекул. О состоянии этих параметров судили по снижению поглощения в пике при 673 нм, а также уменьшению амплитуды характерного для димерной формы Хл специфического сигнала в спектре кругового дихроизма в области 650–700 нм (рис. 2б и 3).
Облучение в атмосфере аргона данных проб светом с интенсивностью 700 μE м–2 с–1 в течение 15 мин вызывало деструкцию Хл и нарушение его димерной структуры не более, чем на 10%, что свидетельствует о сравнительно высокой фотоустойчивости тетрамерного холобелка BoWSCP (рис. 2, 3).
Рис. 3.
Спектр кругового дихроизма смеси холоформы Хл-BoWSCP (OD673 = 0.2), 10 мкМ цитохрома c и 150 мМ NaCl в 10 мМ Трис-HCl буфере, pH 8.0, до облучения. На врезке: разностной спектр кругового дихроизма “свет минус темнота” данного образца до и после облучения 15 мин (λ ≥ 650 нм, 700 μE м–2 с–1).
Возникает вопрос, за счет какого источника происходило ревосстановление Хл, подвергшегося окислению при фотохимической редокс-реакции с цитохромом c? Согласно нашим результатам, таким донором служил трис(гидроксиметил)аминометан, присутствовавший в пробах в качестве основания Трис-HCl буферного раствора. Ранее сообщалось об использовании данного соединения в качестве донора электрона в фотохимических экспериментах [14–16].
В пользу участия трис(гидроксиметил)аминометана в качестве донора электрона свидетельствуют результаты опытов, в которых буферную систему (10 мМ Трис-HCl, pH 8.0) заменяли в пробах на 10 мМ Na-фосфатный буфер, pH 8.0. В первые минуты облучения красным светом (λ ≥ ≥ 650 нм, 1800 μE м–2 с–1) проб, содержавших холоформы BoWSCP (OD673 = 0.2), 30 мкМ цитохром с и 150 мМ NaCl в 10 мМ Na-фосфатном буфере, pH 8.0, оптическая плотность при 550 нм сначала незначительно повышалась. Далее происходило ее монотонное снижение, свидетельствовавшее об окислении цитохрома с. Причиной могло служить присутствие в коммерческих препаратах цитохрома c около 2.5% (по массе) примеси восстановленной формы, которая окислялась следовыми количествами кислорода, сохранившимися в пробах после продувки аргоном. При добавлении в пробы Трис-HCl буфера, pH 8.0, до концентрации 10 мМ перед началом световой инкубации или в ходе облучения, наблюдали прирост пика поглощения при 550 нм, что указывало на фотовосстановление цитохрома с (рис. 4).
Рис. 4.
(а) – Участие трис(гидроксиметил)аминометана (основания Трис-HCl буфера) в фотовосстановлении цитохрома с при облучении светом (λ ≥ 650 нм, 1800 μE м–2 с–1) в атмосфере аргона. Состав проб: холобелок BoWSCP (OD673 = 0.2), 30 мкМ цитохром c и 150 мМ NaCl в Na-фосфатном буфере 10 мМ, pH 8.0. Черная линия – без добавления Трис-HCl, красная линия – при добавлении перед началом инкубации Трис-HCl до 10 мМ, pH 8.0. (б) – Облучение пробы в фосфатном буфере (условия как на панели а). После 15-й минуты облучения к пробе добавлен Трис-HCl до 10 мМ, pH 8.0 (момент добавления обозначен пунктирной линией).
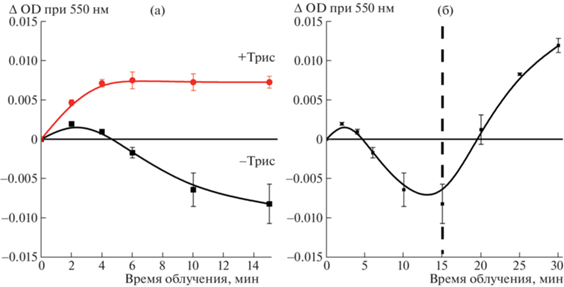
Из рис. 4а видно, что кривая фотовосстановления цитохрома в присутствии Трис-HCl-буфера после 4 мин облучения выходит на плато. Возможно, это является следствием более эффективного окисления цитохрома c в фосфатном буфере, где была использована более высокая концентрация цитохрома c – 30 мкМ вместо 10 мкМ (рис. 2).
Можно заключить, что трис(гидроксиметил)аминометан выполнял при фотосенсибилизированном Хл a восстановлении цитохрома c роль донора электрона, восстанавливающего молекулы Хл, подвергшиеся окислению во время редокс-реакции.
Выявление фотохимической редокс активности у димеров Хл в составе холобелка BoWSCP ориентирует на конструирование на этой основе водорастворимых моделей реакционных центров фотосинтетических систем с целью исследования эволюции фотосинтетического аппарата, а также конструирование искусственных конверторов солнечной энергии. Очевидно, что реализация таких моделей и обоснование их плодотворности потребуют серьезного экспериментального исследования молекулярных механизмов пигмент-пигментных и пигмент-белковых взаимодействий в WSCP с использованием спектральных методик с высоким временным разрешением.
Список литературы
Satoh H., Uchida A., Nakayama K., Okada M. // Plant and Cell Physiology. 2001. V. 42. № 9. P. 906–911.
Малеева Ю.В., Неверов К.В., Обухов Ю.Н., Криц-кий М.С. // Молекулярная биология. 2019. Т. 53. № 6. С. 998–1011.
Schmidt K., Fufezan C., Krieger-Liszkay A., Satoh H., et al. // Biochemistry. 2003. V. 42. № 24. P. 7427–7433.
Damaraju S., Schlede S., Eckhardt U., Lokstein H., et al. // Journal of Plant Physiology. 2011. V. 168. № 12. P. 1444–1451.
Takahashi S., Yanai H., Nakamaru Y., Uchida A., et al. // Plant and Cell Physiology. 2012. V. 53. № 5. P. 879–891.
Horigome D., Satoh H., Itoh N., Mitsunaga K., et al. // Journal of Biological Chemistry. 2007. V. 282. № 9. P. 6525–6531.
Bednarczyk D., Dym O., Prabahar V., Peleg Y., et al. // Angewandte Chemie International Edition. 2016. V. 55. № 24. P. 6901–6905.
Takahashi S., Uchida A., Nakayama K., Satoh H. // The Protein Journal. 2014. V. 33. № 4. P. 337–343.
Blankenship R.E. Molecular Mechanisms of Photosynthesis. 2nd ed. In: Ch.7. Reaction centers and electron transfer pathways in oxygenic photosynthetic organisms, pp. 89–109. John Wiley & Sons, Ltd. Oxford, UK, etc. 2014. ISBN 978-1-4051-8976-7
Palm D.M., Agostini A., Averesch V., Girr P., et al. // Nature Plants. 2018. V. 4. № 11. P. 920–929.
Takahashi S., Yanai H., Oka‑Takayama Y., Zanma‑Sohtome A., et al. // Planta. 2013. V. 238. № 6. P. 1065–1080.
Hirabayashi H., Amakawa M., Kamimura Y., Shino Y., et al. // Journal of Photochemistry and Photobiology A: Chemistry. 2006. V. 183. № 1-2. P. 121–125.
Charlton A., Zachariou M. // Affinity Chromatography. Humana Press. 2008. P. 137–150. ISBN: 978-1-58829-659-7
Diesen V., Jonsson M. // Journal of Advanced Oxidation Technologies. 2012. V. 15. № 2. P. 392–398.
Nikandrov V.V., Shlyk M.A., Zorin N.A., Gogotov I.N., et al // FEBS Letters. 1988. V. 234. № 1. P. 111–114.
Никандров В.В., Надточенко В.А., Семенов А.Ю. и соавторы. Фотобиокатализатор для получения восстановленных форм никотинамидных коферментов NADH или NADPH и фотокаталитический способ получения NADH или NADPH. // Патент RU(11) 2416644. Cрок действия c 17.11.2009.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


