Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 186-190
Влияние метилжасмоната на экспрессию генов, кодирующих ферменты синтеза непротеиновых тиолов, у пшеницы в присутствии кадмия
Н. С. Репкина 1, *, член-корреспондент РАН А. Ф. Титов 1, И. А. Нилова 1, Н. М. Казнина 1
1 Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр Российской академии наук”
Петрозаводск, Россия
* E-mail: nrt9@yandex.ru
Поступила в редакцию 14.11.2022
После доработки 23.11.2022
Принята к публикации 25.11.2022
- EDN: NAZGUM
- DOI: 10.31857/S268673892270010X
Аннотация
На растениях пшеницы (сорт Московская 39) изучено влияние фитогормона метилжасмоната (МЖ) на экспрессию генов TaGS1 и TaPCS1, кодирующих соответственно глутатионсинтетазу и фитохелатинсинтазу, которые являются ключевыми ферментами синтеза глутатиона и фитохелатинов. Впервые показано, что в отсутствие кадмия, обработка растений экзогенным МЖ (1 мкМ) приводит к увеличению накопления транскриптов генов TaGS1 и TaPCS1 в листьях. При добавлении в питательный раствор кадмия (CdSO4, 100 мкМ) уровень транскриптов гена TaGS1 повышался у растений, предобработанных МЖ (по сравнению с необработанными), тогда как уровень транскриптов гена TaPCS1 не различался. Установлено, что предобработка растений МЖ способствует меньшему накоплению кадмия в корнях и листьях пшеницы. При этом МЖ не оказывал влияния на линейные размеры растений, но положительно сказывался на накоплении биомассы в варианте с кадмием. Высказано предположение, что МЖ участвует в повышении устойчивости растений к кадмию за счет увеличения экспрессии генов TaGS1 и TaPCS1, и, как следствие, усиления синтеза хелатирующих соединений, а также за счет снижения поступления ионов металла в растения.
Жасмоновая кислота и ее производные, в частности, метилжасмонат, представляют собой семейство циклопентаноновых соединений, которые образуются из α-линоленовой кислоты через октадеканоидный путь [1]. Как и другие фитогормоны, МЖ играет важную роль в процессах роста и развития растений и сигналинге [2]. К настоящему времени достаточно хорошо изучена роль жасмонатов в повышении устойчивости растений к биотическим факторам [3]. За последние годы накопились данные и об их протекторном действии в отношении таких абиотических факторов, как засуха, засоление, ультрафиолетовое излучение, низкие и высокие температуры [4]. Появились также работы, указывающие на положительное влияние жасмонатов на устойчивость растений к тяжелым металлам [5]. Например, обнаружено, что в условиях действия на растения тяжелых металлов жасмонаты усиливают экспрессию генов ферментов аскорбат-глутатионового цикла, белков теплового шока и PR-белков, а также способствуют повышению активности ряда антиоксидантных ферментов и увеличению содержания пролина [3], что в конечном счете приводит к повышению металлоустойчивости растений. Показано также участие жасмоната в регуляции активности ряда транскрипционных факторов (HLH, MYCs, MYB, WRKY и др.), которые в свою очередь активируют каскад реакций, в том числе направленных на увеличение устойчивости растений к разным стресс-факторам, включая тяжелые металлы [1].
Как известно, одним из наиболее важных механизмов адаптации растений к воздействию тяжелых металлов, в частности к кадмию, является связывание его ионов различными хелаторами в цитоплазме клетки, среди которых ключевую роль играют глутатион и фитохелатины [6]. В синтезе этих соединений участвует ряд ферментов, в том числе глутатионсинтетаза и фитохелатинсинтаза соответственно. Поскольку МЖ, как указано выше, способствует повышению устойчивости растений к кадмию, логично ожидать, что обработка им растений может оказывать положительное влияние на экспрессию генов синтеза этих ферментов (GS1 и PCS1). Однако в известной нам литературе таких данных нет. Учитывая это, целью нашей работы явилось изучение влияния экзогенного МЖ на экспрессию генов GS1 и PCS1 в листьях растений пшеницы, подвернутых действию ионов кадмия.
Впервые было показано, что предобработка растений пшеницы экзогенным МЖ приводит к повышению уровня транскриптов генов GS1 и PCS1, контролирующих синтез непротеиновых тиолов, в листьях еще до начала воздействия кадмия. При действии кадмия она усиливала экспрессию гена GS1, тогда как уровень транскриптов гена PCS1 в этих условиях не менялся. Полученные результаты, наряду с данными о меньшем содержании кадмия у обработанных МЖ проростков, свидетельствуют об участии этого гормона в формировании устойчивости растений к кадмию за счет более эффективного его хелатирования и меньшего содержания в корнях и побегах.
Исследования проводили на проростках озимой пшеницы (Triticum aestivum L.) сорта Московская 39, которые выращивали в течение 7 сут на питательном растворе Хогланда-Арнона (pH 6.2–6.4) при температуре воздуха 22°C, относительной влажности 60–70%, освещенности 180 мкмоль/(м2 с) ФАР и фотопериоде 14 ч. В дальнейшем контрольные растения продолжали расти в этих же условиях. Опытные растения делили на две части, одну из которых переносили на раствор МЖ (1 мкМ “Sigma-Aldrich”, США), а другая оставалась в прежних условиях. Спустя сутки все опытные растения были перенесены на питательный раствор, содержащий 100 мкМ кадмия (CdSO4, “Нева Реактив”, Россия) на 7 сут, сохраняя прочие условия неизменными. Варианты опыта: К (контроль) – растения, находящиеся в условиях оптимального минерального питания; Cd – растения, подвергнутые действию кадмия без предобработки экзогенным МЖ; МЖ + Cd – растения, предобработанные экзогенным МЖ и затем подвергнутые действию кадмия. Концентрации МЖ и кадмия были выбраны на основании предварительных экспериментов.
При измерении ростовых показателей и определении сухой биомассы растений использовали общепринятые методы. Содержание кадмия анализировали с помощью атомно-абсорбционного спектрофотометра (АА-7000, Shimadzy, Япония).
Количество транскриптов генов GS1 и PCS1 определяли в листьях растений. Тотальную РНК выделяли из 50 мг растительного материала с помощью набора ExtractRNA (“Евроген”, Россия). Для удаления остатков ДНК препарат РНК обрабатывали ДНКазой, кДНК синтезировали, используя набор для обратной транскрипции с М-MLV обратной транскриптазой и случайными (random) гексапраймерами (“Евроген”). Количество и качество нуклеиновых кислот проверяли спектрофотометрически на приборе SmartSpecPlus (“Bio-Rad”, США). Уровень экспрессии генов оценивали с помощью ПЦР в режиме реального времени на приборе CFX (“Bio-Rad”), используя наборы для амплификации с интеркалирующим красителем SYBR Green (“Евроген”). В качестве референсного гена использовали actin. Для проведения ПЦР использовали следующие праймеры. GS1 (AF093752), п – 5'-aactattaggaaaaccttgtcag-3', о – 5'-gaatcttcttggtcccgactaaa-3'; PCS1 (AB181991), п – 5'-cctcgcctccctctccgtcgtgc-3', о – 5'-agtcgtggatggtggtctggtcc-3'; Actin (AJ579382), п – 5'-gggacctcacggataatctaatg-3', о – 5'-aacctccactgagaacaacattac-3'. Специфичность продуктов амплификации проверяли плавлением ПЦР фрагментов. Эффективность ПЦР, оцениваемая по стандартной кривой, достигала 98%. Уровень транскриптов генов вычисляли по ∆∆СТ. В каждом опыте использовали от 3 до 6 повторностей, опыт повторяли трижды. Статистическую обработку данных проводили с использованием программы Statistica (StatSoft Inc., США). Различия оценивали на основании F-критерия Фишера. В статье обсуждаются только величины, статистически значимые при р < 0.05.
Проведенное исследование показало, что под влиянием кадмия, независимо от обработки МЖ, рост растений тормозится (по сравнению с контролем), что наиболее отчетливо проявляется спустя 7 сут экспозиции (табл. 1). При этом высота побега у обработанных экзогенным МЖ проростков и у необработанных уменьшалась примерно в равной степени, тогда как снижение биомассы побега в большей степени наблюдалось у необработанных растений.
Таблица 1.
Влияние кадмия (100 мкМ) на рост побегов у обработанных экзогенным МЖ (1 мкМ) и необработанных растений пшеницы сорта Московская 39
| Показатель | Вариант | Экспозиция, сут | |||
|---|---|---|---|---|---|
| 0 | 1 | 3 | 7 | ||
| Высота побега, см | К | 18.6 ± 0.1 d | 21.1 ± 0.2 c | 23.7 ± 0.3 b | 34.7 ± 0.4 a |
| Cd | 18.6 ± 0.1 d | 20.7 ± 0.2 c | 21.62 ± 0.3 b | 25.8 ± 0.5 b | |
| МЖ+ Cd | 18,3± 0.1 d | 20.0 ± 0.2 c | 20.5 ± 0.2 c | 22.8 ± 0.3 b | |
| Сырая биомасса побега, мг | К | 153.1 ± 3.4 h | 191.9 ± 5.8 fg | 237.0 ± 14.0 b | 334.1 ± 12.0a |
| Cd | 153.1 ± 3.4 h | 174.1 ± 3.1 а | 195,1 ± 4.8 f | 216.0 ± 3.1 d | |
| МЖ+ Cd | 161.3 ± 3.7 h | 180.2 ± 4.3 g | 202.2 ± 4.8 f | 224.8 ± 2.8c | |
Аналогичный эффект МЖ наблюдали и другие авторы при действии кадмия на растения риса, мяты и горчицы [7]. Так, предобработка экзогенным МЖ не влияла на линейные размеры растений риса, подвергнутых действию кадмия, но их биомасса оказалась выше у обработанных растений по сравнению с необработанными [8]. Одной из возможных причин такого эффекта может быть положительное влияние МЖ на фотосинтетический аппарат растений, выражающееся, в частности, в увеличении содержания фотосинтетических пигментов [9] и повышении активности ряда ферментов, участвующих в темновых реакциях фотосинтеза [10]. Кроме того, имеются единичные сведения о том, что предобработка растений МЖ препятствовала поступлению кадмия в подземные и надземные органы [7], хотя механизмы воздействия гормона на поступление металла в растения авторами не обсуждались. В наших опытах у проростков, обработанных МЖ, содержание кадмия и в корнях, и листьях также оказалось гораздо меньше, чем у необработанных растений (табл. 2).
Таблица 2.
Содержание кадмия (мкг/г сухого веса) в корнях и листьях, обработанных экзогенным МЖ (1 мкМ), и необработанных растений пшеницы сорта Московская 39 при его высокой концентрации (100 мкМ) в корнеобитаемой среде
| Орган растения | Вариант | Экспозиция, сут | ||
|---|---|---|---|---|
| 1 | 3 | 7 | ||
| Корень | Cd | 199.00 ± 3.89 e | 643.50 ± 18.59 c | 1075.25 ± 30.49a |
| МЖ+ Cd | 137.00 ± 3.29f | 406.25 ± 4.57 d | 836.75 ± 18.06 b | |
| Лист | Cd | 2.65 ± 0.27ij | 4.76 ± 0.32h | 6.09 ± 0.51g |
| МЖ+ Cd | 1.37 ± 0.25k | 2.11 ± 0.18j | 3.57 ± 0.40i | |
Известно, что одним из механизмов, препятствующих поступлению кадмия в растения, является повышение лигнификации клеточных стенок. Поскольку обработка растений МЖ приводит к увеличению в клеточных стенках содержания ферруловой кислоты [11], которая является одним из продуктов, образующихся в ходе синтеза лигнина, возможно, что именно усиление лигнификации способствовало, по крайней мере, отчасти, задержке поступления кадмия в корни пшеницы и, как следствие, транспорту его ионов в лист.
Не менее важным механизмом металлоустойчивости растений считаются хелатирование токсичных ионов в цитоплазме клетки и изоляция этих комплексов в вакуоль [12]. Как уже отмечалось выше, непротеионовые тиолы (глутатион и фитохелатины) играют в этом процессе важную роль. При этом у более металлоусточивых растений экспрессия генов, контролирующих синтез этих соединений, а также их содержание, как правило, выше, чем у неустойчивых. Но как влияет экзогенный МЖ на синтез глутатиона и фитохелатинов, не известно.
Нами впервые показано, что предобработка растений пшеницы экзогенным МЖ приводит к повышению (почти двукратному) уровня транскриптов генов GS1 и PCS1 в их листьях еще до начала воздействия кадмия (рис. 1). Спустя 1 сут экспозиции проростков на растворе с металлом уровень транскриптов обоих генов в листьях резко возрастал, причем в большей степени у обработанных МЖ растений. В дальнейшем по мере увеличения экспозиции, уровень транскриптов гена GS1 в листьях необработанных растений оставался практически неизменным, тогда как у обработанных проростков продолжал увеличиваться, достигая максимальных значений через 7 сут (рис. 1а). В отличие от этого уровень транскриптов гена PCS1 возрастал как у обработанных, так и у необработанных проростков, причем примерно в равной степени (рис. 1б).
Рис. 1.
Влияние сульфата кадмия (100 мкМ) на уровень транскриптов генов TaGS1 (а) и TaPCS1 (б) в листьях, обработанных экзогенным МЖ (1 мкМ), и необработанных растений пшеницы сорта Московская 39. За единицу принят уровень транскриптов генов в листьях контрольных растений.
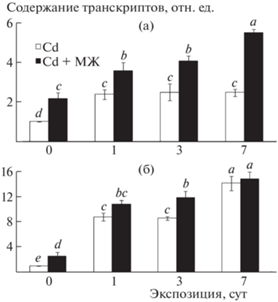
Полученные данные свидетельствуют о том, что обработка растений экзогенным МЖ усиливает уровень транскриптов генов, кодирующих ферменты синтеза глутатиона и фитохелатинов, что в дальнейшем при воздействии кадмия обеспечивает лучшую их активацию в клетках, по сравнению с необработанными растениями, и, как следствие, более высокую устойчивость проростков к металлу.
Увеличение содержания глутатиона и усиление экспрессии генов, участвующих в его синтезе, может быть связано с тем, что, помимо детоксикации металлов, глутатион имеет целый ряд других важных функций в растительной клетке, в том числе участвует в поддержании на определенном уровне окислительно-восстановительного баланса [6, 12]. Чем вызвано увеличение экспрессии гена фитохелатинсинтазы у обработанных МЖ растений в отсутствие кадмия в корнеобитаемой среде, пока не вполне ясно. Однако следует иметь в виду, что МЖ, помимо прочего, может выступать в качестве сигнальной молекулы, способной запускать каскад сигнальных реакций [3], благодаря которым обеспечивается более быстрая реакция растений на последующее стрессовое воздействие. Наконец, возможно, что МЖ влияет на метаболизм серы (предшественника глутатиона) [7, 9], также способствуя повышению содержания непротеиновых тиолов.
Таким образом, в результате проведенных исследований нами впервые установлено, что обработка растений пшеницы экзогенным МЖ усиливает в листьях экспрессию генов, участвующих в биосинтезе глутатиона и фитохелатинов, причем не только в присутствии в корнеобитаемой среде кадмия, но и без него. Более высокий уровень экспрессии генов указанных непротеиновых тиолов в растениях, обработанных МЖ, и меньшее содержание в них кадмия, возможно, и является одной из главных причин их более высокой устойчивости к данному металлу.
Список литературы
Zhai Q., Yan C., Li L. et al. Jasmonates. In: Hormone metabolism and signaling in plants // Amsterdam. Elsevier Ltd, 2017. P. 243–272.
Kuznetsov Vl.V., Dmitrieva G.A. Physiology of Plants. Moscow: Unirite, 2016. (In Russ)
Singh P., Arif Y., Siddiqui H. et al. Jasmonate: A versatile messenger in plants. In: Jasmonates and salicylates signaling in plants // Switzerland. Springer Nature, 2021. P. 129–158.
Kolupaev Yu.E., Yastreb T.O. Jasmonate signaling and plant adaptation to abiotic stressors (Review) // Applied Biochemistry and Microbiology. 2021. V. 57. № 1. P. 1–19.
Bali A.S., Sidhu G.P.S., Kumar V. et al. Mitigating cadmium toxicity in plants by phytohormone. In: Cadmium toxicity and tolerance in plants // Amsterdam. Elsevier Inc, 2019. P. 375–396.
Chandrakar V., Yadu B., Xalxo R. et al. Mechanisms of plant adaptation and tolerance to metal/metalloid toxicity. In: Plant Ecophysiology and adaptation under climate change: Mechanisms and perspectives II Singapore // Springer Nature. 2020. P. 107–130.
Raza A., Charagh S., Najati-Kakavand S. et al. The crucial role of jasmonates in enchancing heavy metals tolerance in plants. In: Jasmonates and salicylates signaling in plants // Switzerland. Springer Nature. 2021. P. 159–183.
Singh I., Shah K. Exogenous application of methyl jasmonate lowers the effect of cadmium-induced oxidative injury in rice seedlings // Phytochemistry. 2014. V. 108. P. 57–66.
Farhangi-Abriz S., Ghassemi-Golezani K. Jasmonates: Mechanisms and functions in abiotic stress tolerance of plants // Biocatalysis and agricultural biotechnology. 2019. V. 20. P. 101210.
Nguen T.H., Goossens A., Lacchini E. Jasmonate: A hormone of primary importance for plant metabolism // Current Opinion in Plant Biology. 2022. V. 67. P. 102197.
Napoleāo T.A., Soares G., Vital C.E. et al. Methyl jasmonate and salicylic acid are able to modify cell wall but only salicylic acid alters biomass digestibility in the model grass Brachypodium distachyon // Plant Science. 2017. V. 263. P. 46–54.
Gallego S.M., Pena L.B., Barcia R.A. et al. Unravelling cadmium toxicity and tolerance in plants: Insight into regulatory mechanisms // Environmental and Experimental Botany. 2012. V. 83. P. 33–46.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


