Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 181-185
Фосфолипидный состав сеголеток атлантического лосося Salmo salar в процессе роста и развития в аквакультуре: влияние разных режимов освещения и кормления
С. А. Мурзина 1, *, Д. С. Провоторов 1, В. П. Воронин 1, Д. И. Манойлова 1, А. Е. Курицын 1, С. Н. Пеккоева 1, академик РАН Н. Н. Немова 1
1 Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр Российской академии наук”
Петрозаводск, Россия
* E-mail: murzina.svetlana@gmail.com
Поступила в редакцию 15.11.2022
После доработки 22.11.2022
Принята к публикации 22.11.2022
- EDN: NAMMOT
- DOI: 10.31857/S2686738922600923
Аннотация
Исследовано влияние различных режимов кормления и освещения (естественного и непрерывного) на фосфолипидный состав сеголеток атлантического лосося, выращиваемых в товарной аквакультуре в летне-осенний период в Северной Осетии-Алании. Качественное и количественное определение фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозитола, лизофосфатидилхолина, сфингомиелина проводили методом высокоэффективной жидкостной хроматографии. Установлено снижение (сентябрь-ноябрь) содержания исследованных фосфолипидов у сеголеток, которое следует рассматривать прежде всего как биохимическую адаптацию развития, подготовку молоди к предстоящей смолтификации. Эффекты режима освещения и кормления на состав фосфолипидов обнаружены главным образом для рыб, находящихся при постоянном режиме освещения и круглосуточном кормлении и рыб, выращиваемых при естественном освещении и кормлении в светлое время суток, при этом следует отметить, что наблюдаемые изменения не являлись специфическими для конкретной экспериментальной группы рыб в рамках настоящего исследования.
ВВЕДЕНИЕ
Известно, что липиды принимают участие в развитии адаптивных изменений у живых организмов и особенно у гидробионтов, биохимические адаптации у которых обусловлены полной зависимостью от среды и принадлежностью к группе эктотермных животных. Адаптивная роль структурных липидов, к которым относятся фосфолипиды (ФЛ), разнообразна как по регулируемой ими функции, так и по механизму действия. Качественные и количественные модификации ФЛ и их жирных кислот (ЖК) обусловливают т.н. “текучесть” биомембран, необходимую для функционирования большого числа мембраносвязанных энзиматических систем [1–4]. С изменением текучести мембраны меняется температура фазового перехода липидов, влияющих на активность большинства мембраносвязаных ферментов – цитохромоксидазы, глюкозо-6-фосфатазы, сукцинатдегидрогеназы, Na+,K+-АТФ-азы, Ca2+-АТФ-азы, аденилатциклазы и др. [4]. Так, одной из функций мембран является их участие в биоэнергетических процессах и, прежде всего, в продуцировании АТФ на внутренней мембране митохондрий. Многие ферменты энергетического обмена работают только в определенном по составу и физико-химическим свойствам липидном окружении [2]. Например, для митохондриальной мембраны красных мышц форели показано трехкратное преобладание количественного содержания ФЛ над холестерином, при этом ФЛ представлены такими классами, как фосфоатидилэтаноламин, фосфатидилхолин, фосфатидилсерин, фосфатидилинозитол, кардиолипин, лизофосфатидилхолин, а сфингомиелин представлен в ничтожно малых количествах [5]. ФЛ митохондриальных мембран рассматриваются в качестве структурных липидов и могут выполнять функцию потенциальных модуляторов и регуляторов процессов, протекающих в митохондриях, а также выступают “партнерами” митохондриальных белков [6].
Принимая во внимание участие липидов и в том числе отдельных ФЛ в биохимических адаптациях рыб к изменению факторов среды, и, учитывая важную роль светового режима и трофического фактора в раннем развитии лососевых рыб [7–9], исследовали влияние различных режимов кормления и освещения (естественного и непрерывного) на фосфолипидный состав сеголеток атлантического лосося, выращиваемых в товарной аквакультуре в летне-осенний период в Северной Осетии-Алании.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование влияния фотопериода на рост и развитие сеголеток (0+) атлантического лосося проводили на предприятии ООО “Остров аквакультура” (Республика Северная Осетия-Алания). Для стимуляции эндогенных механизмов, влияющих на ростовые процессы, во все бассейны с сеголетками (после перехода на экзогенное питание) было установлено непрерывное освещение (24LD) с использованием светодиодных осветителей LED (36W, 6500K). Кормление проводилось в круглосуточном режиме каждые два часа с использованием коммерческого корма марки Scretting Nutra HP (Италия) c 6 по 29 сентября и BioMar Inicio+901 (Дания) с 23 сентября по 15 ноября (фракция 1 и 1.5 в зависимости от веса рыб), оба корма схожи по составу и пищевой ценности; расчет корма проводили согласно нормам возрастной группы и с учетом биомассы. В августе сеголеток средней массой 2.3 г пересадили в выростные лотки размером 4 × 1.2 м, объемом 2.5–2.7 м3, в количестве 4900 особей/лоток. C начала сентября сеголеток разделили на три группы по 2 лотка и стали содержать в следующих (экспериментальных) условиях: контроль – режим освещения постоянный (24LD), кормление круглосуточное (КК); опыт № 1 – естественное освещение (ЕстLD), кормление проводится в светлое время суток (с 06:00 до 18:00 в сентябре, с 08:00 до 18:00 в октябре, с 08:00 до 17:00 в ноябре), через каждые два часа (КД); опыт № 2 – режим освещения постоянный (24LD), кормление проводится только в светлое время суток как у рыб из опыта №1 (КД). Для исследования отбирали сеголеток лосося 6 сентября (стартовая дата забора материала), 6 октября и 9 ноября; из каждой группы было взято до 15 особей из лотка.
Экстракцию липидов из отобранных образцов (сеголеток целиком) молоди лосося проводили по методу Фолча [10]. Качественное и количественное определение индивидуальных фосфолипидных фракций – фосфатидилхолина (ФХ), фосфатидилэтаноламина (ФЭА), фосфатидилсерина (ФС), фосфатидилинозитола (ФИ), лизофосфатидилхолина (ЛФХ), сфингомиелина (СФМ) – осуществляли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием жидкостного хроматографа “Стайер” (ООО “Аквилон”, Россия). Фракционирование общих ФЛ проводили на колонке размером 250 × 4 мм, наполненной сорбентом Нуклеосил 100-7 (“Элсико”, Россия) и с использованием в качестве подвижной фазы смесь ацетонитрил-метанол-гексан-85% фосфорная кислота (918:30:30:17.5 по объему) при скорости потока 1 мл/мин. Детектирование анализируемых липидных классов осуществляли на спектрофотометре по поглощению в ультрафиолетовом свете при длине волны 206 нм [11]. Качественная идентификация липидных классов осуществлялась по стандартам соответствующих компонентов (Sigma-Aldrich, США) с учетом соответствия значений Rf. Исследования выполнены на базе лаборатории экологической биохимии и с использованием оборудования Центра коллективного пользования ФИЦ “Карельский научный центр Российской академии наук”.
Статистическая обработка результатов проводилась с использованием языка программирования “R” (v. 3.6.1.) в среде разработки “RStudio” с применением дополнительных пакетов: “readxl” (v. 1.3.1), “tidyverse” (v. 1.3.0) [12, 13]. Для описания количественного содержания индивидуальных фосфолипидных классов были рассчитаны параметры описательной статистики (среднее арифметическое и ошибка среднего арифметического) с группировкой по месяцам и типу экспериментального освещения. Полученные результаты были визуализированы в виде временной диаграммы.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изменение исследованных индивидуальных фосфолипидных классов в мышечной ткани сеголеток в условиях различного освещения и кормления в летне-осенний период показаны на рис. 1.
Рис. 1.
Динамика некоторых фосфолипидных классов (% сухого вещества) у сеголеток атлантического лосося в контрольном и опытных вариантах в период с сентября по ноябрь.
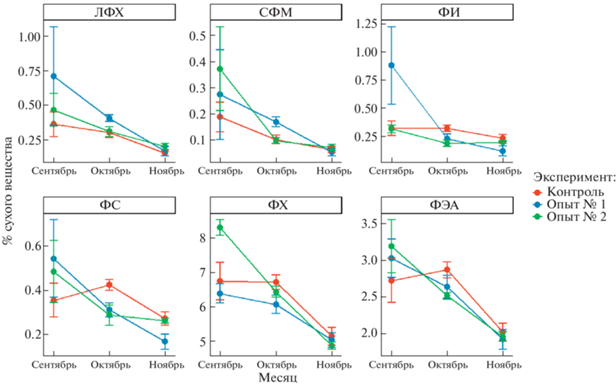
У сеголеток из трех исследованных вариантов (контроль, опыт № 1 и опыт № 2) за период с сентября по ноябрь доминирующими ФЛ являлись ФХ и ФЭА, при этом показана общая тенденция к снижению данных ФЛ к ноябрю. Ранее [14] была показана динамика снижения общих ФЛ наряду с восками, диацилглицеринами, свободными жирными кислотами, холестерином у сеголеток в контроле и двух опытных вариантах в ноябре по сравнению с таковым в сентябре и октябре на фоне недостоверного и незначительного снижения триацилглицеринов (ТАГ). Известно, что как процесс подготовки к смолтификации и собственно смолтификация сопровождаются снижением количества общих липидов [15], в условиях настоящего эксперимента снижение ОЛ проходило за счет ФЛ, в частности мажорных по количеству ФХ и ФЭА. Несмотря на то что ФЛ относятся к структурным липидам, они, наряду с другими энергетическими липидами, являются и формой запасания энергии, которая реализуется в соответствии с потребностями организма и обеспечивает, поддержание гомеостаза в условиях изменяющихся факторов среды (в данном случае – освещения и кормления). ФИ, ФС, а также СФМ и ЛФХ (“минорные” классы ФЛ) у сеголеток атлантического лосося во всех вариантах эксперимента представлены в меньшем количестве. Для них, как и для доминирующих липидов, обнаружено снижение содержания у рыб в сезонном аспекте. Известно, что изменение активности Ca2+-АТФазы и особенно Na+,K+-АТФазы, который является “ферментом осморегуляции” и представляет из себя электрогенный ионный насос [16], регулируется именно за счет ФС, что особенно важно для рыб, которые испытывают флуктуации солености среды как на отдельных этапах жизненного цикла, так и в виде суточных или сезонных колебаний. Известно также, что ФС биомембран посредством регуляции активности мембранносвязанных ферментов принимает участие в процессах слияния миобластов для формирования миотрубки, системной единицы мышечного волокна, слияния остеокластов [17], чем в том числе можно частично объяснить прирост массы сеголеток лосося в процессе роста и развития, особенно в контрольном варианте эксперимента [14].
Установлено недостоверное снижение содержания ФИ у сеголеток контрольного варианта, при этом у рыб из опытных вариантов оно достоверно резко снижается к октябрю, а в ноябре снижение этого показателя недостоверно по сравнению с таковым в октябре (рис. 1). В процессе гидролиза ФИ при участии фосфолипазы С образуются диглицериды, которые считаются сигнальными молекулами [18], и фосфоинозиты, которые образуются под действием гормонов и ряда других эффекторов [19]. Показано [20], что последние увеличивают количество внутриклеточного Ca2+ и диглицеридов, что приводит к повышению активности киназ, которые выступают в роли регуляторов отдельных метаболических путей. Таким образом, ФИ является “поставщиком” в организм метаболически и функционально значимых молекул как в рамках нормального физиологического состояния, так и при условиях, которые требуют адаптивного компенсаторного ответа. Инозитол-липиды формируют липидный профиль биомембраны и поддержание ее гомеостаза [21]. Они участвуют в передаче трансмембранного сигнала, регулируют ионную проницаемость, суб- и межклеточный транспорт, а также являются предшественниками сигнальных молекул (при участии фосфолипазы С) [21]. В целом ФИ рассматривают как источник высоконенасыщенных биоактивных молекул ЖК, в частности арахидоновой ЖК. Эта ЖК предшественник одного из семейств эйкозаноидов, биологически активных соединений липидной природы, синтезируемых в большинстве тканей организма и участвующих в регуляции ряда физиологических процессов: репродукции, иммунного ответа, воспалительных реакций, развития и функционирования зрительной и нервной системы [22–25]. В аналогичном эксперименте [14] показан высокий и константный уровень арахидоновой кислоты у сеголеток всех вариантов эксперимента на всем протяжении эксперимента.
Таким образом, снижение (сентябрь–ноябрь) содержания исследованных фосфолипидов (ФХ, ФЭА, ФИ, ФС, ЛизоФХ, СФМ) наряду с другими, ранее описанными вариациями липидов и жирных кислот [14] у сеголеток атлантического лосося, впервые выращиваемого в условиях аквакультуры в регионе Северная Осетия-Алания, следует рассматривать прежде всего как биохимическую адаптацию развития, готовности молоди к предстоящей смолтификации и переходу из пресной среды в морскую. Обнаруженные изменения ФЛ-состава могут обеспечивать поддержание физико-химического состояния биомембран, которое удовлетворяет скоростям и уровням происходящих в них процессов на данном этапе развития молоди лосося в соответствующих условиях среды. Эффекты режима освещения и кормления на ФЛ состав сеголеток в процессе развития обнаружены главным образом для рыб, находящихся при постоянном режиме освещения и круглосуточном кормлении и рыб, выращиваемых при естественном освещении и кормлении в светлое время суток, однако наблюдаемые изменения не являлись специфическими для конкретной экспериментальной группы рыб в рамках настоящего исследования.
Список литературы
Крепс Е.М. Липиды клеточных мембран. Эволюция липидов мозга. Адаптационная функция липидов. СПб: Наука, 1981. 339 с.
Болдырев А.А., Кяйвяряйнен Е.И., Илюха В.А. Биомембранология: учебное пособие. Петрозаводск: КарНЦ РАН, 2006. 226 с.
Рабинович А.Л., Рипатти П.О. О конформационных свойствах и функциях докозагексаеновой кислоты // Доклады АНССР. 1990. Т. 314. № 3. С. 752–756.
Лось Д.А. Структура, регуляция экспрессии и функционирование десатураз жирных кислот // Успехи биологической химии. 2001. Т. 41. С. 163–198.
Kraffe E., Marty Y., Guderley H. Changes in mitochondrial oxidative capacity during thermal acclimation of rainbow trout: roles of membrane proteins, phospholipids and its fatty acid composition // J. Exper. Biology. 2007. V. 210. P. 149–165.
Daum G. Lipids of Mitochondria // Biochim. Biophys. Acta. 1985. V. 822. P. 1–42.
Немова Н.Н., Нефедова З.А., Мурзина С.А. и др. Влияние экологических условий обитания на динамику жирных кислот у молоди атлантического лосося (Salmo salar L.) // Экология. 2015. № 3. С. 206–211.
Shulgina N.S., Churova M.V., Murzina S.A. et al. The effect of continuous light on growth and muscle-specific gene expression in Atlantic salmon (Salmo salar) yearlings // Life. 2021. V. 11. № 4. P. 328.
Murzina S.A., Voronin V.P., Churova M.V. et al. The Effects of Low-Level Helium–Neon (He–Ne) Laser Irradiation on Lipids and Fatty Acids, and the Activity of Energetic Metabolism Enzymes and Proteome in the Blastula Stage and Underyearlings of the Atlantic Salmon Salmo salar: A Novel Approach in Salmonid Restoration Procedures in the North // Biomolecules. 2022. V. 12 (1). P. 133.
Folch J., Lees M., Sloan-Stanley G.H. A simple method for the isolation and purification of total lipids animal tissue (for brain, liver and muscle) // J. Biol. Chem. 1957. V. 226. P. 497–509.
Arduini A., Peschechera A., Dottori S. et al. High performance liquid chromatography of long-chain acylcarnitine and phospholipids in fatty acid turnover studies // J. Lipid Res. 1996. V. 37. P. 684–689.
Кабаков Р.И. R в действии: Анализ и визуализация данных в программе. М.: ДМК Пресс, 2016. 580 с.
Bruce P., Bruce A., Gedeck P. Practical statistics for data scientists: 50+ essential concepts using R and Python. // O’Reilly Media, 2020.
Мурзина С.А., Провоторов Д.С., Воронин В.П. и др. Показатели липидного обмена у сеголеток атлантического лосося Salmo salar в условиях аквакультуры в южном регионе РФ при разных режимах освещения и кормления // Известия РАН. 2023. В печати.
Sheridan M.A. Alterations in lipid metabolism accompanying smoltification and seawater adaptation of salmonid fish // Aquaculture. 1989. V. 82 (1–4). P. 191–204.
Геннис Р. Биомембраны: Молекулярная структура и функции. М.: Мир, 1997. 624 с.
Verma S.K., Leikina E., Melikov K. et al. Cell-surface phosphatidylserine regulates osteoclast precursor fusion // JBC. 2017. P. 254–270. https://doi.org/10.1074/jbc.M117.809681
Ипатова О.М. Фосфоглив: механизм действия и применение в клинике. М.: ГУНИИ биомедицинской химии РАМН, 2005. 318 с.
Berrigge M.J. Inositol Triphosphate and Diacylglycerol: Two Interacting Second Messengers // Ann. Rev. Biochem. 1987. V. 56. P. 159–193.
Kishimoto A.Y., Takai Y., Mori T. et al. Activation of calcium and phospholipid-dependent protein kinase by diacylglycerol, its possible relation to phosphatidylinositol turnover // Journal of Biological Chemistry. 1980. V. 255. № 6. P. 2273–2276.
Kim Y.J., Guzman-Hernandez M.L., Balla T. Inositol lipid regulation of lipid transfer in specialized membrane domains // Trends in Cell Biology. 2013. V. 23. № 6. P. 270–278.
Tocher D.R. Glycerophospholipid metabolism. In: Hochachka P.W., Mommsen T.P. (Eds.), Biochemistry and Molecular Biology of Fishes. Metabolic and Adaptational Biochemistry, vol. 4. Elsevier Press, Amsterdam, 1995. P. 119–157.
Tocher D.R., Bendiksen E., Campbell P., Bell J. The role of phospholipids in nutrition and metabolism of Teleost fish // Aquaculture. 2008. V. 280. P. 21–34.
Sawyer N., Cauchon E., Chateauneuf A. et al. Molecular pharmacology of the human prostaglandin D2 receptor, CRTH2 // Br J Pharmacol. 2002. V. 137 (8). P. 1163–72.
Hanna V.S., Hafez E.A.A. Synopsis of arachidonic acid metabolism: a review //Journal of advanced research. 2018. V. 11. P. 23–32.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


