Доклады Российской академии наук. Науки о жизни, 2023, T. 513, № 1, стр. 544-548
Уровень экспрессии генов инициации цветения (CONZ1, GIGZ1A, GIGZ1B, FKF1A, FKF1B) в проростках в условиях длинного дня различает ранне- и позднеспелые линии Zea mays l.
Д. Х. Архестова 1, 2, О. К. Анисимова 1, Е. З. Кочиева 1, А. В. Щенникова 1, *
1 Федеральное государственное учреждение «Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук»
Москва, Россия
2 Институт сельского хозяйства, филиал Кабардино-Балкарского научного центра Российской академии наук
Нальчик, Россия
* E-mail: shchennikova@yandex.ru
Поступила в редакцию 10.07.2023
После доработки 02.08.2023
Принята к публикации 04.08.2023
- EDN: XQDDEX
- DOI: 10.31857/S2686738923700385
Аннотация
Охарактеризовано 20 инбредных линий кукурузы Zea mays L. по длительности фенофаз, включая сроки цветения и спелости. Исследована экспрессия ключевых генов инициации цветения, CONZ1, GIGZ1a, GIGZ1b, ZmFKF1a и ZmFKF1b, в проростках шести линий кукурузы, различающихся сроками спелости, в условиях длинного фотопериода. Выявлен существенно более низкий уровень транскриптов всех пяти генов у раннеспелых линий в сравнении с позднеспелыми образцами. Показана сходная экспрессия паралогичных генов GIGZ1a и GIGZ1b, а также значительное преобладание экспрессии ZmFKF1a в сопоставлении с паралогичным ему геном ZmFKF1b.
Наступление репродуктивной фазы развития у высших растений определяется циркадными ритмами, важным экологическим сигналом для установки которых служит фотопериодизм. Показания биологических часов сопоставляются со световыми сигналами, и растение зацветает при длинном фотопериоде (более 12 ч; длиннодневные виды), коротком фотопериоде (короткодневные) или независимо от длины фотопериода (нейтральные; однако количество цветков обусловлено соотношением дня и ночи). Важным компонентом основного циркадианного осциллятора (эндогенные часы) считается транскрипционный фактор (ТФ) GIGANTEA (GI). На примере модельного длиннодневного вида Arabidopsis thaliana L. показано, что белок GI совместно с рецептором синего света FLAVIN-BINDING, KELCH REPEAT, F-BOX 1 (FKF1) стимулируют экспрессию гена ТФ CONSTANS (CO), индуктора цветения растения при длинном дне [1]. Это происходит благодаря тому, что комплекс GI/FKF1 способствует деградации транскриптов ТФ CYCLING DOF FACTOR 1 (CDF1), CDF2 и CDF3, участвующих в репрессии CO [2, 3]. Помимо регуляции времени цветения, GI и FKF1 имеют и другие, не менее важные функции. Активность рецептора FKF1 критична для фотоморфогенеза [4]. ТФ GI играет множество ролей, включая участие в передаче световых и гормон-опосредованных сигналов, удлинении гипокотиля, накоплении крахмала и хлорофиллов, транспирации, устойчивости к стрессам (гербицидам, холоду, засухе и избытку соли) [5–7]. Однако наиболее значимой функцией ТФ GI считается поддержание корректного циркадного периода у растения путем регуляции протеасомозависимой деградации другого центрального циркадианного осциллятора TIMING OF CAB EXPRESSION 1 [5, 8].
Кукуруза (Zea mays L.) является результатом доместикации теосинте (Z. mays ssp. parviglumis), растения короткого дня [9]. Дальнейшая селекция культуры способствовала появлению разнообразия реакций данного вида на продолжительность фотопериода, и современные образцы кукурузы считаются нейтральными, т.е. нечувствительными к фотопериоду в отношении цветения. Тем не менее задержка цветения и изменения в соцветии при длинном дне свидетельствуют о сохранении важности фотопериода для кукурузы при переходе к репродуктивной стадии развития [10]. Консервативность фоточувствительного механизма регуляции перехода к репродуктивной фазе подтверждается наличием в геноме кукурузы генов CONSTANS of Zea mays 1 (CONZ1), GIGANTEA of Zea mays 1 A и B (GIGZ1a, GIGZ1b), ZmFKF1a и ZmFKF1b [1, 2].
При коротком дне пик экспрессии CONZ1 приходится на ночь, тогда как днем транскрипция гена стремится к нулю. При длинном дне паттерн “день–ночь” существенно менее упорядочен, однако тоже подвержен суточным колебаниям, что говорит о способности современных сортов, линий и гибридов кукурузы различать изменения фотопериода, несмотря на декларируемую нечувствительность к ним у вида с точки зрения цветения [1]. Предполагается также, что такой паттерн экспрессии гена может характеризоваться как рудиментарный, т.е. активность гена больше не оказывает существенного влияния на цветение кукурузы, либо фотопериод продолжает воздействовать на переход к репродуктивному развитию, но не столь очевидно, как у предшественника кукурузы – теосинте [1]. Кроме того, чувствительность кукурузы к фотопериоду может сглаживаться при регуляторном включении автономного пути цветения [1].
Гены GIGZ1a и GIGZ1b имеют либо практически идентичные паттерны экспрессии [1], либо GIGZ1a экспрессируется сильнее, чем GIGZ1b [11]. Независимо от фотопериода максимум транскриптов GIGZ1a и GIGZ1b приходится на световую фазу, предшествующую индукции транскрипции CONZ1 [1]. При длинном фотопериоде пик наивысшей экспрессии GIGZ1a и GIGZ1b наблюдается позже, чем в условиях короткого дня. Кроме того, появляется дополнительный пик в суточных колебаниях CONZ1, который не коррелирует с паттерном генов GIGZ1 и за индукцию которого могут отвечать гены рецептора синего света ZmFKF1a и ZmFKF1b [1]. Предполагается, что белки ZmFKF1 образуют комплекс с GIGZ1, и этот комплекс способствует деградации транскриптов CDF, участвующих в репрессии CONZ1, как это продемонстрировано для A. thaliana [2, 3]. В связи со сказанным, оказывается неожиданным, что, как было показано, выключение одного из двух генов GIGZ1 не замедляет, а ускоряет наступление цветения кукурузы в условиях длинного дня [11, 12].
Целью данного исследования стал поиск возможной зависимости уровня экспрессии генов CONZ1, GIGZ1a, GIGZ1b, ZmFKF1a и ZmFKF1b в условиях длинного фотопериода от сроков инициации цветения образцов инбредных линий кукурузы, контрастных по условному индексу скороспелости ФАО (FAO).
В работе были использованы 20 линий кукурузы селекции Института сельского хозяйства (ИСХ) КБНЦ РАН. По 10 образцов каждой линии были высеяны в середине мая 2022 г. в поле ИСХ (КБР, 43°35' с. ш.) и охарактеризованы по категориям ФАО (включая продолжительность периода вегетации, сумму эффективных температур и ряд других факторов) в режиме длинного дня (май–июль в КБР характеризуется 14–15 ч днем).
Было показано, что женские соцветия (будущий початок) у образцов начинают цвести в период с третьей декады июня по третью декаду июля. Определение длительности фенологических фаз позволило охарактеризовать две линии как раннеспелые, две линии как очень позднеспелые, и оставшиеся 16 линий как разные варианты позднеспелости. Для дальнейшего анализа были выбраны 6 линий, представляющие три основные контрастные группы спелости: по две линии с ФАО 100–199 (раннеспелые), 300–400 (позднеспелые) и 600–699 (очень позднеспелые) соответственно (табл. 1).
Таблица 1.
Характеристики линий, отобранных для анализа генной экспрессии
| Линия | Срок спелости | Фаза всходы- цветение/вегетаци-онный период, дни | Сумма активных температур | Сумма эффективных температур | Группа спелости по ФАО |
|---|---|---|---|---|---|
| L1 | Раннеспелая | 39/80 | 2200 | 900–1000 | 100–199 |
| L2 | Очень позднеспелая | 72/165 | 3200 | 1300 | 600–699 |
| L3 | Позднеспелая | 63/150 | 2800 | 1200 | 400–499 |
| L4 | Раннеспелая | 50/90 | 2200 | 900–1000 | 100–199 |
| L5 | Очень позднеспелая | 72/165 | 3200 | 1300 | 600–699 |
| L6 | Средне-позднеспелая | 57/130 | 2600 | 1150 | 300–399 |
Зерна отобранных шести линий кукурузы, собранные в 2022 г., проращивали в 2023 г. в увлажненной почве, в условиях экспериментальной установки искусственного климата (ЭУИК ФИЦ биотехнологии РАН) при длинном фотопериоде (день/ночь: 16/8 ч, 23°С/25°С) до стадии образования 4 листьев. Листовой материал проростков использовали для определения уровня экспрессии генов CONZ1, GIGZ1a, GIGZ1b, ZmFKF1a и ZmFKF1b. Тканевые пробы отбирали спустя 4 ч после начала световой фазы. Выбор временной точки был основан на данных о суточных колебаниях уровня экспрессии генов CONZ1, GIGZ1a и GIGZ1b при длинном дне: в рассветные часы экспрессия CONZ1 идет на спад, а GIGZ1a и GIGZ1b – на подъем [1]. Также было учтено, что ассоциация белков FKF1 и GI, необходимая для индукции гена CO, происходит под воздействием света и разрушается в темноте [13].
Из 50 мг ткани листа выделяли суммарную РНК с дополнительной очисткой от геномной ДНК (RNeasy Plant Mini Kit и RNase free DNasy set, QIAGEN, Германия), синтезировали кДНК (GoScriptтм Reverse Transcription System, Promega, США), концентрацию препаратов кДНК определяли флуориметрически (Qubit 4, Thermo Fisher Scientific, США) и 3 нг кДНК использовали для анализа генной экспрессии с помощью количественной ПЦР в реальном времени (РВ-ПЦР). Реакцию проводили с набором “Реакционная смесь для проведения РВ-ПЦР в присутствии SYBR GreenI и ROX” (ООО “Синтол”, Россия) в системе CFX96 Real-Time PCR Detection System (Bio-Rad Laboratories, США); программа: 5 мин 95°С; 40 циклов (15 с 95°С; 50 с 62°С).
В результате было показано, что образцы обеих раннеспелых линий характеризуются существенно более низким уровнем транскриптов анализируемых генов в сравнении с поздними линиями (рис. 1). При этом степень позднеспелости не коррелирует с разницей в активности генов. Таким образом, несмотря на то, что продукты генов CONZ1, GIGZ1a, GIGZ1b, ZmFKF1a и ZmFKF1b считаются индукторами цветения, их активность в проростках на стадии четвертого листа рано цветущих линий оказалась ниже, чем у поздно цветущих образцов (рис. 1). Возможно, это связано с тем, что в анализе использовали именно вегетативные ткани на ранних стадиях развития растений, а не взрослых растений перед стадией цветения.
Рис. 1.
Уровень экспрессии генов CONZ1 (NCBI Gene ID 100147736), GIGZ1a (100147733), GIGZ1b (100272803), Z-mFKF1a (100383277) и ZmFKF1b (100279726) в листе проростка образцов шести линий (L1–L6) кукурузы Z. mays, различающихся по срокам спелости, спустя 4 ч после рассвета (длинный фотопериод). Использованные праймеры: CONZ1 (5'-GGTCAGTGCTTACACAGATTCC-3' и 5'-TGTCTGTCGTTGCCATGTTGTC-3'); ZmFKF1a (5'-TCAACGCCGCCTTCGAGG-3' и 5'-GGGTGTCGCCTTTGGGCAT-3´); ZmFKF1b (5'-GTCATATACGTCAACGCCGCA-3' и 5'-GATGTCGCCTCTGGGCTC-3´); GIGZ1a (5'-CAGTTTACAGCTGACACCGATCAA-3' и 5'-GCTCCGGATGATGAAGAACAAAAG-3'); GIGZ1b (5'-AGTGAGCAGTTCCCTGAAGATG-3' и 5'-GCTCCGGATGATGAAGAACAAAAG-3'). Референсный ген – Zea mays polyubiquitin (NM_001329666.1; 5'-ATCGTGGTTGTGGCTTCGTTG-3' и 5'-GCTGCAGAAGAGTTTTGGGTACA-3'). Результаты РВ-ПЦР статистически обработаны (one-way ANOVA) с помощью Graph Pad Prism v. 8 (GraphPad Software Inc., США) на основе двух биологических и трех технических повторов (p-value < 0.05 для значимых различий в экспрессии гена). Над столбцами буквами “a”, “b” и “c” обозначено объединение образцов по кластерам со статистически сходной генной экспрессией.
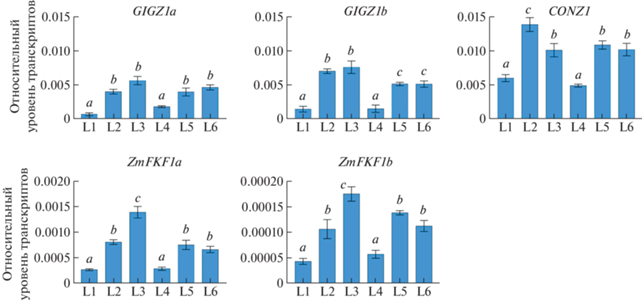
Полученные результаты согласуются с упомянутым выше эффектом выключения одного из двух генов GIGZ1. Как упоминалось выше, мутации в одном из генов, как zmgi1, так и zmgi2, ускоряют цветение кукурузы в условиях длинного дня; при этом повышается экспрессия CONZ1, на основании чего делается вывод о подавляющей цветение роли данных генов [11, 12]. Поскольку двойная мутация zmgi1 zmgi2 не изучалась, эффект одиночных мутаций может свидетельствовать о возможном росте индуцирующей цветение активности второго, невыключенного паралога GIGZ1. В соответствии с данными [1], где GIGZ1a и GIGZ1b экспрессируются одинаково, и в отличие от данных [11], где уровень транскриптов GIGZ1a выше, чем у GIGZ1b, в данной работе гены GIGZ1a и GIGZ1b показывали одинаковый (между линиями, и по уровню транскриптов) тип экспрессии (рис. 1). Это предполагает равное участие генов в выполнении функций GI и способность равноценного замещения друг друга при выключении одного из паралогов. В противоположность эффекту мутаций zmgi, у вида A. thaliana выключение GI (один ген в отличие от двух паралогов у кукурузы) приводит к замедлению цветения, что подтверждает роль GI как индуктора цветения [13].
То, что A. thaliana является длиннодневным растением, а кукуруза – нейтральным или близким к растениям короткого дня, дополнительно свидетельствует в пользу возможной подавляющей цветение функции GIGZ1 в условиях длинного дня. То есть низкий (в сравнении с поздними линиями) уровень транскриптов GIGZ1 у раннеспелых линий кукурузы (рис. 1) может быть причиной их раннего цветения. Однако экспрессия других трех генов индукторов цветения (CONZ1, ZmFKF1a и ZmFKF1b) у ранних линий кукурузы также ниже, чем у поздних линий (рис. 1). Это не согласуется с выводом об угнетающей цветение функции GIGZ1. В этом случае активность генов CONZ1, ZmFKF1a и ZmFKF1b пришлось бы интерпретировать аналогичным GIGZ1 образом, хотя ранее было показано, что и CONZ1, и ZmFKF1 положительно ассоциированы с активацией цветения кукурузы [1, 2]. Отметим также, что уровень экспрессии ZmFKF1b был на порядок ниже, чем уровень транскриптов ZmFKF1a (рис. 1) несмотря на то, что именно генетический локус ZmFKF1b сыграл ключевую роль в адаптивной эволюции цветения женского соцветия кукурузы [2].
Поскольку исследование проводилось на вегетативных проростках, а не на растениях при переходе к репродуктивной стадии развития, при интерпретации результатов нужно учитывать и другие возможные функции ZmFKF1 и GIGZ1, кроме регуляции времени цветения. Активность генов ZmFKF1 может быть связана с участием рецепторов ZmFKF1a и ZmFKF1b в фотоморфогенезе (подобно FKF1 [9]), а генов GIGZ1 – с ролью ТФ GIGZ1a и GIGZ1b в сигнальных путях, росте гипокотиля, поддержании циркадного цикла и других процессах (подобно GI [5, 6, 8]). Поэтому с учетом сказанного и результатов РВ-ПЦР (рис. 1) невозможно однозначно судить об угнетающей или стимулирующей цветение роли генов CONZ1, GIGZ1a, GIGZ1b, ZmFKF1a и ZmFKF1b. Тем не менее наблюдаемую существенную разницу в уровне экспрессии генов между ранними и поздними линиями (рис. 1) можно связать со сроками скороспелости кукурузы и, после подтверждения ассоциации на большем количестве образцов, использовать для отбора доноров признака раннеспелости.
Таким образом, охарактеризованные по срокам цветения инбредные линии кукурузы были проанализированы на предмет уровня экспрессии генов, кодирующих ключевые индукторы цветения, в условиях длинного фотопериода (4 ч после начала дня). Было обнаружено, что ранние линии отличаются от позднеспелых образцов кукурузы пониженным уровнем транскриптов всех проанализированных генов CONZ1, GIGZ1a, GIGZ1b, ZmFKF1a и ZmFKF1b в проростках на стадии четвертого листа. Паралогичные гены GIGZ1a и GIGZ1b экспрессировались на одинаковом уровне, в то время как количество мРНК ZmFKF1b было на порядок ниже, чем в случае паралогичного гена ZmFKF1a. Можно предположить, что уровень экспрессии генов CONZ1, GIGZ1 и ZmFKF1 в проростках в условиях длинного дня может служить маркером времени инициации цветения кукурузы.
Список литературы
Miller T.A., Muslin E.H., Dorweiler J.E. // Planta. 2008. V. 227 (6). P. 1377–1388.
Liu L., Wu Y., Liao Z., et al. // Heredity (Edinb). 2018. V. 120 (4). P. 310–328.
Sawa M., Nusinow D.A., Kay S.A., et al. // Science. 2007. V. 318. P. 261–265.
Kami C., Lorrain S., Hornitschek P., et al. // Curr. Top. Dev. Biol. 2010. V. 91. P. 29–66.
Mishra P., Panigrahi K.C. // Front. Plant Sci. 2015. V. 6. P. 8.
Ronald J., McCarthy K., Davis S.J. // Mol. Plant. 2020. V. 13 (3). P. 357–359.
Ke Q., Kim H.S., Wang Z., et al. // Plant Biotechnol. J. 2017. V. 15 (3). P. 331–343.
Kim W.Y., Fujiwara S., Suh S.S., et al. // Nature. 2007. V. 449. P. 356–360.
Matsuoka Y., Vigouroux Y., Goodman M.M., et al. // Proc. Natl. Acad. Sci. USA. 2002. V. 99 (9). P. 6080–6084.
Chen Q., Zhong H., Fan X.W., et al. // Plant, Cell & Environment. 2015. V. 38 (8). P. 1479–1489.
Bendix C., Mendoza J.M., Stanley D.N., et al. // Plant Cell Environ. 2013. V. 36 (7). P. 1379–1390.
Li Z., Gao F., Liu Y., et al. // Plant Sci. 2023. V. 332. P. 111701.
Rubio V., Deng X.W. // Science. 2007. V. 318 (5848). P. 206–207.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


