Экология, 2019, № 2, стр. 112-124
Метод морфофизиологических индикаторов и функционально-онтогенетический подход при решении экологических задач (на примере спленомегалии у грызунов)
Г. В. Оленев a, *, Е. Б. Григоркина a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: olenev@ipae.uran.ru
Поступила в редакцию 25.09.2018
После доработки 24.10.2018
Принята к публикации 10.10.2018
Аннотация
На примере анализа явления спленомегалии (СМ)1 у грызунов показана продуктивность совместного использования метода морфофизиологических индикаторов (ММФИ) и функционально-онтогенетического подхода в популяционных исследованиях. Предложено решение проблемы анализа органа с гигантским диапазоном изменчивости – раздельный анализ индекса селезенки в состояниях норма и СМ. Показано отсутствие морфофизиологического своеобразия особей разного функционального статуса в анализируемых состояниях. Установлено, что СМ не оказывает значимого влияния на процессы жизнедеятельности животных. Максимальная доля зверьков со СМ отмечена в размножающихся группировках, что связано с высокой интенсивностью процессов метаболизма. Доказана инфекционная природа СМ в районе исследований. Выявлены возбудители природно-очаговых инфекций, рассмотрен механизм развития СМ. Обоснованы критерии соответствия органов морфофизиологическим индикаторам и использование селезенки в качестве экологического индикатора. Совокупность полученных материалов приводит к заключению об адаптации изученной популяции рыжей полевки к длительному действию инфекционного фактора, сформировавшейся исторически в процессе длительной коэволюции системы “паразит–хозяин”.
Метод морфофизиологичеких индикаторов
Многоообразие и сложность взаимодействий живых систем разных уровней организации со средой обусловливают разнообразие методов экологических исследований. В популяционной экологии животных, несмотря на новые высокотехнологичные методы, актуальны простые, доступные методы полевых изысканий. Такой метод – метод морфофизиологических индикаторов (ММФИ), предложенный С.С. Шварцем [1], переживший свой расцвет в ХХ в.
ММФИ базируется на экологической обусловленности морфологических и физиологических особенностей животных, а также на закономерной связи между морфой (массой или размером органов) и их функциями. Авторы [1, с. 4] пишут: “Признавая, что важнейшей целью экологического исследования является установление закономерностей динамики популяций, следует считать особенно целесообразным применение таких методов, которые позволили бы оценивать физиологическое состояние конкретных популяций с учетом … специфики животных, в своей совокупности составляющих популяцию.”. Иными словами, “на основании изменчивости отдельных морфологических или физиологических признаков создается суждение о биологическом своеобразии обследуемых популяций” [1, с. 5].
В качестве основных показателей предлагаются масса тела, относительная масса сердца, печени, почек, надпочечников, тимуса, рассчитывается относительная масса внутренних органов – индексы (отношение массы органа к массе тела в ‰). Список предложенных выше показателей не является завершенным. В зависимости от целей и задач исследований могут использоваться показатели, не вошедшие в список, например относительная масса мозга, витамины, форменные элементы крови, данные по упитанности, развитию мускулатуры, пропорциям органов и тела, индексам гипофиза, поджелудочной железы и многие другие.
Достоинством и неоспоримым преимуществом ММФИ является его доступность. Метод позволяет в полевых условиях, при минимальном наборе инструментов, с использованием простых орудий отлова, мгновенно умерщвляющих зверьков, легко получать массовый материал с нативными параметрами. За счет больших выборок нивелируются случайности. Слегка утрируя, можно поставить следующий вопрос: что лучше, измерить длину одной особи с точностью до 0.1 мм или длину 100 особей с точностью до 1 см? Ответ очевиден: корректно охарактеризовать значение признака в популяции позволяет только второй вариант. Метод предназначен для работы с массовыми видами наземных позвоночных животных, доступными для отлова, не имеющими природоохранного или социо-культурного значения.
К недостаткам метода его противники иногда относят: а) невысокую точность отдельного измерения и б) отрицание однозначной зависимости массы органа от его функционального состояния. Действительно, в полевых условиях неизбежны погрешности при извлечении органов, что имеет значение при малых выборках. Но множество успешных исследований с помощью ММФИ свидетельствует о несостоятельности второго возражения. Например, преимущество эколого-физиологического метода заключается в точности оценки физиологических особенностей животных, но его недостаток – невозможность использования массового материала непосредственно в природе.
Большинство современных высокотехнологичных методов, как правило, требуют доставки в лабораторию живых животных, а для отлова необходимы громоздкие живоловки. В них и при дальнейшей транспортировке в лабораторию животные испытывают стресс, часть гибнет, причем избирательно. В результате для анализа берутся фактически животные, которые нерепрезентативны для популяции и в состоянии, отдаленно отражающем природное.
За 50 лет первоначальный энтузиазм, связанный с появлением ММФИ, закономерно ослаб. Но, несмотря на скептицизм, вызванный некорректным применением, метод широко используется, востребован как рабочий полевой инструмент. Традиционно ММФИ применяется для решения экологических задач при изучении природных популяций мелких млекопитающих, населяющих естественные и подверженные антропогенному воздействию местообитания. Перспективно использование МФИ в качестве признаков, дискриминирующих разные биологические явления, особенно с использованием ФОП. К примеру, при изучении избирательности отлова хищными птицами грызунов разных демографических групп был применен дискриминантный анализ морфофизиологических особенностей полевок разных функционально-возрастных группировок. Результаты показали, что животные трех ФФГ с асимметрией черепа отличаются общими устойчивыми морфофизиологическими чертами [2].
Функционально-онтогенетический подход
При исследовании с помощью ММФИ важное значение имеет выделение структурных внутрипопуляционных единиц. Для изучения популяций цикломорфных млекопитающих разработан концептуальный функционально-онтогенетический подход – ФОП [3], в основе которого лежит впервые детально обоснованная возможность поливариантности онтогенетического развития в классе млекопитающих.
К первым работам, имеющим отношение к функциональной структурированности популяций (будущие типы онтогенеза) грызунов, следует отнести предположение о существовании физиологических рас [4] и представление о “сезонных генерациях” грызунов [5–8]. С.С. Шварц с коллегами показали, что грызуны, родившиеся в разное время года, обладают сложным комплексом морфофизиологических особенностей22; особи разных сезонных генераций специфичны и стареют с разной скоростью [6]. В большинстве работ, касающихся возрастной структуры, С.С. Шварц с коллегами использовали термин “генерация”, причем в двух значениях, что привнесло некоторые терминологические разночтения. В первом случае генерация – это массовые очередные появления пометов молодняка, считая с начала весеннего размножения. В современной литературе [9, 10] этому пониманию соответствует термин когорта, являющаяся элементарной структурной единицей популяции. Во втором случае генерация – это группа из нескольких массовых весенних или осенних пометов (когорт), соответственно “весенняя генерация” или “осенняя генерация”, т.е. сезонные генерации – это группы особей, родившиеся в разные сезоны года, развивающиеся в разных условиях и обладающие определенными биологическими свойствами. Считалось аксиомой, что весной практически все особи, включая сеголеток, размножаются.
Однако результаты многолетнего массового индивидуального мечения [3, 11] показали, что на самом деле “весенняя генерация” (по С.С. Шварцу) состоит не только из сеголеток, участвующих в размножении и создающих лицо данной сезонной генерации. Всегда есть сеголетки, неразмножающиеся в год рождения. Доля таких животных составляет 10–30% в обычные по условиям годы и достигает 100% в экстремальных условиях: засуха [12], высокая плотность [13]. Сезонные генерации состоят из двух группировок особей, функциональное состояние которых определяет большинство анализируемых показателей [3, 11]. Таким образом, в ранних работах анализировались заведомо неоднородные выборки, что вносило в результаты значительные погрешности. Использование функционального подхода освобождает от подобных ошибок и дает возможность работать со строго выделенными внутрипопуляционными группировками.
ФОП используется в широком спектре исследований. Благодаря этому подходу в настоящее время практически не употребляются такие нестрогие термины, как адультус, субадультус и т.п., а выборки стали дифференцировать по функциональному признаку.
Несмотря на то, что ФОП обсуждался ранее [3, 11], кратко остановимся на его основе – типах онтогенетического развития. Для цикломорфных млекопитающих, к которым относится большинство видов мелких грызунов, характерны циклическое изменение большинства биологических характеристик с периодом, примерно равным году, и серийное размножение и перекрывание поколений при наличии двух альтернативных путей развития. Оба типа онтогенеза ярче всего проявляются в популяциях грызунов умеренной зоны северного полушария с арктической периферией, т.е. в резко континентальном климате.
Суть ФОП состоит в том, что при выделении внутрипопуляционных структурных единиц в качестве основного критерия принимается функциональное единство особей в группировках, соответствующих альтернативным типам роста и развития (два типа онтогенеза), роль которых в популяции различна. За основу их выделения принимается функциональный статус животных (функциональное состояние, связанное со спецификой роста, развития, репродуктивного состояния), а также последовательность его изменений во времени. Каждую группировку составляют особи, связанные функциональным единством в воспроизводстве популяции. Животные, характеризующиеся однофазным ростом (I тип онтогенеза – созревшие в год рождения сеголетки), выполняют функцию наращивания численности популяции за счет размножения в год рождения. Функция зверьков II типа онтогенеза – несозревающие в год рождения сеголетки (двухфазный рост, II тип, 1-я фаза) – переживание неблагоприятных условий и последующее возобновление популяции в очередной фазе своего развития – зимовавшие (II тип, 2-я фаза).
Животные, реализующие альтернативные типы онтогенетического развития и выполняющие в популяции разные функции, различаются по интенсивности метаболизма [14], продолжительности жизни и скорости старения [3, 15], радиорезистентности [16], значениям МФИ [1]. Одним из главных преимуществ ФОП является возможность работы с чистыми внутрипопуляционными группировками мелких млекопитающих, в результате чего существенно повышается точность исследований, а также становится логичным проводимый анализ. Показана детерминированность онтогенетических изменений возрастных [15] и биохимических [17] маркеров. Выявлены различия по показателям митотической активности [11], цитогенетической нестабильности [18], накоплению тяжелых металлов [19], а также в реакциях на экстремальные воздействия естественной [12, 13] и антропогенной [16] природы.
Цель нашей работы – продемонстрировать преимущества совместного использования ММФИ и ФОП для анализа феноменологии и причин гигантской изменчивости такого проблемного органа, как селезенка. Решались следующие задачи: 1) предложить способ упорядочивания огромного диапазона изменчивости селезенки; 2) проанализировать явление СМ на основе ММФИ и ФОП; 3) оценить зараженность животных природно-очаговыми инфекциями как причины СМ; 4) оценить возможность использования селезенки как морфофизиологического индикатора и экологического индикатора наличия в популяции повреждающего фактора.
Актуальность исследования гигантских селезенок (СМ) обусловлена повсеместным распространением этого явления в популяциях мелких млекопитающих. Функции селезенки многообразны: кроветворение, формирование иммунитета, депо кроветворных элементов, участие в стрессовых реакциях. Это указывает на реактивность и чувствительность органа к широкому спектру воздействий [20–22]. У взрослых особей Myodes glareolus индекс селезенки варьирует от 0.6 до 180‰, а масса – от 0.02 до 5.5 г., т.е. масса селезенки иногда превышает массу самого большого органа – печени. Вероятно, из-за высокой изменчивости селезенка не включена в число классических МФИ [1]. СМ пытались увязать с видовыми особенностями [23], загрязнениями [24, 25], воспалительными процессами, инфекциями и инвазиями [26–29]. Таким образом, опубликованные сведения о причинах СМ противоречивы, данные о физиологической полноценности особей со СМ отсутствуют, а механизм развития СМ не рассматривался. Все это, как нам представляется, обусловлено отсутствием надлежащей методологии.
МАТЕРИАЛ И МЕТОДЫ
Район исследований. Работа проведена на особо охраняемой территории Ильменского государственного заповедника (ИГЗ) (Челябинская область, Южный Урал), которая относится к полосе сосново-березовых лесов предлесостепья Южного Урала [30] и характеризуется отсутствием источников техногенного загрязнения. Участки отлова грызунов расположены в районе оз. Большой Ишкуль.
Объекты и массив данных. В районе обитают: лесные полевки – рыжая (Myodes glareolus Schreber, 1780), красная (M. rutilus Pallas, 1779), красно-серая (M. rufocanus Sundevall, 1847); серые полевки – темная (пашенная) (Microtus agrestis Linnaeus, 1761), обыкновенная (M. arvalis Pallas, 1779), экономка (M. oeconomus Pallas, 1776); малая лесная мышь (Sylvaemus uralensis Pallas, 1811).
Из массива данных Г. В. Оленева (1975–2018 гг.) использованы материалы, полученные в 1980–2014 гг. В 1997–2000 гг. и мае 2014 г. в сборах материала принимала участие студентка УрГУ Н.М. Салихова (Пасичник). Во время работы над диссертацией ею выполнена оцифровка и частичная обработка материалов по СМ, предоставленных Г.В. Оленевым. В работе использован 4171 экз. грызунов. Соответственно задачам и логике отдельных блоков работы из общего массива данных анализировали разные по объему выборки. Их размер отражен в таблицах. Рыжая полевка использована в качестве модельного вида, поскольку она наиболее многочисленна в сообществе грызунов. В разные годы ее доля в уловах составляет 60–80% [3].
Методы. Для реализации ФОП [3, 11] выделяли три физиологические функциональные группировки (ФФГ) животных: созревшие сеголетки (3 ФФГ); несозревающие сеголетки (2 ФФГ); зимовавшие особи (1 ФФГ). Принадлежность к ФФГ определяли по совокупности экстерьерных и интерьерных признаков: состоянию генеративной системы; возрастным маркерам (тимус, возрастные изменения зубов); учитывали также время отлова.
Животные отловлены методом безвозвратного изъятия давилками конструкции Геро на стационарных площадках. Ежегодно с мая по сентябрь, в отдельные годы – дополнительно в декабре и феврале, выполняли от трех до пяти туров отловов. Зверьки обработаны по ММФИ [1]. С 1975 по 2001 г. параллельно проводили индивидуальное мечение с повторными отловами (CMR-метод), что позволило отслеживать динамику возрастной структуры и функционального состояния населения. Возраст полевок определен по степени возрастных изменений зубов [15].
Для характеристики животных с селезенкой в состояниях норма и СМ использованы основные морфофизиологические индикаторы (МФИ): масса тела, относительные массы сердца, печени, надпочечника, почки, тимуса. В качестве интегрального показателя общего физиологического состояния животных применен индекс благополучия – гепато-супраренальный коэффициент (Г/С коэффициент) [31]. Анализ выполнен на уровне ФФГ с разделением особей на подвыборки с селезенкой в состояниях норма и СМ как двух качественно различных состояний.
Вирусологические и бактериологические исследования. В целях определения возбудителей природно-очаговых инфекций как возможной причины СМ кровь, легкие, печень, селезенку анализировали в аккредитованной лаборатории ФБУЗ “ЦГиЭ по Тюменской области” (г. Тюмень). Перечень определяемых возбудителей был составлен на основании опубликованных сведений о распространенности зоонозных инфекций в Уральском регионе. Использовано 39 особей, отловленных в мае и июле 2013–2014 гг. Лабораторные исследования проведены ПЦР-методом, методом микроскопии, а также с использованием реакции микроагглютинации.
Статистический анализ. Нормальность распределения переменных проверяли при помощи теста Колмогорова-Смирнова и W-критерия Шапиро-Уилка. Парные сравнения проведены с использованием t-критерия Стьюдента (в случае равенства дисперсий) и U-критерия Манна-Уитни (при неравенстве дисперсий). Неравенство дисперсий типично при работе с животными 2 ФФГ. Это связано с разным объемом подвыборок, когда число особей с нормальной селезенкой в 16 раз превышает число особей со СМ. Для анализа взаимосвязи между МФИ использован метод регрессионного моделирования, для выявления вклада МФИ в различия подвыборок (норма–СМ) – дискриминантный анализ. Для анализа данных о встречаемости возбудителей природно-очаговых инфекций использованы обобщенные линейные модели GLM.
РЕЗУЛЬТАТЫ
Упорядочивание диапазона изменчивости селезенки. Масса селезенки сильно изменчива и существенно различается у грызунов разных родов (табл. 1). Наибольшие размеры и частота встречаемости СМ характерны для лесных полевок. Доля M. glareolus со СМ всегда значительна – от 11 до 42%, а диапазон изменчивости индекса селезенки по сравнению с другими видами максимален. Поэтому дальнейший анализ проведен на примере рыжей полевки.
Таблица 1.
Вариабельность индекса селезенки и доля особей со СМ у грызунов разных таксонов (1980−2013 гг.)
| Вид | Индекс селезенки, ‰ | Доля особей со СМ, % | n | |
|---|---|---|---|---|
| min | max | |||
| Myodes glareolus | 0.6 | 169.2 | 23.0 | 2600 |
| M. rutilus | 1.6 | 124.0 | 26.0 | 140 |
| M. rufocanus | 1.9 | 45.2 | 58.0 | 22 |
| Sylvaemus uralensis | 0.9 | 21.0 | 1.6 | 1283 |
| Microtus agrestis | 1.2 | 13.4 | 4.0 | 99 |
| M. oeconomus | 1.2 | 15.1 | 7.0 | 15 |
| M. arvalis | 2.9 | 10.4 | 0.0 | 12 |
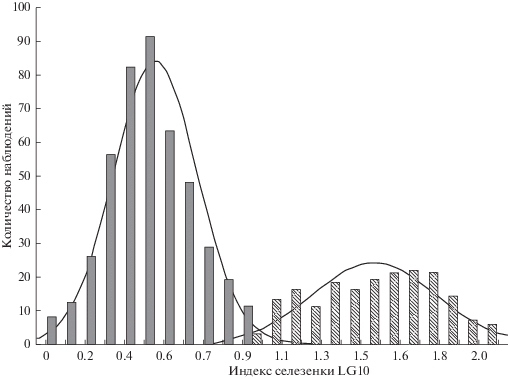
Распределение числа особей M. glareolus с разными значениями индекса селезенки показало сильную гетерогенность по этому признаку с двумя унимодальными распределениями (рис. 1). Граница состояния селезенки в состоянии нормы – до 10‰, в состоянии СМ – более 10‰ [22, 23].
Рис. 1.
Бимодальное распределение логарифма индекса селезенки у M. glareolus: норма (черные столбики) – СМ (заштрихованные столбики). Единица в логарифмической шкале соответствует 10‰ индекса селезенки.
Спленомегалия и признаки, используемые в ММФИ. Результаты сопряженного анализа массы тела с массой селезенки методом регрессионного моделирования показали наличие значимой положительной связи между этими показателями во всех ФФГ (рис. 2). Это подтверждают результаты, полученные как на объединенных по полу выборках, так и в выборках, состоящих только из самцов (табл. 2).
Рис. 2.
Морфофизиологические индикаторы и Г/С коэффициент ($\bar {X}$ ± SD) в подвыборках животных норма (n) – СМ у особей разных ФФГ (кружком показаны значения, значимо различающиеся внутри ФФГ).
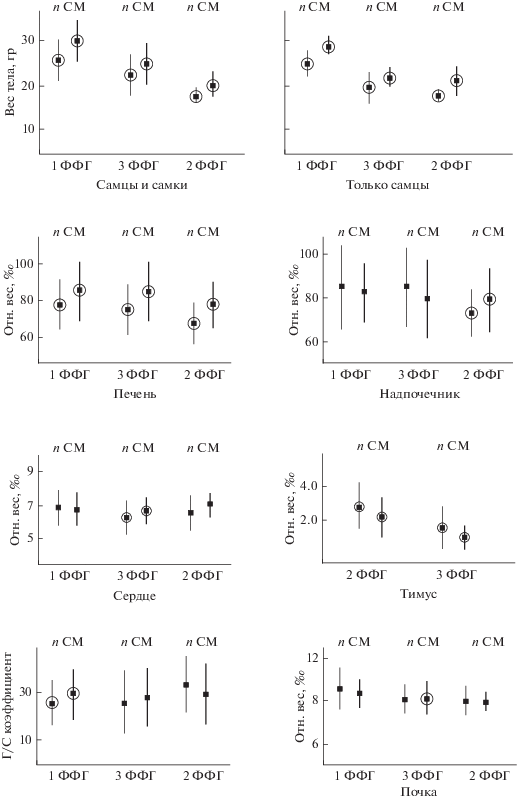
Таблица 2.
Связь между логарифмом индекса селезенки и массой тела (коэффициенты корреляции Пирсона и регрессионные коэффициенты: y = kx + b) в группах 1 ФФГ и 3 ФФГ (подвыборка – самцы) (1981–1983, 1997–2000 гг.)
| ФФГ | r (коэфф. корреляции) |
k (угловой коэффициент) |
t | p | b (свободный член) |
t | p |
|---|---|---|---|---|---|---|---|
| 1 | 0.59 | 0.10 | 7.79 (115)* | <0.001 | –1.64 | –4.48 (115)* | <0.001 |
| 3 | 0.54 | 0.07 | 4.72 (54) | <0.001 | –0.55 | –1.70 (54) | 0.094 |
Сходные результаты получены при анализе индекса печени, который используется как показатель обеспеченности кормами, индикатор напряженности энергетического баланса. Увеличение индекса печени, связанное с упитанностью зверьков, свидетельствует о накоплении питательных веществ [1, 32]. Установлена значимо более высокая масса печени у животных со СМ во всех ФФГ. Существует линейная взаимосвязь индексов селезенки и печени у полевок размножающихся группировок (табл. 3). Это позволяет предположить гепатоспленомегалию – одновременное увеличение размеров печени и селезенки. Эти органы анатомически взаимосвязаны, имеют общую иннервацию и пути лимфооттока.
Таблица 3.
Связь между логарифмом индекса селезенки и логарифмом индекса печени (коэффициенты корреляции Пирсона и регрессионные коэффициенты: y = kx + b) в группах 1 ФФГ и 3 ФФГ (подвыборка – самцы) (1981–1983, 1997–2000 гг.)
| ФФГ | r (коэфф. корреляции) |
k (угловой коэффициент) |
t | p | b (свободный член) |
t | p |
|---|---|---|---|---|---|---|---|
| 1 | 0.30 | 0.04 | 3.41 (115)* | <0.001 | 1.84 | 130.9 (115)* | <0.001 |
| 3 | 0.66 | 0.16 | 6.48 (54) | <0.001 | 3.02 | 115.08 (54) | <0.001 |
Согласно ММФИ [1, 32], индекс надпочечника индицирует степень напряженности обмена веществ. Наибольшие значения этого показателя характерны для животных размножающихся группировок (1 и 3 ФФГ), особенно самок. Установлено отсутствие различий в подвыборках норма-СМ у особей 1 и 3 ФФГ (см. рис. 2). У сеголеток 2 ФФГ со СМ индекс надпочечника значимо больше, чем у особей с нормальной селезенкой.
Индекс сердца – индикатор двигательной активности и энергетических затрат [1]. Изменение условий или образа жизни, связанное с повышением энергетических затрат, а также биологические особенности (рост, размножение и др.) приводят к увеличению размеров сердца и интенсификации его функций [1, 32]. Более высокий индекс сердца установлен у сеголеток 3 ФФГ со СМ (см. рис. 2), а у зверьков 1 и 2 ФФГ различий не выявлено.
Индекс почки, как и индекс сердца, повышен у сеголеток 3 ФФГ со СМ (см. рис. 2). Почки чувствительны к изменению обмена веществ, и интенсификация метаболизма сопровождается увеличением их индекса [1, 32]. Повышенные значения индексов почки и сердца у сеголеток 3 ФФГ со СМ отражают высокий уровень метаболизма.
Тимус – индикатор возраста в начальный период онтогенеза. Прямая зависимость между относительной массой тимуса и жизнеспособностью молодых животных позволяет считать индекс тимуса показателем интенсивности роста молодняка [1, 5]. У сеголеток 3 ФФГ после созревания тимус практически полностью инволюирует за 1–2 мес.; при росте сеголеток 2 ФФГ масса тимуса также уменьшается; у зимовавших тимус отсутствует [11]. У сеголеток разного функционального статуса (2 и 3 ФФГ) со СМ индекс тимуса ниже, чем в норме (см. рис. 2). С одной стороны, это может быть обусловлено большей массой тела животных со СМ, из-за чего происходит кажущееся снижение рассчитанных значений всех индексов. С другой стороны, животные со СМ в каждой ФФГ в среднем старше, чем с селезенкой в нормальном состоянии; соответственно у более старых особей более выражена инволюция тимуса. Не исключено, что снижение индекса тимуса у особей со СМ может быть связано и с иммунным статусом животных.
Г/С коэффициент – это индикатор интенсивности метаболических и мобилизационных процессов, а также обеспеченности энергетическими ресурсами. Его величина прямо пропорциональна уровню энергетического потенциала организма и обратно пропорциональна энергонапряженности регуляторных и компенсаторных механизмов [31]. Высокие значения Г/С коэффициента установлены у зимовавших (1 ФФГ) со СМ, а различия между подвыборками сеголеток (2 и 3 ФФГ) отсутствуют (см. рис. 2). Следовательно, животные с нормальной селезенкой и СМ характеризуются одинаковой резистентностью и энергетическим потенциалом.
Оценка влияния вклада МФИ в дискриминацию животных с селезенкой в состояниях норма и СМ показала значимость модели для всех ФФГ (табл. 4).
Таблица 4.
Статистики для моделей дискриминантной функции в ФФГ (1981–1983, 1997–2000 гг.)
| ФФГ | Собственные числа (Eigenval) | Лямбда Уилкса (λ) | F | p | χ2 | p |
|---|---|---|---|---|---|---|
| 1 | 0.3134 | 0.761 | 8.83 (6, 169)* | <0.001 | 46.61 (6)* | <0.001 |
| 2 | 0.2147 | 0.823 | 7.76 (7, 253)* | <0.001 | 49.69 (7)* | <0.001 |
| 3 | 0.3876 | 0.721 | 5.24 (7, 95)* | <0.001 | 31.88 (7)* | <0.001 |
Наибольший вклад в дискриминацию подвыборок особей всех ФФГ с селезенкой в состояниях норма и СМ вносят масса тела, индекс печени и связанный с ними Г/С коэффициент (табл. 5).
Таблица 5.
Стандартизованные коэффициенты моделей и факторная структура признаков в ФФГ
| Признаки (переменные) | Стандартизованные коэффициенты | Факторная структура | ||||
|---|---|---|---|---|---|---|
| 1 ФФГ | 2 ФФГ | 3 ФФГ | 1 ФФГ | 2 ФФГ | 3 ФФГ | |
| Масса, г | –0.99 | –0.85 | 0.81 | –0.81* | –0.70 | 0.44 |
| Сердце (индекс), ‰ | –0.45 | –0.08 | 0.68 | 0.07 | –0.02 | 0.40 |
| Печень (индекс), ‰ | –0.20 | –0.47 | 0.68 | –0.46 | –0.39 | 0.53 |
| Почка (индекс), ‰ | 0.17 | 0.09 | –0.01 | 0.22 | 0.06 | –0.09 |
| Надпочечник (индекс), ‰ | –0.28 | –0.52 | –0.11 | 0.10 | –0.20 | –0.01 |
| Тимус (индекс), ‰ | – | 0.31 | –0.04 | – | 0.17 | –0.07 |
| Г/С коэффициент | –0.42 | –0.46 | 0.06 | –0.31 | –0.13 | 0.19 |
| Относительное содержание общей дисперсии (Cum. Prop) | 1.0 | 1.0 | 1.0 | – | – | – |
Сезонная динамика индекса селезенки. В состоянии нормы для особей 3 ФФГ характерен высокий уровень индекса в период репродукции, после чего отразмножавшиеся животные погибают. У сеголеток 2 ФФГ на протяжении вегетационного периода индекс селезенки меняется незначительно, выражена осенне-зимняя депрессия. После перезимовки (переход в 1 ФФГ) относительная масса селезенки в связи с созреванием закономерно увеличивается. По окончании размножения заметно некоторое снижение индекса, но к началу зимы размножавшиеся животные погибают [11]. Проследить полную сезонную динамику индекса селезенки в состоянии СМ невозможно из-за отсутствия особей 2 ФФГ со СМ в зимний период.
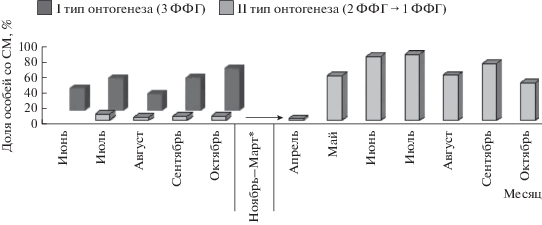
Наиболее информативен анализ сезонных изменений доли особей со СМ в ФФГ (рис. 3). У сеголеток 3 ФФГ СМ регистрируется уже у особей первых когорт. Доля таких особей изменяется от 30% в июне до 56% к концу жизненного цикла. Доля особей 2 ФФГ со СМ невелика (10%). После зимовки (1 ФФГ) в популяции вновь появляются особи со СМ, в апрельских выборках они единичны, а массовая встречаемость СМ (60%) наблюдается уже в начале мая. Синхронно с весенним созреванием индекс селезенки достигает высоких (более 100‰) значений. Доля таких животных максимальна в июле (более 80%) и остается на высоком уровне до окончания жизненного цикла.
Рис. 3.
Сезонная динамика доли особей со СМ у животных разных типов онтогенеза (*– с ноября по март животные со СМ отсутствуют).
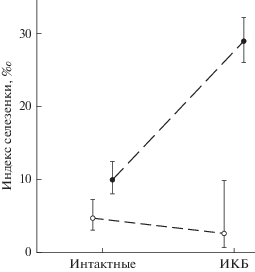
СМ и зараженность природно-очаговыми инфекциями. В популяции рыжей полевки доля населения, инфицированного возбудителем ГЛПС, составляет 27%, в то время как уровень зараженности ИКБ – выше более чем в 2 раза (59%). Частота встречаемости моноцитарного эрлихиоза человека не превышает 5%. Возбудители клещевого энцефалита, бабезиоза, туляремии и лептоспироза не обнаружены.
Эффект инфицирования ИКБ на индекс селезенки рыжих полевок разного функционального статуса оценили в ходе статистического моделирования (табл. 6). У животных, зараженных возбудителем ИКБ, шанс развития СМ в среднем в 2.3 (95% ДИ 1.02–5.0) раза выше, чем у интактных животных. У зимовавших полевок вероятность развития СМ (в среднем) в 2.9 (95% ДИ 1.1–7.8) раза выше, а у созревших сеголеток (3 ФФГ) – в 3.3 (95% ДИ 1.06–10.42) раза выше, чем у несозревающих (2 ФФГ). Значимость взаимодействия факторов индекс селезенки и зараженность возбудителем ИКБ иллюстрирует рис. 4. Сопряженность в изученной популяции СМ с инфицированностью полевок свидетельствует в пользу предположения об инфекционной природе СМ.
Таблица 6.
Оценки параметров GLM (в предположении Гамма распределения для случайной компоненты и лог-преобразования) для индекса селезенки se = exp(ΣbiXi)
| Предикторы | b | se | χ2 Вальда | p≤ | exp | 95% ДИ (CI) | |
|---|---|---|---|---|---|---|---|
| b0* | 1.35 | 0.43 | 9.76 | 0.001 | 3.9 | 1.66 | 9.06 |
| 1 ФФГ | 1.06 | 0.51 | 4.41 | 0.04 | 2.9 | 1.07 | 7.82 |
| 3 ФФГ | 1.20 | 0.58 | 4.25 | 0.04 | 3.3 | 1.06 | 10.42 |
| ИКБ | 0.82 | 0.40 | 4.08 | 0.04 | 2.3 | 1.02 | 5.01 |
ОБСУЖДЕНИЕ
Ключевыми моментами нашего анализа были следующие: 1) строгое отнесение животных к внутрипопуляционным функциональным группировкам [23]; 2) раздельный анализ индекса селезенки в состояниях норма и СМ. Последнее обеспечило принципиальную возможность изучения этого явления. Необходимость разграничения значений индекса селезенки объясняется ее необычно высокой вариабельностью. Общий диапазон варьирования относительной массы селезенки составляет три порядка величин. Ранее это было препятствием для корректного анализа.
Диапазоны значений индекса селезенки различаются у представителей Myodes, Microtus и Sylvaemus. Больше всего особей со СМ выявлено у видов р. Myodes, меньше всего – у видов р. Microtus. Поэтому имеются основания для утверждения о родоспецифичности проявления СМ в районе наших исследований. Это не исключает возможность обнаружения СМ у мелких млекопитающих разных таксонов в других регионах [23, 24, 33]. Интересно, что связь между проявлением СМ и уровнем загрязнения техногенными поллютантами не выявлена [24]. Вместе с тем подтверждена [24] установленная нами [23] пороговая граница нормы индекса селезенки в 10‰. Мы предполагали, что изучение СМ в разных систематических группах потребует выявления специфичных пороговых значений для разграничения нормы и СМ. Действительно, у насекомоядных эта величина в 2.5 раза выше, чем у грызунов [24]. У мышеобразных в темнохвойных лесах Енисейского кряжа в качестве пороговой величины использовано значение 5‰ [29]. В любом случае при исследовании СМ принципиальным является разделение диапазона изменчивости относительной массы селезенки, что позволяет изучать СМ сопряженно с другими характеристиками.
Сезонные изменения индекса селезенки в состоянии нормы подчиняются закономерностям, общим для большинства МФИ [1]. Сезонная динамика индекса селезенки в состоянии СМ не имеет отчетливых закономерностей. Общий момент для сезонных изменений индекса селезенки в состояниях норма и СМ состоит в том, что наибольшие медианные значения наблюдаются в период репродукции с их снижением осенью. Наиболее информативным оказалось сезонное изменение доли особей со СМ в ФФГ. Максимум животных со СМ наблюдается в размножающихся группировках, особенно в группе зимовавших особей. Последнее подтверждается результатами анализа экологических факторов риска развития СМ: наиболее сильный эффект связан с фактором функционального состояния [34]. Шансы развития СМ у репродуктивно активных животных (1 и 3 ФФГ) в 7.4 раза выше, чем у несозревающих сеголеток (2 ФФГ). Связанный с функциональным статусом календарный возраст также является важным фактором риска, поскольку к концу жизненного цикла особи вероятность развития СМ возрастает более чем в 10 раз.
Считается, что основная причина развития СМ – инфекции [26–29, 35]. В соответствии с нашими результатами ИКБ и ГЛПС значительно распространены среди населения рыжих полевок. Более 80% особей со СМ заражены тем или иным возбудителем либо имеет место микст-инфекция. Обращает на себя внимание выявление возбудителей ИКБ у некоторых размножающихся зверьков с нормальной селезенкой. Возможно, это объясняется тем, что необходимо какое-то время с момента заражения для того, чтобы развилась физиологическая реакция в виде увеличения органа до состояния СМ. Здесь важно отметить, что для идентификации возбудителей использован один из надежных методов – ПЦР-анализ, позволяющий детектировать наличие возбудителя на начальном этапе.
Следует отметить различие путей заражения выявленными природно-очаговыми инфекциями: ИКБ переносится иксодовыми клещами, а основной путь заражения ГЛПС – респираторный. Можно предположить, что в случаях микст-инфекций имеет место снижение иммунного статуса организма вследствие заражения одним из возбудителей, что повышает вероятность инфицирования другим.
Сопоставление данных о взаимосвязи зараженности особей с наличием СМ показывает, что животные с индексом селезенки, превышающим 20‰, всегда были инфицированы возбудителем ИКБ. Наши данные свидетельствуют об ассоциированности СМ с наличием возбудителей ИКБ. Это позволяет считать СМ диагностическим признаком зараженности ИКБ в районе исследований. Однако нельзя исключить влияние на развитие СМ и таких возбудителей, как бартонеллез, риккетсиозы, бруцеллез, идентифицировать которые у нас не было возможности.
Вероятно, СМ развивается вследствие заражения возбудителями природно-очаговых инфекций. Собственно заражение наступает в результате укусов инфицированными клещами; возможен также трансплацентарный путь передачи инфекционного начала [28]. Увеличение селезенки происходит по мере нарастания уровня паразитемии вследствие интенсификации ее функций, изменения гистологической и морфологической структуры [29, 33]. Вероятно, животные II типа онтогенеза инфицируются на первой фазе развития (2 ФФГ), становясь носителями инфекции. Низкий уровень обмена, состояние, образно названное С.С. Шварцем “законсервированной молодостью”, тормозит размножение возбудителя и развитие СМ. Интенсификация метаболизма у зимовавших зверьков весной запускает механизм физиологического ответа на заражение в виде массового развития СМ. Уже в майских выборках доля зверьков со СМ составляет 37%, со временем возрастая до 80%, т.е. проявляется накопительный эффект. Кроме того, сезонный пик увеличения заболеваемости может быть связан с иммуносупрессивным эффектом половых гормонов, продукция которых значительно увеличивается при половом созревании [36].
Учитывая масштабы явления и высокую долю животных с гигантской селезенкой, возникает вопрос о физиологической и репродуктивной полноценности особей со СМ. Различаются ли зверьки со СМ и селезенкой в нормальном состоянии по продолжительности жизни, морфофизиологическим показателям, успешности воспроизводства? В настоящей работе впервые изучено морфофизиологическое своеобразие животных разных структурно-функциональных единиц (ФФГ) с нормальной селезенкой и СМ. Наши данные свидетельствуют о существовании таких различий по ряду МФИ. Во всех ФФГ у особей со СМ больше масса тела и относительная масса печени, а у сеголеток разного функционального статуса (2 и 3 ФФГ) – меньше относительная масса тимуса. Особи с селезенкой в состояниях норма и СМ обладают высокой резистентностью и адекватным энергетическим потенциалом, о чем также свидетельствуют сходные значения индекса благополучия. Важно, что СМ не оказывает значимого влияния на продолжительность жизни животных, оцененную по возрастным маркерам [15], и их репродуктивную функцию. Особи со СМ активно участвуют в воспроизводстве популяции; плодовитость особей с селезенкой в состоянии СМ и норма не различается [22, 34].
Таким образом, можно сделать заключение об адаптации популяции рыжей полевки к длительному действию инфекционного фактора, вызывающего СМ, и предположить, что адаптация сформировалась в процессе коэволюции в системе “паразит–хозяин”. Известно, что наибольшая интенсивность репродукции возбудителя характерна для организмов с высоким уровнем обмена веществ. Это подтверждают наши результаты: максимум особей со СМ, а также ее взаимосвязь с инфицированностью регистрируется у репродуктивно активных особей 1 и 3 ФФГ. Доля особей со СМ для 2 ФФГ невелика, но они постоянно присутствуют в популяции, за исключением зимнего периода. Этот интересный факт можно интерпретировать как “покоящуюся” стадию возбудителя. Особи 2ФФГ наиболее устойчивы к неблагоприятным естественным и техногенным воздействиям. Впечатляет их высокая радиорезистентность, связанная с минимизацией обмена веществ [16]. Документально подтверждены также зимнее усиление иммунитета у грызунов из природных популяций и роль сезонной изменчивости состояния иммунной системы грызунов в циркуляции зоонозных инфекций [37].
ЗАКЛЮЧЕНИЕ
Мы рассмотрели возможность использования показателя состояния селезенки и феномен СМ с позиций ММФИ, проанализировав соответствие селезенки критериям, предъявляемым к органам-индикаторам в ММФИ. Общие критерии органов-индикаторов: 1) жизненно необходимы; 2) есть однозначное представление, индикаторами чего являются; 3) четко реагируют на изменения окружающей среды, обладая достаточной реактивностью; 4) отражают физиологическое состояние животных, выполняя конкретные функции; 5) имеющаяся изменчивость позволяет проводить статистическую обработку; 6) позволяют получать информацию в полевых условиях, не требуя сложного оборудования; 7) допускают обследование массового материала.
Селезенка – орган, хирургическое удаление которого не приводит к гибели животных. Нет однозначного представления, индикатором чего является селезенка. Она выполняет многообразные функции, характеризуется высокой реактивностью, но не ясно, на что реагирует. У селезенки гигантская изменчивость, но разделение на диапазоны нормальной изменчивости и патологического состояния позволяет проводить корректный статистический анализ. Информацию о состоянии селезенки можно массово получать без сложного оборудования.
Таким образом, по четырем критериям из семи селезенка не соответствует критериям морфофизиологического индикатора. Однако благодаря высокой чувствительности к неблагоприятным воздействиям и простоте обнаружения СМ селезенку можно считать индикатором экологического неблагополучия. СМ индицирует влияние повреждающих факторов, вероятно, различных в разных регионах и популяциях. Наши материалы позволяют рекомендовать СМ у мелких млекопитающих в качестве маркера зараженности природно-очаговыми инфекциями. Обнаружение СМ – это основание для настороженности в эпидемиологическом отношении. Поэтому мы рекомендуем наши результаты для использования органами Роспотребнадзора при целевом обследовании территорий зоологами санэпидстанций, проводящими учеты численности клещей и их прокормителей в природных и антропогенных стациях, при составлении прогнозов и выработке стратегий оптимизации эпидемических рисков для человека.
Прошло 50 лет после выхода книги “Метод морфофизиологических индикаторов в экологии наземных позвоночных”. Этот метод остается надежным, простым и эффективным инструментом популяционной экологии. В комплексе с другими, более технологичными методами ММФИ приложим для широкого круга популяционных исследований, в том числе при оценке последствий разных антропогенных вмешательств и реакции популяций на средовые пессимумы. Хорошие результаты дает применение ММФИ для дискриминации разных явлений, особенно в комплексе с функционально-онтогенетическим подходом [2]. В частности, совместное использование этих методов позволяет успешно решать даже нетрадиционные экологические задачи, пример чего реализован в настоящей работе. Мы показали, что МФФИ и ФОП дополняют друг друга, совместное их использование позволяет успешно решать даже нетрадиционные задачи, связанные с анализом проблемных органов и перспективно для решения других экологических задач.
Работа выполнена в рамках госзадания Института экологии растений и животных УрО РАН, а также частично поддержана Комплексной программой УрО РАН (проект № 18-4-4-28).
Список литературы
Шварц С.С., Смирнов В.С., Добринский Л.Н. Метод морфофизиологических индикаторов в экологии наземных позвоночных. Свердловск, 1968. 378 с.
Васильев А.Г. Эпигенетические основы фенетики: на пути к популяционной мерономии. Екатеринбург: Академкнига, 2005. 640 с.
Оленев Г.В. Альтернативные типы онтогенеза цикломорфных грызунов и их роль в популяционной динамике (экологический анализ) // Экология. 2002. № 5. С. 341–350. [Olenev G. Alternative types of ontogeny in cyclomorphic rodents and their role in population dynamics: an ecological analysis // Rus. J. Ecology. 2002. V. 33. № 5. P. 321–330.]
Stieve H. Untersuchungen uber die Wechselbeziehungen zwischen Gesamtkorper und Keimdrusen. Mitt 2 // Arch. mikrosk. Anat. Entwicklungmech. 1923. Bd. 99. S. 2. P. 390–560.
Оленев В.Г. Сезонные изменения некоторых морфофизиологических признаков грызунов в связи с динамикой возрастной структуры популяций: Автореф. дис. … канд. биол. наук. Свердловск, 1964. 26 с.
Шварц С.С., Ищенко В.Г., Овчинникова Н.А. и др. Чередование поколений и продолжительность жизни у грызунов // Журн. общ. биол. 1964. Т. 25. № 6. С. 417–431.
Покровский А.В. Сезонные колебания веса тела у полевок // Тр. Ин-та биологии Урал. фил. АН СССР. Свердловск, 1967. Вып. 51. С. 95–106.
Амстиславская Т.С. Митотическая активность покровного эпителия у сезонных генераций полевок р. Clethrionomys: Автореф. дис. … канд. биол. наук. Свердловск, 1975. 24 с.
Gliwicz J. Why do some young voles growing? // Polish Ecological Studies. 1995. V. 20. № 3-4. P. 335–341.
Шилов И.А. Биосфера, уровни организации жизни и проблемы экологии // Экология. 1981. № 1. С. 5–11.
Оленев Г.В. Функционально-онтогенетический подход в изучении популяций цикломорфных млекопитающих: Автореф. дис. … докт. биол. наук. Екатеринбург, 2004. 47 с.
Оленев Г.В. Популяционные механизмы приспособлений к экстремальным факторам среды (на примере рыжей полевки) // Журн. общ. биол. 1981. № 4. С. 506–511.
Колчева Н.Е., Оленев Г.В. Сопряженность популяционных изменений у лесной мыши и рыжей полевки в лесных биогеоценозах Южного Урала // Экология. 1991. № 1. С. 43–52.
Новиков Е.А., Кондратюк Е.Ю., Петровский Д.В. Влияние типа онтогенеза на биоэнергетические показатели красной полевки (Myodes rytilus Pall.) из горно-таежной популяции юга Западной Сибири // Экология. 2015. № 5. С. 387–391. doi 10.7868/ S0367059715050157
Оленев Г.В. Определение возраста цикломорфных грызунов, функционально-онтогенетическая детерминированность, экологические аспекты // Экология. 2009. № 2. С. 103–115. [Olenev G. Determining the age of cyclomorphic rodents: Functional-ontogenetic determination, ecological aspects // Rus. J. of Ecology. 2009. V. 40. № 2. P. 93–104.]
Григоркина Е.Б., Оленев Г.В. Роль поливариантности развития животных в оценке последствий радиационного воздействия // Радиац. биология. Радиоэкология. 2015. Т. 55. № 1. С. 16–21. doi 10.7868/S086980311501004X
Гуляева И.П., Оленев Г.В. Об изменении электрофоретической картины трансферринов сыворотки крови рыжей полевки в зависимости от физиологического состояния животных // Экология. 1979. № 6. С. 47–52.
Ракитин С.Б. Цитогенетическая нестабильность у рыжей полевки из разных структурно-функциональных группировок // Биосфера и человечество. Екатеринбург, 2000. С. 219–224.
Безель В.С., Оленев Г.В. Внутрипопуляционная структура грызунов в условиях техногенного загрязнения среды обитания // Экология. 1989. № 3. С. 40–45.
Gilbert C.W. A double minus log transformation of mortality probabilities // Int. J. Radiat. Biol. 1974. V. 25. P. 633–634.
Inra C.N., Zhou B.O., Acar M. et al. A perisinusoidal niche for extramedullary haematopoiesis in the spleen // Nature. 2015. V. 527. № 26. P. 466–470.
Салихова Н.М. Экологический анализ феномена спленомегалии в популяциях цикломорфных млекопитающих: Автореф. дис. … канд. биол. наук. Екатеринбург, 2015. 20 с.
Оленев Г.В., Пасичник Н.М. (Салихова Н.М.) Экологический анализ феномена гипертрофии селезенки с учетом типов онтогенеза цикломорфных грызунов // Экология. 2003. № 3. С. 208–219. [Olenev G., Pasichnik N. Ecological analysis of spleen hypertrophy in cyclomorphic rodents taking into account the type of ontogeny // Rus. J. Ecology. 2003. V. 34. № 3. P. 188–197.]
Давыдова Ю.А., Мухачева С.В., Кшнясев И.А. Спленомегалия у мелких млекопитающих: факторы риска // Экология. 2012. № 6. С. 446–456. doi 10.1134/S1067413612060045
Гагарская (Игнатова) Н.К., Чернова Е.Н. Мониторинг элементного состава листьев березы, дуба, лещины и состояния населения мелких млекопитающих в техногеосистеме // Вестник КрасГАУ. 2013. № 1. С. 74–79.
Wiger R. Hematological, splenic and adrenal changes associated with natural and experimental infections of Trypanosoma lemmi in the Norwegian lemming, Lemmus lemmus (L.) // Folia Parasitologica (Praha). 1978. № 25. P. 295–230.
Yurdakul P., Dalton J., Beattie L. et al. Compartment-specific Remodeling of splenic micro-architecture during experimental visceral leishmaniasis // The Americ. J. of Pathology. 2011. V. 179. № 1. P. 23–29.
Коренберг Э.И., Помелова В.Г., Осина Н.С. Природно-очаговые инфекции, передающиеся иксодовыми клещами. М., 2013. 464 с.
Екимов Е. В., Шишикин А. С., Борисов А. Н. О причинах массовой спленомегалии в природных популяциях полевок // Экология. 2015. № 2 С. 149–155. doi 10.7868/S036705971502003
Горчаковский П.Л. Растительность Урала // Урал и Приуралье. М., 1968. С. 211–262.
Пузанский В.Н. О некоторых критериях оценки жизнеспособности популяций водяной полевки // Экология. 1974. № 2. С. 81–83.
Ивантер Э.В., Ивантер Т.В., Туманов И.А. Адаптивные особенности мелких млекопитающих. Л.: Наука, 1985. 316 с.
Давыдова Ю.А., Мухачева С.В., Кшнясев И.А. и др. Феномен гипертрофии селезенки мелких млекопитающих: экологический и гистологический анализ // Докл. РАН. 2011. Т. 440. №. 3 С. 414–416.
Оленев Г.В., Салихова Н.М., Григоркина Е.Б., Колчева Н.Е. Феномен спленомегалии в популяциях цикломорфных грызунов: проявление, экологические факторы риска, причины // Вестн. ТвГУ. Сер. “Биология и экология”. 2014. № 4. С. 160–168.
Большаков В.Н., Беляев П.А., Попова Э.Ф. Об эпидемиологическом значении лесных полевок в природном очаге геморрагической лихорадки с почечным синдромом на Урале // Тр. Ин-та полиомиелита и вирусных энцефалитов. М., 1965. Т. 7. С. 101–106.
Moshkin M., Gerlinskaya L., Evsikov V. The role of the immune system in behavior strategies of reproduction // J. Reprod. Dev. 2000. V. 46. № 6. P. 341–365.
Лохмиллер Р.Л., Мошкин М.П. Экологические факторы и адаптивная значимость изменчивости иммунитета мелких млекопитающих // Сиб. экол. журн. 1999. № 1. С. 37–58.
Дополнительные материалы отсутствуют.