Экология, 2019, № 2, стр. 101-111
Роль популяционного структурирования в формировании кариотипического разнообразия обыкновенной бурозубки Sorex araneus (Lipotyphla, Mammalia)
Н. А. Щипанов a, С. В. Павлова a, *
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский пр., 33, Россия
* E-mail: swpavlova@mail.ru
Поступила в редакцию 07.05.2018
После доработки 09.07.2018
Принята к публикации 04.07.2018
Аннотация
В обзоре рассматриваются известные факты кариотипического, морфологического и генетического структурирования населения у обыкновенной бурозубки Sorex araneus (Lipotyphla, Mammalia). Мы пытаемся объяснить некоторые неясные и противоречивые аспекты такого структурирования на основе популяционного подхода. При этом подразделение вида на десятки (более 76) парапатричных хромосомных рас не соответствует морфологическому и генетическому структурированию вида. В местах контакта ареалов рас образуются хромосомные гибридные зоны. Частота межрасовых гибридов F1 в природе невелика, однако мы показали, что в неволе расы скрещиваются довольно легко. Этот вид подразделен на относительно небольшие популяции, характеризующиеся единством функционирования, которое обеспечивается преимущественным расселением особей каждой из популяций в пределах своего популяционного пространства. Хотим также подчеркнуть, что основные положения, изложенные С.С. Шварцем в его концептуальной монографии “Эволюционная экология животных”, сохраняют актуальность и в настоящее время.
Возникновение парапатричных форм обычно связывают с послеледниковой реколонизацией территории особями, сохранившимися в изолированных рефугиумах [1]. У обыкновенной бурозубки число таких форм явно превышает количество возможных рефугиумов – вид образует не менее 76 парапатричных хромосомных рас, а их распределение в пространстве часто не соответствует расположению возможных физических или экологических преград [2]. Распространение рас и межрасовые границы не связаны ни с климатическими и экологическими характеристиками занимаемых ими ареалов, ни с возможными физическими преградами. Для объяснения возникшего на послеледниковом пространстве разнообразия предложена модель, основанная на “плотностно-зависимых” процессах. Предполагается, что в ходе быстрого заселения пространства форма, оказавшаяся на периферии, на фронте расселения, имеет больший репродуктивный потенциал и соответственно больше шансов для заселения свободной площади. Форма попадает на “волну выноса” случайно и может не иметь селективного преимущества. Вселение вторичных иммигрантов блокируется резидентами на уже заселенной территории по принципу “конкурентного исключения” [3]. Модель универсально пригодна для объяснения образования парапатричных форм в пространственных масштабах от “микробного секторирования” – образования секторов, занятых разными микробными штаммами, до заселения послеледникового пространства, последовательно возникающих океанических островов и расселения человека [3].
Распространение хромосомных рас хорошо соответствует быстрой реколонизации современного ареала вида из двух рефугиумов – приледникового (прибалтийского) и прибайкальского [2]. Однако в случае бурозубки предложенная модель может быть реализована, если оперировать не отдельной особью, а популяцией с фиксированным кариотипом. Существуют противоречия в оценке потока генов через хромосомные гибридные зоны. Если исходить из распределения кариотипов, то этот поток ограничен, и можно предполагать начало хромосомного видообразования [4]. Молекулярные маркеры ограничений потока не подтверждают [5]. Морфологическая и генетическая (“молекулярная”) изменчивости не связанны с кариотипическим структурированием населения. Мы полагаем, что представление о популяционном структурировании вида может значительно способствовать пониманию эволюционных процессов у этого вида.
Российская экологическая школа формировалась с учетом ясного понимания популяции как единицы населения, в которой происходят специфические для этого уровня организации живой материи процессы [6–8]. Этот подход ярко отражен в работах С.С. Шварца, который, в частности, писал: “… экология – наука о популяциях <…> … изучение взаимосвязей и приспособительных реакций с условиями их существования должно стать основной задачей экологии <…> …популяция … – определенная организация (структурное целое) особей, вне которого они существовать не могут [6, с. 5, 12]. К сожалению, приходится констатировать, что интерес российских ученых к исследованию особенностей взаимодействий, свойственных популяционному уровню, в конце 1990-х годов утратился, а популяция понимается как случайная выборка с некоторого общего пространства, характеризующегося определенными свойствами. При таком анализе наибольшее значение приобретает статистический аппарат, позволяющий говорить о достоверности различий. Хотя такой подход, несомненно, достаточен для выявления как самих различий, так и трендов изменчивости, он не предполагает вскрытия глубинных механизмов процессов, обеспечивающих эти различия и тренды.
В настоящем обзоре мы рассмотрим известные факты структурирования населения у S. araneus и попробуем объяснить некоторые неясные и противоречивые результаты на основе популяционного подхода. Цитаты из концептуальной монографии С.С. Шварца [8] использованы нами в качестве эпиграфов к соответствующим разделам.
КАРИОТИПИЧЕСКОЕ СТРУКТУРИРОВАНИЕ ВИДА S. ARANEUS. ХРОМОСОМНЫЕ РАСЫ
Связь этих процессов (внутривидовая дифференциация и видообразование) несомненна и ее установление можно смело отнести к числу важнейших завоеваний биологии [8, с. 10]
Дивергенция в роде Sorex почти не проявляется в морфологии. Сравнительно высокая консервативность морфологических характеристик, по-видимому, связана с особенностями экологической ниши. Основу питания бурозубок составляют беспозвоночные животные, причем особенностью большинства жертв является их “живучесть”. Это определило основные особенности строения краниального скелета, которые обеспечивают возможность эффективного захвата и поедания добычи и соответственно довольно слабые морфологические различия в форме краниального скелета [9]. Основная изменчивость связана с различием в размерах зверьков, что позволяет им оптимизировать энергетические затраты при добыче жертв соответствующего размера и определяет возможность существования видов в трех основных размерных нишах [10].
Вместе с тем бурозубки характеризуются высокими темпами хромосомной эволюции [11] с тенденцией к уменьшению числа хромосом в диплоидном наборе [12, 13]. Отделение видов от общего ствола может быть прослежено по изменениям кариотипа и позволяет построить кариологическую филогению. Такая реконструкция известна для бурозубок в кариотипических группах: “minutus” и “araneus” [14]. В эволюции кариотипа бурозубок наиболее значимы хромосомные перестройки: слияние предковых элементов (fusion), центромерная и нецентромерная диссоциации (fission) и центромерный сдвиг (shift). Предковая форма группы “araneus” возникла 3–2.5 млн лет назад, а собственно Sorex araneus появилась сравнительно недавно, около 200 тыс. лет назад [15, 16].
В группе “araneus” изменения в кариотипе происходят в основном за счет слияний, при этом число хромосомных плеч не изменяется. Для удобства описания кариотипа бурозубок этой группы предложено обозначать хромосомы в порядке убывания размера буквами латинского алфавита начиная с а, образовавшиеся метацентрические хромосомы парой букв, например jl, если в кариотипе представлены метацентрик и два гомологичных акроцентрика – j/l [17]. Кариотип обыкновенной бурозубки представлен инвариантной частью, включающей половые хромосомы: метацентрик Х (плечи d и e), мелкий акроцентрик Y1 (плечо s) и крупный акроцентрик Y2 – гомолог плеча d X-хромосомы [18, 19], и четыре пары аутосом (af, bc, tu, jl) с постоянной комбинацией хромосомных плеч (для jl известен полиморфизм j/l или j-l). Другие 10 исходно самостоятельных хромосом (g, h, i, k, m, n, o, p, q, r) комбинируются в различных вариантах за счет Робертсоновских слияний (Rb) или полноплечевых реципрокных транслокаций (whole-arm reciprocal translocation, WART). Они могут оставаться отдельными хромосомами (акроцентриками) или сливаться в метацентрики: gm, gi, go, gr или hi, hk, hn и т.д. [20, 21]. Хромосомные расы – это “группы популяций, обитающих на географически смежном или недавно разделенном пространстве и имеющих одинаковый набор метацентриков и акроцентриков, передаваемый по наследству” [22]. Часть рас сохраняет свободные акроцентрики в кариотипе. На территории России основное разнообразие обеспечивается хромосомными расами с полностью метацентрическими кариотипами [2, 23].
В местах контакта ареалов рас образуются “напряженные” (tension) гибридные зоны [20]. Такие зоны поддерживаются за счет отбора против гибридов с пониженной приспособленностью. Зависимость между шириной гибридной зоны (w) и величиной отбора против гибридов (s) определяется формулой w = σ√(8/s) [24], где σ – стандартное отклонение дистанций расселения. В случае минимальных кариотипических различий между родительскими расами величина отбора против гибридов (для σ =300 м) оценена как 0.002, а для максимальных различий – 0.08, что свидетельствует о снижении потока генов через гибридную зону [5].
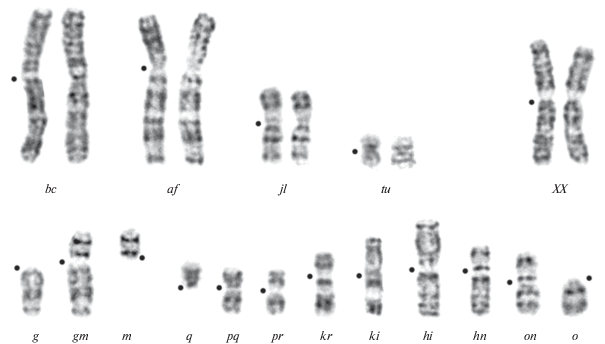
В пользу относительной изоляции рас свидетельствует тот факт, что все известные гибридные зоны “бимодальны”, т.е. количество гибридов меньше ожидаемого для свободного скрещивания. Доля гибридов меньше ожидаемой для свободного скрещивания свидетельствует о том, что формы приобрели дополнительные механизмы, препятствующие гибридизации [25]. Заметим, что кариотипических ограничений на гибридизацию между родительскими расами нет. На рис. 1 представлен кариотип гибрида F1, полученный нами в неволе от скрещивания рас с максимальными различиями в кариотипах – Москва и Селигер. В диагностической части кариотипа этой гибридной особи присутствуют 12 непарных хромосом с монобрахиальной гомологией за счет дополнительного полиморфизма по метацентрику m/q – g/gm/m, q/pq/pr/kr/ki/hi/hn/no/o. Недостаток гибридов первого поколения в зонах контакта рас может служить свидетельством того, что хромосомные расы встали на путь видообразования.
Рис. 1.
G-окрашенный кариотип гибрида F1 между расами Москва и Селигер обыкновенной бурозубки S. araneus с дополнительным полиморфизмом по метацентрику m/q. Точками обозначена локализация центромер, хромосомы – буквами латинского алфавита, согласно принятой номенклатуре [17]; XX – половые хромосомы (самка).
МОРФОЛОГИЧЕСКОЕ СТРУКТУРИРОВАНИЕ
Группа соседних популяций не является единой функциональной системой. Их сходство определяется развитием в сходной (или тождественной) среде и поэтому проявляется и в том случае, когда непосредственной связи между популяциями нет [8, с. 17]
Хромосомные расы у S. araneus появились сравнительно недавно – практически все исследователи говорят об их послеледниковом происхождении [22, 26, 27]. Можно было бы ожидать, что благодаря изоляции, обусловленной различием в кариотипах, хромосомные расы приобретут морфологическую и генетическую обособленность. Однако изучение морфологической изменчивости такой обособленности не выявило [28, 29]. Невозможность надежной дифференциации на основе морфологических различий было показано для Западной и Восточной кариогрупп [30, 31]. Морфологическое разделение обыкновенных бурозубок на подвиды на Украине не выявило соответствия распределению хромосомных рас [32]. Морфологическое структурирование не соответствует кариотипическим различиям и на европейской части России [33–45].
Вместе с тем отсутствие ассоциации морфологической изменчивости с кариотипом у S. araneus не свидетельствует об отсутствии морфологической изменчивости внутри вида. Основная роль в морфологической изменчивости отводится биогеографическим факторам [36]. Известные тенденции к изменчивости связаны с широтным и высотным положением анализируемой выборки. Размер особей имеет положительную корреляцию с высотой [33, 36–38]. При этом изменчивость внутри расы может быть более существенной, чем между расами. Так, выборки расы Серов, собранные на участках высотой 300–600 м над ур. м., были значимо больше по размеру черепа по сравнению с выборкой из равнинного участка [33, 38]. Равнинная выборка расы Серов была практически не отличима по размерам от выборки расы Сок, взятой примерно на той же высоте, хотя раса Сок в среднем меньше. Следует обратить внимание на то, что изменение формы было связано с центроидным размером черепа, который в свою очередь связан с высотой [33].
У северных популяций вида обнаружено уменьшение размеров тела, причем этот эффект трактуют как исключение из правила Бергмана и связывают с невозможностью физиологической адаптации [39]. Связь с широтой, по-видимому, опосредована средовыми факторами. Так, в некоторых выборках южнее расположенных рас Мантурово и Сок центроидный размер черепа меньше, чем у северной выборки расы Печора [33]. В то же время размеры выборок более южных рас в целом больше, чем у расы Печора. Можно предполагать, что размерные изменения в наибольшей мере отражают различие в местообитаниях, из которых получены выборки. Так, особи расы Москва из мохового ельника таежного типа в Тверской области по центроидному размеру достоверно меньше, чем особи той же расы из других местообитаний и расы Молога, взятой севернее [34]. По-видимому, основным фактором изменчивости обыкновенной бурозубки является размер основных жертв. Так, гаплотипы (cyt b) ископаемых гигантских землероек укладываются в рамки изменчивости S. araneus, а размеры тела связаны с характером питания [40].
Поскольку явная кариотипическая подразделенность населения не сопровождается столь же очевидной морфологической подразделенностью, можно предполагать, что кариотипическое разнообразие не вносит существенного вклада в дивергенцию вида. Однако отсутствие связи с кариотипическим структурированием определяется не слабой межрасовой, а высокой межпопуляционной изменчивостью. Было показано [37], что межпопуляционный уровень морфометрических различий значительно и значимо больше, чем межрасовый и, иногда, межвидовой. Аналогичные результаты были получены нами при изучении морфологической изменчивости рас на Северо-Востоке европейской части России [33, 34, 38]. При этом во всех исследованиях не обнаружено корреляции уровня различий с дистанцией. Это позволяет говорить о том, что морфологические особенности зверьков в наибольшей степени отражают специфику локальной мозаики условий среды, т.е. каждая выборка характеризует определенную популяцию как самостоятельную единицу, функционирующую в специфических условиях конкретной среды. В результате различия между расами, оцениваемые по дисперсиям признаков, оказываются замаскированы межпопуляционными различиями.
ГЕНЕТИЧЕСКОЕ СТРУКТУРИРОВАНИЕ
… генетическое единство популяции всегда сочетается с ее генетическим разнообразием [12, с. 20]
В качестве основных исследуемых маркеров у обыкновенной бурозубки использовали митохондриальную ДНК, аутосомные микросателлиты и микросателлиты Y-хромосомы [41]. Дифференциация выборок на основе сходства цитохрома b не соответствует хромосомной дифференциации и в большей степени отражает географическую историю вида в целом, а не различия между недавно возникшими расами: хромосомные мутации возникли недавно и передавались от одной популяции к другой [42]. Распределение гаплотипов по принципу минимальных различий образует звездообразную фигуру с общим гаплотипом в центре. На основании отсутствия филогеографической структуры предполагается, что распределение гаплотипов свидетельствует о быстрой послеледниковой экспансии предковых форм. При этом популяции сохранили высокий предковый полиморфизм. Изучение гена цитохрома b также позволяет предполагать, что современные расы сформировались в пределах заселенного видом пространства уже после ледникового периода [26]. Наибольший вклад в гаплотипическое разнообразие вносит внутрипопуляционная изменчивость, которая вне зависимости от расы или кариотипической группы составляла более 70% [41]. Около 75% гаплотипов были уникальны для выборки и возникли in situ. Уровень различия между популяциями внутри рас (Fst) соответствует уровню межрасовых различий [43]. Это позволяет по аналогии с расами говорить о частичной изоляции локальных популяций.
Значимое географическое структурирование на Шотландских островах не обнаружено у “материковых” рас [44]. Гаплотипы, обнаруженные на островах, отсутствуют на “материковой территории”, но большинство островных гаплотипов происходят от “материкового”, занимающего центральное место в звездообразной сети [44]. Такие различия связаны с эффектом основателя и генетическим дрейфом. По-видимому, похожий эффект мы наблюдали в островной популяции расы Сок в Заволжье (Дьяковский лес). Наиболее часто встречающийся в ней гаплотип за пределами этой популяции принадлежит к редко встречающимся “материковым” гаплотипам [45].
Характеризуя гаплотипическую изменчивость выборок в целом, можно отметить повсеместно высокий уровень разнообразия: около 70% выборок представлены уникальными или встречающимися единично гаплотипами, рассеянными по ареалу вида. Так, в Центральной России единично обнаружены гаплотипы, известные у британской расы Aberdeen и польской Drnholec [45]. При таком разнообразии и разбросе различия в основном определяются гаплотипами, попадающими в выборку случайно. В результате значительные локальные различия поглощают различия между выборками рас в целом.
Популяционное структурирование населения S. araneus обнаружено при изучении распределения аутосомных микросателлитов. Интересно, что минимальное расстояние, на котором были обнаружены значимые различия в частотах между популяциями одной расы в Швейцарии, составило 3 км. В выборках, взятых на расстоянии 1.5 км, различия были недостоверны [46].
Изучение аллозимного полиморфизма 12 популяций S. araneus на 36-километровой трансекте в гибридной зоне между расами Guzowy Młyn и Lęgucki Młyn в Польше показало достоверное различие частот между всеми выборками [47], причем уровень различий не связан с расстоянием между выборками. Выборки были взяты в разные годы, максимально с интервалом 7 лет, и значимых различий, связанных со временем взятия проб, обнаружено не было, т.е. популяционное структурирование устойчиво во времени.
По-видимому, пространственное структурирование населения в наибольшей степени влияет на оценку величины потоков гена в гибридных зонах, которая основана на отношении различий межгрупповой вариансы частоты признака к общегрупповой вариансе – Fst. При ограничении потока различия должны быть больше в гибридных зонах с более сложными гетерозиготами (гибридами) и между перестроенными (по сравнению с обычными) хромосомами [6]. Всего было проанализировано 5 гибридных зон с различной сложностью гетерозигот, и в каждой из них обнаружено небольшое, но высоко достоверное значение Fst, т.е. популяционное структурирование населения. Различия между популяциями внутри расы (Fsc) были значимы, а между расами в целом (Fct) – слабы и в большинстве гибридных зон недостоверны. Не обнаружено связи уровня межрасовых различий со сложностью гетерозигот и связи уровня Fct с положением локуса.
Такой результат может свидетельствовать о том, что хромосомные перестройки не существенны для образования и поддержании гибридных зон у S. araneus. Однако этот вывод резко противоречит результатам анализа распределения кариотипов в гибридных зонах. Авторы [6] приводят несколько возможных причин такого противоречия: ограничения потока генов могут не обнаруживаться в результате того, что снижение фертильности Робертсоновских гетерозигот в случае S. araneus проявляется не так сильно, как у других таксонов; отражает слабую молекулярную дифференциацию рас; неадекватный выбор маркеров, т.е. может зависеть от конкретной связи маркеров с различными хромосомами или быть связано с положением маркера внутри хромосомы. И наконец, конфигурация гибридных зон может в большой степени определяться “популяционными (demographic), географическими или историческими факторами” [6].
Если мы допустим, что популяция представляет собой функциональное единство особей, которое поддерживает собственное внутреннее разнообразие, последнее объяснение окажется наиболее правдоподобным.
ВОЗНИКНОВЕНИЕ ХРОМОСОМНЫХ РАС. РЕКОЛОНИЗАЦИЯ СОВРЕМЕННОГО АРЕАЛА
Закономерности, отражающие зависимость между динамикой структуры популяций и преобразованием их генетического состава, мы рассматриваем в качестве важнейшего фактора эволюционного процесса [12, с. 13]
Распространение хромосомных рас по современному ареалу S. araneus рассматривается как один из случаев формирования разнообразия в ходе послеледниковой реколонизации [1, 26, 48, 49]. Предположительно в рефугиумах, где вид пережил последнее оледенение, возникали и фиксировались различия, которые препятствуют последующему слиянию форм. В зависимости от достигнутого уровня различий формы, встречаясь в ходе реколонизации, образуют гибридные зоны разных типов, из которых “напряженные” гибридные зоны представляют наибольший интерес, так как в этом случае дальнейшая дивергенция форм становится более вероятной, чем их слияние [50]. До настоящего времени нет общепринятых представлений о месте положения предполагаемых рефугиумов и происхождении хромосомных рас. Предполагается [15, 16, 51–55], что образование рас (или их предковых форм) происходило в позднем плейстоцене и голоцене и продолжается в настоящее время.
Большинство исследователей согласны, что исходно кариотип обыкновенной бурозубки был представлен диагностическими хромосомами в акроцентрическом состоянии [12–14]. В результате Rb слияний образовывались метацентрические хромосомы [52, 54, 55, 57–59]. Дальнейшая диверсификация происходит за счет полноплечевых реципрокных транслокаций (WART) [53, 56–59]. На основании минимизации дистанции между кариотипами и географической дистанции между расами была предложена “глобальная сеть” хромосомных рас, в которой представлены возможные межрасовые связи [27]. На территории России расы, содержащие акроцентрические хромосомы, распространены на северо-западе, около Балтийского моря, и в окрестностях оз. Байкал (рис. 2). Полностью метацентрические кариотипы начинают появляться уже на расстоянии менее 500 км от мест концентрации акроцентриков.
Рис. 2.
Ареалы хромосомных рас S. araneus, распространенных на территории России (27 рас), и 4 “кариотипические цепочки” рас. Ареалы рас, входящие в каждую из четырех цепочек, показаны одинаковой штриховкой: 1 – цепочка “Иломанси”, 2 – цепочка “Кириллов-Москва”, 3 – цепочка “Сок” и 4 – цепочка “Байкал” (по [2] с изменениями). Названия рас указаны аббревиатурой (см., например, [2] или [32]). Вертикальной чертой обозначены полиморфные варианты метацентриков (например, g/k). Предполагаемые, но до сих не обнаруженные варианты кариотипов залиты серым цветом и обозначены как вар.1, 2 и т.д.
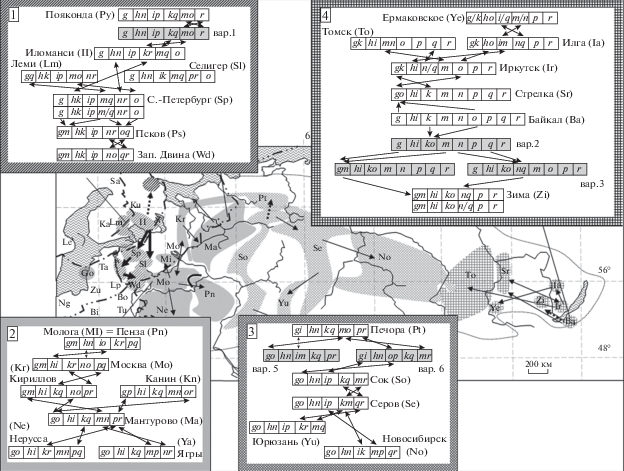
Следуя логике изменения кариотипов, мы предложили схему взаимоотношений рас, обитающих на территории России. Четыре “кариотипические цепочки” рас были построены по принципу минимального изменения, т.е. одной мутации Rb или WART, между кариотипами соседних рас. Трансформацию кариотипов рас, составляющих три цепочки (“Иломанси”, “Кириллов-Москва” и “Сок”) из четырех можно проследить в направлении с северо-запада на юго-восток России. Все они могут быть сведены к одному корню и “завершаются” расой Новосибирск. Четвертая “цепочка” рас (“Байкал”) наоборот “тянется” с востока ареала (от оз. Байкал) и “завершается” расой Томск в районе р. Енисей. Кариотип расы Новосибирск полностью метацентрический, и ни один из ее диагностических метацентриков не встречается у соседней расы Томск (см. рис. 2). Таким образом, эти кариотипы не могут быть получены один из другого в результате простой трансформации [2].
“Кариотипические цепочки” трансформаций кариотипов образуют “потоки”, которые в свое время встречались и пересекали друг друга. В местах их контакта образовывались гибридные зоны, где, на наш взгляд, и сформировалось основное разнообразие рас на российской территории. Установлено [4, 60–62], что новые генетические варианты, включая хромосомные, особенно часто обнаруживаются в зонах контакта рас. По нашим данным, около 95% известных случаев хромосомного полиморфизма сосредоточено именно в гибридных зонах. Например, в зоне между расами Москва и Селигер был обнаружен новый вариант метацентрика (hm), не известный ранее ни у одной другой расы [4]. Однако для того, чтобы гибридные зоны начали образовываться, необходимо возникновение хотя бы одной метацентрической хромосомы.
Очевидно, что первые слияния акроцентриков должны были бы произойти в районах рефугиумов. Действительно, большинство авторов [1, 20, 26, 51, 63] связывают возникновение рас с их многократной изоляцией в ледниковых рефугиумах, а их современное распространение – с расселением по освободившейся вследствие ледниковых процессов площади.
Фиксация de novo метацентрика вполне вероятна в маленькой изолированной популяции [64]. Размеры минимальной жизнеспособной популяции для обыкновенной бурозубки составляют менее 50 особей [65]. Проведенная нами математическая симуляция вероятности случайной фиксации хромосомной мутации в результате дрейфа (изменения частоты на вариансу – ±pq) показывает, что в популяции с минимальной эффективной численностью (Ne), равной 50, и отборе против гетерозигот s = 0.002 (отбор против гибридов рас с одним метацентриком) эта вероятность составляет около 5%. Таким образом, возникновение популяции с фиксированным метацентриком вполне вероятно, если допустить, что на периферии ареала периодически формировались маленькие изолированные популяции. В этом случае положение рефугиумов может быть маркировано большим разнообразием хромосомных вариантов и большим числом сохранившихся акроцентриков. Возникает вопрос, где могли происходить подобные события и как формировалось современное разнообразие рас на российской части ареала?
Традиционно ледниковые рефугиумы “помещают” в южной части видового ареала. У обыкновенной бурозубки рефугиумы предполагаются в Иберии и на Балканах [42, 48, 66, 67], в северном Причерноморье и Прикаспии [60] и на Южном Урале [56]. В.Н. Орлов и А.И. Козловский [63] предполагают наличие северного рефугиума в районе Валдайской возвышенности в Европейской России. Однако если исходить из предположения о том, что на месте рефугимуов должно было бы сохраниться наибольшее кариотипическое разнообразие, придется признать, что в указанных областях следов рефугиумов не сохранилось. Мы проанализировали распределение разнообразия хромосом и кариотипических вариантов и пришли к выводу, что в западной части ареала наиболее вероятными местами выживания землероек были приледниковые области [2]. Повторим вкратце нашу аргументацию.
Обыкновенная бурозубка, как и все представители рода, не способна длительно голодать. При этом способ кормодобывания не предусматривает целенаправленный поиск жертв, зверьки охотятся на ту добычу, которую вспугивают в ходе патрулирования территории. Для них характерна полифазная активность, и они периодически кормятся в течение суток. В широкой перигляциальной гиперзоне на месте современной тундры, лесов и степей существовали “экстра аридные” условия [67]. В таких условиях активность пищевых объектов землероек ограничена, и пища недоступна в течение длительных периодов. Однако в узкой полосе вдоль ледника сохранялась разнообразная травянистая растительность [68]. В настоящее время этот тип растительности сохраняется местами в северо-восточной части ареала S. araneus и, по-видимому, является благоприятным для обитания бурозубок, поскольку в таких биотопах они достигают значительной численности. К югу и востоку от полосы вдоль ледника существовала скудная степная растительность с пионерными сообществами на нарушенных или несформировавшихся почвах [68]. Температуры в период наибольшего похолодания были ниже на 10–15°C зимой и на 5–7°C летом [69]. Такое понижение температур некритично для обыкновенной бурозубки, которая хорошо адаптирована к холоду, и рассмотрение этих адаптаций может составить предмет самостоятельного обзора. Здесь же мы только заметим, этот вид и сейчас обилен в холодных условиях на севере Архангельской области и Республики Коми, на Северном Урале и в Центральной Сибири. Вместе с тем и сейчас ее распространение ограничено аридными территориями.
Как известно, для последнего оледенения характерны повторяющиеся периоды временных потеплений, сменяющиеся похолоданиями [70]. В периоды коротких потеплений могли возникать временные водотоки, вдоль которых формировалась луговая растительность. Заметим, что и сейчас на таких поймах возникают богатые луга. Таким образом, именно в этой области сложились условия для фиксации отдельных метацентрических хромосом. В итоге на пространстве между границей ледника в период максимального оледенения (LGM) и в период его отступления (LGT) успели сформироваться полностью метацентрические расы, которые позднее распространялись на свободную территорию. Мы не выявили [2] ограничений в распространении рас, связанных с наличием физических препятствий или экологическими свойствами местности. Лишь занятость территории другой хромосомной расой S. araneus ограничивает распространение соседней расы.
Модель расселения, управляемого плотностно-зависимыми процессами, предсказывает уменьшение разнообразия при удалении от исходной области расселения, отсутствие специфических адаптаций к условиям на заполняемом пространстве и последовательное увеличение ареалов формы, случайно оказавшейся на волне расселения [3]. Распространения рас на современном ареале в пределах России полностью соответствует этим ожиданиям [2]. Однако для того, чтобы этот сценарий реализовался, на периферии должна оказаться не отдельная особь с некоторым особым кариотипом, а популяция, в которой метацентрические хромосомы были бы фиксированы.
ПОПУЛЯЦИЯ КАК САМОСТОЯТЕЛЬНО ФУНКЦИОНИРУЮЩАЯ ЕДИНИЦА
…элементарной единицей эволюционного процесса является популяция; изменение генетической структуры популяции – начальный этап эволюционного процесса… [8, с. 9]
Все рассмотренные аспекты формирования разнообразия хорошо объяснимы, если исходить из того, что население подразделено на единицы, связанные единством функционирования и относительно независимые от других таких же единиц, – популяции. Есть ли у нас какие-либо данные, подтверждающие такое разделение?
Основной характеристикой популяции является ее численность. Поддержание определенного уровня численности на всей территории популяции обеспечивается двумя процессами – репродукцией и расселением. При этом единство функционирования связано именно с расселением [71]. Можно ожидать, что популяции, функционирующие независимо, будут характеризоваться и независимой динамикой численности. Обнаружение такой независимости более вероятно для видов, у которых интенсивность расселения связана с генетическими процессами в популяции. В этом случае собственная динамика у соседних популяций может не совпадать.
Если рассматривать функционирование популяции в отношении интенсивности расселения, то по этому признаку виды могут быть объединены в три группы. В первую группу входят виды, способные изменять интенсивность расселения, во вторую – виды с постоянно высоким уровнем расселения и в третью – виды с низким уровнем расселения и не способные повысить интенсивность расселения [72]. Первая группа разделена на подгруппу “а”, куда входят виды, способные интенсифицировать расселение непосредственно в ответ на воздействие, и подгруппу “б”, куда входят виды с отложенным ответом. В последнем случае интенсификация дисперсии опосредована внутрипопуляционными генетическими процессами. Появление внутривидовых, различающихся генетически форм наиболее вероятно в 3-й группе и подгруппе 1б, но при этом виды 1б более устойчивы в нестабильной среде [72]. Если единство функционирования популяции опосредовано процессами расселения, можно ожидать, что в независимо функционирующей популяции вида 1б, при отсутствии синхронизирующих внешних воздействий, можно будет обнаружить независимость динамики численности.
Такое явление мы наблюдали на стационаре в Тверской области, где проводится долгосрочный мониторинг популяций [73]. Расстояние между участками с несинхронной динамикой составляло около 3 км, при этом участки не разделены какими-либо физическими или средовыми преградами. Наблюдения проводили в разных местообитаниях, но численность в пределах одного участка в разных биотопах менялась синхронно [73]. Поскольку предположительно независимость динамики была связана с отсутствием значимой миграции между этими популяциями, мы оценили вероятность перехода, используя в качестве маркеров споры и колониеобразующие единицы микроскопических грибов, распространяемых на шерсти зверьков. Всего было обнаружено 108 видов микромицетов (846 положительных тестов). В результате оказалось, что частоты встречаемости сходны в разных местообитаниях в пределах каждого из участков, но резко различаются в выборках, взятых с разных участков. Интересно, что наибольший уровень различий оказался в районе предполагаемой “границы” [73]. По-видимому, на периферию популяций попадали зверьки, несущие фоновые виды микромицетов, по которым и разделялись выборки, в то время как попадание на периферию более редких видов менее вероятно.
Если популяции функционируют независимо, можно ожидать, что частоты наследуемых признаков также изменяются независимо. Выборки с этих территорий были изучены с точки зрения их генетического разнообразия. Как и в предыдущих случаях, сравнивали частоты гаплотипов (d-петли) в выборках из разных местообитаний и разных популяций. Обнаружено, что частоты различаются недостоверно в разных местообитаниях на участке одной популяции, но все они значимо различаются с выборкой, взятой на участке другой популяции [74]. Аналогичные результаты были получены и при морфометрическом анализе. Различия по форме черепа, изученной методами геометрической морфометрии, показали отсутствие достоверных различий выборок внутри популяции и достоверное различие выборок из разных популяций [34].
Таким образом, у нас есть основания полагать, что обыкновенная бурозубка подразделена на относительно небольшие популяции, характеризующиеся единством функционирования, которое обеспечивается преимущественным расселением особей каждой из популяций в пределах своего популяционного пространства. Такое понимание структуры вида во многом объясняет противоречия, получаемые при оценке распределения в пространстве частотных признаков и кариотипа. Морфологические различия накапливаются в каждой отдельной популяции, и, поскольку эти популяции малы, накопление может происходить быстро. В этом случае морфологическая и генетическая изменчивость между локальными популяциями не связана с принадлежностью к определенной хромосомной расе. При высокой межпопуляционной изменчивости мы можем попросту не увидеть филогеографического сигнала.
Следует отдельно остановиться на огромном генетическом разнообразии выборок. Согласно Ю.П. Алтухову [75], даже небольшое ограничение свободной миграции между популяциями, объединенными в систему, создает геногеографическую структурированность, причем частоты аллелей в локальных популяциях могут сильно различаться, но при этом в системе взаимодействующих популяций в целом поддерживается исходный уровень разнообразия. В результате генетического дрейфа аллель может как уменьшать, так и увеличивать свою частоту, и если в одной из локальных популяций аллель исчезает, то в другой может оказаться фиксированым. В результате миграции аллель снова попадает в популяцию, из которой исчез, и т.д. Если изоляция локальных популяций достаточна для того, чтобы в ней стали заметны процессы дрейфа, но эти популяции соединены миграцией, возникает “популяционная система” [76]. Компьютерное моделирование показывает [77], что подразделенность популяции препятствует потере генетического разнообразия: за то время, когда панмиктическая популяция некоторой численности полностью вырождается, т.е. становится полностью гомозиготной, подразделенная популяция той же суммарной численности сохраняет исходный уровень разнообразия. Популяционная система в природе может формироваться при отсутствии физико-географических барьеров, способных нарушать панмиксию [75]. Если допустить, что у обыкновенной бурозубки формируется такая популяционная система, можно объяснить и обилие редких аллелей, и высокое разнообразие выборок.
В заключение хотелось бы заметить, что популяционные полевые исследования трудоемки и требуют продолжительных наблюдений. Такие исследования в настоящее время непопулярны. Однако понимание сути процессов невозможно без углубленного изучения взаимодействий на уровне популяции. Не хотелось бы, чтобы Российская школа экологии потеряла направление, которое так успешно и плодотворно сформировали наши предшественники.
Список литературы
Hewitt G.M. The genetic legacy of the Quaternary ice ages // Nature. 2000. V. 405. P. 907–913. doi 10.1038/35016000
Shchipanov N.A., Pavlova S.V. Density-dependent processes determine the distribution of chromosomal races of the common shrew Sorex araneus (Lipotyphla, Mammalia) // Mammal Research. 2017. V. 62. № 3. P. 267–282. doi 10.1007/s13364-017-0314-4
Waters J.M., Fraser C.I., Hewitt G.M. Founder takes all: density-dependent processes structure biodiversity // Trends in Ecology & Evolution. 2013. V.28. P. 78–85. doi 10.1016/j.tree.2012.08.024
Bulatova N., Jones R.M., White T.A. et al. Natural hybridization between extremely divergent chromosomal races of the common shrew (Sorex araneus, Soricidae, Soricomorpha): hybrid zone in European Russia // J. Evol. Biol. 2011. V. 24. P. 573–586. doi 10.1111/j.1420-9101.2010.02191.x
Horn A., Basset P., Yannic G. et al. Chromosomal rearrangements do not seem to affect the gene flow in hybrid zones between karyotypic races of the common shrew (Sorex araneus) // Evolution. 2012. V. 66. P. 882–889. doi 10.1111/j.1558-5646.2011.01478.x
Шварц С.С. Принципы и методы современной экологии животных // Тр. Ин-та биологии УФАН СССР. 1960. Вып. 21. С. 1–51.
Наумов Н.П. Экология животных. М.: Высшая школа, 1963. 618 с.
Шварц С.С. Эволюционная экология животных. Свердловск: Уральский фил. АН СССР, 1969. 199 с.
Зайцев М.В. Эколого-морфологические особенности функционирования жевательного аппарата землероек // Эволюционные факторы формирования разнообразия животного мира. М.: КМК, 2005. С. 135–145.
Whitaker J.O., French T.W. Foods of six species of sympatric shrews from New Brunswick // Canadian J. Zoology. 1984. V. 62. № 4. P. 622–626. doi 10.1139/z84-091
Bengtsson B.O. Rates in karyotype evolution in placental mammals // Hereditas. 1980. V. 92. P. 37–47.
Ivanitskaya E. Comparative cytogenetics and systematics of Sorex: a cladistic approach // Carnegie museum of natural history, special publication No 18. Pittsburgh, PA, 1994. P. 313–323.
Zima J., Lukáčová L., Macholán M. Chromosomal evolution in shrews // Evolution of shrews. Mammal Research Institute of Polish Academy of Sciences. Białowieża, 1998. P. 175–218.
Biltueva L., Vorobieva N., Perelman P. et al. Karyotype evolution of Eulipotyphla (Insectivora): the genome homology of seven Sorex species revealed by comparative chromosome painting and banding data // Cytogenetic and Genome Research. 2011. V. 135. P. 51–64. doi 10.1159/000330577
Fumagalli L., Taberlet P., Stewart D.T. et al. Molecular phylogeny and evolution of Sorex shrews (Soricidae: Insectivora) inferred from mitochondrial DNA sequence data // Molecular Phylogenetics and Evolution. 1999. V. 11. P. 222–235. doi 10.1006/mpev.1998.0568
Yannic G., Basset P., Hausser J. A new perspective on the evolutionary history of western European Sorex araneus group revealed by paternal and maternal molecular markers // Molecular Phylogenetics and Evolution. 2008. V. 47. P. 237–250. doi 10.1016/ j.ympev.2008.01.029
Searle J.B., Fedyk S., Fredga K. et al. Nomenclature for the chromosomes of the common shrew (Sorex araneus) // Mémoires de la Société Vaudoise des Sciences Naturelles. 1991. V. 19. P. 13–22.
Орлов В.Н., Булатова Н.Ш. Сравнительная цитогенетика и кариосистематика млекопитающих. М.: Наука, 1983. 405 с.
Sharman G.B. History of discovery and recognition of XY1Y2 systems and chromosomes polymorphism in mammals // Mémoires de la Société Vaudoise des Sciences Naturelles. 1991. V. 19. P. 7–12.
Searle J.B., Wójcik J.M. Chromosomal evolution: the case of Sorex araneus. Survey of hybrid zones // Evolution of shrews. Mammal Research Institute Polish Acad. Sci. Białowieża, 1998. P. 243–253.
Wójcik J.M., Ratkiewicz M., Searle J.B. Evolution of the common shrew Sorex araneus: chromosomal and molecular aspects // Acta Theriologica. 2002. V. 47. Suppl. 1. P. 139–167.
Hausser J., Fedyk S., Fredga K. Definition and nomenclature of the chromosome races of Sorex araneus // Folia Zoologica. 1994. V. 43. P. 1–9.
Щипанов Н.А., Павлова С.В. Многоуровневая подразделенность в группе видов “araneus” рода Sorex. 1. Хромосомная дифференциация // Зоол. журн. 2016. Т. 95. № 2. С. 216–233. doi 10.7868/S0044513416020148
Barton N.H., Gale K.S. Genetic analysis of hybrid zones // Hybrid Zones and the Evolutionary Process. New York: Oxford University Press, 1993. P. 13–45.
Jiggins C.D., Mallet J. Bimodal hybrid zones and speciation // TREE. 2000. V. 15. P. 250–255.
Ratkiewicz M., Fedyk S., Banaszek A. et al. The evolutionary history of the two karyotypic groups of the common shrew Sorex araneus, in Poland // Heredity. 2002. V. 88. P. 235–242. doi 10.1038/sj.hdy.6800032
White T.A., Bordewich M., Searle J.B. A network approach to study karyotypic evolution: the chromosomal races of the common shrew (Sorex araneus) and house mouse (Mus musculus) as model systems // Systematic Biology. 2010. V. 59. P. 262–276. doi 10.1093/sysbio/syq004
Searle J.B., Thorpe R.S. Morphometric variation of the common shrew (Sorex araneus) in Britain, in relation to karyotype and geography // J. Zoology. 1987. V. 212. P. 373–377.
Meyer A., Searle J.B. Morphological studies on British common shrews // Folia Zoologica. 1994. V. 43. Suppl. 1. P. 115.
Wójcik J.M., Bogdanowicz W., Pucek Z., Zalewska A. Morphometric variation of the common shrew Sorex araneus in Poland, in relation to karyotype // Acta Theriologica. 2000. V. 45. Suppl. 1. P. 161–172.
Banaszek A., Smakulska J., Fedyk S. et al. Morphometric differentiation of shrews (Sorex araneus L, 1758) from the hybrid zone between the Guzowy Młyn and Łęgucki Młyn chromosome races in Poland // Mammalia. 2003. V. 67. P. 217–224.
Mishta A.V. Morphometric variation of the common shrew Sorex araneus in Ukraine, in relation to geoclimatic factors and karyotype // Rus. J. Theriol. 2007. V. 6 (1). P. 51–62.
Shchipanov N.A., Voyta L.L., Bobretsov A.V., Kuprianova I.F. Intra-species structuring in the common shrew Sorex araneus (Lipotyphla: Soricidae) in European Russia: morphometric variability could give evidence of limitation of interpopulation migration // Rus. J. Theriol. 2014. V. 13(2). P. 119–140.
Щипанов Н.А., Сычёва В.Б., Тумасьян Ф.А. Морфометрические дистанции и структурирование населения обыкновенной бурозубки Sorex araneus L. (Lipotyphla: Soricidae) // Изв. РАН. Сер. биол. 2016. № 5. С. 511–524.
Sulkava S., Vahtola M., Fredga K. Structure of the upper tooth-row of Sorex araneus in Scandinavia // Acta Zool. Fennica. 1985. V.173. P. 237–239.
Homolka M. Biometrisher Vergleich zweier Populationen Sorex araneus // Acta Sc. Nat. Brno. 1980. V. 14. P. 1–34.
Polly P.D. Phylogeographic differentiation in Sorex araneus: morphology in relation to geography and karyotype // Rus. J. Theriol. 2007. V. 6. P. 73–84.
Щипанов Н.А., Бобрецов А.В., Куприянова И.Ф., Павлова С.В. Межрасовая и межпопуляционная изменчивость фенотипических (краниальных) признаков обыкновенных бурозубок (Sorex araneus L., 1758) // Генетика. 2011. Т. 47. № 1. С. 76–86.
Ochosińska D., Taylor J.R.E. Living at the physiological limits: field and maximum metabolic rates of the common shrew (Sorex araneus) // Physiological and Biochemical Zoology. 2005. V. 78. P. 808–818.
Prost S., Klietman J., van Kolfschoten T. Effects of late quaternary climate change on Palearctic shrews // Global Change Biology. 2013. V.19. P. 1865–1874. doi 10.1111/gcb.12153
Andersson A.-C., Narain Y., Tegelström H., Fredga K. No apparent reduction of gene flow in a hybrid zone between the West and North European karyotypic groups of the common shrew, Sorex araneus // Molecular Ecology. 2004. V. 13. P. 1205–1215. doi 10.1111/j.1365-294X.2004.02146.x
Taberlet P., Fumagalli L., Hausser J. Chromosomal versus mitochondrial DNA evolution: tracking the evolutionary history of the south-western European populations of the Sorex araneus group (Mammalia, Insectivora) // Evolution. 1994. V. 48. P. 623–636.
Andersson A.-C., Alström-Rapaport C., Fredga K. Lack of mitochondrial DNA divergence between chromosome races of the common shrew, Sorex araneus, in Sweden. Implications for interpreting chromosomal evolution and colonization history // Molecular Ecology. 2005. V. 14. P. 2703–2716. doi 10.1111/j.1365-294X.2005.02584.x
White T.A., Searle J.B. The colonization of Scottish islands by the common shrew, Sorex araneus (Eulipotyphla: Soricidae) // Biological Journal of the Linnean Society. 2008. V. 94. P. 797–808. doi 10.1111/j.1095-8312.2008.01019.x
Распопова А.А., Щипанов Н.А. Изменчивость участка цитохрома b в разных хромосомных расах и популяциях обыкновенной бурозубки // Генетика. 2011. Т. 47. № 4. С. 527–536.
Lugon-Moulin N., Balloux F., Hausser J. Genetic differentiation of common shrew Sorex araneus populations among different alpine valleys revealed by microsatellites // Acta Theriologica. 2000. V.45. P. 103–117.
Ratkiewicz M., Banaszek A., Jadwiszczak K.A. et al. Genetic diversity, stability of population structure and barriers to gene flow in a hybrid zone between two Sorex araneus chromosome races // Mammalia. 2003. V. 67. P. 275–284.
Hewitt G.M. Post-glacial colonization of European biota // Biol. J. Linn. Society. 1999. V. 68. P. 87–112. doi 10.1111/j.1095-8312.1999.tb01160.x
Hewitt G.M. Genetic consequences of climatic oscillations in the Quaternary // Philosophical Transactions of the Royal Society B: Biological Sciences. 2004. V. 359(1442). P. 183–110. doi 10.1098/rstb.2003.1388
Hewitt G.M. Hybrid zones – natural laboratories for evolutionary studies // TREE. 1988. V. 3. P. 158–165. doi 10.1016/0169-5347(88)90033-X
Fredga K. Reconstruction of the postglacial colonization of Sorex araneus into northern Scandinavia based on karyotype studies, and the subdivision of the Abisko race into three // Rus. J. Theriol. 2007. V. 6. P. 85–96.
Hausser J., Catzeflis F., Meylan A., Vogel P. Speciation in the Sorex araneus complex (Mammalia, Insectivora) // Acta Zool. Fennica. 1985. V.170. P. 125–130.
Halkka L., Soderlund V., Skaren U., Heikkila J. Chromosomal polymorphism and racial evolution of Sorex araneus // Hereditas. 1987. V. 106. P. 257–275.
Wójcik J.M. Chromosome races of the common shrew Sorex araneus in Poland: a model of a karyotype evolution // Acta Theriologica. 1993. V. 38. P. 315–338.
Hausser J. The Sorex of the araneus-arcticus group (Mammalia, Soricidae): do they actually speciate // Special Publication of Carnegie Museum of Natural History. 1994. № 18. P. 295–306.
Поляков А.В., Панов В.В., Ладыгина Т.Ю. Хромосомная эволюция обыкновенной бурозубки Sorex araneus L. в послеледниковое время на Южном Урале и в Сибири // Генетика. 2001. Т. 37. № 4. С. 448–455.
Volobouev V.T. Phylogenetic relationships of the Sorex araneus-arcticus species complex (Insectivora, Soricidae) based on high resolution chromosome analyses // J. Heredity 1989. V. 80. P. 284–290.
Volobouev V.T., Catzeflis F. Mechanisms of chromosomal evolution in three European species of the Sorex araneus-arcticus group (Insectivora; Soricidae) // Zeitschrift für Zoologische Systematik und Evolutionsforschung. 1989. V. 27. P. 252–262.
Searle J.B., Hübner R., Wallace B.M.N., Garagna S. Robertsonian variation in wild mace and shrews // Chromosomes Today. 1990. V. 10. P. 253–263.
Shaw D.D., Wilkinson P., Coates D.J. Increased chromosomal mutation-rate after hybridization between 2 subspecies of grasshoppers // Science. 1983. V. 220. P. 1165–1167.
Barton N.H., Hewitt G.M. Analysis of hybrid zones // Annu. Rev. Ecol. Syst. 1985. V. 16. P. 113–148.
Павлова С.В., Булатова Н.Ш. Идентификация новой WART-подобной перестройки у комплексных гетерозигот в межрасовой гибридной зоне обыкновенной бурозубки Sorex araneus L. // Генетика. 2010. Т. 46. № 9. С. 1269–1271.
Орлов В.Н., Козловский А.И. О роли ледниковых эпох в формировании хромосомного полиморфизма обыкновенной бурозубки Sorex araneus L. (Insectivora, Mammalia) // Докл. РАН. 2002. Т. 386. С. 423–426.
Hausser J. Genetic drift and selection; their respective and weights in the morphological and genetical differentiation of four species of shrews in Southern Europe (Insectivora, Soricidae) // J. Zool. Syst. Evol. Res. 1984. V. 22. P. 302–320.
Fumagalli L., Taberlet P., Favre L., Hausser J. Origin and evolution of homologous repeated sequences in the mitochondrial DNA control region of shrews // Mol. Biol. Evol. 1996. V. 13. P. 31–46. https://doi.org/ doi 10.1093/oxfordjournals.molbev.a025568
Bilton D.T., Mirol P.M., Mascheretti S. et al. Mediterranean Europe as an area of endemism for small mammals rather than a source for northwards postglacial colonization // Proc. R. Soc. Lond. 1998. V. 265. P. 1219–1226. doi 10.1098/rspb.1998.0423
Velichko A.A. Late Pleistocene paleoclimatic reconstructions // Late Quaternary environments of the Soviet Union. Minneapolis: University of Minnesota Press, 1984. P. 261–285.
Гричук В.П. История флоры и растительности Русской равнины в плейстоцене. М.: Наука, 1989. 183 с.
Velichko A.A., Zelikson E.M. Landscape, climate and mammoth food resources in the East European plain during the Late Paleolithic epoch // Quaternary International. 2005. P. 126–128. doi 10.1016/j.quaint.2004.04.019
Andersen K.K., Azuma N., Barnola J.-M. et al. High-resolution record of Northern Hemisphere climate extending into the last interglacial period // Nature. 2004. V. 431. P. 147–151. doi 10.1038/nature02805
Щипанов Н.А. Функциональная организация популяций: возможный подход к изучению популяционной устойчивости. Прикладные аспекты (на примере мелких млекопитающих) // Зоол. журн. 2002. Т. 81. Вып. 9. С. 1048–1077.
Щипанов Н.А. Популяция как единица существования вида. Мелкие млекопитающие // Зоол. журн. 2003. Т. 82. Вып. 4. С. 450–469.
Shchipanov N.A. Understanding the boundaries between chromosomal races of common shrews in terms of restricted movement by individual shrews // Rus. J. Theriol. 2007. V. 6 (1). P. 117–122.
Щипанов Н.А., Распопова А.А., Тумасьян Ф.А. и др. Признаки внутривидовой подразделенности у обыкновенной бурозубки (Sorex araneus L.) // Проблемы популяционной и общей генетики: Мат-лы Междун. конф., посвященной 75-летию со дня рождения академика Ю.П. Алтухова. М., 2013. С. 171–179.
Алтухов Ю.П. Генетические процессы в популяциях. 3-е перераб. и дополн. изд. М.: ИКЦ Академ-книга, 2003. 431 с.
Алтухов Ю.П., Рычков Ю.Г. Популяционные системы и их структурные компоненты. Генетическая стабильность и изменчивость // Журн. общ. биол. 1970. Т. 31. № 5. С. 507–525.
Алтухов Ю.П., Бланк М.Л. Компьютерное моделирование генетических процессов в структурированных популяциях // ДАН СССР. 1991. Т. 319. № 6. С. 1467–1472.
Дополнительные материалы отсутствуют.


