Экология, 2019, № 6, стр. 419-428
Сообщества почвенных нематод различных тундровых фитоценозов, отличающихся степенью развития кустарникового яруса
А. А. Кудрин a, *, Т. Н. Конакова a, А. А. Таскаева a
a Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: kudrin@ib.komisc.ru
Поступила в редакцию 09.06.2018
После доработки 06.02.2019
Принята к публикации 18.03.2019
Аннотация
В ряду фитоценозов от кустарничковой до крупноерниковой тундры (Воркутинский р-н, Республика Коми), с увеличением кустарникового яруса изменяются структура сообществ нематод, рост их численности и разнообразия. Среди трофических групп общей тенденции соответствовало изменение численности бактерио-, мико- и фитотрофов. Хищники демонстрировали обратную тенденцию, тогда как обилие политрофов мало отличалось на исследованных участках. Различия сообществ нематод ассоциированы с изменением гидротермального режима и химических свойств почвы. Эколого-фаунистические индексы, рассчитанные на основе данных об обилии и разнообразии нематод, свидетельствуют о низком уровне поступления органического вещества в почвенную пищевую сеть и равной пропорции грибного и бактериального путей разложения. Однако требуется дополнительная верификация работоспособности таких индексов в тундровых экосистемах.
Нематоды являются наиболее многочисленными многоклеточными животными на планете Земля [1], представляя собой один из важнейших компонентов почвенной биоты. Функционируя на разных трофических уровнях, они участвуют в регуляции многих почвенных процессов. В частности, нематоды имеют большое значение для трансформации азота и фосфора в почве [2, 3], регулируют активность почвенных микроорганизмов [4, 5], играют огромную роль как паразиты растений [6] и т.д. Однако, несмотря на их высокую экологическую значимость, исследования данной группы в Арктике и Субарктике крайне ограничены [7].
Арктические и субарктические территории чувствительны к процессам глобального изменения климата. За последние десятилетия произошли существенные перемены в структуре растительных сообществ тундровой зоны, проявившиеся в увеличении обилия, высоты и проективного покрытия кустарникового яруса [8–10]. В настоящее время сложно оценить значимость таких изменений растительности для почвенных животных, поскольку недостаточно данных об отличиях сообществ почвенной фауны и особенно нематод в различных тундровых фитоценозах.
В умеренных широтах растительность считается одним из ведущих факторов, определяющих качественные и количественные характеристики комплексов нематод [11, 12]. Наиболее строго такая зависимость проявляется для фитотрофов, в то время как микробоядные и хищные нематоды могут быть связаны с растением опосредованно, через свойства почвы, определяемые надземным и подземным опадом [13]. С увеличением степени развития кустарникового яруса в тундре растет количество и изменяется качество наземного опада, ускоряются процессы минерализации/иммобилизации азота и деструкции органического вещества [8]. В результате таких изменений в почве регистрируется снижение концентрации углерода и показателя C/N, а с увеличением транспирации к концу вегетационного периода наблюдается снижение влажности почвы [14, 15]. Кроме того, развитие кустарникового яруса определяет и температурный режим почвы [16]. Установлено, что под кустарничковой тундрой формируются почвы с относительно “холодным” режимом, тогда как почвы под кустарниковой растительностью характеризуются более мягкими температурными условиями [17].
Одна из особенностей почвенных нематод – их значительный индикационный потенциал [18]. Четкая трофическая специализация и различия в жизненной стратегии позволили разработать эколого-фаунистические индексы, которые дают представление как о характере антропогенного воздействия, так и о естественных процессах, протекающих в почве. В частности, на их основе можно судить о степени нарушенности, структурированности, обеспеченности органическими ресурсами, а также оценить соотношение грибного и бактериального путей разложения органического вещества в почве [1, 19]. Эколого-фаунистические индексы широко применяются в почвенной экологии, но при исследовании комплексов нематод тундровой зоны практически не использовались [20].
Ранее изучение нематод в Арктике и Субарктике в основном было связано с фитоценозами, не имеющими кустарникового яруса: дриадово-осоково-моховые, полигональные, пятнистые тундры [20–23]. Наше исследование проведено в подзоне южных тундр (Воркутинский р-н, Республика Коми), где доминирующим типом растительности являются кустарниковые тундры, хотя кустарничковые сообщества также распространены [24]. Существование таких тундровых фитоценозов в непосредственной близости друг от друга позволило выделить ряд модельных участков, отличающихся по степени развития кустарникового яруса, для которых ранее было показано некоторое различие родового богатства и структуры доминирования нематод [25].
Целью работы было оценить различия сообществ почвенных нематод в тундровых фитоценозах, формирующих ряд по увеличению степени развития кустарникового яруса, и определить возможные факторы, ответственные за такие различия. Для характеристики сообществ были использованы эколого-фаунистические индексы, рассчитываемые на основе данных о численности отдельных таксонов нематод.
МАТЕРИАЛ И МЕТОДЫ
Исследования проведены в 2016 г. в окрестностях г. Воркуты в юго-восточной части Большеземельской тундры (подзона южных тундр), в районе распространения массивно-островной многолетней мерзлоты [26]. Среднегодовая температура воздуха по метеостанции Воркута (1947–2006 гг.) – минус 5.8°C, средняя сумма положительных среднесуточных температур воздуха – около 1000°C, среднегодовое количество осадков – 550 мм.
На изучаемой территории зональным типом растительности являются кустарниковые тундры, в которых доминируют карликовая береза и различные виды ив. Однако в условиях неблагоприятного гидротермического режима возможно формирование кустарничковых, кустарничково-моховых и кустарничково-мохово-лишайниковых тундр [24]. Нами в качестве модельных участков были выбраны фитоценозы, характеризующиеся схожим флористическим составом, однако формирующие ряд по увеличению степени развития кустарникового яруса [25].
Участок 1. Кустарничковая мохово-лишайниковая тундра (67.434299° с.ш., 63.830271° в.д.). Расположен на выровненной первой надпойменной террасе р. Воркута. Глубина залегания мерзлоты 80–100 см. Несмотря на присутствие отдельных экземпляров карликовой березы (Betula nana), высота которых не превышает 0.2–0.3 м, кустарниковый ярус здесь отсутствует. Доминантами в сообществе выступают кустарнички сем. Вересковые – брусника (Vaccinium vitis-idaea) и голубика (Vaccinium uliginosum). Встречены различные виды осок и злаков. ОПП травянисто-кустарничкового яруса 40–50%. Лишайниково-моховой покров сплошной.
Участок 2. Мелкоерниковая кустарничково-моховая тундра (67.431100° с.ш., 63.831043° в.д.). Участок расположен в 200 м от участка 1 в пределах второй надпойменной террасы р. Воркута, полого наклонен в сторону русла реки. Глубина залегания мерзлоты составляет 100–120 см. Кустарниковый ярус представлен в основном карликовой березой при участии различных видов ив, хорошо выражен и достигает высоты 0.5–0.7 м. Травянисто-кустарничковый ярус сложен различными видами сем. Вересковые – брусника, голубика и водяника (Empetrum hermafroditum). Зарегистрированы некоторые виды осок и злаков. Моховой покров сплошной, состоит главным образом из зеленых мхов.
Участок 3. Крупноерниковая кустарничково-моховая тундра (67.530410° с.ш., 64.135940° в.д.). Расположен на вершине водораздельной гряды на расстоянии 15 км от других участков. Глубина залегания мерзлоты составляет 150–180 см. Кустарниковый ярус, сформированный карликовой березой и различными видами ив, достигает высоты 0.7–1.2 м. Кустарничковый ярус хорошо выражен и состоит из видов сем. Вересковые – брусника, голубика и водяника. На участке отмечены различные виды осок и злаков. Моховой покров сплошной, сложен в основном из зеленых мхов.
На каждом участке в 2016 г. было отобрано по 10 проб размером 5 × 5 × 5 см. Физико-химические исследования образцов почв выполнены в экоаналитической лаборатории Института биологии Коми НЦ УрО РАН. Величину актуальной кислотности почв (рНводн) определяли потенциометрически в водной вытяжке; массовую долю органического углерода ω(Собщ) и общего азота ω(Nобщ) – на CHNS-элементном анализаторе ЕА 1110 (CarloErba, Италия); аммонийный (N-${\text{NH}}_{4}^{ + }$) и нитратный (N-${\text{NO}}_{3}^{ - }$) азот – фотометрически по методу ЦИНАО на фотометре КФК-3; влажность почвы –гравиметрически высушиванием образцов при температуре 105°C в течение 12 ч. Почвенные температуры измеряли при помощи установки цифровых логгеров (HOBO U12-008, ONSET) в верхний органогенный горизонт почвы на глубину 3–5 см, запрограммированных на 6 измерений в сутки. В дальнейшем рассчитывали среднедневные показатели. Период измерения температуры составил 231 день – с 08.07.2016 по 23.02.2017.
Экстракцию нематод осуществляли при помощи модифицированного метода Бермана с экспозицией 48 ч из навески почвы массой 50 г. Фиксацию материала проводили 4%-ным формалином. Для выявления таксономического состава нематод было идентифицировано не менее 100 экз. из каждой пробы. Основываясь на классификации Итса с соавт. [27], нематоды были разделены на пять трофических групп: бактериотрофы, микотрофы, политрофы, хищники и фитотрофы. Согласно ряду авторов [28, 29], род Filenchus был включен в группу микотрофов, а другие рода сем. Tylenchidae – в группу фитотрофов. Каждому таксону было присвоено значение на основе c–p шкалы Бонгерса [1]: от 1 (r – стратеги или колонизаторы, обладают короткими жизненными циклами, значительными флуктуациями численности, высокой плодовитостью и устойчивостью к нарушениям среды) до 5 (К – стратеги или персисторы, обладают низкой плодовитостью и высокой чувствительностью к нарушениям среды).
Для оценки состояния сообществ нематод и особенностей функционирования почвенной пищевой сети был использован ряд эколого-фаунистических индексов. Индекс зрелости (ΣMI) применяли как индикатор нарушения почвенной экосистемы. Он рассчитывается на основе соотношения таксонов нематод с различным рангом по c–p шкале (высокие значения отражают зрелость нематодного сообщества, а низкие – нарушение среды в целом). Индекс обогащения (EI), рассчитываемый на основе соотношения бактериотрофов и микотрофов с c–p 1 и 2, рассматривали как уровень обогащения почвы доступным органическим веществом (высокие значения указывают на высокий уровень доступных пищевых ресурсов; варьирует от 0 до 100). Структурный индекс (SI), вычисляемый на основе соотношения комплексов нематод с высокими значениями по с–р шкале (бактериотрофы – 3–5, микотрофы – 3–5, политрофы – 4–5, хищники – 3–5), использовался как показатель сложности и структурированности почвенной пищевой сети (высокие значения указывают на большое число трофических связей в экосистеме, значительную степень зрелости почвенной трофической сети, сложность и стабильность среды обитания в целом; варьирует от 0 до 100). Расчет индексов осуществляли по формулам, предложенным Феррисом с соавт. [19]. Для расчета соотношения бактериального и грибного энергетических каналов в почве был использован индекс NCR [30]: NCR = B/(B + F), где B и F – это относительное обилие бактериотрофов и микотрофов соответственно. Нами также были рассчитаны индекс Шеннона (H`) – показатель разнообразия и выравненности нематодного сообщества и родовая насыщенность (S) – количество родов нематод в пробе.
Для оценки значимости различий между средними использовали непараметрический критерий Манна-Уитни при p < 0.05. Ординация сообществ нематод была получена методом неметрического многомерного шкалирования (NMDS) с использованием индекса Брея-Кертиса на основе численности отдельных таксонов нематод. Влияние физико-химических свойств почвы на сообщества нематод оценивали при помощи функции Envfit, а значимость корреляций – перестановочным тестом (9999 перестановок). Согласно рекомендациям [31], численность нематод была трансформирована по lg10(n + 1) перед проведением анализа. Статистический анализ выполнен с использованием пакета VEGAN в среде R [32].
РЕЗУЛЬТАТЫ
Физико-химические свойства почвы. Большинство оцениваемых параметров почвы различались между исследованными участками (табл. 1): влажность почвы и C/N на всех трех участках с максимальными значениями на участке 1 и минимальными – на участке 3; содержание аммонийного азота, Cобщ и кислотность почвы были сходными на участках 1 и 2, тогда как на участке 3 для первых двух параметров были отмечены более низкие значения, а для рН, наоборот, более высокие. Минимальное содержание нитратного азота зарегистрировано на участке 2, а содержание Nобщ на участках было сходным.
Таблица 1.
Физико-химические свойства почв исследованных участков (среднее ± SE, n = 10)
| Показатель | Участок 1 | Участок 2 | Участок 3 |
|---|---|---|---|
| Влажность, % | 277 ± 28a | 156 ± 12b | 110 ± 4c |
| pH | 3.4 ± 0.1b | 3.3 ± 0.1b | 4.3 ± 0.1a |
| N-${\text{NH}}_{4}^{ + }$, мг/кг | 29.1 ± 2.6a | 28.9 ± 2.9a | 4.9 ± 2.7b |
| N-${\text{NO}}_{3}^{ - }$, мг/кг | 11.2 ± 2.8a | 4.5 ± 1.3b | 12.4 ± 2.5a |
| Nобщ, % | 0.8 ± 0.1 | 0.9 ± 0.1 | 0.8 ± 0.1 |
| Cобщ, % | 31.7 ± 1.8a | 32.1 ± 3.1a | 20.0 ± 2.1b |
| C/N | 45.1 ± 1.6a | 37.7 ± 1.5b | 29.2 ± 0.7c |
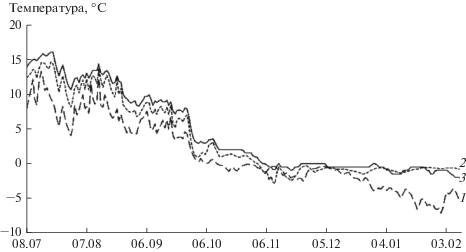
Температура почвы была максимальна на участке 3 (рис. 1). Температурный режим второго участка несколько отличался от третьего, особенно в летние месяцы, когда температура была на 1–2°C ниже, однако в осенние и зимние месяцы разница между ними практически отсутствовала. Наиболее неблагоприятными условиями характеризовался участок 1: температура почвы здесь в определенные месяцы была на 5–7°C ниже, чем на других участках.
Рис. 1.
Динамика среднедневной температуры почвы на глубине 3–5 см (○C) на исследованных участках: 1 – кустарничковая тундра (уч. 1); 2 – мелкоерниковая тундра (уч. 2); 3 – крупноерниковая тундра (уч. 3).
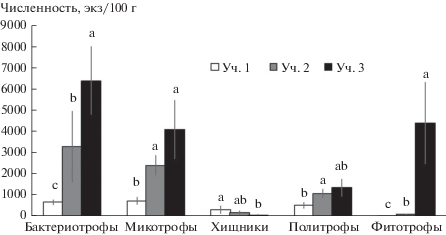
Комплекс почвенных нематод. Всего было зарегистрировано 29 родов почвенных нематод, 10 из которых встречались на всех участках (табл. 2). Только на участке 1 были найдены представители родов Achromadora, Panagrolaimus и Iotonchus, на участке 2 – Tylencholaimus, Acrobeles, Bunonema, на участке 3 – Anaplectus, Prismatolaimus, Aporcelaimellus, Lelenchus, Helicotylenchus. В рассмотренном ряду с увеличением степени развития кустарникового яруса происходило увеличение численности (рис. 2а) и родовой насыщенности (рис. 2б) нематод. Обилие бактериотрофов и фитотрофов соответствовало тенденции изменения общей численности (рис. 3). Для микотрофов минимальные показатели численности были зарегистрированы на участке 1, тогда как на двух других оно было выше и не различалось между собой. Хищники демонстрировали тенденцию сокращения численности в рассмотренном ряду. Обилие политрофов мало различалось на исследованных участках (см. рис. 3). Изменение численности большинства таксонов нематод соответствовало общей тенденции. Однако в случае родов Tripyla и Prionchulus наблюдалось не увеличение, а снижение обилия в исследованном ряду участков (см. табл. 2).
Таблица 2.
Численность (экз/100 г) отдельных таксонов почвенных нематод на исследованных участках (среднее ± SE, n = 10)
| Роды нематод | c–p значение** | Участок 1 | Участок 2 | Участок 3 |
|---|---|---|---|---|
| Микотрофы* | ||||
| Aphelenchoides | 2 | 229 ± 60 | 735 ± 240 | 1227 ± 305 |
| Ditylenchus | 2 | 4 ± 4 | 11 ± 7 | 0 ± 0 |
| Filenchus | 2 | 498 ± 175 | 1644 ± 340 | 2870 ± 1203 |
| Tylencholaimus | 4 | 0 ± 0 | 14 ± 8 | 0 ± 0 |
| Бактериотрофы | ||||
| Metateratocephalus | 3 | 36 ± 21 | 95 ± 43 | 0 ± 0 |
| Teratocephalus | 3 | 49 ± 21 | 182 ± 53 | 384 ± 170 |
| Achromadora | 6 ± 6 | 0 ± 0 | 0 ± 0 | |
| Anaplectus | 2 | 0 ± 0 | 0 ± 0 | 26 ± 26 |
| Plectus | 2 | 544 ± 108 | 1664 ± 876 | 1007 ± 310 |
| Eucephalobus | 2 | 0 ± 0 | 14 ± 11 | 39 ± 27 |
| Heterocephalobus | 2 | 0 ± 0 | 6 ± 6 | 13 ± 13 |
| Acrobeloides | 2 | 2 ± 2 | 1157 ± 792 | 4429 ± 1255 |
| Acrobeles | 0 ± 0 | 11 ± 11 | 0 ± 0 | |
| Alaimus | 3 | 4 ± 4 | 0 ± 0 | 101 ± 59 |
| Prismatolaimus | 2 | 0 ± 0 | 0 ± 0 | 71 ± 32 |
| Bunonema | 0 ± 0 | 32 ± 28 | 0 ± 0 | |
| Panagrolaimus | 1 | 21 ± 21 | 0 ± 0 | 0 ± 0 |
| Rhabditidae | 1 | 6 ± 2 | 127 ± 112 | 324 ± 198 |
| Политрофы | ||||
| Eudorylaimus | 4 | 523 ± 146 | 1084 ± 207 | 1275 ± 402 |
| Aporcelaimellus | 5 | 0 ± 0 | 0 ± 0 | 79 ± 50 |
| Хищники | ||||
| Tripyla | 3 | 236 ± 166 | 122 ± 46 | 0 ± 0 |
| Clarkus | 4 | 24 ± 14 | 10 ± 7 | 39 ± 27 |
| Prionchulus | 4 | 62 ± 27 | 49 ± 44 | 26 ± 26 |
| Iotonchus | 4 | 4 ± 0 | 0 ± 0 | 0 ± 0 |
| Фитотрофы | ||||
| Malenchus | 2 | 4 ± 2 | 4 ± 2 | 2 ± 1 |
| Telenchus | 2 | 6 ± 6 | 60 ± 26 | 0 ± 0 |
| Lelenchus | 2 | 0 ± 0 | 0 ± 0 | 10 ± 10 |
| Paratylenchus | 3 | 0 ± 0 | 16 ± 12 | 92 ± 53 |
| Heterodera | 3 | 0 ± 0 | 20 ± 15 | 4270 ± 1891 |
| Helicotylenchus | 3 | 0 ± 0 | 0 ± 0 | 26 ± 26 |
| Неидентифицированные личиночные стадии |
0 ± 0 | 162 ± 93 | 45 ± 29 |
Рис. 2.
Численность (а) и родовая насыщенность (б) нематод на исследованных участках (среднее ± SE, n = 10). Разные буквы указывают на статистически значимые различия (p < 0.05).
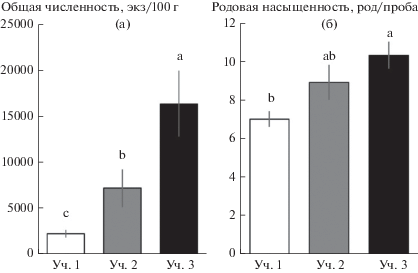
Рис. 3.
Численность отдельных трофических групп почвенных нематод на исследованных участках (среднее ± SE, n = 10). Разные буквы указывают на статистически значимые различия в пределах каждой трофической группы (p < 0.05).
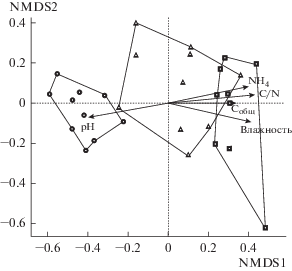
Ординация продемонстрировала весьма четкое разделение структуры сообществ нематод исследованных участков. Различия были ассоциированы с изменением кислотности и влажности почвы, содержанием углерода и аммонийного азота, а также показателем C/N (рис. 4).
Рис. 4.
Многомерное шкалирование сообществ почвенных нематод на исследованных участках. Пробы из одних и тех же фитоценозов обведены линией: квадрат – участок 1, треугольник – участок 2, окружность – участок 3. Стрелками показаны физико-химические свойства почвы, достоверно коррелирующие с изменениями в составе комплекса почвенных нематод (Envfit, 9999 permutations, p < 0.05).
Эколого-фаунистические индексы. Среди эколого-фаунистических индексов только ΣMI и SI достоверно различались между фитоценозами (табл. 3). Величина ΣMI была выше на участке 1 и не различалась между участками 2 и 3. Значения SI снижались в исследованном ряду.
Таблица 3.
Значения эколого-фаунистических индексов нематод на исследованных участках (среднее ± SE, n = 10)
| Индекс | Участок 1 | Участок 2 | Участок 3 |
|---|---|---|---|
| H` | 1.47 ± 0.06 | 1.58 ± 0.09 | 1.69 ± 0.05 |
| ΣMI | 2.7 ± 0.1a | 2.4 ± 0.1b | 2.4 ± 0.1b |
| EI | 32.8 ± 2.9 | 39.3 ± 3.3 | 34.8 ± 3.3 |
| SI | 69.1 ± 4.4a | 57.1 ± 6.4ab | 43.5 ± 5.3b |
| NCR | 0.52 ± 0.06 | 0.43 ± 0.07 | 0.62 ± 0.03 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты свидетельствуют о сильных различиях разнообразия и количественных показателей сообществ нематод между фитоценозами, отличающимися степенью развития кустарникового яруса. Исследования тундровых фитоценозов без выраженной ярусности также демонстрируют явную связь нематод с растительностью, проявляющуюся в увеличении разнообразия и численности с ростом обилия растительного покрова [21]. Видимо, как и в умеренных широтах, в тундровой зоне растительность является одним из ведущих факторов, определяющих распределение нематод.
Как и следовало ожидать, изменение характера растительности в значительной степени отразилось на нематодах, напрямую связанных с растениями (см. рис. 2). Численность фитогельминтов зависит от обилия и биомассы корней растений, наличия определенных видов хозяев и т.д. [33]. В нашем исследовании изменение данной трофической группы происходило в основном за счет представителей рода Heterodera, достигающих крайне высокого обилия на участке 3 (см. табл. 2). Именно данный участок характеризовался существенным развитием ивы, которая считается одним из хозяев этих фитопаразитических нематод [34].
Сильная связь нематод с растительностью может объяснять относительно слабую реакцию почвенных животных, и нематод в частности, на манипулирование температурами в тундровых экосистемах [35–37]. Относительно небольшая длительность экспериментов по нагреванию почвы на несколько градусов не позволяет проявиться выраженной реакции растений, а следовательно, и реакции почвенной фауны. С другой стороны, температура может регулировать жизненные циклы нематод, ускоряя или замедляя эмбриогенез, развитие и рост [38]. К сожалению, в настоящей работе температура не была включена в ординационный анализ из-за невозможности мониторинга данного показателя в каждой точке отбора проб. Однако весьма сильные различия температур (5–7°C между исследованными участками (см. рис. 1)), вероятно, могут вносить вклад в формирование облика нематодных сообществ рассматриваемых фитоценозов.
Различия комплексов нематод между исследованными участками довольно четко соответствовали изменению влажности почвы (см. рис. 3). Данный показатель является важным фактором, определяющим изменение численности и разнообразия нематод. Обычно их реакция носит прямой положительный характер [39, 40], однако в условиях переувлажнения отмечена отрицательная зависимость [41, 42]. Рассмотренные нами участки характеризовались весьма высокими показателями влажности, которые снижались в исследованном ряду (см. табл. 1), что могло стать одной из причин роста численности нематод (см. рис. 2а). В отличие от большинства таксонов представители рода Tripyla, наоборот, имели максимальное обилие на наиболее увлажненном участке 1 (см. табл. 2). Данный род является типичным представителем пресноводной фауны и широко представлен в переувлажненных местообитаниях [43].
Различия нематодных сообществ между участками ассоциировали с изменением ряда почвенных характеристик (см. рис. 4). В естественных условиях почвенные нематоды весьма чувствительны к pH, предпочитая менее кислую реакцию среды [44, 45]. На исследованных нами участках наименьшая кислотность была отмечена в крупноерниковой тундре (см. табл. 1), что может являться одной из причин высокой численности нематод в данном фитоценозе (см. рис. 2б). Возможно и опосредованное влияние – через изменение бактериального комплекса. Обилие и разнообразие бактерий обычно положительно коррелируют со значением pH [46, 47]. Поэтому высокая численность бактериотрофов на участке 3 может быть обусловлена такой взаимосвязью. Неорганический азот характеризуется негативным влиянием на нематод. При этом супрессирующее воздействие в основном ассоциировано с аммонийной формой и главным образом отражается на фитотрофах [48]. В нашем случае концентрация аммонийного азота была минимальна на участке 3, что очень хорошо согласуется с распределением фитотрофных нематод (см. рис. 1). Согласно литературным данным, нематоды напрямую не связаны с C/N субстрата, однако данный показатель имеет большое значение для почвенной микробиоты, в особенности в тундровых почвах [46, 49]. Низкие значения C/N свидетельствуют о значительной доступности субстрата, а следовательно, и о более высокой активности микроорганизмов. К тому же C/N обычно отрицательно коррелирует с разнообразием микробных сообществ [46]. Таким образом, уменьшение отношения углерода к азоту в исследованном ряду могло стать одной из причин различий численности нематод микробофагов, которые обычно тесно связаны со своим источником питания.
Исследованый нами ряд участков также может быть рассмотрен как некий условный пример, описывающий последствия изменения климата. В данном ряду наблюдаются увеличение степени развития кустарникового яруса и повышение температуры почвы, что является одним из наиболее характерных изменений, происходящих в тундровой зоне [8–10]. Несомненно, такой “пример” может быть рассмотрен только со значительными допущениями, однако в связи с невозможностью в настоящее время оценить долговременные последствия климатических изменений для почвенной фауны он позволяет сделать некоторые предположения уже сейчас. Так, климатические изменения и вызванная этим трансформация растительного облика тундры могут привести к росту общей численности и родовой насыщенности нематод, причем изменения будут протекать в основном за счет микробоядных и фитотрофных форм нематод.
Несмотря на довольно высокое общее количество (29) отмеченных родов нематод в данном исследовании, родовая насыщенность и значения индекса Шеннона имеют весьма низкие показатели (см. табл. 3). В бореальных лесах количество регистрируемых родов обычно варьирует от 20 до 30 в зависимости от типа леса, однако значения индекса Шеннона при этом достигают 3.0–3.5 [50]. Такая ситуация, с одной стороны, соответствует предположению о слабом снижении разнообразия нематод в высоких широтах северного полушария [36], с другой стороны, указывает на очень низкую выравненность распределения, что хорошо укладывается в представления о функционировании экосистем в экстремальных условиях.
Среди использованных нами эколого-фаунистических индексов EI и NCR слабо варьировали между фитоценозами. Невысокие значения EI указывают на относительно низкий уровень поступления органического вещества в почвенную пищевую сеть (см. табл. 3). Схожие результаты были отмечены и при изучении комплексов нематод в полярных пустынях [20]. В естественных экосистемах умеренных широт его значения обычно выше [51], что, вероятно, объясняется несколько большими скоростями поступления мертвого органического вещества в почву по сравнению с тундровой зоной. Данный индекс основан на высокой чувствительности с–р 1 бактериотрофов и с–р 2 микотрофов к изменению микробного пула вследствие поступления легкодоступного органического вещества [19]. Таким образом, невысокие значения EI могут быть обусловлены не только недостаточным поступлением органики, но и ее низким качеством. Например, наземный опад в кустарниковых и кустарничковых тундрах характеризуется высоким содержанием трудноразлагаемых соединений, прежде всего лигнина [52]. Необходимо отметить, что низкие значения EI обнаруживаются и в хвойных лесах [50].
Значения индекса NCR указывают на относительно равное соотношение бактериального и грибного энергетических каналов в исследованных местообитаниях (см. табл. 3), которое слабо варьирует вне зависимости от характера растительности и температурных условий в тундре. В свою очередь в арктических пустынях “нематодные” индексы указывают на абсолютное доминирование грибного канала [20], тогда как в умеренных широтах – на высокую роль бактерий в деструкции органического вещества [50]. Подобные результаты хорошо согласуются с глобальными оценками микробного сообщества, демонстрирующими увеличение доли грибного компонента в микробиоме с продвижением на север [53].
Значения индексов ΣMI и SI снижались в ряду от первого к третьему участку, указывая на увеличение степени нарушенности биотопов, снижение числа трофических связей и стабильности среды обитания в целом, хотя результаты измерений абиотических факторов дают основание полагать обратное. Мы предполагали, что в кустарничковой тундре (участок 1) в связи с суровым температурным режимом (см. рис. 1), значительным переувлажнением (см. табл. 1) и слабым развитием растительности индексы ΣMI и SI должны иметь минимальные значения. Как показал анализ литературы, такие несоответствия наиболее часто регистрируются в местообитаниях, отличающихся экстремальностью условий. Так, нематодные сообщества островов архипелага Кузов (Белое море) в ряде биотопов отличались доминированием хищников [54], которые имеют высокий ранг по c–p шкале (4–5) и определяют высокие значения индексов ΣMI и SI [19]. Согласно Л.И. Груздевой с соавт. [54], это было обусловлено скудными пищевыми ресурсами, которые могли удовлетворить лишь определенные виды нематод. На арктических и антарктических островах с крайне суровыми климатическими условиями индекс SI в ряде случаев достигал максимально возможных показателей [20]. В регулярно затопляемых местообитаниях он также отличался высокими показателями, что было обусловлено значительным развитием нематод, имеющих высокие значения по c–p шкале и способных использовать для питания водоросли [41, 42].
В противоположность общей тенденции роста численности нами было обнаружено снижение обилия хищных родов Tripyla и Prionchulus (c–p 3 и 4 соответственно), что, вероятно, и стало причиной уменьшения индексов ΣMI и SI в ряду участков. Видимо, в экстремальных экосистемах на фоне крайне неблагоприятных условий и угнетения нематодного сообщества в целом ряд таксонов за счет специфической реакции на определенные факторы среды и/или наличия подходящего источника питания могут увеличивать свою численность, что приводит к существенному росту значений индексов и искажению получаемой информации. В связи с этим требуются дополнительные исследования по апробации “нематодных” индексов в тундровой зоне с последующим определением ограничений их использования, а пока следует с осторожностью относиться к интерпретации значений ΣMI и SI, полученных в арктических и субарктических экосистемах.
Работа выполнена в рамках государственного задания по теме “Распространение, систематика и пространственная организация фауны и населения наземных и водных животных таежных и тундровых экосистем Европейского Северо-Востока России”, № Гр РК АААА-А17-117112850235-2, Парус-НИР 0414-2018-0005. Авторы выражают благодарность Е.М. Лаптевой и А.Н. Панюкову за помощь в выборе и описании участков, а также Ю.А. Холопову за помощь при отборе проб.
Список литературы
Bongers T. The maturity index: an ecological measure of environmental disturbance based on nematode species composition // Oecologia. 1990. V. 83. P. 14–19.
Ferris H., Venette R.C., van der Meulen H.R., Lau S.S. Nitrogen mineralization by bacterial-feeding nematodes: verification and measurement // Plant and Soil. 1998. V. 203. P. 159–171.
Irshad U., Villenave C., Brauman A., Plassard C. Grazing by nematodes on rhizosphere bacteria enhances nitrate and phosphorus availability to Pinus pinaster seedlings // Soil Biol. Biochem. 2011. V. 43. P. 2121–2126.
Griffiths B.S. Microbial-feeding nematodes and protozoa in soil – their effects on microbial activity and nitrogen mineralization in decomposition hotspots and the rhizosphere // Plant and Soil. 1994. V. 164. P. 25–33.
Мамилов А.Ш., Бызов Б.А., Покаржевский А.Д. Звягинцев Д.Г. Регуляция микрофауной биомассы и активности почвенных микроорганизмов // Микробиология. 2000. Т. 69. С. 727–736.
Neher D.A. Ecology of plant and free-living nematodes in natural and agricultural soil // Annual Review of Phytopathology. 2010. V. 48. P. 371–394.
Song D., Pan K., Tariq A. et al. Large-scale patterns of distribution and diversity of terrestrial nematodes // Appl. Soil Ecol. 2017. V. 114. P. 161–169.
Myers-Smith I.H., Forbes B.C., Wilmking M. et al. Shrub expansion in tundra ecosystems: dynamics, impacts and research priorities // Environ. Res. Lett. 2011. V. 6. P. 1–15.
Elmendorf S.C., Henry G.H.R., Hollister R.D. et al. Plot-scale evidence of tundra vegetation change and links to recent summer warming // Nat. Clim. Chang. 2012. V. 2. P.453–457.
Tape K., Sturm M., Racine C. The evidence for shrub expansion in northern Alaska and the Pan-Arctic Glob // Change Biol. 2006. V. 12. P. 686–702.
de Goede R.G.M., Bongers T. Nematode community structure in relation to soil and vegetation characteristics // Appl. Soil Ecol. 1994. V. 1. P. 29–44.
Cesarz S., Ruess L., Jacob M. et al. Tree species diversity versus tree species identity: driving forces in structuring forest food webs as indicated by soil nematodes // Soil Biol. Biochem. 2013. V. 62. P. 36–45.
Zhang X.K., Guan P.T., Wang Y.L. et al. Community composition, diversity and metabolic footprints of soil nematodes in differently-aged temperate forests // Soil Biol. Biochem. 2015. V. 80. P. 118–126.
Buckeridge K.M., Zufelt E., Chu H., Grogan P. Soil nitrogen cycling rates in low arctic shrub tundra are enhanced by litter feedbacks // Plant and Soil. 2010. V. 330. P. 407–421.
Chu H., Grogan P. Soil microbial biomass, nutrient availability and nitrogen mineralization potential among vegetation-types in a low arctic tundra landscape // Plant and Soil. 2010. V. 329. P. 411–420.
Sturm M., McFadden J.P., Liston G.E. et al. Snow-shrub interactions in Arctic tundra: A hypothesis with climatic implications // J. Clim. 2001. V. 14. P. 336–344.
Каверин Д.А., Пастухов А.В. Особенности температурного режима сезоннопромерзающих почв тундровых ландшафтов Европейского Северо-Востока России // Бюл. Почв. ин-та им. В.В. Докучаева. 2017. Вып. 87. С. 3–21.
Neher D.A. Role of nematodes in soil health and their use as indicators // J. of Nematology. 2001. V. 33. P. 161–168.
Ferris H., Bongers T., de Goede R.G.M. A framework for soil food web diagnostics: extension of the nematode faunal analysis concept // Appl. Soil Ecol. 2001. V. 18. P. 13–29.
Peneva V., Lazarova S., Elshishka M. et al. Nematode assemblages of hair-grass (Deschampsia spp.) microhabitats from polar and alpine deserts in the Arctic and Antarctic // Species and Communities in extreme environment. 2009. Pensoft Publishers and KMK Scientific Press. P. 419–438.
Kuzmin L.L. Free-living nematodes in the tundra of western Taimyr // Oikos. 1976. V. 27. P. 501–505.
Mulvey R.H. Some soil-inhabiting, fresh-water and plant-parasitic nematodes from the Canadian Arctic and Alaska // Arctic Journal. 1963. V. 16. P. 203–204.
Чернов Ю.И., Стриганова Б.Р., Ананьева С.И., Кузьмин Л.Л. Животный мир полярной пустыни мыса Челюскин // Арктические тундры и полярные пустыни Таймыра. Л.: Наука, 1979. С. 35–49.
Сочава В.Б., Городков Б.Н. Арктические пустыни и тундры // Растительный покров. Ч. 1. М., Л.: Наука, 1956. С. 61–139.
Таскаева А.А., Колесникова А.А., Конакова Т.Н., Кудрин А.А. Зооэдафон Восточно-Европейских тундр // Изв. Коми научного центра УрО РАН. 2017. Вып. 32. С. 15–24.
Oberman N.G., Mazhitova G.G. Permafrost mapping of Northeast European Russia based on period of the climatic warming of 1970–1995 // Norwegian J. Geography. 2003. V. 57. P. 111–120.
Yeates G.W., Bongers T., de Goede R.G.M. et al. Feeding habits in soil nematode families and genera: An outline for soil ecologists // J. of Nematology. 1993. V. 25. № 3. P. 315–331.
Okada H., Kadota I. Host status of 10 fungal isolates for two nematode species, Filenchus misellus and Aphelenchus avenae // Soil Biol. Biochem. 2003. V. 35. P.1601–1607.
Christensen S., Alphei J., Vestergard M., Vestergaard P. Nematode migration and nutrient diffusion between vetch and barley material in soil // Soil Biol. Biochem. 2007. V. 39. P. 1410–1417.
Yeates G.W. Nematodes as soil indicators: functional and biodiversity aspects // Biol. Fert. Soils. 2003. V. 37. P. 199–210.
Шитиков В.К., Мастицкий С.Э. Классификация, регрессия, алгоритмы Data Mining с использованием R. [Электронный ресурс]. 2017. https:// github.com/ranalytics/data-mining
Oksanen J., Blanchet F.G., Kindt R. et al. vegan: Community Ecology Package. R package version 2.0-2. 2011. URL: https://cran.r-project.org/web/packages/ vegan.
Кирьянова Е.С., Кралль Э.Л. Паразитические нематоды растений и меры борьбы с ними. Т. 1. Л.: Наука, 1969. 447 с.
Кирьянова Е.С. О структуре субкристалического слоя нематод рода Heterodera (Nematoda: Heteroderidae) с описанием двух новых видов // Паразитология. 1969. Вып. 1. С. 81–91.
Nielsen U.N., Wall D.H. The future of soil invertebrate communities in polar regions: different climate change responses in the Arctic and Antarctic? // Ecology Letters. 2013. V. 16. P. 409–419.
Ruess L., Michelsen A., Schmidt I.K., Jonasson S. Simulated climate change affecting microorganisms, nematode density and biodiversity in subarctic soils // Plant Soil. 1999. V. 212. P. 63–73.
Sohlenius B., Bostrom S. Effects of climate change on soil factors and metazoan microfauna (nematodes, tardigrades and rotifers) in a Swedish tundra soil – a soil transplantation experiment // Appl. Soil Ecol. 1999. V. 12. P. 113–128.
Trudgill D.L., Perry J.N. Thermal time and ecological strategies – a unifying hypothesis // Ann. Appl. Biol. 1994. V. 125. P. 521–532.
Schouten A.J., van Esbroek M.L.P., Alkemade J.R.M. Dynamics and stratification of functional groups of nematodes in the organic layer of a Scots pine forest in relation to temperature and moisture // Biol. Fertility Soils. 1998. V. 26. P. 293–304.
Sohlenius B., Wasilewska L. Influence of irrigation and fertilization on the nematode community in a Swedish pine forest soil // J. Appl. Ecol. 1984. V. 21. P. 327–342.
Okada H., Niwa S., Takemoto S. et al. How different or similar are nematode communities between a paddy and an upland rice fields across a flooding-drainage cycle? // Soil Biology & Biochemistry. 2011. V. 43. P. 2142–2151.
Кудрин А.А., Лаптева Е.М. Разнообразие и плотность населения почвенных нематод в пойменных лесах долины среднего течения реки Печора // Вест. Института биологии Коми НЦ УрО РАН. 2015. № 5 (193). С. 25–29.
Гагарин В.Г. Свободноживущие нематоды пресных вод СССР. СПб.: Гидрометеоиздат, 1992. 152 с.
Raty M., Huhta V. Earthworms and pH affect communities of nematodes and enchytraeids in forest soil // Biol. Fertil. Soils. 2003. V. 38. P. 52–58.
Hyvönen R., Persson T. Effects of acidification and liming on feeding groups of nematodes in coniferous forest soils // Biol. Fertil. Soils. 1990. V. 9. P. 205–210.
Chu H.Y., Fierer N., Lauber C.L. et al. Soil bacterial diversity in the Arctic is not fundamentally different from that found in other biomes // Environ Microbiol. 2010. V. 12. P. 2998–3006.
Rousk J., Baath E., Brookes P.C. et al. Soil bacterial and fungal communities across a pH gradient in an arable soil // The ISME. 2010. V. 4. P. 134–151.
Wei C.Z., Zheng H.F., Li Q. et al. Nitrogen addition regulates soil nematode community composition through ammonium suppression // PLoS ONE. 2012. V. 7. e43384.
Ni Y., Yang T., Zhang K. et al. Fungal communities along a small-scale elevational gradient in an alpine tundra are determined by soil carbon nitrogen ratios // Front Microbiol. 2018. V. 9. P. 1815.
Матвеева Е.М., Сущук А.А. Особенности сообществ почвенных нематод в различных типах естественных биоценозов: информативность параметров // Изв. РАН. Серия биол. 2016. № 5. С. 551–560.
Neher D.A., Weicht T.R. Nematode genera in forest soil respond differentially to elevated CO2 // J. Nematol. 2013. V. 45. P. 214–222.
Маслов М.Н. Углерод, азот и фосфор в тундровых экосистемах северной Фенноскандии: Дис. … канд. биол. наук. М.: МГУ им. Ломоносова, 2015.
Bahram M., Hildebrand F., Forslund S.K. et al. Structure and function of the global topsoil microbiome // Nature. 2018. V. 560. P. 233–237.
Груздева Л.И., Коваленко Т.Е., Матвеева Е.М. Особенности фауны нематод островов архипелага Кузова в Белом море // Проблемы изучения, рационального использования и охраны ресурсов Белого моря. Петрозаводск, 2005. С. 81–86.
Дополнительные материалы отсутствуют.


