Экология, 2020, № 1, стр. 5-15
Внутри- и межпопуляционная одонтологическая изменчивость красно-серой полевки (Craseomys rufocanus) и принцип компенсации Ю.И. Чернова
А. Г. Васильев a, *, В. Н. Большаков a, И. А. Васильева a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: vag@ipae.uran.ru
Поступила в редакцию 02.07.2019
После доработки 30.07.2019
Принята к публикации 06.08.2019
Аннотация
Методами геометрической морфометрии изучены географическая и хронографическая формы изменчивости конфигурации третьего верхнего щечного зуба (M3) у красно-серой полевки (C. rufocanus) – петрофильного вида, специализированного на Урале к горным местообитаниям. Установлено усиление степени полового диморфизма зуба от Южного к Полярному Уралу. На Среднем Урале выявлены различия формы M3 между годами с относительно высокой и низкой численностью вида, выраженные в наибольшей степени у самцов, которые обусловлены переключением морфогенеза зуба. Это позволяет предположить изменение морфофункциональных свойств зубов и связанных с ними трофических предпочтений самцов и самок, заключающихся в возможности потребления ими разного спектра кормовых ресурсов. Усиление полового диморфизма M3 к северу и в нетипичных низкогорных биотопах соответствует проявлению принципа компенсации Ю.И. Чернова на внутри- и межпопуляционном уровнях, способствуя снижению трофической конкуренции самцов и самок. Фенотипическая пластичность зубов обеспечивает виду популяционно-ценотическую устойчивость в климатически неблагоприятные годы, в нехарактерных биотопах и условиях гор Полярного Урала.
В последние годы в эволюционной экологии в русле концепции расширенного эволюционного синтеза (extended evolutionary synthesis) [1–3] широко обсуждается проблема быстрых морфогенетических перестроек видов за счет вызванных средовым стрессом эпигенетических изменений и их фиксации механизмами трансгенерационного наследования [4–6]. В этой связи актуальной задачей может стать изучение соотношения проявления хронографической и географической форм изменчивости у эвритопных неспециализированных и стенотопных специализированных видов. Эволюционно-экологическое исследование проблемы соотношения географической и хронографической изменчивости тесно связано с оценкой эволюционного потенциала вида, его фенотипической пластичности и эволвабильности [7, 8], т.е. способности к быстрым эволюционным перестройкам морфогенеза при климатических и/или антропогенных изменениях среды [9, 10].
Поиск адекватных природных моделей для изучения данной эволюционно-экологической и одновременно эколого-морфологической проблем заключается в подборе ситуаций, когда имеется возможность соотнести хронографическую и географическую (внутри- и межпопуляционную) формы изменчивости в природных условиях.
В качестве одной из таких моделей можно рассматривать выборки красно-серой полевки (Craseomys rufocanus Sundevall, 1846), добытые в конце XX в. на территории Урала. В Уральском регионе вид экологически проявляет себя как специализированный петрофил, приурочен к горным и низкогорным литоморфным биотопам от Южного до Полярного Урала. Полевка предпочитает хвойное и лиственное криволесье на краю каменистых россыпей (курумов), населяет горно-таежные ландшафты и формирует относительно изолированные островные популяции в подгольцовом поясе Уральских гор [11].
Молекулярно-генетические исследования показали [12], что внутривидовое генетическое разнообразие вида на большей части его ареала выражено крайне слабо. В европейской части ареала, в том числе на Урале, встречается общая группа сходных гаплотипов гена цитохром-b мтДНК (гаплогруппа C-1), появление и расселение которой датируется от 12 до 31 тыс. лет назад. Поэтому с эволюционно-экологических позиций представляет интерес соотнести проявление географической и хронографической форм изменчивости и морфоразнообразия (morphological disparity) красно-серой полевки как специализированного вида в географически удаленных популяциях Урала, учитывая относительно недавнее распространение представителей гаплогруппы С-1 на данной территории.
В соответствии с экологическим принципом компенсации Ю. И. Чернова [13] можно предполагать, что изменчивость вида в обедненных олиговидовых сообществах грызунов горных и, особенно, полярных северных биотопов, а также в нетипичных условиях низкогорий должна компенсаторно возрастать. Ранее мы встречали подобные компенсаторные эффекты на внутрипопуляционном уровне у широко распространенного эвритопного вида – рыжей полевки Clethrionomys glareolus [14] и специализированного к подземному роющему образу жизни вида – обыкновенной слепушонки Ellobius talpinus [15].
Поскольку экологическая специализация вида в первую очередь должна быть связана с его трофической специализацией, то это должно отразиться и на особенностях изменчивости щечных зубов. Конфигурация щечных зубов во многом определяет морфофункциональные возможности грызунов при первичной инструментально-механической обработке кормовых объектов [16].
Ранее в условиях вивария на ряде видов полевок было установлено [17, 18], что паттерны морфотипической изменчивости их зубов могут существенно измениться у представителей лабораторных колоний по сравнению с особями исходных природных родительских популяций из географически удаленных частей ареала. Экспериментальные исследования одонтологической изменчивости в разных условиях среды, однако, крайне ограничены [17, 19]. Для красно-серой полевки такие неонтологические исследования нам не известны, поэтому в рамках настоящей работы появляется возможность приблизиться к решению данной экоморфологической задачи.
В последние годы для описания изменчивости формы зубов полевок все шире применяются методы геометрической морфометрии, позволяющие анализировать изменчивость собственно формы морфологических объектов и исключить влияние их размеров [10, 20, 21]. Подчеркнем, что это допускает возможность морфогенетической интерпретации выявляемых различий [22]. Данный подход может быть применен для проверки гипотезы о компенсаторном повышении популяционного морфоразнообразия и изменчивости формы зубов полевок при воздействии на процесс развития неблагоприятных и/или нетипичных для вида эколого-климатических и/или ландшафтно-биотопических условий.
Поэтому цель работы состояла в оценке методами геометрической морфометрии проявлений хронографической и географической форм изменчивости конфигурации третьего верхнего щечного зуба (M3) красно-серой полевки на примере выборок обоих полов, собранных в горах Южного, Среднего и Полярного Урала и хранящихся в виде краниологических серий в Зоологическом музее ИЭРиЖ УрО РАН. При этом основная задача заключалась в оценке устойчивости формы жевательной поверхности зуба M3 в разных экологических условиях и специфики морфогенетической реакции особей разного пола на одни и те же условия обитания. Наибольший интерес представляло изучение и соотношение внутри- и межпопуляционной изменчивости M3 полевок с учетом их половой принадлежности.
МАТЕРИАЛ И МЕТОДЫ
Материалом для работы послужили краниологические коллекции Зоологического музея Института экологии растений и животных УрО РАН, представленные следующими выборками красно-серой полевки, добытыми в летние месяцы (июль–август) на Южном, Среднем и Полярном Урале: 1 – горный массив Рай-Из, Ямало-Ненецкий АО (Полярный Урал: 66°53′ с.ш., 65°46′ в.д.), 1975–1977 гг., 81 экз. (коллектор к.б.н. В.С. Балахонов); 2 – Висимский природный биосферный государственный заповедник, Свердловская обл. (Средний Урал: 57°28′ с.ш., 60°00′ в.д.), 1975 и 1977 гг., 95 экз. (коллектор к.б.н. К.И. Бердюгин); 3 – гора Иремель, Республика Башкортостан (Южный Урал: 54°30′ с.ш., 58°50′ в.д.), 1978–1979 гг., 73 экз. (коллектор к.б.н. О.Ф. Садыков). При анализе географической (межгрупповой) изменчивости сравнивали объединенные за разные годы, но подразделенные по полу выборки. Для внутрипопуляционного анализа хронографической изменчивости использовали материал из Висимского заповедника, который в 1975 г. был собран при высокой относительной численности популяции (22.8 особи на 100 лов.-сут, благоприятные условия: самцы – 22 экз., самки – 17 экз.), а в 1977 г. – при низкой (3.2 особи на 100 лов.-сут, неблагоприятные условия: самцы – 26 экз., самки – 30 экз.). На имеющемся коллекционном материале соотношение географической и хронографической форм изменчивости оценивали при параллельном сравнении выборок обоих полов, собранных в одни и те же годы (1975 и 1977) на Полярном и Среднем Урале.
Отловы во всех географических точках проведены с помощью линий ловушек-плашек в относительно сходных биотопических условиях на границе каменистых россыпей (курумов) и горно-таежных лесов. Исключение составляют выборки из популяции Висимского заповедника, добытые в хвойных и лиственных криволесьях и смешанных таежных лесах низкогорий Среднего Урала. Все изученные выборки представлены сеголетками обоих полов (ювенильные особи исключены). Соотношение числа изученных самцов и самок в выборках, собранных на Южном и Полярном Урале, приведено в табл. 1.
Таблица 1.
Сравнение центроидных размеров – CS (с учетом стандартных ошибок, ±SE) жевательной поверхности третьего верхнего щечного зуба (M3) самцов и самок красно-серой полевки в популяциях Полярного, Среднего и Южного Урала
| Локалитет: пол, год | Центроидный размер, число экз. |
|---|---|
| Полярный Урал: | |
| самцы, 1975–1977 | 831.60 ± 8.03 (42) |
| самки, 1975–1977 | 846.48 ± 8.24 (39) |
| Средний Урал: | |
| самцы, 1975 и 1977 | 857.16 ± 6.96 (48) |
| самки, 1975 и 1977 | 883.98 ± 7.67 (47) |
| самцы, 1975 | 874.76 ± 5.27 (22) |
| самки, 1975 | 895.46 ± 10.07 (17) |
| самцы, 1977 | 842.27 ± 11.35 (26) |
| самки, 1977 | 877.48 ± 10.50 (30) |
| Южный Урал: | |
| самцы, 1978–1979 | 834.73 ± 6.41 (38) |
| самки, 1978–1979 | 847.78 ± 8.98 (35) |
Для характеристики изменчивости формы жевательной поверхности щечного зуба M3 применили методы геометрической морфометрии [10, 20, 23–25]. Всего изучили 249 оцифрованных фотографий жевательной поверхности правых щечных зубов M3 полевок. Фотографии M3 выполнены с помощью фотоаппарата Canon Eos 450, установленного на микроскопе МБС-10 с разрешением 2400 dpi. На изображениях зубов с помощью программ tpsUtil [26] и tpsDig2 [27] разместили конфигурации 30 меток-ландмарок (landmarks), позволяющие характеризовать изменчивость формы (shape) жевательной поверхности зуба (рис. 1а, б). Предварительная двукратная повторная расстановка ландмарок не выявила значимых смещений оценок, связанных с ошибками оператора.
Рис. 1.
Размещение меток-ландмарок, характеризующих изменчивость формы жевательной поверхности третьего верхнего щечного зуба (M3) красно-серой полевки (a) и каркасная (wireframe) схема конфигурации ландмарок 1–30 (б).

Косвенную оценку общих размеров жевательной поверхности зубов выполнили на основе использования центроидного размера (CS – centroid size), который вычисляли как квадратный корень из суммы квадратов расстояний от центра конфигурации изображения до каждой из меток [23].
Суперимпозицию (superimposition) конфигураций ландмарок осуществили методом генерализованного Прокрустова анализа – GPA [23] с применением метода наименьших квадратов и вычислением прокрустовых координат (Procrustes coordinates) и относительных деформаций (Relative warps – RW), характеризующих изменчивость формы (shape) рисунка жевательной поверхности зубов. Межгрупповые различия конфигурации зубов оценивали с помощью методов дискриминантного анализа прокрустовых координат и канонического анализа относительных деформаций. Для оценки иерархии групповых различий между выборками по итогам канонического анализа выполнили кластерный анализ матрицы квадратов обобщенных расстояний Махаланобиса (D 2) методом UPGMA. Адекватную метрику дистанций при проведении кластерного анализа выбирали по наибольшему значению коэффициента кофенетической корреляции (cophenetic corr. – Rcoph).
Степень проявления полового диморфизма для разных показателей оценивали по формуле SDM = [(Xf/Xm) – 1]100, где Xf – среднее значение показателя у самок, а Xm – у самцов [28]. При многомерном анализе для этой цели использовали квадратированные обобщенные расстояния Махаланобиса (D2) с соответствующей оценкой уровней их значимости.
Оценки внутригруппового морфоразнообразия (morphological disparity) получили методом анализа паттерна ближайших соседних ординат (nearest neighbour point pattern analysis) в пределах групповых полигонов изменчивости [29, 30], построенных по значениям первых двух канонических переменных. Величина средней дистанции между ближайшими соседними ординатами MNND (mean nearest neighbor distance) и ее дисперсия VarNND характеризуют уровень внутригруппового морфоразнообразия, а в случае применения методов геометрической морфометрии возрастание этих показателей трактуется нами как увеличение веера морфогенетических траекторий [10].
Для оценки множественных межгрупповых различий по отдельным показателям использовали однофакторный дисперсионный анализ (One-Way ANOVA). Межвыборочные парные различия оценили на основе t-критерия и апостериорного теста по Q-критерию Тьюки (Tukey’s pairwise post-hoc Q-test).
При выполнении процедур геометрической морфометрии и методов статистического анализа использовали пакеты программ TPS [26, 27], PAST 2.17с [31], IMP [24] и MorphoJ 1.6d [25].
РЕЗУЛЬТАТЫ
Центроидные размеры зубов (CS) в объединенных выборках как самцов, так и самок Висимской популяции на Среднем Урале были достоверно больше (F = 10.85; d.f.1,2 = 2, 246; p < 0.0001), чем в таких же выборках Южного и Полярного Урала. При более детальном сравнении выборок разных полов в Висимской популяции установлено, что значения CS как у самок, так и у самцов при высокой численности в 1975 г. по величине были больше, чем в 1977 г. при низкой численности, однако значимое различие проявилось только у самцов (p < 0.01), отражая некоторое угнетение роста зверьков и соответственно их зубов в менее благоприятных условиях 1977 г. (см. табл. 1). При этом как в 1975, так и в 1977 гг. средний центроидный размер зубов у самок Висимской популяции имел тенденцию превышать таковой у самцов (см. табл. 1). Значимо этот эффект превышения CS у самок проявился в 1977 г. (p < 0.01). Общая тенденция более крупных размеров зубов у самок по сравнению с самцами (включая выборки разных лет) наблюдается во всех трех сравниваемых популяциях (см. табл. 1): в разных выборках показатель полового диморфизма (SDM) для CS колеблется от 1.6 до 4.2%.
В случайно выровненных по минимальному объему объединенных выборках средний CS у самцов составил 837.21 ± 4.57, а у самок – 863.13 ± 5.30 (t = 3.7; p = 0.00027). Показатель степени полового диморфизма в целом составил SDM = 3.1%. Площадь рисунка жевательной поверхности зуба, вычисленная в пределах контура, ограниченного ландмарками, в среднем также значимо (p < 0.001) была больше у самок. Наибольшая степень полового диморфизма по размерам и площади рисунка M3 проявилась в популяции Висимского заповедника в 1977 г.
Возможный аллометрический эффект изменения формы зуба в зависимости от его центроидного размера для выборок самцов и самок каждой популяции оценили с помощью линейной регрессии значений первой относительной деформации (RW1) по величине натуральных логарифмов центроидных размеров (LnCS) зубов в соответствии с существующими рекомендациями [24]. Предварительный анализ вариационного ряда значений RW1 выявил его бимодальность (двухвершинность), которая отражает различия между двумя характерными для вида морфотипами M3: “simplex” и “typica” [см. 17, 18, 32]. У первого из них на лингвальной стороне зуба в конфигурации талона имеется только один выступающий угол (третий), а у второго намечается или отчетливо проявляется еще и четвертый. Установлено, что в области нулевого значения RW1 проходит граница между зубами этих двух морфотипов.
Оценки линейной регрессии и корреляции RW1 и CS отдельно по каждому морфотипу (значения RW1 ниже нуля формально соответствуют морфе simplex, а выше нуля – typica) в обоих случаях не выявили каких-либо связей формы зуба с его размером (величины коэффициентов корреляции Пирсона близки к нулю и статистически незначимы). Поэтому в пределах зубов каждого морфотипа аллометрический эффект не проявился.
Для оценки географической изменчивости конфигурации M3 между выборками самцов и самок трех сравниваемых популяций Урала провели канонический анализ значений 42 первых относительных деформаций (RW1–RW42), характеризующих 97.4% общей дисперсии. В итоге установлено, что межгрупповые различия по форме M3 статистически значимы вдоль первых четырех канонических переменных, которые объясняют 96.8% дисперсии. Результаты канонического анализа приведены в табл. 2 и на рис. 2. Географические различия проявились главным образом вдоль первой канонической оси (CV1), на которую приходится 39.28% межгрупповых различий. Коэффициент корреляции Спирмена между значением CV1 и рангом географического положения выборок составил rs = 0.73 (p < 0.0001). Вдоль второй оси (CV2 – 30.92% дисперсии) от всех остальных отклоняются центроиды выборок самцов и самок популяции Среднего Урала. Можно полагать, что вдоль СV2 проявляются характерные ландшафтно-биотопические и/или высотные различия по форме M3 между двумя типично горными южной и северной популяциями, с одной стороны, и низкогорной центральной популяцией Висимского заповедника, с другой. Коэффициент корреляции Спирмена, характеризующий связь CV2 с рангом высоты местности точек сбора выборок, также оказался большим и значимым – rs = 0.68 (p < 0.0001). Изменчивость вдоль третьей канонической переменной CV3 (14.20% межгрупповой дисперсии) связана главным образом с полом (rs = 0.38; p < 0.0001).
Таблица 2.
Результаты канонического анализа относительных деформаций (RW), характеризующих изменчивость формы третьего верхнего щечного зуба M3 в выборках самцов и самок трех географически удаленных популяций красно-серой полевки Урала
| Локалитет, пол | Каноническая переменная | ||
|---|---|---|---|
| CV1 | CV2 | CV3 | |
| Центроиды выборок (±SE) | |||
| Полярный Урал, самцы | 1.544 ± 0.167 | 0.425 ± 0.199 | 0.361 ± 0.184 |
| Полярный Урал, самки | 0.798 ± 0.148 | 0.234 ± 0.130 | –0.497 ± 0.150 |
| Средний Урал, самцы | –0.176 ± 0.154 | –1.045 ± 0.143 | –0.246 ± 0.149 |
| Средний Урал, самки | –0.378 ± 0.135 | –0.807 ± 0.126 | 0.371 ± 0.150 |
| Южный Урал, самцы | –0.914 ± 0.149 | 0.922 ± 0.167 | 0.137 ± 0.141 |
| Южный Урал, самки | –0.930 ± 0.178 | 0.768 ± 0.174 | –0.111 ± 0.152 |
| Итоги канонического анализа | |||
| Λ Уилкса (Wilks’ Λ) | 0.0930 | 0.2137 | 0.4322 |
| Собственные числа | 1.2981 | 1.0220 | 0.4692 |
| Каноническая корреляция | 0.75 | 0.71 | 0.57 |
| Доля дисперсии, % | 39.28 | 30.92 | 14.20 |
| Критерий χ2 | 533.22 | 346.41 | 188.34 |
| Число степеней свободы (d.f.) | 205 | 160 | 117 |
| Уровень значимости | p < 0.0001 | p < 0.0001 | p = 0.00003 |
Рис. 2.
Результаты канонического анализа относительных деформаций (RW), характеризующих изменчивость формы M3 в выборках самцов (M) и самок (F) трех популяций красно-серой полевки: Полярного (P), Среднего (С) и Южного (S) Урала (ординаты центроидов выборок приведены с учетом их стандартных ошибок (±SE) в морфопространстве вдоль первых трех канонических осей – CV1–CV3).
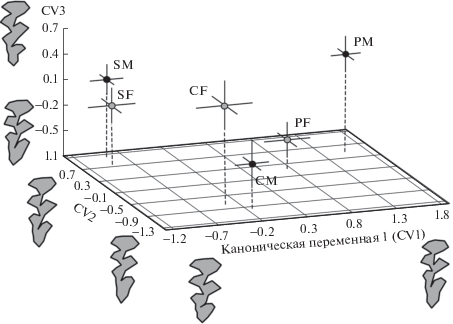
Географическая изменчивость проявилась в общем удлинении талона M3 и одновременно относительном сужении передней непарной петли зуба с юга на север (см. рис. 2). Ландшафтно-биотопическая специфика низкогорной Висимской популяции характеризуется общей тенденцией к увеличению просвета между дентиновыми полями передней части талона и смежного с ним треугольника. В свою очередь половые различия в наибольшей степени затрагивают форму талона, который у самок, как правило, имеет более простую конфигурацию, чаще приближаясь к морфотипу “simplex”. Обращает на себя внимание усиление половых различий от наиболее южной популяции к самой северной. Наибольшие половые различия по форме M3 выявлены в популяции Полярного Урала (D 2 = 4.043; p = 0.0002), промежуточные – на Среднем Урале (D 2 = 3.488; p = 0.0001), а наименьшие – на Южном Урале (D 2 = 2.117; p = 0.2876).
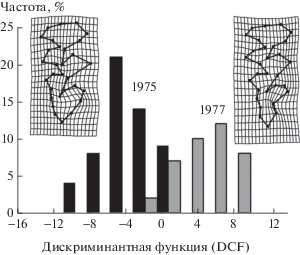
Поскольку строго совместить по годам все изученные выборки невозможно, рассмотрим отдельно хронографическую изменчивость на примере самцов и самок Висимской популяции на Среднем Урале. Дискриминантный анализ прокрустовых координат выборок в годы высокой и низкой численности выявил значимые (Лямбда Уилка (Wilk’s Λ) = 0.233; D 2 = 13.31; T 2 Хотеллинга (Hotelling’s T 2) = 305.82; d.f.1,2 = 4, 90; F = = 74.02; p < 0.0001) межгрупповые различия. На деформационных решетках изображены контрастные конфигурации ландмарок, соответствующие наименьшему и наибольшему значениям дискриминантной функции и характеризующие форму M3 в разные годы (рис. 3). Наибольшие различия проявились в строении талона, сложность которого возросла при низкой численности (намечается четвертый выступающий угол с лингвальной стороны). Доля относительно простых морфотипов зубов M3 (два входящих и три выступающих угла с лингвальной стороны и три входящих и три выступающих угла с буккальной) значимо различается в разные годы: в 1975 г. она составила 78.95 ± 5.40%, а в 1977 – 33.33 ± 12.10% (t = 3.44; p < 0.001), что хорошо согласуется с результатами дискриминантного анализа.
Рис. 3.
Результаты дискриминантного анализа прокрустовых координат формы щечного зуба M3 в Висимской популяции красно-серой полевки в 1975 г. (высокая численность) и 1977 г. (низкая численность). Изображены каркасные сплайны (wireframe splines) конфигураций ландмарок (landmarks) для минимального и максимального значений дискриминантной функции.
Существенные различия выявлены и при дискриминантном анализе формы зубов самцов и самок Висимской популяции без учета года сравнения (Лямбда Уилка = 0.354; D2 = 7.12; T 2 Хотеллинга = 169.18; d.f.1,2 = 4, 90; F = 40.92; p < 0.0001). В данном случае талон M3 самцов, как правило, имеет отчетливый третий входящий угол с лингвальной стороны зуба в отличие от большинства самок.
Наиболее интересен результат канонического анализа относительных деформаций, характеризующих изменчивость формы рисунка щечного зуба M3 в аллохронных выборках самцов и самок Висимской популяции (рис. 4). Значимые межгрупповые различия проявились вдоль всех трех канонических переменных. Межгрупповая дисперсия вдоль первых двух канонических осей составила 81.8%.
Рис. 4.
Результаты канонического анализа относительных деформаций (RW – relative warps) третьего верхнего щечного зуба (M3) выборок самцов (1, 3) и самок (2, 4) Висимской популяции красно-серой полевки в годы с высокой (1, 2) и низкой (3, 4) численностью.
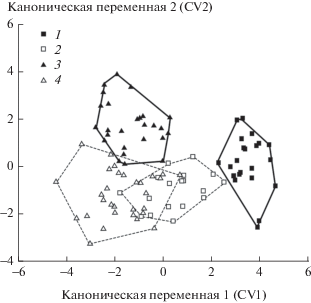
Из рис. 4 следует, что сильнее различаются по форме M3 выборки самцов, полигоны изменчивости которых наиболее разобщены вдоль первой канонической оси (на ее долю приходится 61.4% межгрупповой дисперсии). Выборки самок менее существенно различаются по форме M3, чем самцы, поскольку их полигоны изменчивости отчасти трангрессируют в плоскости, образованной CV1 и CV2. Примечательно, что на разных уровнях численности в Висимской популяции проявились значимые половые различия: полигоны изменчивости самок смещены по отношению к полигонам самцов и занимают специфическую область морфопространства (см. рис. 4). Таким образом, выявлено резкое переключение морфогенеза зуба у обоих полов при разных уровнях численности популяции. Половой диморфизм M3 при разной численности полевок фенотипически выражен по-разному. Если в 1975 г. при высокой численности половые различия проявляются и вдоль первой канонической оси, совпадая с направлением различий в форме M3 между годами, то в 1977 г. при низкой численности они наиболее четко выражены вдоль второй канонической оси.
Особый интерес представляло сравнение показателей среднего внутригруппового морфологического разнообразия (MNND) формы M3 самцов и самок Висимской популяции на разных уровнях численности. Из рис. 5 следует, что в 1975 г. среднее морфоразнообразие M3 у самцов значимо меньше, чем у самок, и достоверно ниже по величине, чем у самцов в 1977 г. Напротив, у самок высокий уровень морфоразнообразия наблюдается и в 1975 г., и в 1977 г. Интересно отметить, что дисперсия величин ближайших дистанций между соседними ординатами (VarNND) у самок в эти годы значимо выше, чем у самцов (1975 г.: F = 3.84; d.f.1,2 = 17, 22; p < 0.01; 1977 г.: F = 3.00; d.f.1,2 = 30, 26; p < 0.01). Следовательно, можно заключить, что у самцов в относительно благоприятных условиях 1975 г. низкий уровень внутригруппового разнообразия M3 сопровождается меньшей величиной его дисперсии (VarNND), т.е. морфогенез зуба протекает относительно стабильно. В 1977 г. на фоне низкой численности у самцов величина MNND и дисперсия NND значимо возрастают. Последнее косвенно указывает на усиление дестабилизации морфогенеза зуба в неблагоприятных условиях. У самок, судя по обоим показателям, дестабилизация морфогенеза M3 наблюдается как в 1975 г., так и в 1977 г.
Рис. 5.
Сравнение показателя внутригруппового морфоразнообразия (MNND) и его дисперсии (VarNND) с учетом их стандартных ошибок (±SE) в выборках самцов и самок Висимской популяции красно-серой полевки в 1975 и 1977 гг. в морфопространстве CV1 и CV2.

В заключение проанализируем результаты канонического анализа 14 первых относительных деформаций (RW1–RW14) зуба, позволяющего соотнести географическую и хронографическую формы изменчивости на примере синхронно собранных в 1975 и 1977 гг. выборок самцов и самок из двух популяций Полярного и Среднего Урала. Значимые межгрупповые различия проявились вдоль первых трех канонических осей, характеризующих 89.2% дисперсии. Ранговый корреляционный анализ Спирмена выявил сильную связь первой канонической переменной (CV1), на которую пришлось 47.3% дисперсии, с рангом географической локализации выборок с юга на север (rs = 0.77; p < 0.001). Вторая каноническая переменная (32.4% дисперсии) значимо коррелирует с фактором года сбора выборок, отражая в основном хронографические различия (rs = –0.63; p < 0.001). Третья ось (CV3), характеризующая 9.5% дисперсии, тесно связана с полом (rs = 0.38; p < 0.001). Поэтому, судя по величинам межгрупповой дисперсии вдоль первых трех канонических осей, можно заключить, что географическая изменчивость в данном случае превышает хронографическую, которая в свою очередь больше, чем изменчивость, обусловленная полом. Однако это усредненный эффект, который в каждой локальной популяции может проявляться по-разному.
По итогам анализа на основе матрицы квадратов обобщенных расстояний Махаланобиса (D2) между сравниваемыми выборками мы провели кластерный анализ (UPGMA), используя хордовую (Chord) метрику дистанций (ее выбор обусловлен наибольшим значением коэффициента кофенетической корреляции Rcoph = 0.90 по сравнению с другими метриками). Из рис. 6 следует, что структура кластера, отражая феномен географической изменчивости, иерархически включает два крупных субкластера, один из которых объединяет все выборки популяции Полярного Урала, а второй – все выборки Среднего Урала. Субкластер Полярного Урала далее четко разбивается на два иерархически подчиненных субкластера, характеризующих с одной стороны выборки самцов, а с другой – самок. Кластер каждого пола разбивается в этом случае на подчиненные субкластеры выборок 1975 и 1977 гг. Структура субкластера для выборок Среднего Урала представлена иначе. В данном случае выборки сначала подразделяются по годам, а затем в пределах каждого года – по полу. Поэтому хронографические и половые различия и их соотношение действительно проявляются в разных популяциях Полярного и Среднего Урала неодинаково.
Рис. 6.
Кластерный анализ (UPGMA) матрицы квадратов обобщенных расстояний Махаланобиса (D 2) по итогам канонического анализа относительных деформаций M3 между выборками самцов и самок красно-серой полевки, собранных параллельно на Полярном и Среднем Урале в 1975 и 1977 гг. (указано соотношение уровней географических (Геогр.), хронографических (Хроно.) и половых (Пол.) межгрупповых различий).

ОБСУЖДЕНИЕ
Фактически форма зубов у самцов и самок красно-серой полевки во многом различна, что указывает и на их трофическую специализацию, поскольку степень сложности зубов, характеризуемая числом входящих и выступающих углов призм, тесно связана с их инструментальными возможностями при первичной обработке кормовых объектов [16].
Анализ материала показал, что у красно-серой полевки на Урале по конфигурации и размерам щечного зуба M3 отчетливо проявились три формы межгрупповой изменчивости: географическая, хронографическая и половая. Географическая изменчивость зуба выражена в наибольшей степени и отражает особенности морфофункциональной адаптации вида к горным биотопам на разных широтах от Южного до Полярного Урала. Внутривидовая дифференциация популяций, сопровождающаяся проявлением географической изменчивости, реализовалась в регионе, судя по молекулярно-генетическим данным [12], за относительно короткий период времени – от 10 до 30 тыс. лет, в процессе заселения Урала полевками единой гаплогруппы C-1. При этом гаплотипы гена цитохрома-b мтДНК из популяций Среднего Урала (окр. с. Шигаево, Свердловская обл.) и Полярного Урала (окр. г. Лабытнанги, ЯНАО) почти идентичны [см. 12]. Другими словами, молекулярно-генетические изменения еще не успели сформироваться, тогда как локальные морфогенетические адаптивные перестройки M3 за это время уже возникли и закрепились, превышая по размаху хронографические межгодовые колебания. Вероятно, усилению и закреплению внутривидовых морфологических (географических) различий способствовали относительная пространственная и ландшафтно-биотопическая формы изоляции локальных популяций вида на Урале.
Разное соотношение двух форм групповой изменчивости M3 – хронографической и половой, в типичном горном ландшафте Полярного Урала и нехарактерном для вида низкогорном таежном ландшафте Висимского заповедника на Среднем Урале (см. рис. 6) можно истолковать следующим образом. В горах Полярного Урала на первый план выходит половой диморфизм M3, а хронографическая изменчивость выражена слабее. Иначе говоря, специализированный к жизни в горах вид за счет исторически выработанной возможности переключения морфогенеза, приводящего к усилению полового диморфизма в типичном горном биотопе, способен тем самым компенсировать и регулировать размах межгодовых (хронографических) колебаний формы M3. Напротив, на Среднем Урале в нетипичном для вида низкогорном ландшафте хронографическая изменчивость превышает уровень половых различий (см. рис. 6). Вероятно, морфогенетическая компенсация хронографической изменчивости только за счет усиления полового диморфизма в этих ландшафтно-климатических условиях для данного специализированного вида затруднена или невозможна. Тем не менее, как было показано, половые различия по форме M3 у красно-серой полевки на Среднем Урале не только выражены, но в разные годы проявились и резкие различия между самцами. Здесь же увеличиваются по сравнению с иными горными популяциями общие размеры зубов. На этом фоне в данной популяции резко возрастает общее разнообразие морфотипов M3, достигая 16 дискретных вариантов строения, тогда как в горных биотопах и на севере, и на юге в каждой популяции встречается не более 8 морфотипов зуба [32].
Обращает на себя внимание факт значимого возрастания внутригруппового разнообразия M3 у самок на Среднем Урале. В этой связи можно было предположить, что в отличие от самцов развитие самок красно-серой полевки на территории Висимского заповедника в 1975 г. могло быть осложнено влиянием летней засухи, охватившей большинство районов Урала и многие другие регионы страны. Ранее Г.В. Оленев [33] обнаружил, что в 1975 г. у близкого вида лесных полевок – рыжей полевки – на территории Ильменского заповедника в Челябинской области в засушливый год сеголетки не созрели и не участвовали в размножении. Зиму они пережили в полувзрослом состоянии и приступили к размножению только весной следующего года. Поэтому можно было ожидать, что действие засухи могло затронуть и более северные популяции другого вида лесных полевок – красно-серой. Однако размножение красно-серой полевки в Висимской популяции в 1975 г. протекало, в отличие от рыжей полевки, вполне успешно, а численность была высокой. Поэтому более вероятна другая причина проявления дестабилизации формы M3 у самок в 1975 и 1977 гг., которая могла заключаться в их общей инадаптивной морфогенетической реакции на развитие в нехарактерных для вида ландшафтно-биотопических условиях низкогорья.
На реальность феномена переключения морфогенеза зубов в данной популяции указывает резкое реверсивное изменение соотношения частот встречаемости двух характерных морфотипов M3 – simplex и typica у полевок Висимской популяции в близкие смежные годы. Наблюдавшееся изменение соотношения морфотипов на противоположное за такой короткий срок не может быть объяснено исключительно селективными причинами. Однако оно вполне может быть обусловлено быстрыми стрессовыми перестройками эпигенетических профилей ДНК, приводящими к пороговым переключениям морфогенеза [4, 5]. Механизмы и факторы порогового переключения морфогенеза из подпрограммы формирования морфотипа simplex в подпрограмму typica нам пока неизвестны, но они, как показало данное исследование, не обусловлены прямыми аллометрическими эффектами.
Если морфогенез M3 самцов красно-серой полевки в отличие от самок оказался устойчив к действию засухи 1975 г., то в экологически неблагоприятном 1977 г. у обоих полов усилилась его дестабилизация. Самки в нетипичных для вида ландшафтно-биотопических условиях низкогорья в Висимском заповеднике на Среднем Урале, по-видимому, в процессе развития испытывали стресс как в год высокой, так и в год низкой численности. Поэтому есть основания полагать, что специализированный к горным литоморфным биотопам вид-петрофил еще не вполне адаптирован к условиям таежного низкогорья и способен заселять их лишь в отдельные благоприятные годы.
ЗАКЛЮЧЕНИЕ
Полученные нами результаты хорошо согласуются с принципом компенсации Ю.И. Чернова [13] на меж- и внутрипопуляционном уровнях. В Висимской популяции в не характерных для вида условиях низкогорья по морфофункциональным свойствам зуба, связанным с трофической функцией, самцы и самки “компенсаторно” расходятся, формируя подобие двух, а при разных уровнях численности – трех специализированных в трофическом отношении “экоморф”. Тем самым особи-носители этих морф M3 компенсируют в сообществе роль других сопутствующих видов – потребителей иной части трофических ресурсов, но имеющих в данный год низкую численность. В этом отношении “экоморфы” выполняют в сообществе роль временно возникающих дополнительных “эковидов” [6], усиливая разнообразие не только популяции, но и сообщества. Феномен переключения морфогенеза полевок при разной плотности населения мы ранее наблюдали на примере хронографической изменчивости формы нижней челюсти в популяции рыжей полевки на Среднем Урале [14].
В относительно неблагоприятных условиях при низкой численности морфофункциональные различия между полами, обусловленные разной формой щечных зубов, сохраняются, но реализуется иная, чем при высокой численности, программа морфогенеза зубов. Тем самым происходит переключение морфогенеза M3, обеспечивающее смену инструментальных возможностей вида при механической обработке кормовых объектов.
Исторически сформировавшийся в каждой локальной популяции вида поливариантный спектр потенциальных морфогенетических подпрограмм обеспечивает возможность мобильных адаптивных перестроек развития в ответ на изменение условий обитания. Спектр вариантов индивидуального развития может различаться у самцов и самок как внутри популяции, так и между популяциями и позволяет усилить морфофункциональное разнообразие, способствующее снижению трофической конкуренции между полами и расширению трофических возможностей популяций. Усиление проявления полового диморфизма в конфигурации M3 от самой южной к самой северной популяции красно-серой полевки также может быть объяснено действием экологического принципа компенсации Ю.И. Чернова [13]. Обнаруженное нами в суровых условиях горных ландшафтов Полярного Урала с ограниченными трофическими ресурсами и низким ценотическим разнообразием грызунов возрастание внутрипопуляционного разнообразия в форме усиления полового диморфизма также может обеспечить снижение трофической конкуренции в популяции. Выявленные возможности быстрого дифференциального переключения морфогенеза щечных зубов у самцов и самок красно-серой полевки позволяют этому специализированному виду обеспечить популяционно-ценотическую устойчивость в климатически неблагоприятные годы, а также в форпостных поселениях нетипичных ландшафтов низкогорий и в более суровых условиях гор Полярного Урала.
Таким образом, феномен морфогенетической пластичности зубов полевок необходимо учитывать не только при внутривидовой диагностике и палеоэкологических интерпретациях [34], но и в эволюционной синэкологии [6] как эффект принципа компенсации Ю.И. Чернова [13], который проявляется и на внутри-, и на межпопуляционном уровнях.
Авторы благодарят Зоологический музей ИЭРиЖ УрО РАН и к.б.н. К.И. Бердюгина за предоставленную возможность работы с коллекциями. Благодарим А.В. Лунева за подготовку серии цифровых фотографий M3. Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН АААА-А19-119031890087-7, а также при частичной поддержке Комплексной программы фундаментальных исследований УрО РАН (проект № 18-4-4-28).
Список литературы
Pigliucci M. Do we need an extended evolutionary synthesis? // Evolution. 2007. V. 61. P. 2743–2749.
Dickins T., Rahman Q. The extended evolutionary synthesis and the role of soft inheritance in evolution // Proc. R. Soc. B. 2012. V. 278. P. 1721–1727.
Laland K.N., Uller T., Feldman M.W. et al. The extended evolutionary synthesis: its structure, assumptions and predictions // Philos. Trans. R. Soc. B.: Biol. Sci. 2015. V. 282. P. 1–14. https://doi.org/10.1098/rspb.2015.10
Jablonka E., Raz G. Transgenerational epigenetic inheritance: prevalence, mechanisms, and implications for the study of heredity and evolution // Q. Rev. Biol. 2009. V. 84. P. 131–176.
Burggren W. Epigenetic inheritance and its role in evolutionary biology: re-evaluation and new perspectives // Biology. 2016. V. 5. № 24. P. 2–22.
Васильев А.Г. Эволюционная экология в XXI веке: новые концепции и перспективы развития // Экология. 2019. № 2. С. 88–100. [Vasil’ev A.G. Evolutionary ecology in the 21st Century: new concepts and development prospects // Rus. J. Ecology. 2019. V. 50. № 2. P. 102–114.]
Wagner G.P., Draghi J. Evolution of evolvability // Evolution: the extended synthesis / Eds. Pigliucci M., Müller G.B. Cambridge, MA: MIT Press., 2010. P. 218–228.
Schlichting C.D., Wund M.A. Phenotypic plasticity and epigenetic marking: an assessment of evidence for genetic accommodation // Evolution. 2014. V. 68. P. 656–672.
Sterelny K. What is evolvability? // Philosophy of biology / Eds. Matthen M., Stephens C. The Netherlands, Amsterdam: Elsevier, 2007. P. 163–178.
Васильев А.Г., Васильева И.А., Шкурихин А.О. Геометрическая морфометрия: от теории к практике. М.: Тов-во научн. изд. КМК, 2018. 471 с.
Бердюгин К.И., Большаков В.Н., Балахонов В.С. и др. Млекопитающие Полярного Урала. Екатеринбург: Изд-во Урал. ун-та, 2007. 384 с.
Abramson N.I., Petrova T.P., Dokuchaev N.E. et al. Phylogeography of the gray red-backed vole Craseomys rufocanus (Rodentia: Cricetidae) across the distribution range inferred from nonrecombining molecular markers // Rus. J. Theriol. 2012. V. 11. № 2. P. 137–156.
Чернов Ю.И. Видовое разнообразие и компенсационные явления в сообществах и биотических системах // Зоол. журн. 2005. Т. 84. Вып. 10. С. 1221–1238.
Васильев А.Г., Васильева И.А., Городилова Ю.В., Добринский Н.Л. Принцип компенсации Ю.И. Чернова и влияние полноты состава сообщества грызунов на изменчивость популяции рыжей полевки (Clethrionomys glareolus) на Среднем Урале // Экология. 2017. № 2. С. 116–125. [Vasil’ev A.G., Vasil’eva I.A., Gorodilova Yu.V., Dobrinskii N.L. Chernov’s compensation principle and the effect of rodent community completeness on the variability of Bank Vole (Clethrionomys glareolus) population in the Middle Urals // Rus. J. Ecology. 2017. V. 48. № 2. P. 161–169.]
Васильев А.Г., Большаков В.Н., Евдокимов Н.Г., Синева Н.В. Морфоразнообразие моно‑ и полиморфных популяций обыкновенной слепушонки: реализуется ли “принцип компенсации” Ю.И. Чернова внутри популяции? // Докл. РАН. 2016. Т. 468. № 1. С. 118–121.
Воронцов Н.Н. Низшие хомякообразные (Cricetidae) мировой фауны. Ч. I. Морфология и экология. Фауна СССР. Млекопитающие. Л.: Наука, 1982. Т. III, вып. 6. 451 с.
Большаков В.Н., Васильева И.А., Малеева А.Г. Морфотипическая изменчивость зубов полевок. М.: Наука, 1980. 140 с.
Васильев А.Г., Васильева И.А. Гомологическая изменчивость морфологических структур и эпигенетическая дивергенция таксонов: Основы популяционной мерономии. М.: Тов-во научн. изд. КМК, 2009. 511 с.
Покровский А.В., Большаков В.Н. Экспериментальная экология полевок. М.: Наука, 1979. 147 с.
Павлинов И.Я., Микешина Н.Г. Принципы и методы геометрической морфометрии // Журн. общ. биол. 2002. Т. 63. № 6. С. 473–493.
Voyta L.L., Golenishchev F.N., Tiunov M.P. Analysis of shape and sizevariation of the first lower molar in the Far-Eastern grey voles of genus Alexandromys (Rodentia: Cricetidae) from Russian fauna using geometric morphometrics // Rus. J. Theriol. 2013. V. 12. № 1. P. 19–32.
Sheets H.D., Zelditch M.L. Studying ontogenetic trajectories using resampling methods and landmark data // Histrix. The Italian J. of Mammalogy. 2013. V. 24. № 1. P. 67–73.
Rohlf F.J., Slice D. Extension of the Procrustes method for the optimal superimposition of landmarks // Syst. Zool. 1990. V. 39. № 1. P. 40–59.
Zelditch M.L., Swiderski D.L., Sheets H.D., Fink W.L. Geometric morphometrics for biologists: A Primer. New York: Elsevier Acad. Press, 2004. 437 p.
Klingenberg C.P. MorphoJ: an integrated software package for geometric morphometrics // Mol. Ecol. Resour. 2011. V. 11. P. 353–357.
Rohlf F.J. TpsUtil. Version 1.60. Department of Ecology and Evolution, State University of New York, Stony Brook, 2013 (program).
Rohlf F.J. TpsDig2, digitize landmarks and outlines, version 2.17. Department of Ecology and Evolution, State University of New York at Stony Brook, 2013 (program).
Lovich J.E., Gibbons J.W. A review of techniques for quantifying sexual size dimorphism // Growth, Development & Aging. 1992. V. 56. P. 269–281.
Дэвис Д.С. Статистический анализ данных в геологии. Кн. 2. М.: Недра, 1990. 427 с.
Hammer Ø. New methods for the statistical analysis of point alignments // Computers and Geosciences. 2009. V. 35. P. 659–666.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological Statistics Software Package for Education and Data Analysis // Palaeontologia Electronica. 2001. V. 4. № 1. 9 p.
Васильев А.Г., Лунев А.В. Анализ изменчивости формы М3 красно-серой полевки Висимского заповедника методами геометрической морфометрии // Экологические исследования в Висимском биосферном заповеднике: Мат-лы науч. конф., посвящ. 35-летию Висимского заповедника. Екатеринбург: Сред.-Урал. кн. изд-во, 2006. С. 94–100.
Оленев Г.В. Популяционные механизмы приспособлений к экстремальным факторам среды (на примере рыжей полевки) // Журн. общ. биол. 1981. № 4. С. 506–511.
Borodin A.V., Markova E.A. Keys to identify modern and Pleistocene Arvicolines (Arvicolinae, Rodentia) from the Urals and Western Siberia based on odontological characteristics // Biology Bulletin. 2015. V. 42. № 7. P. 652–663.
Дополнительные материалы отсутствуют.


