Экология, 2020, № 5, стр. 392-396
Трофическая структура мелких беспозвоночных, населяющих подстилку муссонного тропического леса
Е. Э. Семенина a, *, О. Л. Розанова a, Нгуен Ван Тхинь b, А. В. Тиунов a, b
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
11907 Москва, Ленинский просп., 33, Россия
b Российско-Вьетнамский тропический научно-исследовательский и технологический центр
г. Хошимин, Вьетнам
* E-mail: sz-85@mail.ru
Поступила в редакцию 31.01.2020
После доработки 20.02.2020
Принята к публикации 26.02.2020
Одним из механизмов, формирующих структуру пищевых сетей, может быть распределение организмов по размерам. Размер организма – одно из наиболее фундаментальных свойств, которое определяет трофические взаимодействия, интенсивность метаболизма, плотность популяции [1]. Закономерное увеличение трофического уровня с размером тела хорошо прослеживается в водных экосистемах, в которых основными продуцентами являются микроскопические водоросли [2, 3]. Однако базовый пищевой ресурс (детрит) почвенных пищевых сетей не имеет характерного размера частиц. Анализ большого массива данных показал отсутствие корреляции между размером тела и трофическим уровнем у наземных, в том числе почвенных, животных [4]. Разнообразие размеров тела организмов в сочетании с отсутствием четкой размерной структуры почвенной пищевой сети предполагает наличие в ней размерных компартментов, члены которых имеют сходный размер [4]. Это не отменяет размерной упорядоченности трофических взаимодействий в пределах отдельных пищевых цепей: хищники в среднем крупнее своих жертв [5].
Реконструкции пищевых сетей обычно выполняются с использованием видов как основных единиц. Однако каждый вид почвенных беспозвоночных представлен набором онтогенетических стадий, которые различаются по массе тела на порядки. Более того, личиночные стадии беспозвоночных часто игнорируются при реконструкции структуры детритной пищевой сети, что связано с трудностью определения личинок до видового уровня. В свете этого мы сочли необходимым протестировать гипотезу о связи между размером тела и трофической позицией с использованием индивидуального подхода, т.е. отдельных особей в качестве операционных единиц.
Мелкие почвенные животные (клещи, коллемболы, личинки насекомых) представлены преимущественно микробофагами, однако многие из них охотно переходят на питание животным кормом [6]. С увеличением размера тела повышается вероятность перехода на более крупную добычу, в том числе к факультативному хищничеству или каннибализму. Действительно, трофическая позиция почвенных сапро/микробофагов может меняться в процессе онтогенеза, хотя этот вопрос мало исследован [7, 8]. В связи с этим в пределах отдельных компартментов пищевой сети можно ожидать наличие корреляции между размером и трофическим уровнем как у хищников-генералистов, так и у сапрофагов.
В качестве модельного сообщества было выбрано население подстилки тропического муссонного леса. Подстилка эфемерна и как оформленная страта формируется только на несколько месяцев сухого сезона. Она населена преимущественно микроартроподами и сопоставимыми с ними по размеру личинками представителей макрофауны. Энергетическую основу пищевых сетей в подстилке составляет, вероятно, разлагающая опад сапротрофная микрофлора. Целью нашего исследования было выявление трофической структуры комплекса мелких (до 50 мг сухого веса) подвижных артропод, населяющих лесную подстилку. Мы предполагали выявить степень разделения трофических ниш разных групп сапрофагов и хищников, а также протестировать гипотезу о наличии зависимости между размером (массой) тела и трофическим уровнем хищников и сапрофагов.
Для оценки трофической структуры был применен изотопный анализ. Изотопный состав азота (величина δ15N) отражает трофический уровень организма, а изотопный состав углерода (величина δ13С) зависит от базовых для пищевой цепи ресурсов [9]. Материал собран в национальном парке Кат Тьен, Южный Вьетнам (11.35–11.80° с.ш., 107.16–107.56° в.д.) в муссонном полулистопадном тропическом лесу на площадках “Лагерстремия” и “Приречная” [10]. На каждой площадке был произведен сбор подстилки с 8 участков площадью 1 м2. Подстилка была просеяна через сифтер и помещена в экстракторы Винклера, оборудованные нагревателями, что позволило сократить срок экстракции [11]. Размерный диапазон исследованных беспозвоночных был ограничен представителями мезофауны (коллемболы и орибатиды), длина тела которых составляла 0.5–5 мм, а также сопоставимыми с ними по размеру личинками и имаго представителей макрофауны (уховерки, псевдоскорпионы, мелкие пауки и жгутоногие пауки, хилоподы, опилионы, сверчки, богомолы, тараканы), длина тела которых не превышала 10 мм. Животные были высушены при 50°С в течение 3 суток и затем взвешены на микровесах Mettler Toledo XP6 с точностью до 1 мкг.
Изотопный анализ был выполнен в ЦКП при ИПЭЭ РАН. Изотопный состав азота и углерода выражали в тысячных долях (δ, ‰) отклонения от международного стандарта. Диапазон навесок животного материала составил 70–800 мкг. Для компенсации аналитической погрешности, связанной с измерением образцов малой массы, после каждого второго образца с малой навеской (менее 150 мкг) анализировали контрольный материал известного изотопного состава (глютаминовая кислота) схожей навески. После анализа данные были скорректированы с помощью уравнений линейной или логарифмической регрессии [12]. Ошибка определения величин δ13С и δ15N контрольного материала (SD, n = 10) не превышала 0.15‰ в образцах массой 150–800 мкг и 0.3‰ в образцах массой 70–150 мкг. Связь между логарифмом массы тела животных и их изотопным составом оценивали с помощью корреляции Пирсона.
Диапазон средних величин δ15Nair и δ13Cvpdb отдельных таксонов беспозвоночных достигал 10 и 3‰ соответственно (рис. 1). Изотопные подписи хищников формировали континуум величин δ15N – от 2.9‰ у сверчков семейства Gryllidae до 5.8‰ у богомолов (Mantodea), без четкого выделения трофических групп. Значительно повышенным содержанием 15N (7.7‰) отличались только жгутоногие пауки (Amblypygi).
Рис. 1.
Изотопный состав азота (δ15N) и углерода (δ15С) тканей мелких (<50 мг сухого веса) подвижных беспозвоночных, собранных из листового опада на территории национального парка Кат Тьен (средние значения ± стандартная ошибка средней): черными точками выделены наиболее полно представленные в выборке таксономические группы (≥10 экз.); в скобках указано число проанализированных особей; 1–9 – другие таксономические группы (в порядке уменьшения величины δ15N): 1 – Amblypygi (3), 2 – Mantodea (2), 3 – Scorpiones (2), 4 – Staphylinidae (5), 5 – Opiliones (9), 6 – Dermaptera (7), 7 – Tettigoniidae (9), 8 – Mogoplistidae (7), 9 – Diplopoda (4).
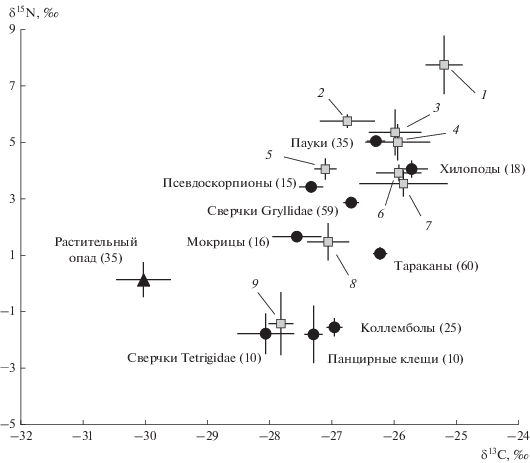
Сапрофаги/микробофаги распадались на две группы по величине δ15N. Наименьшие величины δ15N (≤ –1.0‰), т.е. примерно на 1‰ ниже, чем в опаде, имели коллемболы, панцирные клещи, личинки сверчков семейства Tetrigidae. Низкие величины δ15N обычно связывают с фикофагией (питанием водорослями и лишайниками) [13]. Еще более низкие величины δ15N (–3.7‰) характерны для специализированных термитов-лихенофагов Hospitalitermes bicolor [14]. Повышенную относительно опада и типичную для подстилочных микробо/сапрофагов [15] величину δ15N (>1.0‰) имели тараканы, мокрицы, личинки сверчков семейства Mogoplistidae.
Диапазоны масс отдельных особей хищников и сапрофагов в выборке полностью пересекались (рис. 2). Средняя масса хищников (3.9 ± 0.7 мг сухого веса; n = 134) и сапрофагов (4.0 ± 0.8 мг; n = = 118) также не различалась. Корреляционный анализ выявил слабую (R2 = 0.063), но статистически значимую (P = 0.003) зависимость величины δ15N от массы тела у хищников и даже более выраженную зависимость у сапрофагов (R2 = 0.159; рис. 2а). В пределах отдельных таксономических групп статистически значимая (Р < 0.05) положительная корреляция была обнаружена только у пауков (n = 35) и сверчков семейства Tetrigidae (n = 10). Можно предположить, что рост величины δ15N (т.е. трофического уровня) у более крупных пауков связан с включением хищных беспозвоночных (в том числе других пауков) в состав диеты. У сверчков-тетригид увеличение δ15N с размером может быть связано с переходом на иную диету, включающую меньшую долю почвенных водорослей.
Рис. 2.
Корреляция между массой тела подстилочных хищников и сапрофагов и величиной δ15N, которая отражает трофический уровень (а), и величиной δ13С, которая отражает разнообразие источников углерода (б). Корреляция между массой тела и величиной δ13С у хищников была статистически незначима.
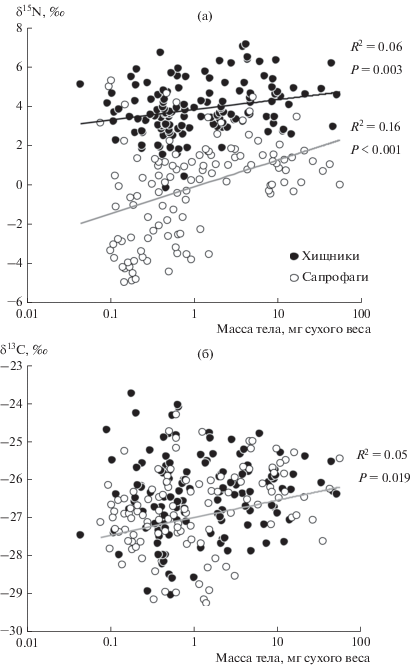
Связь между массой тела и величиной δ13С отсутствовала в выборке хищников и была маргинально значимой (P = 0.019) у сапрофагов. Однако необходимо отметить хорошо выраженную тенденцию к снижению вариации величины δ13С отдельных особей по мере увеличения массы. Как у хищников, так и у сапрофагов массой менее 10 мг диапазон величин δ13С достигал 5‰, а у животных массой более 10 мг не превышал 3‰ (рис. 2б). Аналогично у сапрофагов с увеличением массы снижалась вариация величин δ15N (см. рис. 2а).
Результаты нашей работы подтверждают ряд важных положений. Все исследованные животные были существенно (на 2‰ и более) обогащены 13С по сравнению с растительным опадом. Этот “детритный сдвиг” отражает преимущественное питание сапротрофной микрофлорой, а не собственно растительными остатками [15, 16]. С другой стороны, даже в относительно простой системе выявлена выраженная дифференциация трофических ниш отдельных таксонов.
Гипотеза о возможной связи массы тела и трофического уровня организмов подтвердилась лишь частично. В пределах исследованного диапазона масс (от 0.07 до 50 мг сухого веса) размер особи не указывает на ее принадлежность к хищникам или сапро/микробофагам. Однако положительная корреляция массы и трофического уровня предполагает, что некоторым фрагментам почвенных пищевых сетей присуща размерная упорядоченность. Необходимо отметить, что в детритных пищевых сетях животные и микробные компоненты тесно переплетены и понятие трофического уровня имеет свои особенности. Высокий трофический уровень могут занимать как консументы второго и третьего порядков (высшие хищники), так и животные, замыкающие длинные микробные пищевые цепи (гумифаги) [4, 17].
Увеличение размера тела было сопряжено также с уменьшением разнообразия величин δ13С, что можно интерпретировать как снижение трофической специализации. Это предполагает, что более крупные консументы – как хищники, так и сапрофаги, связаны сразу с несколькими пищевыми цепями, получающими энергию из разных источников.
Таким образом, в комплексе мелких подвижных артропод, населяющих эфемерную подстилку тропического леса, увеличение индивидуального размера особей хищников и сапрофагов ассоциировано с повышением трофического уровня (в том числе микробного) и интеграцией разных потоков вещества и энергии. Выраженная зависимость трофической позиции и других экологических свойств от размера особи у хищников вполне соответствует теории и хорошо показана экспериментально [18], но в отношении сапрофагов таких данных намного меньше.
Работа выполнена при финансовой поддержке РФФИ (проект № 18-04-01200).
Список литературы
White E.P., Ernest S.K.M., Kerkhoff A.J., Enquist B.J. Relationships between body size and abundance in ecology // Trends Ecol. Evol. 2007. 22. P. 323–330. https://doi.org/10.1016/j.tree.2007.03.007
Cohen J.E., Pimm S.L., Yodzis P., Saldana J. Body sizes of animal predators and animal prey in food webs // J. Anim. Ecol. 1993. V. 62. P. 67–78. https://doi.org/10.2307/5483
Shurin J.B., Gruner D.S., Hillebrand H. All wet or dried up? Real differences between aquatic and terrestrial food webs // Philos. Trans. R. Soc. B. 2006. V. 273. P. 1–9. https://doi.org/10.1098/rspb.2005.3377
Potapov A.M., Brose U., Scheu S., Tiunov A.V. Trophic position of consumers and size structure of food webs across aquatic and terrestrial ecosystems // Amer. Nat. 2019. V. 194. P. 823–839. https://doi.org/10.1086/705811
Brose U., Jonsson T., Berlow E.L. et al. Consumer-resource body-size relationships in natural food webs // Ecology. 2006. V. 87. P. 2411–2417. https://doi.org/10.1890/0012-9658(2006)87[2411: CBRINF]2.0.CO;2
Чернова Н.М., Бокова А.И., Варшав Е.В. и др. Зоофагия у коллембол // Зоол. журн. 2007. Т. 86. № 8. С. 899–911.
Potapov A.M., Semenyuk I.I., Tiunov A.V. Seasonal and age-related changes in the stable isotope composition (15N/14N and 13C/12C) of millipedes and collembolans in a temperate forest soil // Pedobiologia. 2014. V. 57. P. 215–222. https://doi.org/10.1016/j.pedobi.2014.09.005
Samoylova E.S., Tiunov A.V. Flexible trophic position of polyphagous wireworms (Coleoptera, Elateridae): A stable isotope study in the steppe belt of Russia // Appl. Soil Ecol. 2017. V. 121. P. 74–81. https://doi.org/10.1016/j.apsoil.2017.09.026
Potapov A.M., Tiunov A.V., Scheu S. Uncovering trophic positions and food resources of soil animals using bulk natural stable isotope composition. // Biol. Rev. 2019. V. 94. P. 37–59. https://doi.org/10.1111/brv.12434
Тиунов А.В. (ред.) Структура и функции почвенного населения тропического муссонного леса (национальный парк Кат Тьен, Южный Вьетнам). М.: КМК, 2011. 277 с.
Semenina E.E., Anichkin A.E., Shilenkova O.L. et al. Rapid extraction of invertebrates from tropical forest litter using modified Winkler apparatus // J. Trop. Ecol. 2015. V. 31. P. 191–194. https://doi.org/10.1017/S0266467414000698
Kudrin A.A., Tsurikov S.M., Tiunov A.V. Trophic position of microbivorous and predatory soil nematodes in a boreal forest as indicated by stable isotope analysis // Soil Biol. Biochem. 2015. V. 86. P. 193–200. https://doi.org/10.1016/j.soilbio.2015.03.017
Potapov A.M., Korotkevich A.Yu., Tiunov A.V. Non-vascular plants as a food source for litter-dwelling Collembola: Field evidence // Pedobiologia. 2018. V. 66. P. 11–17. https://doi.org/10.1016/j.pedobi.2017.12.005
Tsurikov S.M., Ermilov S.G., Tiunov A.V. Trophic structure of a tropical soil-and litter-dwelling oribatid mite community and consistency of trophic niches across biomes // Exp. Appl. Acarol. 2019. V. 78. P. 29–48. https://doi.org/10.1007/s10493-019-00374-4
Potapov A.M., Semenina E.E., Kurakov A.V., Tiunov A.V. Large 13C/12C and small 15N/14N isotope fractionation in an experimental detrital foodweb (litter-fungi-collembolans) //Ecol. Res. 2013. V. 28. P. 1069–1079. https://doi.org/10.1007/s11284-013-1088-z
Tiunov A.V., Semenina E.E., Aleksandrova A.V. et al. Stable isotope composition (δ13C and δ15N values) of slime molds: placing bacterivorous soil protozoans in the food web context // Rapid Commun. Mass Spectrom. 2015. V. 29. P. 1465–1472. https://doi.org/10.1002/rcm.7238
Steffan S.A., Chikaraishi Y., Currie C.R. et al. Microbes are trophic analogs of animals // PNAS. 2015. V. 112. P. 15 119–15 124. https://doi.org/10.1073/pnas.1508782112
Laigle I., Aubin I., Digel C. et al. Species traits as drivers of food web structure // Oikos. 2018. V. 127. P. 316–326. https://doi.org/10.1111/oik.04712
Дополнительные материалы отсутствуют.


