Экология, 2021, № 1, стр. 51-57
Популяционные циклы и синдром Читти
И. А. Кшнясев a, *, Ю. А. Давыдова a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: kia@ipae.uran.ru
Поступила в редакцию 24.03.2020
После доработки 03.06.2020
Принята к публикации 11.06.2020
Аннотация
Исследованы многолетняя (1982–2019 гг.) динамика населения мелких млекопитающих в южно-таежных лесах Среднего Урала и изменчивость размерных (масса и длина тела) признаков доминирующего вида – рыжей полевки. Обнаруженное нами ранее спонтанное изменение режима динамики – переход от регулярного трехлетнего цикла к нециклическому режиму – позволило оценить влияние различных факторов на эффект Читти (увеличение размеров грызунов при их высокой численности) при разных режимах. В режиме трехлетней регулярности эффект Читти в популяции рыжей полевки был ярко выражен: в фазах “роста” и “пика” средние размеры животных больше, чем в фазе “депрессии”; в нециклическом режиме наблюдали промежуточные значения этих признаков. На размеры животных в большей степени влияет не уровень численности, а факторы, определяющие их физиологическое (в том числе репродуктивное) состояние.
Циклический характер многолетней динамики популяций множества видов животных привлекает внимание на протяжении столетий. Упоминания о вспышках численности леммингов в Скандинавии встречались уже в XVI в. [1], а иллюстрации колебаний заготовок шкурок зайца и рыси в Канаде в XIX–XX вв. вошли в учебники экологии [2]. Однако идентификацию механизмов многолетних циклов – повторяющихся пиков и спадов численности животных – до настоящего времени относят к числу нерешенных проблем популяционной экологии [3–5].
Одним из источников данных для горячих дебатов о потенциальных драйверах циклов служат наблюдения за динамикой населения мелких млекопитающих в бореальных экосистемах. Свидетельство тому – неубывающее число публикаций и десятки предложенных гипотез для ее объяснения [6–8]. Одни исследователи объясняют связь колебаний численности с абиотическими факторами среды (например, погодно-климатическими), другие – с биотическими (обилием кормов, конкуренцией, стрессом, прессом хищников, болезнями) [9–14]. В целом динамику населения рассматривают как результат интерференции абиотических и биотических факторов, однако очевидно, что детали ее механизмов изучены недостаточно.
В середине XX столетия Дэнис Читти выдвинул гипотезу о генетической детерминации популяционного цикла [15, 16]. Тогда же был описан и так называемый “эффект Читти” – увеличение массы и размеров тела грызунов при их высокой численности. Д. Читти наблюдал за населением Microtus agrestis в графстве Монтгомеришир (Уэльс), позже аналогичные особенности наблюдали в других местах и на других видах [17–23]. Несмотря на возражения Д. Лэка [24], сторонника концепции трофического лимитирования, и генетиков, акцентирующих внимание на крайне низких скоростях естественного отбора, которые не могут дать ничего существенного в экологическом масштабе времени, Д. Читти предположил, что в популяциях грызунов в разные фазы цикла происходит очень быстрый альтернативный отбор генотипов с ранним или, наоборот, поздним созреванием.
Изменчивость многих морфофизиологических (экстерьерных и интерьерных) признаков сравнивали и в нециклических популяциях видов, и в разных местообитаниях при разной численности [20, 25, 26]. Однако изменение размерных признаков в популяциях одного вида при разных режимах динамики численности не исследовали. Зарегистрированная нами ранее смена режимов динамики населения мелких млекопитающих [27] позволяет провести такое исследование. Однако без учета возраста и репродуктивных характеристик животных можно попасть в ловушку “qui pro quo” – принять следствие существенного сдвига в репродуктивно-возрастной структуре населения в разные фазы популяционного цикла за эффект Читти – отбор разных генотипов.
Цель нашей работы – количественная оценка эффектов факторов (возраст, пол, репродуктивный статус, фаза цикла и режим динамики), влияющих на размерные признаки рыжей полевки.
МАТЕРИАЛ И МЕТОДЫ
В работе использованы материалы долговременных наблюдений за динамикой мелких млекопитающих (1982–2019 гг.), населяющих коренные пихтово-еловые леса Висимского государственного природного биосферного заповедника (ВГПБЗ, южная темнохвойная тайга, Средний Урал, 57°22′ с. ш., 59°46′ в. д., 538 м над ур. м.). Учеты мелких млекопитающих проводили на стационарных участках методом ловушко-линий с помощью ловушек-плашек и деревянных трапиковых живоловок три раза в год: весной, летом и осенью, а с 2004 г. и в зимний период.
Для анализа многолетней динамики мелких млекопитающих объединили собственные данные (1995–2019 гг., по 200 лов./сут. тур) и наблюдения Ю.Ф. Марина (1982–2006 гг., по 1 тыс. лов./сут. весной и осенью), проводимые на других участках заповедника (расстояние ≤14 км). Для увеличения ряда наблюдений важно было оценить согласованность результатов учетов численности мелких млекопитающих, получаемых с помощью стандартных методов, и возможность объединения нескольких рядов наблюдений в один. Мы оценили величину “невязки” в результатах, полученных двумя группами исследователей за 12 лет параллельно проводимых учетов (1995–2006 гг.). Оказалось, что временны́е ряды могут быть объединены без какой-либо специальной коррекции, поскольку оценка смещения существенно не отличается от нуля (0.25 ± 0.34, 95%-ный доверительный интервал (ДИ) –0.44–0.95).
Рыжая полевка (Clethrionomys glareolus Schreber, 1780) [28] преобладала в учетах населения мелких млекопитающих исследуемого участка (размах доли в учетах 0.3–1.0, медиана – 0.7), что позволило данные о динамике всего сообщества мелких млекопитающих считать адекватными и для вида-доминанта. У полевок (1995–2019 гг., n ≤ 1834, только собственные данные) определяли пол, репродуктивный статус и вариант онтогенеза (созревающие и несозревающие в год рождения).
Определение репродуктивно-возрастного статуса актуально для мышевидных грызунов бореальной зоны, характеризующихся бивариантным онтогенезом. Бивариантный онтогенез – частный случай поливариантного онтогенеза – обеспечивает перераспределение репродуктивных усилий в популяции [29], при котором одна часть животных созревает в год своего рождения, другая – на следующий год после зимовки. При этом реализация той или иной траектории развития зависит от времени рождения особи, состояния популяции и других факторов [30].
Массу тела животных измеряли с точностью 0.1 г, длину тела (расстояние от кончика морды до анального отверстия) – с точностью 1 мм. Календарный возраст полевок определяли по методике Г.В. Оленева – точность измерения (5–35 дней) зависит от возраста [31].
Данные измерений (длина тела и логарифм массы тела) моделировали с помощью аппарата теории обобщенных линейных моделей GRM/GLM [32], позволяющей оценить тот или иной фактор при учете эффекта остальных: Y = b0 + ΣbiXi + ε. Статистически оптимальной из набора конкурирующих признавали модель с минимальным значением критерия Маллоуза Cp, который интерпретируется как эффективная размерность (см. Приложение, табл. 1s, 2s ). Предикторами (Xi) служили один непрерывный признак (логарифмированное по основанию 10 значение календарного возраста, измеряемого в днях) и до шести бинарных признаков (пол, репродуктивный статус, визуально диагностируемая беременность, вариант онтогенеза, маркеры фазы цикла и режима). Фазы популяционного цикла (“депрессия”, “рост”, “пик”) и нециклический режим (НЦ) параметризовали либо как категориальный фактор с 4 уровнями, либо при помощи K-1 бинарных (0 или 1) индикаторных переменных, маркирующих соответствующие фазы цикла. Поскольку животные могут быть классифицированы по фазам отлова или рождения, то для сеголеток значения идентичны, но для зимовавших особей возникает лаг в один год. Коллинеарность предикторов контролировали по значению “коэффициента инфляции” (VIF = 1/[1 – R2(XiX•)], все значения VIF ≤ 3). Заметим, что зимние учеты позволили избежать коллинеарности календарного возраста и репродуктивного статуса и не использовать в качестве предиктора принадлежность животного к какой-либо репродуктивно-возрастной группе.
Таблица 1.
Оценки параметров лучших (Cp = min = 8.0) регрессионных моделей для описания изменчивости массы и длины тела рыжей полевки
| Предикторы, xi | β | b | se(b) | t(df*) | p ≤ | Exp(b) | 95% ДИ | |
|---|---|---|---|---|---|---|---|---|
| Ln(масса тела, г) = b0+ Σbixi + ε; R = 0.84, F(7; 1145) = 384.6, MSR = 0.02 | ||||||||
| Log10(возраст) | 0.58 | 0.42 | 0.020 | 21.43 | 0.001 | 1.52 | 1.46 | 1.58 |
| Зрелость | 0.32 | 0.16 | 0.014 | 11.64 | 0.001 | 1.18 | 1.14 | 1.21 |
| Онтогенез | 0.20 | 0.13 | 0.017 | 7.27 | 0.001 | 1.14 | 1.10 | 1.17 |
| Беременность | 0.16 | 0.13 | 0.016 | 8.46 | 0.001 | 1.14 | 1.11 | 1.18 |
| “Депрессия” | –0.16 | –0.17 | 0.018 | –9.45 | 0.001 | 1.19–1 | 1.23–1 | 1.15–1 |
| НЦ | –0.13 | –0.08 | 0.010 | –7.77 | 0.001 | 1.08–1 | 1.11–1 | 1.06–1 |
| Пол | 0.05 | 0.02 | 0.009 | 2.66 | 0.008 | 1.02 | 1.01 | 1.04 |
| b0 | 2.07 | 0.040 | 51.91 | 0.001 | 7.95 | 7.35 | 8.59 | |
| Длина тела (мм) = b0+ Σbixi + ε; R = 0.84, F(7; 968) = 319.3, MSR = 26.3 | ||||||||
| Log10(возраст) | 0.47 | 12.1 | 0.735 | 16.54 | 0.001 | 10.7 | 13.6 | |
| Зрелость | 0.45 | 8.4 | 0.544 | 15.44 | 0.001 | 7.3 | 9.5 | |
| НЦ | –0.19 | –3.9 | 0.389 | –10.05 | 0.001 | –4.7 | –3.1 | |
| “Депрессия” | –0.15 | –6.7 | 0.773 | –8.61 | 0.001 | –8.2 | –5.1 | |
| Онтогенез | 0.07 | 1.5 | 0.678 | 2.27 | 0.02 | 0.2 | 2.9 | |
| Беременность | 0.06 | 2.0 | 0.652 | 3.11 | 0.002 | 0.7 | 3.3 | |
| Пол | 0.05 | 0.9 | 0.357 | 2.45 | 0.01 | 0.2 | 1.6 | |
| b0 | 67.7 | 1.500 | 45.15 | 0.001 | 64.8 | 70.6 | ||
При визуализации контрастов средних значений для фаз популяционного цикла (см. рис. 2) использовали однофакторный дисперсионный анализ, где новой зависимой переменной служили остатки (отклонения от ожидаемого значения) из модели нелинейного роста или редуцированной модели со всеми релевантными предикторами, за исключением интересующего фактора – фазы цикла. Таким образом, мы несколькими способами статистически могли оценить и удалить частные эффекты таких сопутствующих (не интересующих нас в данном исследовании, но неизбежно присутствующих) факторов, как календарный возраст, вариант онтогенеза и др. Наиболее консервативная оценка контраста “депрессия – прочие годы” была выполнена по цензурированным данным (только зимовавшим животным) с помощью непараметрических критериев – медианного (Х2, хи-квадрат) и Краскела-Уоллеса (H). Статистический анализ выполняли в пакете Statistica (StatSoft, Inc., 2001) [33] и PAST [34].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Многолетняя компонента динамики численности населения мелких млекопитающих до 2006/07 г. представляла собой простой трехлетний цикл с удивительно регулярной последовательностью трех фаз: “депрессия”, “рост”, “пик” (рис. 1). При этом фазы популяционного цикла различались не только характерными для них уровнями численности, но и специфическими сезонной динамикой и репродуктивно-возрастной структурой [35, 36]. Например, в годы “роста” сезонный максимум численности наблюдали осенью, а в годы “пика” – в середине лета (Приложение, рис. 1s). Кроме того, в годы “пика” у полевок отмечали “эффект Калела–Кошкиной” [37, 38] – подавление созревания сеголеток при высокой весенней плотности зимовавших животных [35]. Интересно, что изменению режима предшествовали рост амплитуды в конце 1980-х гг. и восходящий тренд в численности мелких млекопитающих в 90-е гг. ХХ–начале XXI вв. (см. рис. 1).
Рис. 1.
Многолетняя динамика индекса численности (n/N – особей на лов/сут) мелких млекопитающих (логит масштаб): отрезки – 95% ДИ, подчеркнуты годы с нециклическим режимом; Висимский заповедник, весна (май) 1982–2019 гг.
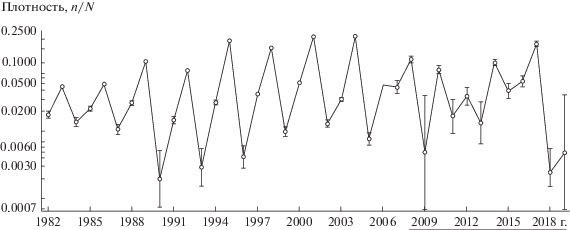
После 2006/07 г. на смену трехлетней цикличности пришел режим с “квазидвухлетним” периодом, более выраженной (по сравнению с трехлетним циклом) сезонной компонентой и отсутствием в популяции рыжей полевки в годы “пиков” тотальной блокировки созревания сеголеток [39]. Это позволило весь ряд наблюдений разделить на две части с различными режимами многолетней динамики (см. рис. 1; Приложение, рис. 2s) [27].
В режиме трехлетней регулярности эффект Читти у рыжей полевки был ярко выражен: в фазах “роста” и “пика” средняя масса тела животных больше, чем в фазе “депрессии”, на 1.9 г (95% ДИ: 0.1–3.7) и 4.2 г (2.4–6.0), средняя длина тела – на 3.5 мм (0.1–7.1) и 8.3 мм (4.8–11.9) соответственно. В нециклическом режиме наблюдали промежуточные значения размерных признаков особей (рис. 2): существенное падение амплитуды колебаний среднегодовых значений массы и длины тела – $s_{{1995 - 2006}}^{2}/s_{{2007 - 2019}}^{2}$ (критерий Бартлетта Х2(1): 27.5 и 6.2 соответственно). Таким образом, изменчивость размерных признаков также отражает изменение характера многолетней динамики, но в координатах экстерьерных признаков особей.
Рис. 2.
Сравнение средних значений остатков от нелинейной модели бифазного роста для массы (а) и длины тела (б) рыжей полевки для трех фаз цикла (Tr – “депрессия”, Inc – “рост”, Peak – “пик”) и нециклического режима (NC); отрезки – 95% ДИ; разные символы (a, b, c) – статистически значимые (критерий Бонферрони) различия.
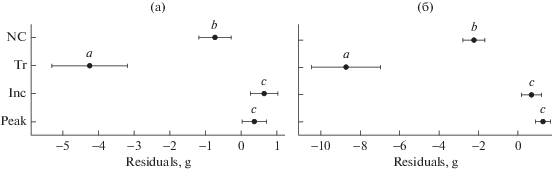
Оценки стандартизированных (безразмерных) коэффициентов регрессии (βi) позволяют соотнести величину эффекта “фаза цикла” (“эффект Читти”) с прочими, но для физической интерпретации удобнее использовать “натуральные” (bi) коэффициенты: например, et ceteris paribus, масса тела при изменении предиктора “логарифм возраста” на единицу возрастает в 1.52 раза (95% ДИ: 1.46–1.58) . Масса тела у половозрелых особей в 1.2 (1.14–1.21) раза выше по сравнению с неполовозрелыми и в 1.2 (1.15–1.23) раза в среднем ниже у животных в фазе “депрессии”. Cозревающие в год рождения сеголетки имеют 14%-ную (10–17%) “фору” в массе тела над несозревающими и т.д. ( табл. 1). Таким образом, мы показали убедительную статистическую значимость частного эффекта Читти и сопоставили его магнитуду с факторами физиологического состояния особей. Аналогичный результат получен и при описании длины тела рыжей полевки (см. табл. 1).
Диаграмма рассеивания длины и логарифма массы тела зимовавших особей рыжей полевки (рис. 3б) показывает, что для животных, отловленных в фазе “депрессии” (рожденных в фазе “пика”), характерны значения ниже медианных как массы (≤/>Me/Депрессия: 173/186/20/1, Х2(1) = 17.6 и H(1, n = 380) = 22.75, p ≤ 0.0001), так и длины тела (141/149/11/1, Х2(1) = 8.54 и H(1, n = = 302) = 18.9, p ≤ 0.0001). В остальные фазы (годы) мы наблюдали как аналогичных, так и более крупных особей. Заметим, что сенильные и с патологическим дефицитом массы тела животные (см. рис. 3б, несколько точек вне доверительного эллипсоида) не были исключены из анализа.
Рис. 3.
Средние и индивидуальные онтогенетические траектории не созревающих в год рождения особей Cl. glareolus: а – в координатах возраст – масса тела; б – в проекции на плоскость длина тела – лог-масса тела (только для зимовавших животных); кружки – животные, отловленные в “депрессии” (рожденные в “пик”); точки – отловленные в прочие годы. На рис. 3б жирная линия – регрессия главных осей, MAR: y = 0.26 + 0.029x; штриховые линии – НК-регрессии: кружки – y = 1.93 + 0.01x, точки – y = 2.12 + 0.01x, Δb0 = 0.2 ± 0.02; эллипсы – ранговые 95% ДИ для значений; серые стрелки – общая медиана, черные – фаза “депрессии”.
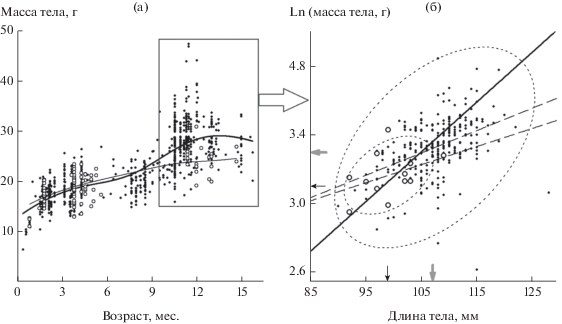
На наш взгляд, более логичным будет говорить (по крайней мере для случая Cl. glareolus) не о более крупных особях в фазе “пика” (собственно эффект Читти), а о более мелких – в фазе “депрессии”, т.е. о своеобразном “идиопатическом нанизме” – карликовости зимовавших полевок (см. рис. 3б). По аналогии с медицинской симптоматической диагностикой, позволяющей определять состояние пациентов (например, по индексу Кетле), в отношении мелких млекопитающих более точным представляется использование термина “синдром” (т.е. набор симптомов) как более адекватного сути явления.
Оценки онтогенетических траекторий для не созревающих в год рождения полевок позволили обнаружить заметную дихотомию – “вилку” (см. рис. 3а) между средними траекториями животных, родившихся в фазе “пика” и отловленных в прочие годы. Наблюдаемая картина вполне соответствует результатам “отбора” (или его иллюзии) более мелких особей во время зимовки и весны при переходе от “пика” к “депрессии” в условиях максимального пресса хищников, олиготрофных (но с лучшими защитными условиями) местообитаний, более высоких расходов энергии при поиске партнеров при экстремально низкой плотности фазы “депрессии” и т.д. В итоге мы наблюдаем лишь субнормальные индивидуальные траектории в нижней части “онтогенетического коридора” (см. врезку на рис. 3а и 3б).
Таким образом, наши результаты, скорее, поддерживают мнение ряда авторов об избыточности привлечения специальных генетических механизмов для генерации эффекта Читти [40, 41], который вполне может быть адекватно объяснен в рамках “нормальной” экологической физиологии. Синдром Читти можно интерпретировать как эколого-физиологический феномен, обусловленный закономерной изменчивостью в ходе популяционного цикла: плотности населения, уровня стресса, пресса хищников, времени рождения (фотопериод и материнский эффект), качества/трофности местообитаний и т.д.
Авторы выражают признательность Ю.Ф. Марину – заместителю директора Висимского заповедника в 1981–2007 гг. – за любезно предоставленные данные учетов мелких млекопитающих, администрации и сотрудникам заповедника – за многолетнюю и всестороннюю поддержку в проведении полевых работ, двум анонимным рецензентам – за искренний интерес к нашей работе и полезные замечания, позволившие улучшить рукопись.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН. В 2010–2012 гг. исследование было поддержано РФФИ (проект № 10-04-01657).
Список литературы
Elton C.S. Periodic fluctuations in the numbers of animals: their causes and effects // J. of Experimental Biology. 1924. V. 2. № 1. P. 119–163.
Бигон М., Харпер Д., Таунсенд К. Экология. Особи, популяции и сообщества: в 2 т. М.: Мир. 1989. Т. 2. 477 с.
Krebs C.J. Population cycles revisited // J. Mammal. 1996. V. 77. P. 8–24.
Berryman A.A. (ed.). Population cycles: the case for trophic interactions. Oxford: Oxford University Press, 2002. 208 p.
Ginzburg L., Colyvan M. Ecological orbits: how planets move and populations grow. Oxford: Oxford University Press, 2004. 166 p.
Krebs C.J., Myers J.H. Population cycles in small mammals // Advances in ecological research. 1974. V. 8. P. 267–399.
Cornulier T., Yoccoz N.G., Bretagnolle V. et al. Europe-wide dampening of population cycles in keystone herbivores // Science. 2013. V. 340. № 6128. P. 63–66.
Korpela K., Delgado M., Henttonen H. et al. Nonlinear effects of climate on boreal rodent dynamics: mild winters do not negate high-amplitude cycles // Global Change Biology. 2013. V. 19. № 3. P. 697–710.
Batzli G.O. Dynamics of small mammal populations: a review // Wildlife 2001: populations. 1992. P. 831–850.
Stenseth N.C. Population cycles in voles and lemmings: density dependence and phase dependence in a stochastic world // Oikos. 1999. V. 87. P. 427–461.
Hanski I. Spatially realistic theory of metapopulation ecology // Naturwissenschaften. 2001. V. 88. № 9. P. 372–381.
Korpimäki E., Brown P.R., Jacob J., Pech R.P. The puzzles of population cycles and outbreaks of small mammals solved? // Bioscience. 2004. V. 54. № 12. P. 1071–1079.
Smith M.J., White A., Lambin X. et al. Delayed density-dependent season length alone can lead to rodent population cycles // Amer. Naturalist. 2006. V. 167. № 5. P. 695–704.
Krebs C.J., Boonstra R., Gilbert B.S. et al. Impact of climate change on the small mammal community of the Yukon boreal forest // Integrative Zoology. 2019. V. 14. № 6. P. 528–541.
Chitty D. Mortality among voles (Microtus agrestis) at Lake Vyrnwy, Montgomeryshire in 1936–1939 // Philosophical Transactions of the Royal Society of London. 1952. № 236. P. 505–552.
Chitty D. Population processes in the vole and their relevance to general theory // Canadian J. of Zoology. 1960. V. 38. P. 99–113.
Lee A.K., McDonald I.R. Stress and population regulation in small mammals // Oxford Reviews of Reproductive Biology. 1985. V. 7. P. 261–304.
Hansson L., Jaarola M. Body size related to cyclicity in microtines: dominance behaviour or digestive efficiency? // Oikos. 1989. V. 55. P. 356–364.
Stenseth N.C., Ims R.A. (eds.). The Biology of lemmings. London: Academic Press, 1993. P. 3–34.
Oli M.K. The Chitty effect: A consequence of dynamic energy allocation in a fluctuating environment // Theoretical Population Biology. 1999. V. 56. P. 293–300.
Norrdahl K., Korpimäki E. Changes in population structure and reproduction during a 3-yr population cycle of voles // Oikos. 2002. V. 96. № 2. P. 331–345.
Sundell J., Norrdahl K. Body size-dependent refuges in voles: an alternative explanation of the Chitty effect // Ann. Zool. Fennici. 2002. V. 39. № 4. P. 325–333.
Чепраков М.И. Составляющие эффекта Читти // Экология. 2011. № 6. С. 478–480. [Cheprakov M.I. Components of the Chitty effect // Rus. J. Ecol. 2011. V. 42. № 6. P. 529–531.]
Лэк Д. Численность животных и ее регуляция в природе. Пер. с англ. М.: Изд-во иностр. лит., 1957. 403 с.
Norrdahl K., Korpimäki E. Changes in individual quality during a 3-year population cycle of voles // Oecologia. 2002. V. 130. № 2. P. 239–249.
Klemme I., Soulsbury C.D., Henttonen H. Contrasting effects of large density changes on relative testes size in fluctuating populations of sympatric vole species // Proceedings of the Royal Society B: Biological Sciences. 2014. V. 281. № 1792.
Кшнясев И.А. Изменение режима динамики популяций мелких млекопитающих: диагностика и симптомы, улики и главные подозреваемые. (Экологический детектив: наброски) // Математические модели в теоретической экологии и земледелии (Полуэктовские чтения): Мат-лы междун. семинара. СПб.: АФИ, 2014. С. 88–92.
Kryštufek B., Tesakov A.S., Lebedev V.S. et al. Back to the future: the proper name for red-backed voles is Clethrionomys Tilesius and not Myodes Pallas // Mammalia. 2020. V. 84. № 2. P. 214–217.
Новиков Е.А., Мошкин М.П. Роль стресса в модификации онтогенетических программ // Успехи современной биологии . 2009. Т. 129. № 3. С. 227–238.
Новиков Е.А., Кондратюк Е.Ю., Петровский Д.В. Влияние типа онтогенеза на биоэнергетические показатели красной полевки (Myodes rutilus Pall) из горно-таежной популяции юга Западной Сибири // Экология. 2015. № 5. С. 387–387. [Novikov E.A., Kondratyuk E.Y., Petrovskii D.V. Effect of the life history pattern on bioenergetic parameters of northern red-backed voles (Myodes rutilus Pall.) in a mountain taiga population from the south of Western Siberia // Rus. J. Ecol. 2015. V. 46. P. 476–480.]
Оленев Г.В. Определение возраста цикломорфных грызунов, функционально-онтогенетическая детерминированность, экологические аспекты // Экология. 2009. № 2. С. 103–115. [Olenev G.V. Determining the age of cyclomorphic rodents: Functional-ontogenetic determination, ecological aspects // Rus. J. Ecol. 2009. V. 40. № 2. P. 93–104.]
Дрейпер Н., Смит Г. Прикладной регрессионный анализ. Пер. с англ. М.: Изд-во “Диалектика”, 2017. 912 с.
StatSoft, I. N. C. STATISTICA (data analysis software system), version 6. Tulsa, USA. 2001.
Hammer O. PAST PAleontological STatistics Version 3.18. Reference Manual, 2017. 259 p.
Кшнясев И.А., Давыдова Ю.А. Динамика плотности и структуры популяций лесных полевок в южной тайге // Вестн. Нижегород. ун-та им. Н.И. Лобачевского. Сер. Биология. 2005. Вып. 1(9). С. 113–123.
Кшнясев И.А., Давыдова Ю.А. Наблюдаемая динамика популяций: детерминизм и стохастика, циклы и хаос // Всероссийский семинар “Гомеостатические механизмы биологических систем” с общей темой “Проблемы популяционной экологии” / Под ред. Розенберга Г.С. Тольятти: Кассандра, 2015. С. 186–191.
Kalela O. Regulation of reproduction rate in subarctic populations of red-backed vole Clethrionomys rufocanus (Sund.) // Ann Acad. Sci. Fenn AIV. 1957. V. 34. P. 1–60.
Кошкина Т.В. Сравнительная экология рыжих полевок в северной тайге // Фауна и экология грызунов. М.: МОИП, 1957. Вып. 5. С. 3–35.
Кшнясев И.А., Давыдова Ю.А. Закономерности и особенности динамики населения мелких млекопитающих в Среднеуральской южной тайге // Современное состояние и перспективы развития ООПТ Урала: Мат-лы науч.-практич. конф., посвященной 40-летию Висимского государственного природного биосферного заповедника и 10-летию присвоения ему статуса биосферного. Екатеринбург: ООО “УИПЦ”, 2011. С. 168–177.
Boonstra R., Krebs C.J. Viability of large-and small-sized adults in fluctuating vole populations // Ecology. 1979. V. 60. № 3. P. 567–573.
Boonstra R., Boag P.T. A test of the Chitty hypothesis: inheritance of life-history traits in meadow voles Microtus pennsylvanicus // Evolution. 1987. V. 41. № 5. P. 929–947.
Дополнительные материалы
- скачать ESM.docx
- Рис. 1s. Число особей мелких млекопитающих на 1 тыс. лов./сут весной и осенью в полных трехлетних циклах. Данные учетов Ю.Ф. Марина, Висимский заповедник (темнохвойная южная тайга, Средний Урал), 1984–2004 гг.
Рис. 2s. Панели снизу вверх: динамика логит-преобразованной плотности мелких млекопитающих (синяя линия), её аппроксимация и прогноз (красная линия) на 2019–2021 гг. гармоническим колебанием (8 гармоник); вейвлетная шкалограмма; вейвлетный спектр (приведены 95% ДИ и конус влияния); оконное преобразование Фурье. Заливка красным – максимумы, синим – минимумы ордината – log2(период). Абсцисса (на всех панелях) – отсчеты времени. До 2004 г. зимние оценки плотности получены интерполяцией. Висимский заповедник (темнохвойная южная тайга, Средний Урал), весна 1982 – осень 2018 гг.
Таблица 1s. Стандартизованные β-коэффициенты регрессии и выбор оптимальных (Cp=min) моделей для описания изменчивости массы тела рыжей полевки
Таблица 2s. Стандартизованные β-коэффициенты регрессии и выбор оптимальных (Cp=min) моделей для описания изменчивости длины тела рыжей полевки


