Экология, 2021, № 4, стр. 298-311
Население обыкновенной бурозубки (Sorex araneus, Eulipotyphla) и кормообеспеченность ее местообитаний в экологически контрастной среде
Л. Е. Лукьянова a, *, Н. Л. Ухова b, О. В. Ухова b, Ю. В. Городилова a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
b Висимский государственный природный биосферный заповедник
624140 Свердловская обл, Кировград, ул. Степана Разина, 23, Россия
* E-mail: lukyanova@ipae.uran.ru
Поступила в редакцию 02.04.2020
После доработки 02.02.2021
Принята к публикации 05.02.2021
Аннотация
Исследования в пихтово-еловых лесах Среднего Урала, в местообитаниях с разной степенью трансформации природными катастрофами (ветровалом и пожарами), показали, что обилие и динамика сообществ беспозвоночных определяют кормообеспеченность местообитаний бурозубок, одну из наиболее важных микросредовых характеристик. Показатель кормообеспеченности отражает состояние кормовой базы обыкновенной бурозубки и является устойчивой биотопической характеристикой, стабильность которой поддерживается благодаря перераспределению обилия разных таксономических групп почвенной мезофауны в ходе их многолетней динамики. Численность обыкновенной бурозубки оказалась не связанной с кормообеспеченностью местообитаний текущего года, но зависела от кормообеспеченности предыдущего года, причем в наибольшей степени эта зависимость выражена в сильно нарушенных местообитаниях.
Обыкновенная бурозубка (Sorex araneus L., 1758) − один из широко распространенных видов землероек в мире. У представителей рода Sorex отмечен самый высокий среди наземных млекопитающих уровень обмена, что объясняет функционирование бурозубок, близкое к пределу физиологических возможностей [1, 2]. Из-за широкого распространения, многочисленности, невероятной прожорливости и круглосуточной активности бурозубки относятся к важным компонентам таежных экосистем. В регулировании обилия беспозвоночных животных их роль является мозаично действующим фактором, но при высокой численности землеройки могут снижать биомассу жертв [3]. Передвигаясь в лесной подстилке, бурозубки способствуют перемешиванию ее компонентов в верхних горизонтах почвы, что ускоряет прорастание семян деревьев и кустарников. Во многих природных очагах клещевого энцефалита они наряду с грызунами являются основными прокормителями личинок иксодовых клещей и возглавляют список животных, способных регулярно поддерживать циркуляцию вируса [4–6].
Жизнедеятельность животных в природе осуществляется в местообитаниях с определенным диапазоном условий окружающей среды и соответственно ресурсов, в котором вид способен выживать и размножаться. Поскольку конкретные периоды жизни мелких млекопитающих проходят на небольших по площади участках, “посредником” между популяцией и внешней средой является микросреда местообитаний, характеристики которой отражают защитные и кормовые условия обитания животных [7]. Известно, что выбор бурозубками участков обитания определяется прежде всего их кормностью, которая влияет на численное распределение особей и может быть оценена по значениям общей численности или биомассы беспозвоночных животных [3, 8]. Следовательно, показатель кормообеспеченности местообитаний бурозубок равнозначен общему обилию почвенно-подстилочных беспозвоночных животных и является важной биотопической характеристикой, определяющейся сложными процессами в разнообразных по таксономическому и численному составу сообществах.
Питание обыкновенной бурозубки изучено достаточно полно, ее кормовой спектр гораздо шире и разнообразнее по сравнению с другими видами рода, а рацион может меняться в зависимости от времени года, погоды и среды обитания [3, 9, 10]. Она не имеет жесткой привязанности к определенным кормовым объектам, переключаясь в разные годы с одних объектов на другие в зависимости от того, как часто те встречаются в местообитаниях [11]. Основу питания вида составляют многочисленные и доступные виды крупных почвенно-подстилочных беспозвоночных животных. В августе–сентябре в ее диете преобладают дождевые черви (Lumbricidae), пауки (Aranei), сенокосцы (Opiliones), как имаго, так и личинки различных жесткокрылых (Coleoptera), среди которых преобладают жужелицы (Carabidae), охотно поедают стафилинид (Staphylinidae) и щелкунов (Elateridae), потребляют в огромном количестве личинок двукрылых (Diptera), а также наземных моллюсков (Gastropoda) [11–15]. Наоборот, в зимний период, когда такие предпочитаемые объекты, как дождевые черви, труднодоступны, бурозубки могут потреблять менее прибыльную и менее приемлемую добычу – двупарноногих многоножек (Diplopoda) [14].
Несмотря на интерес к изучению зависимости численного распределения бурозубок от обилия их потенциальных кормовых объектов [3], такие данные немногочисленны и иногда неоднозначны, что объясняется использованием разных методов. Абсолютные методы учета обилия бурозубок и беспозвоночных показывают наличие тесной положительной корреляции в наиболее благоприятных по кормности биотопах в ненарушенных природных условиях [3, 16]. В местообитаниях, нарушенных природными катастрофическими явлениями (ветровалом и пожаром), связь численности бурозубок с обилием беспозвоночных может быть не очевидной из-за трансформации условий обитания, приводящей к нарушениям в структуре населения мелких насекомоядных: перераспределение видов по численности, изменение долевого участия и смена доминирования [17–22]. В сообществах почвенно-подстилочных беспозвоночных, находящихся в тесной зависимости от целого ряда растительных и почвенных показателей, в местообитаниях с разной степенью пирогенного воздействия меняются обилие и видовое разнообразие большинства таксонов, нарушается соотношение доминирующих групп. На почвенную мезофауну пирогенных территорий оказывают влияние не только сила пожара, структура растительности и почвы, но и состав окружающих поврежденные участки ненарушенных сообществ беспозвоночных [23–28].
В настоящее время в немногочисленных работах, посвященных изучению мелких насекомоядных животных, обитающих в ветровально-пирогенных биотопах, отсутствуют сведения о характере зависимости численности бурозубок от параметров среды их местообитаний. Основная цель нашей работы – в экологически контрастных биотопических условиях изучить связь численности обыкновенной бурозубки с обилием почвенно-подстилочных беспозвоночных, отражающим кормообеспеченность ее местообитаний. Мы предположили, что показатель кормообеспеченности, определяющийся сложными процессами в многочисленных и таксономически разнообразных сообществах беспозвоночных, является многолетней устойчивой характеристикой состояния кормовой базы S. araneus в биотопах с разной степенью нарушенности природными катастрофическими факторами и отражается на численности этого вида. Мы изучали хронографическую и биотопическую изменчивость микросредовых параметров, анализировали динамику численности обыкновенной бурозубки, оценивали ее связь с микросредовыми характеристиками в экологически контрастных местообитаниях, исследовали динамику и изменчивость обилия почвенной мезофауны, а также вклад отдельных таксономических групп в сообщества сравниваемых биотопов. Полученные нами новые данные могут быть полезны для изучения устойчивости биоты к последствиям природных экстремальных явлений, существенный рост которых (особенно лесных пожаров) наблюдается в последние десятилетия [29].
МАТЕРИАЛ И МЕТОДЫ
Материал для исследования (бурозубки и беспозвоночные животные) был собран в лесных биоценозах низкогорной части Среднего Урала на территории Висимского заповедника (57°19′–57°31′ с.ш. и 59°20′–59°50′ в.д.) в Свердловской области, где обыкновенная бурозубка распространена повсеместно и является наиболее многочисленным видом в населении землероек [30].
Экологическая контрастность условий среды местообитаний животных на исследуемой охраняемой территории вызвана существенной трансформацией лесных биогеоценозов под воздействием мощного ветровала в 1995 г. и двух последующих обширных пожаров в 1998 и 2010 гг. На основании сравнительного анализа микросредовых характеристик выбраны три контрастных биотопа: ненарушенный (I), слабо нарушенный (II) и сильно нарушенный (III). Биотоп I представляет собой не нарушенный ветровалом и пожарами участок пихтово-елового высокотравно-папоротникового коренного леса, биотоп II – частично нарушенный ветровалом и одним пожаром участок березового вейниково-разнотравного леса, биотоп III – нарушенный ветровалом и двумя пожарами участок, изначально включал крупнопапоротниковый и липняковый типы коренных и условно-коренных пихто-еловых лесов. В настоящее время биотоп III представляет собой ветровально-гаревый биоценоз, растительные сообщества которого находятся на разных стадиях посткатастрофических восстановительных сукцессий. Все исследуемые биотопы расположены в привершинных частях невысоких гор: биотоп I находится на плоской привершинной части склона г. Малый Сутук (560 м над ур. м.), а биотопы II и III − на привершинной части пологого склона г. Липовый Сутук (495 м над ур. м.).
В июне 1998 г. распространению пожара способствовало большое количество горючего материала, образовавшегося на обширной ветровальной территории. Пожарище протянулось полосой шириной от 1 до 1.5 км и длиной 10 км, общая площадь его составила около 1610 га. В августе 2010 г. в северо-восточной части Висимского заповедника пожар распространился на площади 1800 га, в его зону попали различные насаждения, в основном из подроста, образовавшегося на участках сплошного ветровала. Влияние двух пожаров на лесные биогеоценозы различалось: второй пожар был слабее, он прошел мозаично, сохранились пятна с зелеными мхами, а по участкам с произрастанием вейников, доминировавших в этом биотопе, пожар прошел бегло, уничтожив во многих местах только уже усыхающий травостой. В 2010 г. на территории старого пожарища (1998 г.) было много сухой травы, недогоревших стволов и вывалившегося сухостоя (его доля составила 14%). Второй пожар в отличие от первого затронул не все горевшие ранее участки либо интенсивность горения на них была незначительной [31, 32]. В результате комплексного воздействия природных катастрофических факторов лесные фитоценозы трансформировались в ветровально-гаревые растительные сообщества [33].
Относительную численность (обилие) населения бурозубок, выражаемую в числе особей на 100 ловушко-суток, оценивали стандартным методом ловушко-линий. Отлов бурозубок в биотопе III проводили с 1998 г. (год возникновения первого пожара) по 2019 г., а в биотопах I и II – с 2013 г. по 2019 г., поскольку учетные линии были заложены спустя три года после второго пожара. В каждом из трех исследуемых биотопов ежегодно в конце августа – первой половине сентября выставляли одновременно 50 проволочных капканчиков на расстоянии 5–10 м друг от друга, время экспозиции которых составляло 5 сут. Вокруг каждой ловушки на площади 10 м2 проводили количественное описание параметров микросреды местообитаний мелких млекопитающих на основе методики, предложенной О.А. Лукьяновым и Г. Буяльской [7].
Описания на площадках вокруг 150 ловушек проводили в августе 2013 г., а повторные в то же время в 2017 г. по семи микросредовым характеристикам: площадь покрытия (м2) участков мхом (MC), травянистой растительностью (HC), кустарником (CS), численность (экз.) подроста древесных пород (AU), площадь поперечного сечения (м2) стволов живых (TC), сухих деревьев и пней (SC), площадь покрытия (м2) участков валежом (LC). Всего проведено 300 описаний. Показатель кормообеспеченности местообитаний обыкновенной бурозубки оценивали по общему обилию крупных почвенно-подстилочных беспозвоночных размером более 2 мм (почвенной мезофауны), добытых в биотопах I и II в 2013−2017 гг., а в биотопе III − в 1998−2017 гг. прямым методом учета: выкопки проб почвы и ручным разбором ее на месте [34].
В конце августа–первой половине сентября на каждой пробной площади анализировали 50 проб размером 15 × 15 × 20 см, выбранных беспозвоночных животных фиксировали в 70%-ном спирте. Измеряли общее обилие почвенной мезофауны, а также обилие надвидовых таксонов (ранга семейства и выше) (экз/м2). Включение в анализ отдельных таксономических групп обосновано необходимостью оценки их вклада в общее обилие сравниваемых сообществ беспозвоночных. Учитывали следующие таксоны: дождевые черви (Lumbricidae), энхитреиды (Enchytraeidae), пауки (Aranei), сенокосцы (Opiliones), костянки (Lithobiidae), землянки (Geophilidae), многоножки (Diplopoda), полужесткокрылые (Hemiptera), жужелицы (Carabidae), стафилиниды (Staphylinidae), щелкуны (Elateridae), чешуекрылые (Lepidoptera), перепончатокрылые (Hymenoptera), двукрылые (Diptera), брюхоногие моллюски (Gastropoda). В прочие Coleoptera объединены мягкотелки (Cantharidae), долгоносики (Curculionidae), листоеды (Chrysomelidae), лейодиды (Leiodidae), пилюльщики (Byrrhidae), скрытноеды (Cryptophagidae), блестянки (Nitidulidae), короеды (Scolytidae), жуки-землерои (Geotrupidae), а в прочие беспозвоночные вошли все иные таксоны, не указанные в списке. Материал собирали во второй половине августа, поскольку в конце лета – начале осени население бурозубок наиболее многочисленно, а состав сообществ почвенно-подстилочных беспозвоночных, характеризующийся сезонной изменчивостью, наиболее стабилен [3, 9].
Для изучения влияния погодных условий на численность населения бурозубок и обилие беспозвоночных животных использовали данные метеостанции “Висим”. Гидротермический коэффициент Селянинова (ГТК) вычисляли как отношение суммы осадков в дни, когда температура воздуха была выше +10°C, умноженной на 10, к сумме разниц между среднесуточной температурой и +10°C за этот период. Для характеристики года как “влажного” или “засушливого” сравнивали значения ГТК с его среднегодовым значением (табл. 1).
Таблица 1.
Погодные условия района Висимского заповедника по данным метеостанции “Висим” (средние значения температуры воздуха и сумма осадков за май–август)
| Показатель | Год | Среднее (1987–2018 гг.) |
||||||
|---|---|---|---|---|---|---|---|---|
| 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | ||
| Температура воздуха, °С | 15.8 | 14.6 | 13.5 | 13.4 | 16.0 | 12.9 | 10.7 | 14.1 |
| Сумма осадков, мм | 222.9 | 251.8 | 345.4 | 511.0 | 194.5 | 378.6 | 397.3 | 309.0 |
| Гидротермический коэффициент | 2.64 | 3.60 | 5.63 | 8.18 | 2.34 | 6.87 | 6.33 | 4.4 |
Статистическая обработка собранного материала выполнена с использованием пакета прикладных программ Statistica 6.0. Изучение связи численности обыкновенной бурозубки с общим обилием беспозвоночных животных, обилия отдельных таксономических групп почвенной мезофауны со значениями ГТК осуществляли с помощью коэффициента линейной корреляции Пирсона (r), предварительно проведя процедуру логарифмирования значений, распределение которых отклоняется от нормального. Корреляцию между численностью бурозубок и общим обилием беспозвоночных учитывали только для совпадающих лет учетов: в биотопах I и II – в 2013–2017 гг., а в биотопе III – в 1998–2017 гг. Cвязь численности бурозубок с обилием их потенциальных кормовых объектов оценивали в текущем и предыдущем сезонах, поскольку обилие почвенной мезофауны в предыдущем году отражает кормовые запасы зимнего периода, а обилие беспозвоночных текущего года характеризует актуальные запасы бурозубок. Для выявления различий между биотопами по комплексу микросредовых характеристик и таксономическому составу почвенной мезофауны применяли дискриминантный канонический анализ. Связь численности обыкновенной бурозубки с погодными условиями и микросредовыми характеристиками местообитаний оценивали с использованием регрессионного анализа. Уровень хронографической и биотопической изменчивости общего обилия беспозвоночных, обилия отдельных таксонов, а также микросредовых параметров местообитаний бурозубок изучали с помощью двухфакторного дисперсионного анализа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Микросредовые условия местообитаний обыкновенной бурозубки. В трех сравниваемых биотопах микросредовая обстановка существенно различалась по шести параметрам: площадь покрытия микроучастков мхом (F = 63.79, p < 0.001), травянистой растительностью (F = 19.37, p < 0.001), кустарником (F = 56.42, p < 0.001), численность подроста (F = 4.39, p < 0.05), площадь сечения стволов живых деревьев (F = 41.80, p < 0.001), сухостоя и пней (F = 16.02, p < 0.001). Не выявлены биотопические различия площади покрытия валежом (F = 0.61, p > 0.05), ее значения также не различались в разные годы (F = 2.87, p > 0.05). Площадь покрытия микроучастков травянистой растительностью и численность подроста отличались высокой хронографической изменчивостью (F = 19.01, p < 0.001 и F = 51.28, p < 0.001 соответственно). Микросредовые характеристики, связанные с площадью покрытия участков кустарником (F = 0.02, p > 0.05), площадью сечения стволов живых (F = 1.59, p > 0.05), сухих деревьев и пней (F = 0.29, p > 0.05), не имели значимых межгодовых различий. Дискриминантный анализ переменных микросреды показал высоко значимые различия между тремя биотопами по описаниям в 2013 и 2017 гг. (Λ Уилкса = 0.26, F = 13.38, р < 0.001 и Λ Уилкса = 0.16, F = 19.85, р < 0.001 соответственно). Максимальные различия микросредовых характеристик проявились между сильно нарушенным биотопом III и ненарушенным биотопом I (рис. 1а, б). Наибольший вклад в дис-криминацию микросреды трех местообитаний внесли переменные, оценивающие площадь покрытия участков мхом, травянистой растительностью, кустарником, а также площадь сечения стволов живых деревьев.
Рис. 1.
Микросредовые характеристики местообитаний обыкновенной бурозубки (по 7 количественным показателям) в биотопах I−III в 2013 г. (а) и 2017 г. (б) (эллипсы показывают 95%-ные доверительные области).
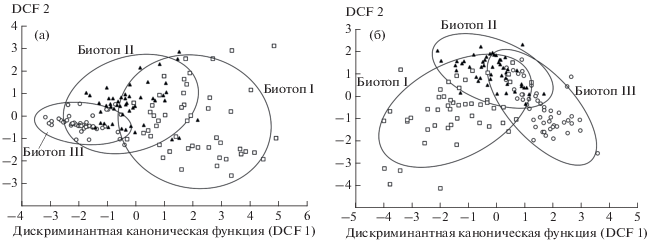
Анализ вариабельности характеристик показал, что микросредовая обстановка в условиях ненарушенного и слабо нарушенного биотопов менее изменчива по сравнению с сильно нарушенным − в этих местообитаниях наименьшим межгодовым размахом характеризуется наибольшее число переменных (табл. 2). В биотопе III наименее изменчивой оказалась площадь покрытия травянистой растительностью (HC), межгодовой размах значений которой был наиболее низким по сравнению с биотопами I и II. В целом в биотопе III микросредовые характеристики имели наибольшие значения коэффициентов вариации, что свидетельствует о неоднородности условий среды, вызванной комплексным воздействием природных катастрофических факторов. В большей степени неоднородным этот биотоп оказался по покрытию участков мхом (MC), стволами сухих деревьев и пнями (SC), а также по площади сечения стволов живых деревьев (TC). Минимальной вариабельностью и сходным размахом межгодовой изменчивости во всех биотопах характеризовалась переменная LC – площадь покрытия микроучастков валежом (см. табл. 2). Близкими высокими значениями коэффициентов вариации в годы описаний и относительно невысоким межгодовым размахом изменчивости в сравниваемых биотопах отличалась характеристика SC – площадь покрытия стволами сухих деревьев и пнями. Выявленные биотопические отличия микросредовых характеристик позволили рассматривать среду сравниваемых местообитаний как экологически контрастную.
Таблица 2.
Микросредовые характеристики биотопов с разной степенью нарушенности
| Признак | 2013 г. | 2017 г. | R | ||||
|---|---|---|---|---|---|---|---|
| X̅ | s | CV | X̅ | s | CV | ||
| Биотоп I | |||||||
| MC | 3.29 | 2.17 | 66 | 2.17 | 1.79 | 83 | 1.2 |
| HC | 7.15 | 1.85 | 26 | 5.16 | 2.11 | 41 | 1.6 |
| CS | 1.33 | 1.24 | 93 | 1.27 | 1.32 | 104 | 1.1 |
| AU | 4.66 | 5.40 | 116 | 4.66 | 5.07 | 109 | 1.1 |
| TC | 0.081 | 0.084 | 104 | 0.07 | 0.08 | 120 | 1.1 |
| SC | 0.05 | 0.09 | 165 | 0.05 | 0.06 | 131 | 1.3 |
| LC | 0.66 | 0.47 | 71 | 0.78 | 0.62 | 79 | 1.1 |
| Биотоп II | |||||||
| MC | 1.26 | 1.69 | 134 | 0.71 | 0.92 | 130 | 1.0 |
| HC | 5.71 | 2.35 | 41 | 3.22 | 1.92 | 60 | 1.5 |
| CS | 0.24 | 0.43 | 179 | 0.13 | 0.26 | 200 | 1.1 |
| AU | 4.92 | 3.82 | 78 | 6.74 | 4.62 | 69 | 1.1 |
| TC | 0.08 | 0.07 | 88 | 0.06 | 0.04 | 67 | 1.3 |
| SC | 0.02 | 0.04 | 200 | 0.03 | 0.05 | 167 | 1.2 |
| LC | 0.69 | 0.47 | 68 | 0.94 | 0.67 | 71 | 1.0 |
| Биотоп III | |||||||
| MC | 0.89 | 1.31 | 147 | 0.02 | 0.08 | 400 | 2.7 |
| HC | 5.47 | 2.27 | 41 | 6.68 | 2.45 | 37 | 1.1 |
| CS | 0.21 | 0.39 | 186 | 0.43 | 0.51 | 119 | 1.6 |
| AU | 1.10 | 2.41 | 219 | 12.78 | 9.01 | 71 | 3.1 |
| TC | 0.004 | 0.012 | 250 | 0.007 | 0.011 | 143 | 1.7 |
| SC | 0.004 | 0.018 | 500 | 0.01 | 0.04 | 400 | 1.3 |
| LC | 0.77 | 0.65 | 84 | 0.75 | 0.66 | 88 | 1.0 |
Влияние на динамику численности обыкновенной бурозубки погодных условий и микросредовых факторов. В многолетней динамике численности обыкновенной бурозубки в трех сравниваемых биотопах в 2013−2019 гг. выделяются два года: 2014 г. – год максимальных значений и 2018 г. – год глубокой депрессии (рис. 2). Значительный рост численности бурозубок в 2014 г. по сравнению с предыдущим годом в биотопах I, II и III (двух-, пяти- и трехкратный соответственно), возможно, объясняется сложившимися благоприятными условиями теплого и влажного летнего сезона 2013 г. с равномерным распределением осадков (см. табл. 1). Поскольку известно, что на численность бурозубок текущего года оказывают положительное влияние благоприятные погодные условия предыдущего сезона [35], можно предположить, что глубокая депрессия численности обыкновенной бурозубки во всех сравниваемых биотопах в 2018 г. является следствием неблагоприятных погодных условий не только предыдущего 2017 г., весенне-летний сезон которого был переувлажненным, а сумма осадков превышала среднегодовые, но и предшествующих сезонов: переувлажненного 2015 г. и засушливого 2016 г. (см. табл. 1). В то же время наблюдаемый высокий уровень численности обыкновенной бурозубки в 2019 г., которому предшествовал сырой и прохладный летний сезон 2018 г., не может быть однозначно объяснен влиянием погодных факторов. Согласно литературным данным, периодичность изменения численности вида далеко не всегда совпадает с периодичностью изменения погодных условий [35]. В целом уровень значений обилия обыкновенной бурозубки в период 2013−2019 гг. оказался выше в сильно нарушенном биотопе по сравнению с биотопами I и II (см. рис. 2). Ранее нами было показано [18], что повышение численности S. araneus на гаревых участках объясняется особенностями ее более успешного восстановления по сравнению с другими видами рода, свидетельствующее о благоприятности условий, сложившихся для обитания вида в ходе постпирогенного восстановления лесных биоценозов.
Рис. 2.
Многолетнее изменение обилия обыкновенной бурозубки в биотопах с разной степенью нарушенности.
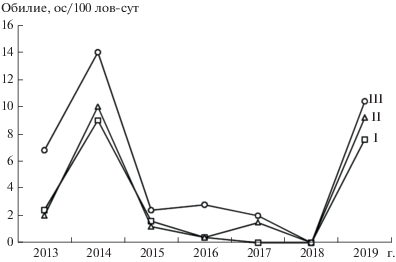
Анализируя зависимость обыкновенной бурозубки от условий среды ее местообитаний, мы обнаружили связь ее численности с наибольшим числом микросредовых параметров в сильно нарушенном биотопе по сравнению с биотопами I и II. Так, в 2015 и 2017 гг. при низком уровне численности населения в биотопе III отмечается прямая зависимость обилия бурозубок от площади покрытия микроучастков мхом (β = 0.66, p < < 0.001), кустарником (β = 0.30, p < 0.05) и валежом (β = 0.34, p < 0.05). Связь с последней характеристикой выявлена и при высоком уровне численности вида в 2019 г. (β = 0.39, p < 0.01). Это свидетельствует о численном преобладании обыкновенной бурозубки при любом уровне ее обилия на нарушенных участках с улучшенными защитными условиями и подтверждает факт предпочтительности зверьками наиболее захламленных местообитаний [3]. В слабо нарушенном биотопе зависимость численности вида от микросредовых характеристик не обнаружена, в ненарушенном местообитании найдена связь лишь с одним параметром: в 2016 г. при низкой численности населения особи преобладали на участках с большей площадью покрытия микроучастков мхом (β = 0.38, p < 0.05).
Динамика обилия почвенной мезофауны. Основу сообществ изучаемых биотопов составляют наиболее многочисленные таксоны, типичные представители почвенно-подстилочного яруса лесных территорий таежной зоны: стафилиниды, многоножки костянки, пауки, энхитреиды, дождевые черви и жужелицы. В разные годы доля их вклада в сообщества сравниваемых биотопов колеблется от 10.1 до 30.5%. Эти таксоны определяют различия между биотопами. Наибольший вклад в их дискриминацию во все годы (за исключением 2016 г.) вносят дождевые черви: значения лямбды Уилкса (Λ Уилкса) в эти годы равны 0.49−0.59 (р < 0.001). Значимым за период наблюдений (2013−2017 гг.), кроме 2017 г., являлся вклад жужелиц: Λ Уилкса = 0.45–0.56 (р < 0.001). Наряду с дождевыми червями в 2013, 2014 и 2017 гг. в отличия по составу сообществ между биотопами вносили энхитреиды (Λ Уилкса = 0.48, 0.53, 0.57; F = 3.49, 13.77, 13.13; р < 0.05, р < 0.05 и р < 0.001 соответственно), а в 2015 и 2016 гг. − стафилиниды (Λ Уилкса = 0.59, 0.49; F = 5.30, 3.61 при р < 0.05 соответственно).
Различия долевого участия таксонов в сообществах в разные годы обусловлены их экологическими особенностями, проявляющимися в меняющихся условиях внешней среды. Известно, что температура воздуха и осадки на почвенно-подстилочных беспозвоночных животных влияют опосредованно, воздействуя на состояние подстилки и почвенного покрова. В биотопе I с хорошо выраженным ярусом подстилки из хвойного опада и травянистых растений по сравнению с биотопами II и III, где горизонт подстилки выражен слабо, высокой численностью отличались стафилиниды. Для этой группы, а также для многоножек костянок и пауков наиболее благоприятными оказались погодные условия 2013 г. с умеренной температурой и суммой осадков летнего сезона (см. табл. 1) − во всех биотопах они были многочисленными (табл. 3). Погодные условия этого года оказались благоприятными для энхитреид и жужелиц в сильно нарушенном биотопе, в котором их численность была высокой (см. табл. 3). Для жужелиц, как и для других представителей почвенной мезофауны, температура на поверхности почвы и уровень осадков считаются наиболее важными факторами, причем метеопараметры предыдущего года оказывают влияние на уровень численности жужелиц в большей степени, чем текущего [36]. В биотопах I и II представители этой группы были малочисленны, обнаружена отрицательная связь их обилия с ГТК (r = –0.63 и –0.78 соответственно). Отметим, что многовидовая группа жужелиц не только в 2013 г., но и в другие годы наблюдений отличалась существенно высоким уровнем обилия в сильно нарушенном биотопе.
Таблица 3.
Обилие (среднее значение ± стандартная ошибка) основных групп почвенно-подстилочных беспозвоночных в биотопах I−III , экз/м2
| Таксон | 2013 г. | 2014 г. | 2015 г. | 2016 г. | 2017 г. |
|---|---|---|---|---|---|
| Биотоп I | |||||
| Lumbricidae | 27.8 ± 5.4 | 16.4 ± 3.5 | 38.9 ± 7.8 | 12.2 ± 5.3 | 30.0 ± 6.0 |
| Enchytraeidae | 7.8 ± 4.2 | 4.7 ± 2.2 | 34.4 ± 11.8 | 8.9 ± 7.8 | 4.4 ± 2.1 |
| Aranei | 65.6 ± 7.1 | 22.2 ± 4.9 | 24.4 ± 6.1 | 53.3 ± 10.3 | 23.3 ± 5.2 |
| Opiliones | – | 1.2 ± 1.0 | 4.4 ± 2.6 | 4.4 ± 2.1 | 2.2 ± 1.5 |
| Lithobiidae | 87.8 ± 9.1 | 59.7 ± 10.6 | 40.0 ± 7.4 | 81.1 ± 13.1 | 33.3 ± 6.9 |
| Geophilidae | 27.8 ± 6.5 | 14.0 ± 4.1 | 14.4 ± 4.3 | 7.8 ± 3.9 | 15.6 ± 6.1 |
| Diplopoda | 3.3 ± 1.8 | 1.2 ± 1.0 | 2.2 ± 1.5 | 2.2 ± 1.9 | 1.1 ± 0.9 |
| Hemiptera (im + l) | 3.3 ± 1.8 | 8.19 ± 4.1 | 1.1 ± 0.9 | 2.2 ± 1.5 | 1.1 ± 0.9 |
| Carabidae (im + l) | 3.3 ± 1.8 | 8.2 ± 2.8 | 6.7 ± 2.5 | 1.1 ± 0.9 | 4.4 ± 2.6 |
| Staphylinidae (im + l) | 110.0 ± 14.3 | 66.7 ± 12.5 | 65.6 ± 13.9 | 70.0 ± 11.4 | 38.9 ± 8.8 |
| Elateridae (im + l + p) | 2.2 ± 1.5 | 1.2 ± 1.0 | 4.4 ± 2.1 | 2.2 ± 1.5 | 7.8 ± 3.1 |
| Прочие Coleoptera (im + l + p) | 11.1 ± 3.5 | 8.2 ± 2.8 | 8.9 ± 3.2 | 13.3 ± 5.1 | 31.1 ± 10.9 |
| Lepidoptera (l + p) | 2.2 ± 1.5 | – | 1.1 ± 0.9 | 2.2 ± 1.5 | 5.6 ± 2.3 |
| Hymenoptera, Symphyta (l + p) | 11.1 ± 3.4 | 1.2 ± 1.0 | 3.3 ± 1.8 | 2.2 ± 1.5 | – |
| Diptera (l + p) | 18.9 ± 5.0 | 16.4 ± 7.7 | 41.1 ± 6.8 | 10.0 ± 4.3 | 17.8 ± 4.4 |
| Gastropoda | 1.1 ± 0.9 | 11.7 ± 4.0 | 8.9 ± 3.3 | 6.7 ± 3.0 | 2.2 ± 1.5 |
| Прочие беспозвоночные | 12.2 ± 3.8 | 15.2 ± 3.4 | 3.3 ± 2.4 | 4.4 ± 2.1 | 8.9 ± 3.2 |
| Общее обилие | 395.6 ± 27.7 | 233.9 ± 24.2 | 298.9 ± 34.2 | 284.4 ± 23.0 | 227.8 ± 28.9 |
| Биотоп II | |||||
| Lumbricidae | 51.1 ± 10.9 | 54.4 ± 6.7 | 36.7 ± 6.9 | 13.3 ± 4.8 | 74.4 ± 10.0 |
| Enchytraeidae | 10.0 ± 3.7 | 3.3 ± 1.9 | 16.7 ± 4.4 | 2.2 ± 1.6 | 7.8 ± 3.9 |
| Aranei | 62.2 ± 12.0 | 17.8 ± 5.0 | 22.2 ± 5.0 | 50.0 ± 8.9 | 31.1 ± 6.8 |
| Opiliones | 1.1 ± 0.9 | 5.6 ± 2.8 | 1.1 ± 0.9 | 3.3 ± 2.5 | 4.4 ± 2.1 |
| Lithobiidae | 76.7 ± 8.9 | 68.9 ± 9.4 | 31.1 ± 7.2 | 45.6 ± 7.5 | 54.4 ± 9.6 |
| Geophilidae | 21.1 ± 4.8 | 22.2 ± 6.0 | 16.7 ± 4.7 | 15.6 ± 3.7 | 38.9 ± 7.3 |
| Diplopoda | 26.7 ± 8.5 | 11.1 ± 5.2 | 12.2 ± 5.5 | 21.1 ± 5.3 | 5.6 ± 2.8 |
| Hemiptera (im + l) | 20.0 ± 7.5 | 15.6 ± 4.9 | 3.3 ± 1.9 | 12.2 ± 3.2 | 11.1 ± 3.5 |
| Carabidae (im + l) | 11.1 ± 3.5 | 7.8 ± 4.2 | 4.4 ± 2.1 | 6.7 ± 2.5 | 6.7 ± 3.0 |
| Staphylinidae (im + l) | 90.0 ± 12.0 | 40.0 ± 7.4 | 14.4 ± 4.6 | 50.0 ± 8.1 | 44.4 ± 6.4 |
| Elateridae (im + l + p) | 12.2 ± 3.9 | 16.7 ± 4.4 | 11.1 ± 3.8 | 7.8 ± 2.7 | 41.1 ± 6.4 |
| Прочие Сoleoptera (im + l + p) | 15.6 ± 5.4 | 6.7 ± 2.5 | 5.6 ± 2.4 | 10.0 ± 3.4 | 7.8 ± 3.5 |
| Lepidoptera (l + p) | 3.3 ± 1.9 | 1.1 ± 0.9 | – | – | 1.1 ± 0.9 |
| Hymenoptera, Symphyta (l + p) | 4.4 ± 2.1 | – | 2.2 ± 1.8 | 1.1 ± 0.9 | 5.6 ± 2.4 |
| Diptera (l + p) | 33.3 ± 5.9 | 18.9 ± 5.0 | 15.6 ± 4.7 | 7.8 ± 3.1 | 26.7 ± 5.2 |
| Gastropoda | 7.8 ± 3.1 | 7.8 ± 3.1 | 14.4 ± 4.0 | 10.0 ± 3.4 | 14.4 ± 5.8 |
| Прочие беспозвоночные | 14.4 ± 4.9 | 6.7 ± 2.5 | 10.0 ± 3.4 | 5.6 ± 2.4 | 12.2 ± 4.8 |
| Общее обилие | 461.1 ± 41.6 | 304.4 ± 22.6 | 217.8 ± 23.8 | 262.2 ± 20.3 | 387.8 ± 32.8 |
| Биотоп III | |||||
| Lumbricidae | 35.6 ± 6.6 | 39.8 ± 8.4 | 80.0 ± 11.7 | 15.6 ± 3.8 | 51.1 ± 8.9 |
| Enchytraeidae | 41.1 ± 9.2 | 36.3 ± 7.3 | 14.4 ± 7.0 | 1.1 ± 0.9 | 34.4 ± 6.8 |
| Aranei | 47.8 ± 7.3 | 18.7 ± 4.9 | 30.0 ± 4.9 | 35.6 ± 6.9 | 30.0 ± 6.2 |
| Opiliones | – | – | – | – | 3.3 ± 1.9 |
| Lithobiidae | 35.6 ± 7.5 | 25.7 ± 5.2 | 22.2 ± 5.7 | 17.8 ± 5.2 | 33.3 ± 7.3 |
| Geophilidae | 20.0 ± 4.5 | 18.7 ± 4.6 | 22.2 ± 5.0 | 7.8 ± 3.1 | 12.2 ± 3.5 |
| Diplopoda | 2.2 ± 1.6 | – | 1.1 ± 0.9 | – | – |
| Hemiptera (im + l) | 13.3 ± 3.9 | 7.0 ± 3.2 | – | 3.3 ± 2.4 | 7.8 ± 2.7 |
| Carabidae (im + l) | 51.1 ± 9.1 | 21.1 ± 4.4 | 20.0 ± 4.8 | 32.2 ± 7.1 | 20.0 ± 5.7 |
| Staphylinidae (im + l) | 93.3 ± 13.3 | 38.6 ± 6.9 | 27.8 ± 8.4 | 28.9 ± 7.2 | 35.6 ± 7.2 |
| Elateridae (im + l + p) | 6.7 ± 2.5 | 19.9 ± 6.9 | 13.3 ± 4.3 | 18.9 ± 5.0 | 20.0 ± 4.8 |
| Прочие Coleoptera (im + l + p) | 25.6 ± 4.8 | 8.2 ± 2.8 | 17.8 ± 4.9 | 7.8 ± 2.7 | 23.3 ± 5.9 |
| Lepidoptera (l + p) | 5.6 ± 2.3 | 1.2 ± 1.0 | – | 4.4 ± 2.6 | 2.2 ± 1.5 |
| Hymenoptera, Symphyta (l + p) | 2.2 ± 1.5 | 1.2 ± 1.0 | 1.1 ± 0.9 | 2.2 ± 1.5 | – |
| Diptera (l + p) | 23.3 ± 7.1 | 9.4 ± 2.9 | 13.3 ± 3.9 | 16.7 ± 4.6 | 10.0 ± 3.4 |
| Gastropoda | 3.3 ± 1.9 | 17.5 ± 4.2 | 17.8 ± 3.8 | 10.0 ± 4.4 | 15.6 ± 5.2 |
| Прочие беспозвоночные | 22.2 ± 5.5 | 10.5 ± 3.5 | 1.1 ± 0.9 | 1.1 ± 0.9 | 5.6 ± 2.8 |
| Общее обилие | 428.9 ± 32.9 | 273.9 ± 26.6 | 282.2 ± 23.2 | 203.3 ± 17.7 | 304.4 ± 28.0 |
Результаты исследований влияния пирогенного фактора на жужелиц противоречивы. Одни авторы указывают на увеличение численности этой группы в биоценозах после пожара в 2–3 раза [28], по нашим данным [24] их обилие снижается, что объясняется спецификой методов учета. Методом почвенных ловушек выявлено увеличение видового разнообразия населения жужелиц на гари и снижение их общей численности: уменьшение числа типично лесных видов одновременно с увеличением лесо-луговых, луговых и полевых, рост доли гигрофилов, суммарного удельного обилия миксофитофагов и стратобионтов-скважников подстилочных [24]. Изменения в экологической структуре многовидового населения жужелиц объясняются сложившимися условиями на гарях, где под воздействием пирогенного фактора уничтожается или резко сокращается запас подстилки, уплотняется верхний слой почвы, снижается влажность, режим микроклимата почвенно-подстилочного напочвенного яруса сдвигается в сторону более ксеротермического с менее стабильными условиями температуры и влажности. В данных условиях существование организмов становится наиболее экстремальным, скорость восстановления численности разных групп отличается, что существенно зависит и от интенсивности воздействия пожаров [26, 28, 37].
В наиболее влажном за исследуемый период 2015 г., отличающимся максимальным значением ГТК (см. табл. 1), наибольшие значения обилия характерны для гигрофильной группы дождевых червей в сильно нарушенном биотопе (см. табл. 3). Эти олигохеты имеют многолетний цикл развития, для которого необходимо стабильное увлажнение [25]. Это подтверждают высокие положительные значения коэффициента корреляции их обилия с ГТК в биотопе III (r = 0.94). Пауки, костянки и жужелицы, напротив, в условиях переувлажненного сезона отличались невысокой численностью как в сильно нарушенном биотопе, так в биотопах I и II (см. табл. 3). Обилие стафилинид в этот год характеризовалось низкими значениями в слабо и сильно нарушенных местообитаниях, в то время как в ненарушенном биотопе их обилие было максимальным, что может объясняться как перераспределением насекомых в микростациях из-за осадков, так и прямым губительным воздействием ливневых потоков на мелкие виды в биотопе со слабо развитой подстилкой.
В наиболее засушливом 2016 г. с самым низким за исследуемый период значением ГТК (см. табл. 1) стафилиниды преобладали в биотопах I и II, а в биотопе III их численность была значительно ниже. Обилие пауков снижалось в ряду биотопов I–II–III, а численность жужелиц, напротив, возрастала (см. табл. 3). В неблагоприятном для дождевых червей засушливом летнем сезоне их обилие в биотопах II и III было выше по сравнению с ненарушенным местообитанием. Наши ранние исследования [38] показывают, что в Висимском заповеднике дождевые черви наиболее многочисленны в луговых сообществах, их обилие также выше в березовых лесах, чем в пихто-ельниках. Развитие вейников в биотопах II и III формирует слаборазложившуюся дернину, густо переплетенную корнями. Под слоем дернины лучше сохраняется влага, что создает благоприятные условия для жизнедеятельности геобионтов: дождевых червей, а также энхитреид, губоногих многоножек землянок и других групп.
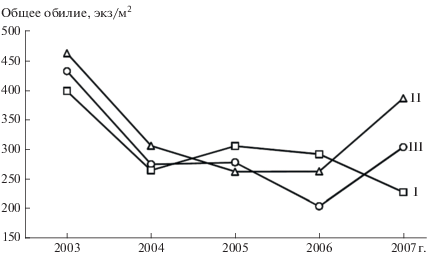
Изучение многолетних значений общего обилия беспозвоночных показывает, что они близки в биотопах I, II и III. За исследуемый период изменение показателя было асинхронным, за исключением 2013 и 2014 гг. (рис. 3). В условиях воздействия сходных погодных факторов асинхронная динамика может быть обусловлена отличительными особенностями биотопов: структурой растительного покрова, гидротермическим режимом почв, которые наиболее динамичны в открытых местообитаниях – на гарях. В отличие от ненарушенных местообитаний с сохранившимся древесным ярусом и развитой кроной почвенный покров на осветленных участках гарей сильнее прогревается и на большую глубину, колебания максимальных и минимальных температур на поверхности почвы значительно выше, толщина подстилки и ее влажность уменьшены, изменен качественный состав. Значения общего обилия беспозвоночных в биотопе III в течение всего периода, кроме 2016 г., занимали промежуточное положение по сравнению с биотопами I и II. В ненарушенном местообитании общее обилие почвенной мезофауны лишь в двух случаях из пяти (в 2015 и 2016 гг.) отличалось повышенными значениями (см. рис. 3). В 2013 и 2014 гг. динамика показателя имела синхронный характер, который в последующие годы нарушился. Асинхронность в большей степени проявилась в 2017 г., когда в биотопах II и III общее обилие возросло, а в биотопе I снизилось, и только в этом году показатели имели высоко значимые биотопические отличия (F(2, 116) = = 7.10, p < 0.001). Подобная асинхронность колебаний общего обилия почвенной мезофауны гаревых участков сосняков-зеленомошников наблюдалась в Окском заповеднике, которая сохранялась на протяжении более 20 лет наблюдений, при этом динамика в ненарушенных пожаром сосняках все годы была синхронной [37].
Рис. 3.
Многолетнее изменение общего обилия почвенной мезофауны в биотопах с разной степенью нарушенности.
Анализ изменчивости показателей обилия разных таксонов в сравниваемых сообществах почвенной мезофауны выявил их существенные различия. Размах межгодовой изменчивости обилия наиболее многочисленной группы стафилинид в разных биотопах составил 110.0–14.4 экз/м2, а обилие жужелиц отличалось более чем в 50 раз (см. табл. 3). Обнаружена статистически значимая биотопическая изменчивость обилия беспозвоночных для всех таксономических групп, за исключением Aranei, Opiliones и Diptera (табл. 4). Отсутствие изменчивости обилия у двух последних групп может объясняться их низкой численностью во всех сравниваемых местообитаниях, а отсутствие биотопических различий у одного из многочисленных таксонов – пауков, возможно, связано с особенностями их восстановления на пирогенных территориях [25, 27]. Известно, что в группах почвенно-подстилочных беспозвоночных нарушенных пожарами биотопов наблюдаются значительные перестройки в составе: таксоны с более высоким видовым разнообразием наиболее устойчивы к воздействию неблагоприятных факторов из-за биологического разнообразия составляющих их видов, а также более устойчивы к негативному воздействию внешних факторов [39].
Таблица 4.
Биотопическая и хронографическая изменчивость обилия основных групп почвенной мезофауны
| Таксономическая группа | Источник изменчивости |
df | Сумма квадратов | Средний квадрат | F-критерий | Уровень значимости, p |
|---|---|---|---|---|---|---|
| Lumbricidae | Биотоп | 2 | 25.53 | 12.77 | 11.14 | <0.001 |
| Год | 4 | 55.89 | 13.97 | 12.19 | <0.001 | |
| “Биотоп” × “год” | 8 | 39.04 | 4.88 | 4.26 | <0.001 | |
| Внутригрупповая | 581 | 666.07 | 1.15 | |||
| Общая | 595 | 786.53 | ||||
| Enchytraeidae | Биотоп | 2 | 16.82 | 8.41 | 12.08 | <0.001 |
| Год | 4 | 11.42 | 2.85 | 4.10 | <0.05 | |
| “Биотоп” × “год” | 8 | 27.54 | 3.44 | 4.95 | <0.001 | |
| Внутригрупповая | 581 | 404.34 | 0.70 | |||
| Общая | 595 | 460.12 | ||||
| Aranei | Биотоп | 2 | 1.61 | 0.81 | 0.77 | ns |
| Год | 4 | 63.44 | 15.86 | 15.26 | <0.001 | |
| “Биотоп” × “год” | 8 | 7.19 | 0.90 | 0.87 | ns | |
| Внутригрупповая | 581 | 603.71 | 1.04 | |||
| Общая | 595 | 675.95 | ||||
| Opiliones | Биотоп | 2 | 0.32 | 0.16 | 2.96 | ns |
| Год | 4 | 0.29 | 0.07 | 1.35 | ns | |
| “Биотоп” × “год” | 8 | 0.52 | 0.07 | 1.20 | ns | |
| Внутригрупповая | 581 | 31.55 | 0.05 | |||
| Общая | 595 | 32.68 | ||||
| Lithobiidae | Биотоп | 2 | 65.24 | 32.62 | 23.53 | <0.001 |
| Год | 4 | 42.65 | 10.66 | 7.69 | <0.001 | |
| “Биотоп” × “год” | 8 | 35.69 | 4.46 | 3.22 | <0.001 | |
| Внутригрупповая | 581 | 805.39 | 1.39 | |||
| Общая | 595 | 948.97 | ||||
| Geophilidae | Биотоп | 2 | 3.15 | 1.57 | 3.19 | <0.05 |
| Год | 4 | 6.09 | 1.52 | 3.08 | <0.05 | |
| “Биотоп” × “год” | 8 | 8.25 | 1.03 | 2.09 | <0.05 | |
| Внутригрупповая | 581 | 286.97 | 0.49 | |||
| Общая | 595 | 304.46 | ||||
| Diplopoda | Биотоп | 2 | 13.26 | 6.63 | 26.60 | <0.001 |
| Год | 4 | 2.68 | 0.67 | 2.69 | <0.05 | |
| “Биотоп” × “год” | 8 | 3.23 | 0.40 | 1.62 | ns | |
| Внутригрупповая | 581 | 144.82 | 0.25 | |||
| Общая | 595 | 163.99 | ||||
| Carabidae | Биотоп | 2 | 35.21 | 17.61 | 46.16 | <0.001 |
| Год | 4 | 5.50 | 1.38 | 3.61 | <0.05 | |
| “Биотоп” × “год” | 8 | 10.20 | 1.28 | 3.34 | <0.001 | |
| Внутригрупповая | 581 | 221.58 | 0.38 | |||
| Общая | 595 | 272.49 | ||||
| Staphylinidae | Биотоп | 2 | 38.69 | 19.35 | 9.62 | <0.001 |
| Год | 4 | 151.77 | 37.94 | 18.87 | <0.001 | |
| “Биотоп” × “год” | 8 | 22.12 | 2.77 | 1.38 | ns | |
| Внутригрупповая | 581 | 1168.14 | 2.01 | |||
| Общая | 595 | 1380.72 | ||||
| Elateridae | Биотоп | 2 | 11.87 | 5.94 | 18.73 | <0.001 |
| Год | 4 | 9.46 | 2.36 | 7.46 | <0.001 | |
| “Биотоп” × “год” | 8 | 8.38 | 1.05 | 3.31 | <0.001 | |
| Внутригрупповая | 581 | 184.11 | 0.32 | |||
| Общая | 595 | 213.82 | ||||
| Diptera | Биотоп | 2 | 2.50 | 1.25 | 2.35 | ns |
| Год | 4 | 7.90 | 1.98 | 3.72 | <0.05 | |
| “Биотоп” × “год” | 8 | 14.02 | 1.75 | 3.30 | <0.001 | |
| Внутригрупповая | 581 | 308.76 | 0.53 | |||
| Общая | 595 | 333.18 | ||||
| Gastropoda | Биотоп | 2 | 2.40 | 1.20 | 4.43 | <0.05 |
| Год | 4 | 3.39 | 0.85 | 3.13 | <0.05 | |
| “Биотоп” × “год” | 8 | 2.19 | 0.27 | 1.01 | ns | |
| Внутригрупповая | 581 | 157.35 | 0.27 | |||
| Общая | 595 | 165.33 | ||||
| Общее обилие | Биотоп | 2 | 68.79 | 34.40 | 2.54 | ns |
| Год | 4 | 858.26 | 214.56 | 15.85 | <0.001 | |
| “Биотоп” × “год” | 8 | 422.15 | 52.77 | 3.90 | <0.001 | |
| Внутригрупповая | 581 | 7865.76 | 13.54 | |||
| Общая | 595 | 9214.96 |
Результаты анализа общего обилия сообществ почвенно-подстилочных беспозвоночных свидетельствуют об отсутствии его биотопической изменчивости, а уровень его межгодовых отличий, напротив, оказался высоко значимым. Разброс многолетних значений общего обилия почвенной мезофауны в конце лета–начале осени 2013–2017 гг. гораздо меньше по сравнению с размахом изменчивости обилия отдельных таксонов сообщества. Минимальное варьирование общего обилия отмечено в биотопе I, где значения отличаются в 1.7 раза, а в сообществах нарушенных биотопов II и III они меняются в 2.1 раза (см. табл. 3). Меньший размах изменчивости данного показателя в ненарушенном биотопе свидетельствует о более стабильных условиях среды в этом местообитании, что подтверждают результаты сравнительного анализа микросредовых характеристик трех биотопов (см. табл. 2).
Полученные результаты свидетельствуют о биотопической “стабильности” показателя общего обилия почвенно-подстилочных беспозвоночных, определяющего кормообеспеченность местообитаний обыкновенной бурозубки в экологически контрастных условиях среды, что может быть объяснено с позиции “принципа компенсации” или возмещения недостающих элементов посредством формирования заменяющих структур, являющегося одним из фундаментальных свойств биологических систем [40]. В целом сообщества беспозвоночных животных как в ненарушенных биотопах, так и в местообитаниях с разной степенью воздействия природных катастрофических факторов сохраняют устойчивость за счет перераспределения в них численности разных таксономических групп в ходе многолетней динамики.
Оценка связи численности обыкновенной бурозубки с общим обилием беспозвоночных животных. Мы не обнаружили связи численности бурозубок с общим обилием почвенной мезофауны в текущем году, отражающим актуальные кормовые запасы мелких насекомоядных. Однако выявлена положительная корреляция численности населения текущего года с общим обилием почвенно-подстилочных беспозвоночных в предыдущем году, характеризующим накопленные запасы корма обыкновенной бурозубки (табл. 5). В наибольшей степени эта связь проявилась во всех сравниваемых местообитаниях в 2014 г., когда население бурозубок отличалось максимальными значениями численности за весь исследуемый период (см. рис. 2), а предыдущий 2013 г. характеризовался наиболее высокими показателями общего обилия почвенно-подстилочных беспозвоночных (см. табл. 3) и, следовательно, максимальным уровнем показателя кормообеспеченности местообитаний обыкновенной бурозубки. Это согласуется с мнением о том, что запас потенциальных кормов жестко определяет пространственное распределение мелких насекомоядных млекопитающих при максимальной численности последних, а при снижении численности зверьков связь биомассы потенциального корма и распределения землероек ослабевает [41]. Обнаруженная в сильно нарушенном биотопе тесная связь численности обыкновенной бурозубки с общим обилием ее потенциальных кормовых объектов в предыдущем году, характеризующим накопленные за зиму запасы, проиллюстрирована данными за более длительный (1998–2019 гг.) период наших наблюдений (рис. 4).
Таблица 5.
Связь численности обыкновенной бурозубки с общим обилием беспозвоночных животных в биотопах с разной степенью нарушенности
| Биотоп | Текущий год | Предыдущий год | ||
|---|---|---|---|---|
| r | p | r | p | |
| I | 0.13 | ns | 0.68 | ns |
| II | 0.28 | ns | 0.96 | * |
| III | 0.29 | ns | 0.94 | * |
Рис. 4.
Зависимость численности обыкновенной бурозубки текущего года от общего обилия почвенной мезофауны в предшествующий год за 1998–2019 гг. в нарушенном ветровалом и двумя пожарами биотопе.
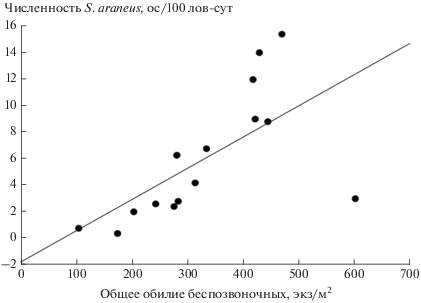
Таким образом, выдвинутое нами предположение о наличии связи численности обыкновенной бурозубки с общим обилием беспозвоночных, характеризующим кормообеспеченность местообитаний, обоснованно и подтверждено результатами проведенного исследования. Выявленная зависимость численности S. araneus текущего года от кормообеспеченности ее местообитаний в предыдущем году может быть объяснена с позиции пространственно-временной неоднородности состава сообществ беспозвоночных. Почти для всех групп почвенной мезофауны характерны сезонные колебания численности, особенно выраженные у дождевых червей, пауков, жуков и двукрылых [36, 42]. Состав и динамика численности беспозвоночных в большей степени определяются характеристиками биотопа и погодными условиями вегетационного сезона. Немаловажную роль играют такие экологические и биологические аспекты жизнедеятельности беспозвоночных, как продолжительность жизненного цикла, приуроченность к местообитаниям и пищевая избирательность. В осенний период формируется относительно стабильный в количественном отношении состав почвенно-подстилочного населения, а подстилка наряду с этим обогащается беспозвоночными, заселяющими ее на предстоящий зимний период. Следовательно, в разных сообществах максимальная концентрация беспозвоночных отмечается в осенний сезон, когда в почве полностью формируется уходящий на зимовку состав [42], и, следовательно, накопленный зимний запас кормов предыдущего сезона фактически определяет кормообеспеченность бурозубок в следующем году.
ЗАКЛЮЧЕНИЕ
Исследованы экологические особенности населения обыкновенной бурозубки и ее потенциальных кормовых объектов – крупных почвенно-подстилочных беспозвоночных − в контрастных биотопических условиях таежных лесов Среднего Урала. Экологическая контрастность среды обитания животных в трех сравниваемых биотопах, нарушенных в разной степени природными катастрофическими факторами, подтверждена разным уровнем хронографической и биотопической изменчивости микросредовых параметров. Численность обыкновенной бурозубки характеризовалась более высокими показателями в сильно нарушенном биотопе (ветровалом и двумя пожарами), что может свидетельствовать о более благоприятных условиях по сравнению со слабо нарушенными и ненарушенными местообитаниями. В условиях сильно нарушенного биотопа особи обыкновенной бурозубки в большей степени “привязаны” к участкам с лучшими защитными условиями.
Многолетние значения обилия наиболее многочисленных представителей сообществ почвенно-подстилочных беспозвоночных различались в контрастных биотопических условиях, что связано с биологическими и экологическими особенностями сравниваемых таксонов. Вклад отдельных таксономических групп почвенной мезофауны в общую изменчивость сравниваемых биотопов различается в разные годы. Кормообеспеченность, равнозначная показателю общего обилия беспозвоночных, является устойчивой биотопической характеристикой, отражающей состояние кормовой базы бурозубок, стабильность которой обеспечивается за счет численного перераспределения разных таксономических групп почвенной мезофауны в экологически контрастной среде местообитаний. Обнаруженная положительная корреляция численности обыкновенной бурозубки текущего года с общим обилием почвенно-подстилочных беспозвоночных в предыдущем году свидетельствует о важной роли в жизнедеятельности землероек запаса потенциальных кормов, накопленного к зиме за предшествующий летне-осенний период.
Работа выполнена в рамках государственных заданий Института экологии растений и животных УрО РАН и Висимского государственного природного биосферного заповедника, а также при частичной поддержке Комплексной программы УрО РАН (№ 18-4-4-28). Авторы заявляют об отсутствии конфликта интересов и подтверждают, что в работе с животными соблюдались применимые этические нормы.
Список литературы
Taylor J.R.E. Evolution of energetic strategies in shrews // Evolution of shrews. Wójcik J.M., Wolsan M. Eds. Białowieża, 1998. P. 309–346.
Ochosińska D., Taylor J.R.E. Living at the physiological limits: field and maximum metabolic rates of the common shrew (Sorex araneus) // Physiological and Biochemical Zoology. 2005. V. 78. P. 808–818.
Ивантер Э.В. Очерки популяционной экологии мелких млекопитающих на северной периферии ареала. М.: Тов-во научн. изд. КМК, 2018. 770 с.
Докучаев Н.Е. Экология бурозубок Северо-Восточной Азии. М.: Наука, 1990. 160 с.
Bown K.J., Lambin X., Telford G. et al. The common shrew (Sorex araneus): a neglected host of tick-borne infections? // Vector-borne and Zoonotic Diseases. 2011. V. 11. P. 947–953.
Щипанов Н.А., Маханько Е.В. Заметки о прокормлении личинок и нимф иксодовых клещей бурозубками рода Sorex (Lipotyphla) на юго-востоке Тверской области // Зоол. журн. 2018. Т. 97. Вып. 2. С. 190−195.
Буяльска Г., Лукьянов О.А., Мешковска Д. Детерминанты локального пространственного распределения численности островной популяции рыжей полевки // Экология. 1995. № 1. С. 35–45.
Ивантер Э.В., Макаров А.М. Пространственная организация популяций землероек-бурозубок (Sorex, Insectivora) и ее связь с кормностью биотопов // Зоол. журн. 1994. Т. 73. Вып. 9. С. 124–138.
Pernetta J.C. Diets of the Shrews Sorex araneus L. and Sorex minutus L. in Wytham Grassland // J. Animal Ecol. 1976. V. 45. № 3. P. 899–912.
Klenovšek T., Novak T., Čas M. et al. Feeding ecology of three sympatric Sorex shrew species in montane forests of Slovenia // Folia Zool. 2013. V. 62. № 3. P. 193–199.
Юдин Б.С. Насекомоядные млекопитающие Сибири. Новосибирск: Наука, 1971. С. 169.
Юдин Б.С. Экология бурозубок (р. Sorex) Западной Сибири // Вопросы экологии, зоогеографии и систематики животных. Новосибирск: СО АН СССР, 1962. Вып. 8. С. 33–134.
Churchfield S., Rychlik L. Diets and coexistence in Neomys and Sorex shrews in Białowieża forest, eastern Poland // J. Zool. Lond. 2006. V. 269. P. 381−390.
Churchfield S., Rychlik L., Taylor J.R.E. Food resources and foraging habits of the common shrew, Sorex araneus: does winter food shortage explain Dehnel’s phenomenon? // Oikos. 2012. № 121. P. 1593–1602.
Shchipanov N.A., Zima J., Churchfield S. Introducing the common shrew // Shrews, Chromosomes and Speciation (Cambridge studies in morphology and molecules: New paradigms in evolutionary bio). Cambridge: Cambridge University Press, 2019. P. 19–67.
Шварц Е.А., Демин Д.В., Замолодчиков Д.Г. Экология сообществ мелких млекопитающих лесов умеренного пояса (на примере Валдайской возвышенности). М.: Наука, 1992. 127 с.
Козленко А.Б., Шефтель Б.И. Мелкие млекопитающие енисейских таежных гарей // Фауна и экология птиц и млекопитающих Средней Сибири. М.: Наука, 1987. С. 213–228.
Лукьянова Л.Е. Мелкие млекопитающие в экологически дестабилизированной среде: последствия локальных природных катастроф: Автореф. дис. … докт. биол. наук. Екатеринбург: ИПЦ УрФУ, 2013. 42 с.
Баженов Ю.А. Особенности населения мелких млекопитающих пирогенных сообществ тайги и лесостепных боров Восточного Забайкалья // Вестник Томского гос. ун-та. Биология. 2016. № 1 (33). С. 50–61.
Larsen K.W., Adams I.T., Haughland D.L. Small mammal communities in a pyrogenic habitat mosaic // Intern. J. Wildland Fire. 2007. V. 16. № 6. P. 728–740.
Kelly L.T., Nimmo D.G., Spence-Bailey L.M. et al. Influence of fire history on small mammal distributions: insights from a 100-year post-fire chronosequence // Diversity Distrib. 2011. V. 17. № 3. P. 462–473.
Mendonça A.F., Armond T., Camargo A.C.L. et al. Effects of an extensive fire on arboreal small mammal populations in a neotropical savanna woodland // J. Mammal. 2015. V. 96. № 2. P. 368–379.
Есюнин С.Л., Козьминых В.О., Ухова Н.Л. Структура и разнообразие первичнопирогенных сообществ герпетобионтных членистоногих на месте коренных пихто-ельников Среднего Урала // Тр. Ин-та биоресурсов и прикл. экол. 2002. № 2. С. 56–62.
Ухова Н.Л. Численность и структура населения почвенной мезофауны на начальных стадиях послеветровальных и послепожарных сукцессий в пихто-ельниках Висимского заповедника // Экологические исследования в Висимском заповеднике. Екатеринбург, 2006. С. 303–315.
Мордкович В.Г., Любечанский И.И., Березина О.Г. Проблема лесных пожаров и пирогенных сукцессий сообществ почвенных членистоногих в Сибири // Сиб. экол. журн. 2007. Т. 14. № 2. С. 169–181.
Краснощекова Е.Н. Трансформация комплексов почвенных беспозвоночных под воздействием пожаров в среднетаежных сосняках Енисейской равнины: Автореф. дис. … канд. биол. наук. Красноярск: УОП ИЛ СО РАН, 2009. 19 с.
Балязин И.В. Пирогенная динамика структуры населения почвенной мезофауны в лесных сообществах Южно-Минусинской котловины (на примере участка Шунерского бора) // Изв. Иркутского гос. ун-та. Сер.: Биология. Экология. 2013. Т. 6. № 2. С. 67–73.
Гонгальский К.Б. Структурно-функциональная организация почвенной биоты после лесных пожаров: Автореф. дис. … докт. биол. наук. М., 2018. 48 с.
de Groot W.J., Flannigan M.D., Cantin A.S. Climate change impacts on future boreal fire regimes // For. Ecol. Manage. 2013. № 294. P. 35–44.
Большаков В.Н., Бердюгин К.И., Васильева И.А., Кузнецова И.А. Млекопитающие Свердловской области: справочник-определитель. Екатеринбург: “Екатеринбург”, 2000. 240 с.
Сибгатуллин Р.З. Сукцессионные процессы в коренных и производных лесах Висимского заповедника после крупномасштабных природных нарушений // Экологические исследования в Висимском заповеднике. Екатеринбург, 2006. С. 284–293.
Сибгатуллин Р.З. Послепожарная динамика пихто-ельника липнякового в Висимском заповеднике // Биологическое разнообразие растительного мира Урала и сопредельных территорий. Екатеринбург, 2012. С. 34–35.
Беляева Н.В. Динамика травяно-кустарничкового яруса лесных сообществ Висимского заповедника после ветровала и пожара // Лесоведение. 2007. № 4. С. 25–35.
Гиляров М.С. Учет крупных почвенных беспозвоночных (мезофауны) // Методы почвенно-зоологических исследований. М.: Наука, 1975. С. 12–29.
Ивантер Э.В. К изучению динамики численности обыкновенной бурозубки (Sorex araneus) (опыт аналитического обзора состояния проблемы) // Зоол. журн. 2019. Т. 98. Вып. 8. С. 949–959.
Ананина Т.Л. Пространственная организация сообщества жужелиц (Coleoptera, Carabidae) в высотно-поясном градиенте Баргузинского хребта // Вестник Томского гос. ун-та. Биология. 2009. № 328. С. 178–182.
Потапова Н.А. Почвенные беспозвоночные (мезофауна) – 20 лет наблюдений в Окском заповеднике // Мониторинг сообществ на гарях и управление пожарами в заповедниках. М.: ВНИИ Природа, 2002. С. 57–65.
Ухова Н.Л. Структура населения и численность почвенной мезофауны в коренных и производных биотопах Висимского заповедника // Исследования эталонных территорий природных комплексов Урала. Екатеринбург, 2001. С. 409–439.
Kiss L., Magnin F., Torre F. The role of landscape history and persistent biogeographical patterns in shaping the responses of Mediterranean land snail communities to recent fire disturbances // J. Biogeogr. 2004. V. 31. P. 145–157.
Чернов Ю.И. Экология и биогеография. М.: КМК, 2008. 580 с.
Макаров А.М. Экологический анализ питания и территориальной организации популяций мелких насекомоядных млекопитающих тайги: Автореф. дис. … докт. биол. наук. Петрозаводск, 2004. 47 с.
Сергеева Е.В. Сезонная динамика состава и структуры почвенной мезофауны в сообществах коренной террасы Иртыша // Современные проблемы науки и образования. 2015. № 6. С. 595.
Дополнительные материалы отсутствуют.


