Экология, 2022, № 2, стр. 112-119
Изменение разнообразия хвойно-широколиственных лесов Южного Приморья в связи с рубками и пожарами
А. В. Иванов a, b, *, Е. В. Иванова a, С. В. Гамаева a
a Приморская государственная сельскохозяйственная академия
692510 Уссурийск, ул. Блюхера, 44, Россия
b Центр по проблемам экологии и продуктивности лесов РАН
117234 Москва, ул. Профсоюзная, 84/32, Россия
* E-mail: aleksandrgg86@mail.ru
Поступила в редакцию 21.04.2021
После доработки 30.07.2021
Принята к публикации 03.08.2021
- EDN: ETLTCB
- DOI: 10.31857/S0367059722020044
Аннотация
Определено разнообразие видов древостоя, подроста и подлеска, живого напочвенного покрова и таксоценов жужелиц лесных экосистем Южного Приморья различной степени нарушения. Оценки разнообразия получены на 13 постоянных пробных площадях в условно-коренных, нарушенных выборочными рубками и постпирогенных насаждениях. С помощью дисперсионного анализа установлено, что группы пробных площадей значимо отличаются по видовому составу древостоя, подроста и подлеска, индексам Шеннона древостоя, живого напочвенного покрова и таксоценов жужелиц. Индекс флористического сходства Жаккара для видов живого напочвенного покрова при сравнении пробных площадей внутри групп составил <0.1, между группами кедровников и дубняков 0.3–0.5, что указывает на радикальное изменение состава травянистых растений после пирогенной трансформации лесов. Численность особей жужелиц выше в дубовых лесах, но индекс Шеннона для жужелиц больше в кедровниках. Сделан вывод, что на юге Приморья выборочные рубки умеренной интенсивности существенно не изменяют видовой состав лесов, в то время как системные лесные пожары представляют угрозу их биологическому разнообразию.
Леса поддерживают и регулируют функционирование биосферы и с той или иной интенсивностью используются человечеством, что в некоторых регионах имеет форму системного сведения лесных насаждений, например для сельского хозяйства [1]. На настоящем этапе развития человечества неизбежен компромисс между потреблением экосистемных услуг лесов и потреблением лесных ресурсов, прежде всего древесины. За последние десятилетия число научных исследований экосистемных сервисов лесов сильно увеличилось, что привело к ряду политических решений и снижению темпов обезлесения в мире [2–5].
Функции и услуги лесов находятся в тесной взаимосвязи с биологическим разнообразием сообществ видов живых организмов [6, 7]: с одной стороны, составляющие биоразнообразия имеют четкие определения и количественные выражения, а с другой “биоразнообразие – это сложная и многомерная концепция, которую трудно измерить и контролировать, особенно в крупных масштабах” [8]. Утрата биоразнообразия лесов сопряжена с угрозами биологической продуктивности, региональному климату, непосредственно жизни и здоровью людей [7, 9]. Однако изменение способов и технологий лесопользования с учетом знаний об устойчивости связей между компонентами конкретных экосистем может снизить негативные последствия эксплуатации лесов [10, 11].
В зависимости от условий среды и характера возмущающего воздействия последствия пожаров и рубок для видового состава экосистем могут иметь противоположные результаты. Например, пожары, хотя и приводят к радикальным изменениям в экосистеме леса, могут как увеличивать, так и уменьшать разнообразие жужелиц [12–15]. В обзорной работе [17] эффект послерубочного увеличения биологического разнообразия лесов был отмечен в 38 из 145 исследований и сформулирован “парадокс нарушений”: рост возмущающих воздействий на леса в условиях изменения климата в целом может привести к ослаблению их экосистемных функций с одновременным увеличением биологического разнообразия.
Наше исследование посвящено изучению разнообразия некоторых компонентов хвойно-широколиственных лесов южной части Приморского края в связи с регулярными лесными пожарами и выборочными рубками. Пожары в этом регионе – мощный фактор преобразования ландшафтов. Опубликованы сведения о пирогенной трансформации кедровников в Приморском крае на площади более 1.5 млн га [18]. В настоящее время большие площади к югу от г. Владивостока и западу от г. Уссурийска полностью лишились лесного покрова в связи с регулярными пожарами антропогенной природы [19]. На обширных территориях коренные хвойно-широколиственные леса трансформированы в насаждения дуба монгольского [19]. Последствия этих процессов с позиции утраты экосистемных функций и биологического разнообразия не описаны. В литературе чаще всего обсуждаются последствия однократного нарушения известной интенсивности. Мы рассматриваем системное действие лесных пожаров в течение десятилетий.
Цель работы – выявить характер изменения видового богатства лесных биоценозов под действием пожаров и выборочных рубок. Разнообразие лесов оценено для древостоев, подроста и подлеска, живого напочвенного покрова и таксоценов жужелиц рода Carabus. Включение в анализ жужелиц обусловлено отсутствием в регионе исследования подобных работ и признанным индикаторным значением этой группы.
МАТЕРИАЛ И МЕТОДЫ
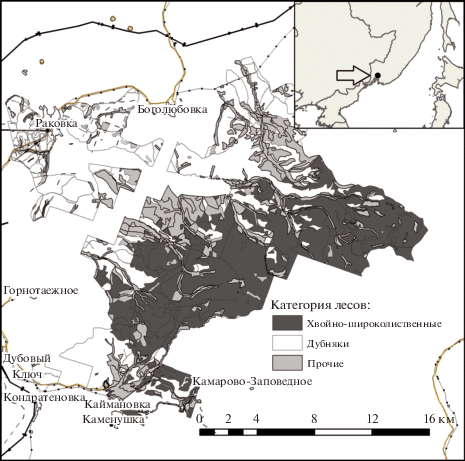
Район и пробные площади. Исследование выполнено на лесном участке Приморской государственной сельскохозяйственной академии (ПГСХА) площадью 28 тыс. га, входящем в состав Уссурийского лесничества Приморского края. Он расположен в 30 км к востоку от г. Уссурийска и граничит на западе с Уссурийским заповедником (рис. 1). Участок имеет следующие выгодные для исследований особенности: пересеченный рельеф (горы Пржевальского); густая речная сеть; высокое естественное разнообразие типов леса, характерное для региона в целом; место стыка маньчжурской и охотской флор; наличие лесосек разной давности с различными видами и интенсивностями рубок; близость к Приханскайской равнине – открытой, безлесной территории, откуда приходят сельскохозяйственные палы. Климатические условия характеризуются длительным вегетационным периодом (более 150 дней), среднегодовой температурой 3.5–5.5°C и годовым количеством осадков 600–950 мм, что обусловливает относительно высокую продуктивность лесов [20].
Сеть дорог и населенных пунктов в западной части участка также способствовала трансформации коренных лесов с доминированием кедра корейского (Pinus koraiensis Siebold & Zucc.) и пихты цельнолистной (Abies holophylla Maxim.) во вторичные дубняки под влиянием пожаров [21, 22]. Уссурийский заповедник и прилегающая к нему территория лесного участка – это относительно нетронутые коренные хвойно-широколиственные леса. Таким образом, по участку в направлении с юго-запада на северо-восток проходит естественная граница между постпирогенными и коренными лесами. Это обстоятельство мы использовали при обосновании выбора мест расположения пробных площадей (ПП).
На территории лесного участка ПГСХА заложили 13 постоянных ПП: 4 – в северо-западной части участка, в дубняках; 9 – в юго-восточной части, в кедрово-пихтовых лесах, 4 из которых расположены на лесосеках 2000-х гг., где проходили выборочные рубки. На каждой ПП размером 50 × 50 м выполнено таксационное описание древостоя [23].
Описание подроста, подлеска и живого напочвенного покрова. На каждой ПП по углам закладывали по три учетные площадки размером 10 × 10 м, на которых определяли виды растений подроста (молодые растения видов деревьев-лесообразователей), подлеска (кустарники и деревья, не участвующие в формировании древостоя) и живого напочвенного покрова (травянистые растения) с указанием общего числа видов (N) и общего проективного покрытия (ОПП). Описания выполнены в кедровниках в конце июня 2019 г., в дубняках – в конце июня 2020 г.
Сбор жужелиц осуществляли с помощью ловушек Барбера в кедровниках в 2017 г., в дубняках – в 2020 г. На каждой ПП на прямолинейной трансекте через 2–3 м вровень с землей вкапывали 15 стаканчиков объемом 200 мл . В ловушки заливали 6%-ный яблочный уксус. Проверку выполняли еженедельно в июне–июле. Таким образом, на каждой ПП выполнено 9 сборов насекомых. По данным метеостанции “Тимирязевский”, в распределении тепла и осадков в указанные годы не было аномалий, а локальная сезонная динамика встречаемости жуков нивелируется частотой сборов. Учитывали только виды рода Carabus; в каждую дату сбора по каждому виду указывали число пойманных особей.
Анализ данных. Разнообразие оценивали с помощью индекса Шеннона (H), используя натуральный логарифм [24, 25]. Практическое значение индекса Шеннона при анализе биоразнообразия показано в ряде работ [14, 25–27]. Флористическое сходство между пробными площадями характеризовали с помощью критерия Жаккара (J). Значимость различий средних значений оценивали с помощью дисперсионного анализа.
РЕЗУЛЬТАТЫ
Древостой. Деление ПП в хвойно-широколиственных лесах на нарушенные и ненарушенные сделано по относительной степени изъятия запаса и внешним признакам (число пней, неравномерность размещения деревьев). В табл. 1 приведены состав насаждений и основные таксационные показатели насаждений на пробных площадях. Нарушающие воздействия изменяют видовой состав древостоя с одновременным уменьшением запаса древесины, а следовательно, и запаса углерода фитомассы.
Таблица 1.
Таксационная характеристика пробных площадей
| ПП | Состав | М, м3/га | G, м2/га | A, лет | D, см | H |
|---|---|---|---|---|---|---|
| Относительно ненарушенные леса (группа 1) | ||||||
| 1 | 6П2Д1К1Лп + Бж, Г, Кл, Кпн, Я, Бх, Тр | 506 | 42.4 | 83 | 42.7 | 1.53 |
| 2 | 6П2К1Бж1Кл + Лп, Г, Я, Бб | 466 | 37.1 | 102 | 45.6 | 1.48 |
| 3 | 4Д3Лп2П1Я + Кл, П, Бч, Бб, Ил, Яб, Ма | 333 | 33.7 | 118 | 31.4 | 1.65 |
| 4 | 3Лп2Д2Я1К1П1Бб + Кл, Ил, Бч, Ма, Бж, Кпн, Клм, Ор | 324 | 34.0 | 102 | 33 | 2.04 |
| 5 | 3П2К2Бж1Лп1Кл1Г + Ор, Д, Ил, Кпн, Ма, Я, Бх, Тр | 312 | 32.0 | 80 | 24.2 | 2.15 |
| Леса после выборочных рубок (группа 2) | ||||||
| 1 | 4К2Лп1П1Кл1Бж1Г + Ил, Бх, Я, Тр, Чм | 273 | 26.8 | 110 | 40 | 1.87 |
| 2 | 3Лп2Кл2Д1П1Кпн1Г + К, Бж, Ма, Клл, Бб, Я, Ил, Бж | 207 | 23.1 | 105 | 34.6 | 2.20 |
| 3 | 3П2К2Лп1Бж1Кл1Г + Я, Ил, Тр, Ор | 283 | 29.1 | 110 | 37.8 | 1.85 |
| 4 | 3К2П2Ил2Кл1Гр + Лп, Тр, Бж, Ма, Ор | 105 | 10.3 | 94 | 31.1 | 1.70 |
| Вторичные постпирогенные леса, дубняки (группа 3) | ||||||
| 1 | 6К2Д2Бч | 305.2 | 37.6 | 80‒90 | 18.5 | 0.99 |
| 2 | 10Д + Ос, Бч, К | 128.2 | 17.4 | 80‒90 | 14.1 | 0.27 |
| 3 | 9Д1К + Бч, Ос | 182.4 | 25.7 | 80‒90 | 16.1 | 0.56 |
| 4 | 10Д + Бч | 200.4 | 26.3 | 80‒90 | 16.3 | 0.17 |
Примечание. М – запас стволовой древесины; G – абсолютная полнота (сумма площадей сечений стволов на высоте 1.3 м); А – средний возраст; D ‒ средний диаметр ствола доминирующего вида; H – индекс Шеннона. Виды деревьев: К – сосна кедровая корейская; П – пихта цельнолистная; Д – дуб монгольский; Лп – липы амурская и маньчжурская; Бж – береза желтая; Я – ясень маньчжурский; Ил – ильм японский; Бх – бархат амурский; Кпн – калопанакс семилопастный; Г – граб сердцелистный; Ор – орех маньчжурский; Бч – береза даурская; Бб – береза плосколистная; Ос – тополь дрожащий (осина); Кл – клен мелколистный; Клм – клен маньчжурский; Клл – клен ложнозибольдов; Ма – маакия амурская; Чм – черемуха Маака. После знака “+” приводятся виды, доля участия которых в составе насаждения по запасу не превышает 5%.
В составе древостоев относительно ненарушенных и послерубочных лесов участвуют 8–14 видов, в то время как в дубняках 2–4 вида. Средний возраст насаждений не превышает 120 лет, что соответствует средневозрастным кедровникам. Постпирогенные древостои почти полностью образованы дубом монгольским, устойчивым к низовым пожарам. Средние запасы насаждений в относительно ненарушенных, послерубочных и послепожарных лесах составляют 388 ± 40, 216 ± 41 и 204 ± 37 м3/га соответственно. Выборочные рубки, интенсивность которых не превышала 50% по запасу древесины, проводились на лесном участке в последние 15–40 лет, при этом, как будет показано далее, в целом здесь сохранена лесная среда, характерная для кедровых и чернопихтовых лесов. К возрасту 90 лет средний диаметр дуба составляет 14–18 см, т.е. прирост биомассы низок. Индекс Шеннона различается между группами древостоев в несколько раз. В относительно ненарушенных, послерубочных и послепожарных лесах среднее значение Н составило 1.77, 1.91, 0.50 соответственно. С помощью дисперсионного анализа получены значимые различия между группами лесов по числу видов (F = 24.1; p < 0.001), запасу древостоя (F = 7.0; p < 0.05), индексу Шеннона (F = 27.2; p < 0.001).
Подрост, подлесок и живой напочвенный покров. Характеристики состояния подроста, подлеска и живого напочвенного покрова изменялись в следующих пределах: живой напочвенный покров: N = 19–42 шт., ОПП = 11.5–49.9%, Н = = 0.66–2.50; подрост и подлесок: N = 7–27 шт., ОПП = 14.8–79.2%, Н = 0.66–2.66.; индекс Шеннона для подроста и подлеска в послепожарных дубняках значимо ниже, чем в кедровниках (F = 5.9; p < 0.05). В дубняках ярус кустарников разрежен. Большая часть проективного покрытия приходится на растения дуба монгольского высотой 1–3 м с зонтичной формой кроны. Общее число видов подроста и подлеска в послепожарных дубняках примерно в 2 раза меньше, чем в относительно ненарушенных и послерубочных лесах (F = 32.4; p < < 0.001).
При попарном сравнении списков видов трав между ПП внутри групп лесов (относительно ненарушенных, послерубочных и послепожарных) получены высокие значения индексов Жаккара (максимальное значение 0.76), что свидетельствует о высоком сходстве видового состава живого напочвенного покрова. Сравнивая составы видов трав хвойно-широколиственных лесов и дубняков, мы получили значения индексов, близкие к нулю. Различия в величине общего проективного покрытия трав между тремя группами лесов незначимы, в то время как средние значения индекса Шеннона между группами значимо различаются (F = 4.9; p < 0.05), что объясняется распространением в дубняках чужеродных видов растений.
Разнообразие видов рода Carabus. Всего поймано 2397 экз. жужелиц рода Carabus, относящихся к 9 видам (табл. 2): к редким видам на всех участках относятся C. macleayi, C. maakii, C. schrenkii и C. smaragdinus, остальные 5 видов встречаются массово. Число видов максимально на ПП в ненарушенных лесах и минимально во вторичных лесах. Количество пойманных особей в дубняках значительно больше: средние значения по группам ПП 1, 2, 3 – 160, 101 и 298 шт. соответственно. Однако некоторые виды, встречающиеся массово в кедровниках, в дубняках обнаружены лишь единично. Средние величины индекса Шеннона в относительно ненарушенных, послерубочных и послепожарных лесах составляют 1.35, 1.09 и 0.77 соответственно, при этом различия между группами лесов значимы (F = 16.0; p < 0.001).
Таблица 2.
Встречаемость видов жужелиц рода Carabus на пробных площадях (1‒5)
| Виды Carabus |
Относительно ненарушенные леса | Леса после выборочных рубок | Постпирогенные дубняки | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | |
| C. macleayi Blackburn | 5 | 1 | |||||||||||
| C. billbergi Mannerheim | 7 | 32 | 49 | 32 | 26 | 5 | 98 | 11 | 11 | 364 | 157 | 182 | 144 |
| C. careniger Chaudoir | 5 | 12 | 20 | 22 | 33 | 16 | 16 | 25 | 29 | 37 | 36 | 48 | 48 |
| C. granulatus L. | 7 | 13 | 38 | 45 | 7 | 3 | 6 | 19 | 31 | 1 | 1 | ||
| C. maackii Mor. | 1 | 1 | |||||||||||
| C. schrenkii Motsch. | 1 | 3 | 3 | 4 | 2 | 1 | 2 | 1 | 3 | 6 | 7 | ||
| C. smaragdinus Fischer | 5 | 9 | 10 | 4 | 3 | 3 | 8 | 2 | 2 | ||||
| C. venustus Mor. | 11 | 21 | 18 | 18 | 87 | 15 | 25 | 46 | 10 | 2 | 1 | 1 | 4 |
| C. vietinghoffi Adams | 42 | 11 | 33 | 163 | 7 | 1 | 11 | 2 | 35 | 74 | 11 | 25 | |
| Итого | 79 | 89 | 167 | 292 | 175 | 46 | 160 | 104 | 93 | 439 | 272 | 250 | 231 |
| Число видов | 8 | 5 | 8 | 7 | 8 | 7 | 7 | 5 | 7 | 5 | 6 | 6 | 7 |
ОБСУЖДЕНИЕ
Исследованные нами древостои лесов после выборочной рубки характеризуются более высоким индексом Шеннона по сравнению с ненарушенными древостоями. Такое различие можно объяснить появлением в окнах древостоя после рубки как светолюбивых (береза плосколистная Betula platyphylla Sukaczev, осина Populus tremula L.), так и широколиственных видов. Появление этих видов повышает выровненность состава древостоя. Наоборот, в ненарушенных лесах велико господство крупных (до 40 м высотой) деревьев кедра и пихты, под пологом которых в подчиненном положении находятся широколиственные виды. Подобный эффект отмечен, например, при выборочных рубках в насаждениях дуба и сосны в Испании [28].
В дубняках видовое богатство живого напочвенного покрова выше, чем в кедровниках и пихтарниках. В связи с частыми низовыми пожарами в дубняках в них появляются не характерные для кедровников адвентивные виды. В американских Аппалачах пожары также стали причиной увеличения разнообразия видов растений в местных сообществах [38]. Однако когда пожары происходят системно и усиливаются изменениями климата, возникает риск полной утраты лесных экосистем, как это происходит в Юго-Восточной Азии [29].
Повторяемость пожаров в дубняках на юге Приморья составляет не реже чем один раз в 10 лет, поэтому кустарниковый ярус не успевает сформироваться, а наиболее распространенные виды подроста и подлеска – это спутники гарей: леспедеца двуцветная (Lespedeza bicolor Turcz.), дуб монгольский (Quercus mongolica Fisch. ex Ledeb.), осина (Populus tremula L.), береза даурская (Betula dahurica Pall.). Слабо развитый подлесок в дубняках является вторым фактором высокого видового богатства травянистых растений, поскольку приземный слой сообществ оказывается более освещенным.
Показатели разнообразия живого напочвенного покрова, подроста и подлеска между пробными площадями относительно ненарушенных и нарушенных выборочной рубкой лесов меньше отличаются. Это указывает на большой потенциал насаждений к восстановлению естественного облика, минуя промежуточные сукцессионные этапы. Выборочные рубки невысокой интенсивности не приводят к резким изменениям разнообразия в формации кедровых и чернопихтовых лесов. Например, рубка с интенсивностью 50% в лесах центральной Финляндии также не привела к сильному изменению состава видов [30], а в лесах северной Мексики умеренная рубка значительно не повлияла на разнообразие древесных растений [10].
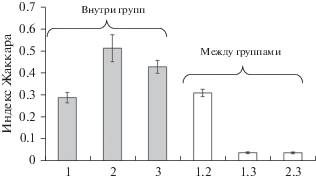
Средние значения индексов Жаккара при попарном сравнении списков видов травянистых растений внутри трех групп ПП, а также между группами ненарушенных и послерубочных лесов находятся в диапазоне 0.3–0.5 (рис. 2), что характеризует принадлежность всех пробных площадей этих групп лесов к одной формации. Сходство состава видов трав между послепожарными дубняками и другими лесами в несколько раз меньше. Следовательно, в дубняках и кедрово-пихтовых лесах произрастают преимущественно разные виды растений. При оценке флористического сходства насаждений на Алтае пороговое значение индекса Жаккара для сильного уровня сходства составило 0.5 [31]. Вероятно, с продвижением на юг это пороговое значение может уменьшаться в связи с увеличением числа видов. В нашем исследовании значение индекса >0.3 можно считать указывающим на сильное сходство.
Рис. 2.
Средние значения индекса Жаккара при сравнении перечней видов внутри групп пробных площадей и между группами: 1 – относительно ненарушенные леса, 2 – послерубочные леса, 3 – послепожарные леса.
Мы выявили виды растений, характерные преимущественно для хвойно-широколиственных лесов: оноклея чувствительная (Onoclea sensibilis L.), кислица обыкновенная (Oxalis acetosella L.), копытень Зибольда (Asarum sieboldi Miq.), чистоустник азиатский (Osmundastrum asiaticum Tagawa), триллиум Комарова (Trillium komarovii H. Nakai et Ко. Ito.), василистник нитчатый (Thalictrum filamentosum Maxim.), осока ржавопятнистая (Carex siderosticha Hance), кочедыжник женский (Athyrium filix-femina (L.) Roth ex Mert.), подмаренник даурский (Galium dahuricum Turcz. ex Ledeb.), адиантум стоповидный (Adiantum pedatum L.). Некоторые виды характерны преимущественно для дубняков: грушанка мясокрасная (Pyrola incarnata Freyn), клевер люпиновидный (Trifolium lupinaster L.), лютик японский (Ranunculus japonicus Thunb.), одуванчик лекарственный (Taraxacum officinale Webb ex F.H. Wigg.), осот полевой (Sonchus arvensis L.), очиток живучий (Sedum aizoon L.), полынь побегоносная (Artemisia stolonifera Kom.), ясенец мохнатоплодный (Dictamnus dasycarpus Turcz.).
Сезонная динамика встречаемости жужелиц на лесном участке ПГСХА описана ранее [32, 33]. Показано, что встречаемость определяется прежде всего фенологическими особенностями видов и осадками, обусловливающими влажность лесной подстилки и почвы. Насаждения дуба монгольского, почти чистые по составу, слабо устойчивы к листогрызущим насекомым. При фитопатологическом мониторинге насаждений лесного участка мы неоднократно фиксировали вспышки численности непарного шелкопряда (Lymantria dispar L.) и зимней пяденицы (Operophtera brumata L.), личинки которых составляют кормовую базу жужелиц Carabus. Вероятно, высокая численность жужелиц в дубняках опосредованно является следствием нарушения структуры леса. При этом разнообразие, оцененное индексом Шеннона, в дубняках вдвое ниже по сравнению с хвойно-широколиственными лесами. Некоторые исследования, выполненные в других регионах, показывают негативное воздействие пожаров на разнообразие почвенной энтомофауны и объясняют это, в частности, изменением разнообразия условий на поверхности почвы после удаления фрагментов мертвой древесины и подстилки [16, 34–36]. При оценке влияния пожаров на сообщества жужелиц в лиственничных лесах Великих озер [15] и штата Техас [14] установлено положительное воздействие прогораний на видовое богатство. Такие противоположные результаты, по-видимому, объясняются различными условиями среды, прежде всего разными запасами мертвой древесины и режимом осадков.
В целом выборочные рубки интенсивностью до 40% в южном Сихотэ-Алине не изменяют биологического разнообразия четырех исследуемых в настоящей работе элементов леса. Системное действие пожаров на эти элементы неодинаково: в постпирогенных лесах мы зафиксировали уменьшение разнообразия древостоя, подроста и подлеска и увеличение разнообразия живого напочвенного покрова, которое является следствием радикальной смены растительных ассоциаций, что подтверждается анализом индексов Жаккара. Численность жужелиц оказалась выше в дубняках, но индекс Шеннона для таксоценов жужелиц здесь значительно меньше, чем в кедрово-широколиственных лесах.
В современных исследованиях биологическое разнообразие оценивается не само по себе, а в связи с экосистемными функциями лесов [6, 10, 16]. В ряде работ показана связь между запасами углерода в лесных экосистемах и их биоразнообразием [6, 7, 37]. Нами использовался только один показатель продуктивности лесов – запас насаждений. Описанные изменения видового богатства при трансформации кедрово-пихтовых лесов в дубняки связаны с двукратным уменьшением запаса насаждений (см. табл. 1). Лесные пожары в Южном Приморье, происходившие два последних столетия, не способствовали поддержанию биоразнообразия: здесь проявляются четкие градиенты наступления пирогенных лесов на коренные с полным исчезновением лесов на части территорий Хасанского и Ханкайского районов.
ЗАКЛЮЧЕНИЕ
Разнообразие лесных экосистем на юге Приморья под действием выборочных рубок и лесных пожаров изменяется неодинаково. Выборочные рубки умеренной интенсивности в хвойно-широколиственных лесах не представляют серьезной угрозы их разнообразию; запасы биомассы здесь будут восстанавливаться с сохранением исходного видового состава древостоя. Для пирогенных вторичных лесов, возникающих на месте коренных насаждений с господством кедра корейского и пихты цельнолистной, характерен иной состав видов древостоя, подроста и подлеска, живого напочвенного покрова. Видовой состав жужелиц отличается слабо, однако общая их численность выше во вторичных лесах, а индекс Шеннона больше в коренных лесах. Многолетнее воздействие пожаров на хвойно-широколиственные леса ведет также к уменьшению запасов насаждений в среднем на 50%.
Исследование выполнено в рамках темы государственного задания ЦЭПЛ РАН № АААА-А18-118052590019-7 “Методические подходы к оценке структурной организации и функционирования лесных экосистем” (полевые работы) и при поддержке проекта Российского научного фонда № 19-77-30015 “Разработка методов и технологии комплексного использования данных дистанционного зондирования Земли из космоса для развития системы национального мониторинга бюджета углерода лесов России в условиях глобальных изменений климата” (анализ данных).
Список литературы
Состояние лесов мира – 2020. Леса, биоразнообразие и люди. Рим, ФАО. 228 с.https://doi.org/10.4060/ca8642ru
Acharya R.P., Maraseni T., Cockfiel G. Global trend of forest ecosystem services valuation – An analysis of publications // Ecosystem Services. 2019. V. 39. P. 100 979. https://doi.org/10.1016/j.ecoser.2019.100979
Fiorini A.C., Mullally C., Swisher M., Putz F.E. Forest cover effects of payments for ecosystem services: Evidence from an impact evaluation in Brazil // Ecological Economics. 2020. V. 169. P. 106522. https://doi.org/10.1016/j.ecolecon.2019.106522
Cao S., Suo X., Xia C. et al. Net value of forest ecosystem services in China // Ecological Engineering. 2020. V 142. P. 105645. https://doi.org/10.1016/j.ecoleng.2019.105645
Barua S.K., Boscolo M., Animon I. Valuing forest-based ecosystem services in Bangladesh: Implications for research and policies // Ecosystem Services. 2020. V. 42. P. 101 069. https://doi.org/10.1016/j.ecoser.2020.101069
Felipe-Lucia M.R., Soliveres S., Penone C. et al. Land-use intensity alters networks between biodiversity, ecosystem functions, and services // Proceedings of the National Academy of Sciences of the United States of America. 2020. V. 117. P. 28140‒28149. https://doi.org/10.1073/pnas.2016210117
Лукина Н.В., Гераськина А.П., Горнов А.В. и др. Биоразнообразие и климаторегулирующие функции лесов: актуальные вопросы и перспективы исследований // Вопросы лесной науки. 2020. Т. 3. № 4. С. 1‒90. https://doi.org/10.31509/2658-607x-2020-3-4-1-90
Watermeyer K.E., Guillera-Arroita G., Bal P. et al. Using decision science to evaluate global biodiversity indices // Conservation Biology. 2020. V. 25. P. 492–501. accepted article.https://doi.org/10.1111/cobi.13574
Gogoi A., Ahirwal J., Sahoo U.K. Plant biodiversity and carbon sequestration potential of the planted forest in Brahmaputra flood plains // Journal of Environmental Management. 2020. V. 280. P. 111 671.https://doi.org/10.1016/j.jenvman.2020.111671
Monarrez-Gonzalez J.C., Gonzalez-Elizondo M.S., Marquez-Linares M.A. et al. Effect of forest management on tree diversity in temperate ecosystem forests in northern Mexico // Plos one. 2020. V. 15. P. 1–16.https://doi.org/10.1371/journal.pone.0233292
Munks S.A., Chutera A.E., Koch A.J. ‘Off-reserve’ management in practice: Contributing to conservation of biodiversity over 30 years of Tasmania’s forest practices system // Forest Ecology and Management. 2020. V. 465. P. 117941. https://doi.org/10.1016/j.foreco.2020.117941
Sukhodolskaya R.A., Saveliev A.A. Effects of ecological factors on size-related traits in the ground beetle Carabus granulatus L. (Coleoptera, Carabidae) // Russ. J. Ecol. 2014. V. 45. Iss. 5. P. 414–420.
Sklodowski J.J. Three phases of changes in carabid assemblages during secondary succession in a pine forest disturbed by windthrow – results from the first 10 years of observations // Insect Conservation and Diversity. 2017. V. 10. P. 449-41. https://doi.org/10.1111/icad.12237
Michels G.J., Carney V.A., Jones E.N., Pollock D.A. Species diversity and qualitative assessment of ground beetles (Coleoptera: Carabidae) in Three Riparian Habitats // Environmental Entomology. 2010. V. 39. P. 738–752. https://doi.org/10.1603/EN09049
Auclerc A., Le Moine J.M., Hatton P.-J. et al. Decadal post-fire succession of soil invertebrate communities is dependent on the soil surface properties in a northern temperate forest // Science of the Total Environment. 2019. V. 647. P.1058–1068. https://doi.org/10.1016/j.scitotenv.2018.08.041
Thom D., Seidl R. Natural disturbance impacts on ecosystem services and biodiversity in temperate and boreal forests // Biol. Rev. 2015. V. 91. P. 760–781. https://doi.org/10.1111/brv.12193
Latty Erika F., Werner Shahla M., Mladenoff David J. et al. Response of ground beetle (Carabidae) assemblages to logging history in northern hardwood–hemlock forests // Forest Ecology and Management. 2006. V. 222. P. 335–347. https://doi.org/10.1016/j.foreco.2005.10.028
Корякин В.Н. Кедрово-широколиственные леса Дальнего Востока России. Хабаровск: ДальНИИЛХ, 2007. 359 с.
Куренцова Г.Э. Естественные и антропогенные смены растительности Приморья и Южного Приамурья. Новосибирск: Наука, 1973. 230 с.
Иванов А.В., Касаткин А.С., Мудрак В.П., Замолодчиков Д.Г. Надземная фитомасса древостоев хвойно-широколиственных лесов Южного Приморья // Лесоведение. 2018. № 6. С. 454–463.
Комаров В.Л. Типы растительности Южно-Уссурийского края // Тр. Почв.-ботан. экспедиции по исслед. колонизац. районов Азиатской России. М., 1917. Ч. II. Вып. 2.
Розенберг В.А., Колесников Б.П. Порослевые древесно-кустарниковые заросли малолесных районов Приморского края // Вопросы реконструкции и повышения продуктивности лесов Дальнего Востока. Сер. ботанич. Владивосток: ДВФ СО АН СССР, 1958. Т. IV (VI). С. 5–45.
Анучин Н.П. Лесная таксация: Учебник для ВУЗов. 5-е изд. М.: Лесная пром-сть, 1982. 552 с.
Лебедева Н.В., Дроздов Н.Н., Криволуцкий Д.А. Биологическое разнообразие и методы его оценки. М.: Изд-во МГУ, 1999. 94 с.
Шитиков В.К., Розенберг Г.С. Оценка биоразнообразия: попытка формального обобщения // Количественные методы экологии и гидробиологии: Сб. науч. тр. памяти А.И. Баканова. Тольятти: Самарский научный центр РАН, 2005. С. 91–129.
Bässler C., Förster B., Moning C., Müller J. The BIOKLIM Project: Biodiversity research between climate change and wilding in a temperate montane forest – The conceptual framework // Waldökologie, Landschaftsforschung und Na-turschutz (For. Ecol., Landscape Res. & Nat. Conserv.). 2009. Heft (Iss.) 7. P. 21–33.
Stirling G. Empirical relationships between species richness, evenness and proportional Diversity // American Naturalist. 2001. V. 158. P. 286–299. https://doi.org/10.1086/321317
MartinQueller E., Diez J.M., Ibanez I., Saura S. Effects of silviculture on native tree species richness: Interactions between management, landscape context and regional climate //Journal of Applied Ecology. 2013. V. 50. P. 775–785.
Sodhi N.S., Koh L.P., Brook B.W. Ng P.K.L. Southeast Asian biodiversity: an impending disaster // Trends in Ecology and Evolution. 2004. V. 19. № 12. P. 654‒660. https://doi.org/10.1016/j.tree.2004.09.006
Koivula Matti J., Venn Stephen, Hakola Pia, Niemelä Jari. Responses of boreal ground beetles (Coleoptera, Carabidae) to different logging regimes ten years post harvest // Forest Ecology and Management. 2019. V. 436. P. 27–38. https://doi.org/10.1016/j.foreco.2018.12.047
Тимошок Е.Е., Тимошок Е.Н., Райская Ю.Г. Биоразнообразие сосудистых растений в старовозрастных лесах Северо-Чуйского центра современного оледенения (Горный Алтай) // Успехи современного естествознания. 2018. № 11-2. С. 389–394.
Иванов А.В., Гамаева С.В., Панфилова Е.В. Оценка видового разнообразия растений и жужелиц на пробных площадях в кедрово-широколиственных насаждениях постпирогенного происхождения // Сибирский лесной журн. 2018. № 3. С. 73–82.
Панфилова Е.В., Ким Я.В., Иванов А.В. Видовое разнообразие жужелиц на лесном участке Приморской ГСХА // Аграрный вестник Приморья. 2017. № 3. С. 36‒38.
Saint-Germain M., Larrivee M., Drapeau P. et al. Short-term response of ground beetles (Coleoptera: Carabidae) to fire and logging in a spruce-dominated boreal landscape // Forest Ecology and Management. 2005. V. 212. P. 118–126.
Buckingham S., Murphy N., Gibb H. Effects of fire severity on the composition and functional traits of litter- dwelling macroinvertebrates in a temperate forest // Forest Ecology and Management. 2019. V. 434. P. 279–288. https://doi.org/10.1016/j.foreco.2018.12.030
Hammond J.H.E., Langor D.W., Spence J.R. Changes in saproxylic beetle (Insecta: Coleoptera) assemblages following wildfire and harvest in boreal Populus forests // Forest Ecology and Management. 2017. V. 401. P. 319–329. https://doi.org/10.1016/j.foreco.2017.07.013
Xu S., Eisenhauer N., Ferlian O. et al. Species richness promotes ecosystem carbon storage: evidence from biodiversity-ecosystem functioning experiments // Proc. R. Soc. B. 2020. V. 287. P. 2020–2063. https://doi.org/10.1098/rspb.2020.2063
Reilly Matthew J., Wimberly Michael C., Newell Claire L. Wildfire effects on plant species richness at multiple spatial scales in forest communities of the southern Appalachians // British Ecological Society. Journal of Ecology. 2005. V. 94. P. 118–130. https://doi.org/10.1111/j.1365-2745.2005.01055.x
Дополнительные материалы отсутствуют.