Экология, 2022, № 5, стр. 370-384
Многолетняя динамика концентраций тяжелых металлов в организме землероек рода Sorex в периоды высоких и сниженных выбросов медеплавильного завода
С. В. Мухачева *
Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: msv@ipae.uran.ru
Поступила в редакцию 18.02.2022
После доработки 17.05.2022
Принята к публикации 18.05.2022
- EDN: MVXMFJ
- DOI: 10.31857/S0367059722050092
Аннотация
Анализировали многолетнюю динамику накопления Cu, Zn, Cd и Pb в содержимом желудка и печени четырех видов землероек рода Sorex, обитающих в окрестностях Среднеуральского медеплавильного завода в периоды его высоких (1990–1997 гг.), сниженных (1998–2009 гг.) и почти прекратившихся (2010–2019 гг.) выбросов. Минимальные концентрации всех элементов в организме животных отмечены на незагрязненных участках, максимальные – в непосредственной близости от завода (Cu, Zn, Pb) или при умеренном загрязнении (Cd). Видовая специфика накопления рассмотренных элементов в организме определялась составом рационов и выражалась в повышенной аккумуляции Cu и Cd в печени S. araneus, Pb – S. caecutiens. Многократное сокращение промышленных выбросов не привело к эквивалентному снижению содержания тяжелых металлов (ТМ) ни в корме, ни в организме землероек. За 30 лет направленные изменения концентраций ТМ в печени отмечены только у S. caecutiens: на сильно загрязненных участках (1–3 км от завода) содержание Zn не изменилось, концентрации Cd и Pb снизились в 1.2–1.5 раза, а Cu, напротив, увеличились в 1.5 раза; в зоне умеренного загрязнения (4–10 км) содержание Cu, Zn и Pb не изменилось, а концентрации Cd уменьшились в 1.5 раза; на фоновой территории (20–34 км) содержание эссенциальных элементов (Cu, Zn) поддерживалось на одном уровне, а токсичных (Cd и Pb) снизилось в 4–5 раз.
В последние десятилетия в большинстве стран в силу разных причин выбросы промышленных предприятий сокращаются [1, 2]. Однако разнообразные загрязнители, в том числе тяжелые металлы (ТМ), продолжают циркулировать в окружающей среде в течение длительного времени, оказывая негативное воздействие на биоту [3]. Скорость восстановления разных компонентов наземных экосистем после снижения выбросов неодинакова и зависит от многих факторов, в том числе от снижения токсической нагрузки [4–12]. Поэтому для изучения закономерностей естественного восстановления экосистем необходима информация о динамике поступления поллютантов в среду и их содержании в компонентах биоты [2].
Мелких млекопитающих – мышевидных грызунов и мелких насекомоядных – традиционно рассматривают в качестве модельных объектов экотоксикологических исследований благодаря их широкому распространению, значительной численности, высокой плодовитости, относительной оседлости и простоте сбора [13, 14]. В наземных экосистемах мелкие млекопитающие играют разные функциональные роли – как первичных (фитофаги), так и вторичных (зоофаги) консументов. Их использование позволяет охарактеризовать токсическую нагрузку одновременно на двух уровнях: концентрации элементов в содержимом желудка дают интегральную оценку поступления загрязнителей с кормом, а данные о накоплении в органах-депо служат ее “маркером” на уровне организма [15].
Мелкие насекомоядные, в том числе землеройки рода Sorex, представляют потенциальный интерес для долговременных исследований. Небольшие размеры тела, высокая скорость метаболизма и диета на основе беспозвоночных, накапливающих значительные количества ТМ, делают их более уязвимыми к воздействию ксенобиотиков по сравнению с другими млекопитающими [16–18]. Антропогенное загрязнение приводит к существенным изменениям у землероек на разных уровнях организации – от ценотического и популяционного до организменного и клеточного [8, 16, 19–23]. Экспериментально [24, 25] и в натурных исследованиях [16, 20, 26] установлено, что землеройки способны накапливать ТМ в количествах, значительно превышающих уровни, вызывающие в организме мышевидных грызунов необратимые нарушения, вплоть до летальных. Однако фактические данные о динамике содержания ТМ в корме и организме землероек в условиях хронического промышленного загрязнения, а также после существенного сокращения выбросов предприятий нам не известны.
В течение последних 30 лет мы проводили ежегодные обследования населения мелких млекопитающих в зоне воздействия Среднеуральского медеплавильного завода (СУМЗ). Ранее [15] были представлены результаты анализа многолетней динамики содержания ТМ (Cu, Zn, Cd, Pb) в рационе и организме особей рыжей полевки (Myodes (Clethrionomys) glareolus). Этот широко распространенный, экологически пластичный вид является типичным фитофагом. Многократное (50 раз за 25 лет) сокращение промышленных выбросов СУМЗа не привело к эквивалентному снижению концентраций ТМ ни в корме, ни в организме полевок: в зоне сильного загрязнения двукратно увеличилось содержание Cd, на фоновых участках в 1.7–2.5 раза снизились концентрации Pb, в остальных случаях направленных изменений не выявлено. Это позволило сделать вывод о ключевой роли рационов и системы элементоспецифичных гомеостатических барьеров в накоплении ТМ в организме фитофагов. Представляется интересным изучить подобные изменения у представителей другого трофического уровня – зоофагов, и попытаться ответить на вопрос, будут ли у них наблюдаться такие же закономерности.
Цель настоящей работы – анализ многолетней динамики концентраций ТМ (Cu, Zn, Cd, Pb) в организме землероек рода Sorex, обитающих в зоне действия крупного медеплавильного завода, в период высоких выбросов и после их значительного сокращения. Проверяли две гипотезы: 1) накопление ТМ в организме совместно обитающих видов землероек неодинаково и определяется спецификой их рациона; 2) снижение выбросов ведет к уменьшению концентраций ТМ в организме землероек.
МАТЕРИАЛ И МЕТОДЫ
Источник выбросов. Исследования проведены в зоне воздействия атмосферных выбросов Среднеуральского медеплавильного завода (СУМЗ), расположенного в 50 км к западу от г. Екатеринбурга. Предприятие работает с 1940 г. и является крупнейшим на Урале по выплавке меди из первичного сырья и производству серной кислоты. В 1980-е гг. валовые выбросы СУМЗа (в основном газообразные соединения S, F и N, а также пылевые частицы с сорбированными Cu, Pb, Zn, Cd, Fe, Hg, As) достигали 225 тыс. т/год, что делало предприятие одним из основных источников промышленного загрязнения в России. В течение 1990-х гг. объем выбросов сократился в 2 раза – со 148 тыс. т в 1990 г. до 65 тыс. т в 1999 г; в последующие 10 лет снижение было еще более выраженным – с 63 тыс. т в 2000 г. до 22 тыс. т в 2009 г. С 2010 г., после завершения реконструкции завода, валовые выбросы не превышают 3–5 тыс. т/год. За последние 30 лет валовые выбросы предприятия сократились более чем в 50 раз, при этом сильнее всего снизились концентрации SO2 (в 80 раз), Cu (3000 раз), Zn (15 раз) и Pb (8.5 раза) [27].
Район исследований. Ключевые участки расположены в елово-пихтовых лесах на разном удалении (от 1 до 34 км) к западу от СУМЗа (против господствующего направления ветров). Они сгруппированы в три зоны, различающиеся степенью поражения экосистем – фоновую, буферную и импактную. Выраженность процессов деградации лесных фитоценозов в разных зонах нагрузки неодинакова: фоновая зона (20–34 км от завода) характеризует относительно ненарушенное состояние, которое обусловлено действием только региональных выпадений поллютантов; в буферной зоне (4–10 км) отмечаются структурные перестройки экосистем, вызванные действием локального загрязнения; в импактной зоне (1–3 км) структура экосистем кардинально отличается от фонового состояния – здесь представлены крайние варианты техногенной дигрессии сообществ [28, 29]. Детальное описание района исследований, ключевых участков и методики сбора материала опубликованы ранее [8].
Исследования охватывали 30 лет, которые пришлись на периоды высоких (1990–1997 гг., далее – период I), сниженных (1998–2009 гг., период II) и почти прекратившихся (2010–2019 гг., период III) выбросов. Основная часть материала собрана на 7 ключевых участках, расположенных в импактной (1, 1.5 и 2 км от завода), буферной (4 и 6 км) и фоновой (20 и 30 км) зонах. В течение III периода население мелких млекопитающих дополнительно исследовали еще на 4 ключевых участках в импактной (3 км от завода), буферной (7 и 10 км) и фоновой (34 км) зонах.
Сбор материала. Животных отлавливали ежегодно (май, июль, сентябрь), одновременно на всех ключевых участках, используя метод ловушко-линий [30]. Деревянные ловушки-плашки с крючком устанавливали на стационарных маркированных линиях (25 шт. через 5–7 м в течение 3–5 сут с ежедневной однократной проверкой), на каждом участке в течение тура располагали от 2 до 4 линий. При анализе многолетней динамики накопления ТМ в корме и организме землероек использование стационарных точек отлова позволило существенно снизить влияние пространственной неоднородности условий, особенно выраженное на загрязненных территориях (в том числе мозаичности полей загрязнения, состава и обилия кормовых ресурсов, качества микроучастков, пригодных для обитания разных видов) [8, 27, 28]. Принимая во внимание ограничения данного метода для учета землероек, на смежных территориях регулярно проводили дополнительные отловы животных с использованием других схем и орудий лова (трапиковых живоловок, конусов с заборчиками, ловушек Барбера). Это позволило получить более полные данные о видовом составе землероек рода Sorex в разных зонах загрязнения и собрать более представительный материал. За время исследований отработано около 100 тыс. лов.-сут, в анализ включены 952 особи. Видовую идентификацию землероек проводили на основе экстерьерных признаков (масса тела, длина тела, хвоста, задней ступни), кондилобазальной длины черепа и особенностей зубного ряда [31, 32]. Латинские названия и последовательность видов в табл. 1 соответствуют сводке “Mammals Species of the World” [33].
Таблица 1.
Концентрация ТМ в содержимом желудка и печени землероек рода Sorex, мкг/г сухой массы
| Зона загрязнения | Содержимое желудка | Печень | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | Cu | Zn | Cd | Pb | n | Cu | Zn | Cd | Pb | |
| Sorex araneus | ||||||||||
| Фоновая | 30 | 16.7 [80.4] (2.9–86.6) |
160.2 [42.0] (60.4–359.8) |
7.6 [63.9] (0.6–24.8) |
4.7 [91.5] (na–36.2) |
185 | 19.3 [33.0] (6.6–46.5) |
92.3 [36.2] (34.2–343.6) |
15.2 [65.7] (0.03–65.3) |
1.5 [97.3] (na–14.0) |
| Буферная | 7 | 39.8 [86.9] (12.8–136.9) |
310.1 [20.0] (220.5–393.9) |
24.3 [52.8] (9.8–49.4) |
28.8 [91.6] (14.5–97.6) |
206 | 27.9 [44.8] (8.7–80.3) |
100.1 [26.8] (27.0–210.8) |
37.5 [66.3] (4.7–165.8) |
3.7 [152.0] (na–94.2) |
| Импактная | 5 | 54.3 [65.2] (19.0–131.5) |
142.1 [29.9] (88.3–209.4) |
3.2 [85.7] (1.5–10.2) |
15.2 [88.4] (4.7–50.2) |
23 | 28.0 [39.1] (7.8–47.5) |
105.0 [43.9] (32.9–237.4) |
26.0 [46.5] (2.7–59.4) |
5.2 [71.2] (0.4–19.2) |
| Sorex caecutiens | ||||||||||
| Фоновая | 10 | 19.2 [60.7] (8.2–45.4) |
148.3 [66.1] (48.7–472.4) |
1.7 [100.8] (0.2–9.9) |
5.5 [101.5] (1.2–29.5) |
126 | 18.4 [23.0] (11.2–36.9) |
97.8 [29.2] (49.9–272.1) |
6.6 [89.4] (0.8–44.8) |
2.8 [141.3] (na–68.8) |
| Буферная | 10 | 36.0 [60.8] (19.4–98.2) |
157.4 [19.3] (104.6–211.7) |
3.3 [57.7] (0.4–7.7) |
17.9 [96.0] (4.0–87.7) |
149 | 19.0 [35.2] (10.4–74.7) |
94.6 [24.8] (24.2–229.6) |
11.9 [85.8] (0.1–97.1) |
4.9 [116.0] (na–81.1) |
| Импактная | 20 | 46.0 [44.3] (17.2–107.5) |
158.9 [37.3] (94.6–330.8) |
3.1 [92.7] (0.2–19.8) |
11.9 [125.5] (1.3–92.8) |
155 | 22.5 [30.0] (7.8–55.4) |
97.2 [39.1] (32.9–336.2) |
11.2 [72.5] (1.3–61.0) |
6.8 [116.9] (0.3–103.0) |
| Sorex isodon | ||||||||||
| Фоновая | 7 | 14.7 [72.2] (9.7–44.5) |
215.4 [51.7] (116.6–492.3) |
6.5 [53.9] (1.0–14.8) |
6.0 [73.4] (1.2–29.5) |
67 | 20.4 [33.3] (11.8–45.4) |
97.4 [30.2] (42.0–216.0) |
16.2 [80.0] (1.70–77.3) |
1.8 [197.8] (0.04–56.0) |
| Буферная | 0 | – | – | – | – | 10 | 27.1 [35.8] (16.1–46.9) |
95.4 [20.6] (74.1–131.2) |
26.4 [76.3] (6.2–84.2) |
3.2 [113.8] (0.6–21.0) |
| Импактная | 0 | – | – | – | – | 1 | 20.5 | 91.6 | 37.3 | 0.4 |
| Sorex minutus | ||||||||||
| Фоновая | 1 | 34.8 | 60.2 | 1.8 | 2.9 | 7 | 20.2 [30.4] (13.6–32.4) |
119.2 [29.8] (67.6–168.2) |
8.7 [71.6] (3.2–25.7) |
5.4 [59.4] (0.6–13.2) |
| Буферная | – | – | – | – | 4 | 20.6 [10.2] (19.4–23.8) |
113.1 [18.0] (83.7–127.2) |
5.9 [69.8] (3.0–12.8) |
3.4 [62.9] (1.4–7.5) |
|
| Импактная | 1 | 41.1 | 195.6 | 6.4 | 9.2 | 6 | 18.7 [32.6] (11.8–29.6) |
84.7 [16.2] (61.7–100.9) |
8.5 [71.5] (3.1–20.9) |
5.6 [60.1] (1.5–12.2) |
Объекты исследования. Землеройки рода Sorex представлены во всех зонах загрязнения [8]. Доля группы в населении мелких млекопитающих фоновой и буферной зон составляла в среднем 12–13%, импактной – около 17%. Лишь в отдельные годы на некоторых участках вклад бурозубок достигал 40–60% от общей численности мелких млекопитающих [34]. Во всех зонах представлены четыре вида: обыкновенная (Sorex araneus Linnaeus, 1758), средняя (S. caecutiens Laxmann, 1788), малая (S. minutus Linnaeus, 1766) и равнозубая (S. isodon Turov, 1924) бурозубки. Первые два вида обычны во всех зонах и регулярно регистрируются в уловах. Малая бурозубка хотя и представлена во всех зонах, но в силу своих небольших размеров редко отлавливается давилками и живоловками, а особенности других методов учета не позволили использовать образцы для химического анализа. Равнозубая бурозубка наиболее многочисленна в фоновой зоне, а на загрязненных территориях встречается эпизодически.
Для землероек рода Sorex характерны высокая метаболическая активность и значительная потребность в пище: суточное потребление корма у большинства видов составляет от 100 до 250% массы тела [35–39]. Кормовой спектр широкий и состоит главным образом из насекомых, паукообразных и дождевых червей (у крупных видов) [40, 41]. Специфика питания совместно обитающих видов проявляется в преимущественном поедании разных групп беспозвоночных, хотя списки основных жертв почти полностью перекрываются [42]. Это достигается за счет разделения горизонтов обитания и кормодобывания: для S. araneus и S. isodon – почвенный и (частично) напочвенный слои, для S. caecutiens и S. minutus – напочвенно-подстилочный слой [43, 44]. Немаловажным фактором, определяющим выбор кормовых объектов, является соответствие размеров жертв особенностям челюстного аппарата [42]. Основу рациона S. araneus и S. isodon составляют дождевые черви (более 60%) и личинки двукрылых, а S. caecutiens и S. minutus – паукообразные, напочвенные жесткокрылые (Carabidae, Elateridae, Staphylinidae), личинки двукрылых, клопы [40–42]. При этом трофические связи с собственно почвенными беспозвоночными ослабевают в ряду S. isodon > > S. araneus > S. caecutiens > S. minutus [43].
Химический анализ образцов. В течение всего периода наблюдений образцы для химического анализа собирали по единому протоколу, который был создан в начале работ и затем неуклонно соблюдался. Печень и содержимое желудка (индивидуально для каждой особи) сушили на предметных стеклах при температуре 75°С, упаковывали в герметичные пластиковые пакеты и хранили в сухом прохладном месте до начала аналитических работ. Образцы взвешивали на аналитических весах КERN-770 (точность 0.0001 г), помещали в тефлоновые сосуды с 7 мл 65%-ной HNO3 (осч) и 1 мл деионизированной H2O, выдерживали в течение 30 мин и затем озоляли в микроволновой печи МWS-2 (Berghof, Германия). После озоления объем пробы доводили до 10 мл деионизированной H2O. Концентрацию элементов (мкг/г сухой массы) определяли методом атомной абсорбции на спектрометре AAS6 Vario (Analitik Jena, Германия) с использованием пламенного (Cu, Zn) и электротеротермического (Cd, Рb) вариантов атомизации.
Качество измерений оценивали по международному стандартному образцу СRМ 185R (бычья печень). Извлечение составило, %: Cu – 93.2, Zn – 99.8, Cd – 114.2, Pb – 94.4; предел обнаружения, мкг/мл: для Cu – 0.013, Zn – 0.005, Cd – 0.001, Pb – 0.013. В случае, когда концентрация элемента была ниже предела обнаружения, для статистического анализа использовали значение, равное половине предела обнаружения. Проанализировано 939 образцов печени, 91 образец содержимого желудка.
Подготовка проб и определение концентраций ТМ выполнены в течение 2015–2017 гг. и 2019 г. по стандартным протоколам на одном и том же оборудовании в лаборатории экотоксикологии популяций и сообществ ИЭРиЖ УрО РАН. Исключение составила небольшая выборка (около 90 образцов печени обыкновенной бурозубки, сборы 1990–1995 гг.), проанализированная в 1995 г. на аналогичном оборудовании (AAS-3). Слепое повторное тестирование образцов не проводилось ввиду малых объемов исходного материала.
Статистический анализ. Распределение концентраций элементов в большинстве случаев было близко к логнормальному. Для концентраций ТМ рассчитаны описательные статистики (среднее геометрическое, размах, коэффициент вариации). Статистической единицей считали особь. Для оценки различий в концентрациях ТМ между участками и периодами, а также между видами использовали двухфакторный ANOVA (значения предварительно логарифмировали, Log10). Множественные сравнения выполнили по критерию Тьюки. Для анализа динамики концентраций ТМ, в том числе в варианте для смешанных эффектов, использовали линейную регрессию. В статистических тестах значимыми считали различия при p < 0.05. Расчеты выполнили в пакете JMP v.11 [45], анализ моделей со смешанными эффектами в среде R v.4.1 [46] посредством пакета lme4 v. 1.1 [47]. Исходные данные и код размещены на репозитории zenodo (https://doi.org/10.5281/ zenodo.6560130).
РЕЗУЛЬТАТЫ
Концентрация ТМ в организме и рационе землероек. Данные о содержании ТМ в печени и содержимом желудка четырех видов рода Sorex, обобщенные за весь период наблюдений (1990–2019 гг.), приведены табл. 1. В пределах зоны элементный состав печени и содержимого желудков был наиболее близким у тех пар видов, которые характеризуются сходным рационом и ярусом кормодобывания: S. araneus – S. isodon и S. caecutiens – S. minutus. Из-за недостатка данных по S. isodon и S. minutus для дальнейшего сравнения использовали результаты только по S. araneus и S. caecutiens, предполагая, что они могут характеризовать и другой вид из “своей” пары. Различия между этими видами были статистически значимыми для всех ТМ (F = 4.6–144.5, p = 0.032–0.0001), поэтому далее виды рассмотрены отдельно.
Концентрация ТМ в печени S. araneus. Накопление всех элементов зависело от зоны загрязнения, для Cu и Pb статистически значимыми были также период и взаимодействие факторов (табл. 2). Минимальные уровни накопления ТМ зарегистрированы на фоновой территории, максимальные концентрации Cu, Zn и Pb – в импактной зоне, Cd – в буферной (см. табл. 1).
Таблица 2.
Результаты дисперсионного анализа различий концентраций ТМ в печени S. araneus и S. caecutiens между зонами нагрузки и периодами (F-критерий, в скобках – достигнутый уровень значимости, n – число образцов)
| Источник изменчивости | df | Cu | Zn | Cd | Pb |
|---|---|---|---|---|---|
| Sorex araneus | |||||
| Зона | 2 | 41.7 (<0.0001) | 12.4 (<0.0001) | 61.9 (<0.0001) | 40.5 (<0.0001) |
| Период | 2 | 10.3 (<0.0001) | 0.7 (0.484) | 0.1 (0.881) | 8.9 (0.0002) |
| Зона × период | 4 | 3.5 (0.008) | 2.6 (0.038) | 2.3 (0.056) | 3.5 (0.009) |
| n | 410 | 410 | 410 | 341 | |
| Sorex caecutiens | |||||
| Зона | 2 | 10.6 (<0.0001) | 0.5 (0.615) | 8.8 (0.0002) | 18.5 (<0.0001) |
| Период | 2 | 39.5 (<0.0001) | 7.2 (0.001) | 11.4 (<0.0001) | 24.1 (<0.0001) |
| Зона ×период | 4 | 2.4 (0.048) | 1.6 (0.167) | 3.2 (0.014) | 1.6 (0.184) |
| n | 430 | 430 | 430 | 405 | |
В годы высоких выбросов (период I) содержание Pb на загрязненных участках превышало фоновые значения в 2–3.2 раза, Cd – в 2.7 раза, Cu – в 1.6–2.8 раза, Zn – в 1.2–1.5 раза (табл. 3). После почти полного прекращения выбросов (период III) различия между фоновыми и загрязненными участками сохранились для Cu и Zn на том же уровне, а для Cd и Pb стали более выраженными – в 4 и 5–6.5 раза. Усиление различий по Cd обусловлено двукратным увеличением концентрации в печени животных буферной зоны при неизменных фоновых значениях. Для Pb подобные изменения, напротив, связаны с трехкратным падением концентрации в фоновой зоне при менее значительном снижении (до 30–70%) в окрестностях завода (рис. 1).
Таблица 3.
Концентрация тяжелых металлов в печени Sorex araneus в градиенте загрязнения среды в периоды высоких (I), сниженных (II) и почти прекратившихся выбросов (III), мкг/г сухой массы
| Зона | Период | n | Cu | Zn | Cd | Pb | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| Фоновая | I | 65 | 17.6 [37.4] (6.6–45.1) |
b | 79.4 [34.2] (34.2–154.6) |
b | 12.5 [66.2] (0.03–47.2) |
a | 1.7 [71.3] (0.06–7.9) |
a |
| II | 88 | 19.8 [32.2] (7.2–46.5) |
ab | 101.5 [21.4] (42.6–166.4) |
a | 18.0 [66.1] (1.3–65.3) |
a | 2.1 [89.8] (0.3–12.3) |
a | |
| III | 32 | 21.8 [24.1] (13.8–35.8) |
a | 87.2 [14.0] (72.5–122.4) |
b | 14.4 [42.4] (1.2–31.4) |
a | 0.5 [117.5] (0.01–6.3) |
b | |
| Буферная | I | 146 | 27.4 [41.4] (8.7–78.2) |
b | 95.5 [28.3] (27.0–210.8) |
b | 33.7 [59.8] (8.8–104.9) |
b | 3.5 [54.5] (0.4–11.8) |
a |
| II | 35 | 23.2 [20.7] (16.2–38.5) |
b | 114.2 [15.9] (72.7–164.4) |
a | 42.9 [48.7] (9.1–101.6) |
ab | 4.5 [75.4] (0.7–20.7) |
a | |
| III | 25 | 39.7 [44.3] (15.6–80.3) |
a | 109.4 [27.9] (70.1–193.8) |
ab | 58.4 [67.4] (4.7–165.8) |
a | 2.7 [97.8] (0.1–21.7) |
a | |
| Импактная | I | 10 | 49.7 [25.1] (7.8–44.1) |
a | 117.6 [46.8] (32.9–237.0) |
a | 33.8 [31.2] (16.9–51.9) |
a | 5.5 [12.2] (4.9–6.2) |
a |
| II | 6 | 26.3 [32.2] (14.2–39.3) |
a | 94.2 [16.8] (65.7–111.9) |
a | 22.8 [46.2] (11.0–40.0) |
a | 9.1 [58.2] (3.8–19.1) |
a | |
| III | 7 | 34.8 [28.2] (17.6–28.2) |
a | 98.0 [43.5] (65.8–169.1) |
a | 20.2 [68.0] (2.7–59.4) |
a | 3.2 [80.1] (0.4–10.9) |
a | |
Примечание. Здесь и в табл. 4 приведены среднее геометрическое, в круглых скобках – минимальное и максимальное значения, в квадратных – коэффициент вариации (%), n – количество проанализированных образцов. Одинаковые буквы означают отсутствие значимых различий в пределах зоны для каждого элемента (по критерию Тьюки).
Рис. 1.
Многолетняя динамика концентрации (мкг/г сухой массы) ТМ в печени Sorex araneus в разных зонах загрязнения. Результаты линейной регрессии рассчитаны на основе среднегодовых значений (медиан): здесь и на рис. 2 точки – индивидуальные значения; кружки – среднее для года значение; $R_{{{\text{adj}}}}^{2}$ – коэффициент детерминации; b – коэффициент регрессии; р – достигнутый уровень значимости; линии – тренды линейной регрессии.
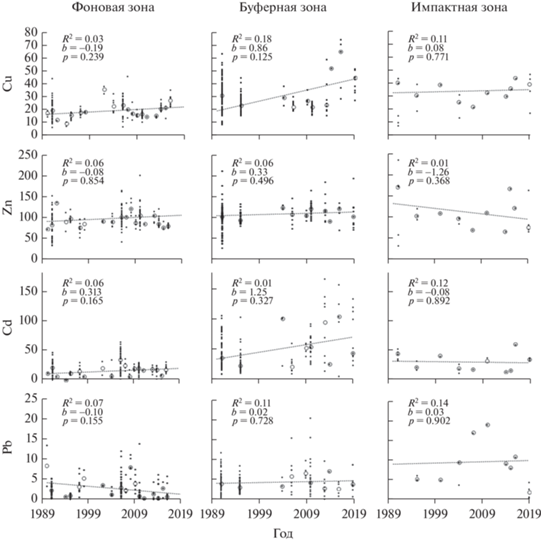
На протяжении всего периода наблюдений концентрации ТМ в печени характеризовались высокой изменчивостью: во всех зонах минимальное варьирование зарегистрировано для эссенциальных элементов (Cu, Zn), тогда как для токсичных (Cd, Pb) величины коэффициента вариации были в 2–4 раза выше (см. табл. 3).
Концентрация ТМ в печени S. caecutiens. Накопление ТМ (за исключением Zn) зависело от зоны загрязнения и периода, значимым было также взаимодействие этих факторов для Cu и Cd (см. табл. 2). Минимальные уровни ТМ зарегистрированы в фоновой зоне, максимальные концентрации Cu и Pb – в импактной зоне, Cd – в буферной (см. табл. 1).
В период I содержание Pb в импактной зоне превышало фоновые значения в 1.5 раза, Cu и Zn – на 10–15%, а концентрации Cd, напротив, в 1.2–1.4 раза были ниже фоновых. В период III различия между фоновыми и загрязненными участками для Cu, Cd и Pb стали более выраженными, тогда как для Zn сохранились на том же уровне (табл. 4). Усиление различий в содержании элементов было обусловлено наличием четких трендов. В импактной зоне содержание Cu в печени животных повышалось со скоростью 1% в год, что за 30 лет наблюдений привело к 30%-ному росту по сравнению с исходными значениями (рис. 2). Усиление различий по Cd (в 2.3–2.7 раза) связано в первую очередь с направленными изменениями в фоновой зоне, где в результате постепенного снижения (на 3% в год) концентрация элемента уменьшилась в 4 раза. На загрязненных территориях итогом направленного снижения уровня Cd (на 1.2– 1.3% в год) за тот же временной интервал стало общее уменьшение концентрации элемента примерно в 1.5 раза. Для Pb подобные изменения были выражены еще сильнее: в фоновой зоне снижение концентрации со скоростью 4% в год привело к пятикратному падению по сравнению с исходными значениями, в импактной зоне снижение было менее значительным (на 1% в год) и составило 1.5 раза (см. табл. 4).
Таблица 4.
Концентрация тяжелых металлов в печени Sorex caecutiens в градиенте загрязнения среды в периоды высоких (I), сниженных (II) и почти прекратившихся выбросов (III), мкг/г сухой массы
| Зона | Период | n | Cu | Zn | Cd | Pb | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| Фоновая | I | 10 | 17.1 [18.7] (13.1–25.2) |
b | 76.3 [25.1] (49.9–111.2) |
b | 16.4 [50.5] (4.3–27.8) |
a | 4.4 [72.3] (1.3–12.6) |
a |
| II | 96 | 17.9 [21.9] (11.2–36.9) |
b | 98.3 [22.0] (62.4–159.2) |
a | 6.6 [86.8] (0.8–33.2) |
b | 3.3 [102.2] (0.2–31.0) |
a | |
| III | 20 | 21.6 [22.1] (12.6–29.8) |
a | 99.7 [34.6] (53.8–202.3) |
a | 3.9 [56.0] (1.3–10.6) |
c | 0.9 [125.1] (0.05–8.85) |
b | |
| Буферная | I | 34 | 18.3 [27.0] (10.4–36.9) |
b | 89.4 [17.4] (52.9–139.8) |
a | 13.5 [58.4] (5.0–39.1) |
a | 3.3 [114.6] (0.9–29.4) |
b |
| II | 96 | 18.3 [21.9] (12.2–45.1) |
b | 95.8 [24.2] (24.2–177.0) |
a | 11.3 [81.8] (0.1–80.0) |
a | 5.9 [77.7] (0.1–32.4) |
a | |
| III | 19 | 22.9 [23.3] (12.3–32.6) |
a | 92.8 [27.2] (70.3–159.4) |
a | 8.9 [65.8] (2.3–26.8) |
b | 2.6 [140.5] (0.05–37.4) |
b | |
| Импактная | I | 37 | 18.7 [27.1] (7.8–36.1) |
b | 88.5 [20.4] (32.9–137.0) |
a | 12.0 [64.6] (3.1–36.9) |
a | 6.5 [47.9] (1.1–20.0) |
a |
| II | 54 | 19.7 [21.3] (12.7–40.2) |
b | 102.3 [30.3] (65.2–199.2) |
a | 11.6 [68.9] (1.3–45.3) |
a | 10.3 [70.9] (1.2–50.1) |
a | |
| III | 64 | 27.6 [19.3] (16.8–37.6) |
a | 93.5 [41.3] (63.6–222.9) |
a | 10.4 [63.4] (1.3–36.2) |
b | 4.4 [118.6] (0.3–46.0) |
a | |
Рис. 2.
Многолетняя динамика концентрации (мкг/г сухой массы) ТМ в печени Sorex caecutiens в разных зонах загрязнения. Условные обозначения см. на рис. 1.

Концентрации ТМ в печени сильно варьировали на протяжении всего периода наблюдений и, как правило, превышали значения коэффициента вариации для S. araneus. Во всех зонах минимальное варьирование зарегистрировано для эссенциальных элементов (Cu, Zn), тогда как для токсичных (Cd, Pb) величины коэффициента вариации были в 2–6 раз выше (см. табл. 4).
Изменение концентраций ТМ в печени землероек в градиенте загрязнения. Поскольку накопление ТМ в печени зависело от периода исследований, использовали данные только одного из них (период III), но для максимального числа ключевых участков (n = 11), наиболее полно охватывающих весь градиент загрязнения (от 1 до 34 км). При приближении к СУМЗу в печени обоих видов землероек происходило монотонное увеличение концентраций всех ТМ (кроме Zn у S. caecutiens). При этом концентрации Pb были выше у S. caecutiens, а Cu и Cd, напротив, интенсивнее накапливались у S. araneus – на отдельных участках межвидовые различия достигали 8 раз (рис. 3).
Рис. 3.
Изменение концентраций ТМ (мкг/г сухой массы, Log10) в содержимом желудка (а) и печени (б) S. araneus (SA) и S. caecutiens (SC) при удалении от завода (км, Log10). Результаты линейной регрессии рассчитаны на основе средних значений для ключевого участка (медиан). Маркеры – средние значения для участков, линии – тренды линейной регрессии, $R_{{{\text{adj}}}}^{2}$ – коэффициент детерминации; b – коэффициент регрессии, р – достигнутый уровень значимости. Светлые маркеры, пунктирные линии – для S. araneus; темные маркеры, сплошные линии – для S. caecutiens.

Изменение концентраций ТМ в содержимом желудка землероек в градиенте загрязнения. Анализировали данные только одного периода (III), полученные на 11 ключевых участках. При приближении к СУМЗу концентрации Cu у обоих видов монотонно увеличивались, а темпы изменений были выше, чем в печени: для S. araneus – в 2.6 раза, для S. caecutiens – в 3.4 раза (см. рис. 3). Концентрации Cd в пище S. caecutiens при приближении к заводу монотонно возрастали, тогда как у S. araneus менялись нелинейно с максимумом на умеренно загрязненных участках (6–10 км от завода) при сходных фоновых и импактных значениях (см. рис. 3). Сравнение двух моделей показало, что нелинейная модель лучше описывала изменения в уровнях накопления Cd в пище S. araneus: коэффициент детерминации был выше (R2 = 0.24 против R2 = 0.03 для линейной модели), а AIK – ниже (50.28 против 67.99 соответственно). Для других элементов направленные изменения отсутствовали. Уровни накопления Cu, Zn и Cd в содержимом желудков S. araneus, как правило, были выше, чем у S. caecutiens (см. рис. 3).
Связь концентраций ТМ в корме и печени. Содержание ТМ в корме и печени животных коррелировало для всех элементов, кроме Zn (рис. 4): для обобщенной выборки по всем участкам (n = 79) парные коэффициенты корреляции оказались значимы (r = 0.31–0.49, p < 0.01). Использование выборок для отдельных видов показало, что у S. araneus значима связь для Cu, Cd и Pb (r = 0.37–0.57, n = 35, p < 0.05), у S. caecutiens – только для Cu и Cd (r = 0.29–0.37, n = 44, p < 0.05).
Рис. 4.
Зависимость накопления ТМ в печени (мкг/г, Log10) землероек рода Sorex от их концентраций в содержимом желудка (мкг/г, Log10). Маркеры – индивидуальные значения, линии – тренды линейной регрессии. Светлые маркеры, пунктирные линии – для S. araneus, темные маркеры, сплошные линии – для S. caecutiens.

Одновременное влияние рассмотренных выше факторов на накопление ТМ в корме и организме землероек дополнительно анализировали посредством общих линейных моделей со смешанными эффектами. Для оценки использовали данные по двум видам – S. araneus и S. caecutiens. В качестве фиксированных эффектов рассматривали зону и период исследования, случайных – вид с вложенными факторами “элемент” и “тип образца” (печень/содержимое желудка) (AIC = 3029, R2 = = 0.666). Использование вместо категориальных предикторов (период, зона) более детальных количественных (год, ключевой участок) не улучшило качество модели (AIC = 3059, R2 = 0.663). В градиенте загрязнения увеличение концентраций ТМ более выражено от фоновых ключевых участков к буферным, в окрестностях завода темпы прироста снижались (табл. 5). Многолетняя динамика концентраций ТМ характеризовалась постепенным (но слабым) снижением в организме землероек. Анализ случайных эффектов показывает, что рацион обоих видов землероек содержал больше ТМ, чем печень, при этом различия в уровнях накопления между типами образцов в пределах вида более выражены у S. araneus. Кроме того, концентрации ТМ в печени S. araneus, как правило, превышали соответствующие значения у S. caecutiens.
Таблица 5.
Результаты анализа различий концентраций ТМ в печени и содержимом желудка S. araneus и S. caecutiens по данным анализа общих линейных моделей со смешанными эффектами
| Источник изменчивости | Estimate | Std. error1/Std.dev.2 | t-value |
|---|---|---|---|
| Фиксированные эффекты | |||
| Зона фоновая | 0.197 | 0.0141 | 13.928 |
| Зона импактная | 0.215 | 0.0171 | 12.361 |
| Период | –0.016 | 0.0091 | –1.831 |
| Случайные эффекты | |||
| Элемент | 0.341 | 0.5842 | |
| LgCu | 0.074 | ||
| LgZn | 0.735 | ||
| LgCd | –0.129 | ||
| LgPb | –0.680 | ||
| Тип образца с учетом вида | 0.003 | 0.0592 | |
| Содержимое желудка S. araneus | 0.064 | ||
| Содержимое желудка S. caecutiens | 0.118 | ||
| Печень S. araneus | –0.033 | ||
| Печень S. caecutiens | –0.042 | ||
| Видовая специфика | 0.005 | 0.068 | |
| S. araneus | 0.040 | ||
| S. caecutiens | –0.040 | ||
| Residual | 0.1332 | 0.364 | |
ОБСУЖДЕНИЕ
Видовая специфика накопления ТМ. Основные сведения о накоплении ТМ в организме мелких насекомоядных в условиях антропогенного загрязнения относятся к типичным европейским видам – S. araneus и S. minutus [16, 20, 21, 47]. Информация по другим (азиатским) видам – Sorex caecutiens и Sorex isodon – фрагментарна. Поскольку горизонты обитания и спектры кормовых объектов S. minutus и S. caecutiens близки [42, 44], представляется возможным использовать для сравнения данные, полученные другими исследователями для S. minutus.
Как правило, межвидовые различия в содержании ТМ в организме землероек рода Sorex незначительны. Например, концентрации Cu, Zn, Cd, Pb и Cr в печени S. araneus и S. minutus из окрестностей медно-никелевого завода (Харьявалта, Финляндия) значимо не различались, хотя в почках S. araneus накапливалось больше Zn [16]. В зоне действия свинцово-цинкового завода (Англия) межвидовые различия в накоплении ТМ в печени отсутствовали, тогда как почки S. araneus содержали больше Cd [47]. В антропогенных биотопах с высоким региональным уровнем загрязнения (Северная Богемия, Чехия) концентрации Cd в печени S. araneus двукратно превышали уровни у S. minutus, тогда как Pb в 7 раз интенсивнее накапливался в печени S. minutus [20]. Другие авторы регистрировали повышенные уровни Сd, Pb и Zn в печени S. araneus по сравнению с S. minutus [21]. Межвидовые различия в накоплении ТМ цитируемые авторы обычно связывали с разными пищевыми стратегиями: рацион S. araneus состоит из активно передвигающихся по поверхности почвы насекомых, а также дождевых червей, пищеварительный тракт которых содержит частицы загрязненной почвы, тогда как S. minutus питается обитающими в подстилке беспозвоночными, но не червями.
Результаты нашего исследования свидетельствуют о наличии специфики в накоплении ТМ в организме разных видов. На протяжении всего градиента загрязнения Cu, Zn и Cd интенсивнее накапливались в печени S. araneus, тогда как Pb – S. caecutiens (см. рис. 3). Для двух других видов – S. isodon и S. minutus – данные ограничены небольшими выборками, но и они позволяют получить представление об уровнях накопления этих элементов (см. табл. 1). Как и ожидалось, близкие концентрации ТМ в рационе и печени отмечены для тех пар видов, которые были максимально сходны по кормовым спектрам и горизонтам кормодобывания (S. isodon – S. araneus и S. minutus – S. caecutiens).
Как и указанные выше авторы, мы полагаем, что межвидовые различия обусловлены главным образом особенностями питания сравниваемых видов. В фоновой зоне почвенные беспозвоночные разнообразны и обильны [6], межвидовые различия кормовых спектров землероек невелики и определяются в основном ярусом кормодобывания и размерами жертв. Поэтому концентрации Cu, Zn и Pb в корме S. araneus и S. caecutiens были сходными, а содержание Cd повышенным в рационе S. araneus, включающем значительное количество дождевых червей.
В зоне умеренного загрязнения состав корма, характерный для каждого вида, мало отличался от фоновых участков, при этом уровни загрязнения почв [27], а следовательно, и почвенных беспозвоночных здесь выше. Это объясняет резкое (в 2–6 раз) увеличение концентраций большинства ТМ в корме землероек по сравнению с фоновыми значениями (см. табл. 1). Полученные результаты хорошо согласуются с прямыми оценками накопления ТМ в теле дождевых червей и содержимом желудка крота из буферной зоны (7 км от СУМЗа), которые показывают превышение фоновых концентраций Cd и Pb в 4–7 раз [48].
На импактных участках спектр кормовых объектов землероек обеднен в результате кардинальных перестроек в составе почвенных беспозвоночных: одни группы (Lumbricidae, Enchytraeidae, Diplopoda, Mollusca) исчезли, численность других (Chilopoda, Carabidae, Staphylinidae, Arachnidae, личинки Diptera) резко уменьшилась, доля третьих (личинки Elateridae), напротив, значительно возросла [5, 6]. Основу рациона обоих видов землероек в импактной зоне составляли жесткокрылые (Elateridae, Staphylinidae, Carabidae), характеризующиеся пониженным накоплением ТМ [48]. В результате частичной смены кормов происходит своеобразное “очищение” рациона землероек импактной зоны, которое выражается в снижении концентраций токсических элементов (Cd и Pb) в 1.5–8 раз в сравнении с буферными значениями. При этом уровни накопления эссенциальных элементов поддерживаются на одном уровне (Zn) либо увеличиваются (Cu) (см. табл. 1). Подобный эффект пониженного (по сравнению с фоновой зоной) накопления токсичных элементов в корме землероек, населяющих участки в непосредственной близости от СУМЗа, был отмечен ранее для S. caecutiens [19]. Таким образом, видовая специфика накопления ТМ в корме землероек, совместно обитающих на территориях с разным уровнем загрязнения, вероятно, связана с различиями в составе рационов.
О тесной связи элементного состава печени и кормовых объектов свидетельствуют результаты экспериментов по скармливанию беспозвоночных разным видам землероек [24, 25, 50]. Например, при употреблении в пищу дождевых червей с повышенным содержанием Pb (в 2 раза), Zn (в 3 раза) и Cd (в 4 раза) концентрации Pb и Cd в печени землероек увеличились в 1.6 и 2.4 раза соответственно [51].
Полученные нами результаты показывают, что, несмотря на высокие концентрации Cu, Zn и Pb в корме животных с загрязненных территорий, токсическая нагрузка этих элементов на организм незначительна вследствие эффективного выведения их избыточных количеств через желудочно-кишечный тракт (см. рис. 4). Для Cd такой барьер не столь эффективен, поэтому его повышенное поступление с кормом приводит к значительному увеличению концентрации элемента в печени землероек (особенно у S. araneus и S. isodon). Ранее подобные особенности аккумуляции ТМ в печени были отмечены для мелких млекопитающих другого трофического уровня – растительноядных рыжих полевок, обитающих на тех же территориях в зоне действия СУМЗа [15].
Таким образом, исходная гипотеза о неодинаковом накоплении ТМ в организме совместно обитающих видов землероек подтвердилась. Ключевую роль в аккумуляции ТМ в печени землероек играл рацион животных.
Изменение концентраций ТМ в градиенте загрязнения. Чаще всего содержание ТМ в организме землероек родов Sorex и Crocidura, населяющих окрестности металлургических и горнодобывающих предприятий, увеличивается при приближении к источнику загрязнения [20, 22, 48], однако описаны и противоположные случаи. Так, Е. Pankakoski et al. [16] отметили более высокие концентрации Pb в печени и почках S. araneus с фоновых территорий по сравнению с участками вблизи предприятия черной металлургии (Koverhar, Финляндия), хотя верхние горизонты почв в окрестностях завода были сильно загрязнены ТМ (особенно Pb и Zn). Авторы объяснили такое несоответствие возможным влиянием кислотности почв на биодоступность отдельных элементов: защелачивание участков в окрестностях завода (рН 7.6) по сравнению с фоновыми территориями (рН 4.6) было связано с поступлением значительных количеств кальцийсодержащей пыли.
Результаты нашего исследования показывают, что минимальные концентрации всех ТМ в печени и корме четырех видов землероек отмечали в фоновой зоне, максимальные – на импактных участках (Cu, Zn, Pb) или в зоне умеренного загрязнения (Cd). При приближении к заводу (от 34 до 1 км) содержание ТМ менялось сходным образом у S. araneus и S. caecutiens: концентрации Cu, Cd, Pb (у обоих видов) и Zn (у S. araneus) монотонно увеличивались. При этом уровни накопления ТМ у S. araneus были, как правило, выше, чем у S. caecutiens.
Таким образом, концентрации ТМ в корме и печени четырех видов землероек из окрестностей завода были значимо выше, чем на незагрязненных территориях, что хорошо согласуется с выводами других авторов.
Многолетняя динамика содержания металлов в печени. Долговременные исследования динамики элементного состава организма наземных позвоночных в условиях снижения промышленных выбросов до сих пор немногочисленны [2]. Основные работы выполнены на мелких воробьиных в окрестностях предприятий цветной металлургии в Финляндии [12] и Швеции [10, 11]. Показано, что даже в пределах одного вида (Ficedula hypoleuca) реакция на существенное (от 60 до 95%) сокращение выбросов неоднозначна и зависит от конкретных условий: в одних случаях содержание ТМ в организме птенцов быстро снижалось [12], в других – снижение почти отсутствовало [11]. Такие различия авторы связали с особенностями питания (разным спектром кормовых объектов).
Подобная информация по мелким млекопитающим фрагментарна [52, 53]. Единственное подробное исследование многолетней динамики содержания ТМ в рационе и организме рыжей полевки (Myodes glareolus) выполнено в районе СУМЗа [15]. Оказалось, что существенное сокращение поступления в среду Cu, Zn и Pb не повлияло на их содержание в печени, что связано с наличием в организме эффективных барьеров на уровне желудочно-кишечного тракта. Поскольку Cd преодолевает этот барьер, его повышенное поступление с кормом привело к эквивалентному увеличению концентрации элемента в печени импактных животных даже после сокращения выбросов [15]. Кроме того, за 25 лет наблюдений в корме рыжей полевки фоновой зоны значительно (в 3 раза) снизилось содержание Pb, в результате этого концентрации элемента в печени двукратно уменьшилась [15].
Результаты нашей работы свидетельствуют о том, что многократное сокращение выбросов не привело к направленным во времени изменениям концентраций ТМ в печени S. araneus, тогда как у S. caecutiens четкие тренды регистрировали для Cu, Cd и Pb. За 30 лет наблюдений в печени значительно снизились концентрации токсичных элементов: Cd – в импактной (в 1.2 раза), буферной (в 1.5 раза) и фоновой (в 4 раза) зонах, Pb – в импактной (в 1.5 раза) и фоновой (в 5 раз) зонах. За тот же период содержание Cu в печени S. caecutiens с импактных участков выросло в 1.5 раза. Наблюдаемые изменения уровней ТМ в корме и организме мелких насекомоядных кардинально отличаются от результатов аналогичных исследований, выполненных на рыжей полевке, представляющей другой трофический уровень. Многократное сокращение выбросов СУМЗа в течение 25–30 лет наблюдений стало причиной разнонаправленных изменений концентраций Cd в печени животных, обитающих на загрязненных территориях: у фитофагов они увеличивались, тогда как у зоофагов снижались. Содержание Pb постепенно уменьшалось в печени животных обоих трофических уровней, но у зоофагов изменения были более выраженными.
Таким образом, гипотеза об уменьшении концентраций ТМ в организме землероек рода Sorex в результате многократного сокращения выбросов подтвердилась лишь частично: четкие временные тренды выявлены лишь для S. caecutiens, в печени которых концентрации Cd и Pb за 30 лет наблюдений снизились.
На основании представленных выше данных можно ожидать, что темпы восстановления природных популяций мелких млекопитающих разных трофических уровней, населяющих территории в окрестностях СУМЗа, будут неодинаковы. Позитивные сдвиги в населении мелких насекомоядных будут более выраженными, что в ближайшем будущем приведет к опережающему по сравнению с мышевидными грызунами увеличению численности землероек в непосредственной близости от завода. В первую очередь этому будут способствовать изменения в сообществах почвенных и наземных беспозвоночных в импактной и буферной зонах. Эти предположения подтверждаются результатами прямых наблюдений за населением мелких млекопитающих: в течение последних 20 лет суммарное обилие бурозубок в импактной зоне увеличилось в 3 раза, тогда как численность лесных полевок почти не изменилась.
Анализ данных и подготовка рукописи выполнены в рамках государственного задания Института экологии растений и животных УрО РАН. Автор выражает признательность Ю.Л. Суморокову, Е.Ю. Сумороковой, С.Ю. Суморокову, А.А. Герасимову и Т.Ю. Сурковой за помощь в полевом сборе и первичной обработке материала, Э.Х. Ахуновой и А.В. Щепеткину – за выполнение аналитических работ, А.Н. Созонтову – за помощь в статистической обработке данных, Е.Л. Воробейчику и анонимному рецензенту – за конструктивные замечания к тексту рукописи.
Автор заявляет об отсутствии конфликта интересов и подтверждает соблюдение применимых этических норм в работе с животными.
Список литературы
Mammals and birds as bioindicators of trace element contaminations in terrestrial environments: an ecotoxicological assessment of the Northern Hemisphere // Ed. Kalisińska E. Springer Nature Switzerland AG, 2019. 229 p. https://doi.org/10.1007/978-3-030-00121-6
Воробейчик Е.Л. Естественное восстановление наземных экосистем после прекращения промышленного загрязнения: 1. Обзор современного состояния исследований // Экология. 2022. № 1. С. 3–41. https://doi.org/10.31857/S0367059722010115
Gall J.E., Boyd R.S., Rajakaruna N. Transfer of heavy metals through terrestrial food webs: a review // Environ. Monit. Asses. 2015. V. 187. № 4. P. 1–21. https://doi.org/10.1007/s10661-015-4436-3
Бельский Е.А., Ляхов А.Г. Динамика населения птиц-дуплогнездников в условиях сокращения промышленных выбросов (на примере Среднеуральского медеплавильного завода) // Экология. 2021. № 4. С. 278–288.https://doi.org/10.31857/S0367059721040041
Воробейчик Е.Л., Ермаков А.И., Золотарев М.П. и др. Изменение разнообразия почвенной мезофауны в градиенте промышленного загрязнения // Russ. Entomol. J. 2012. V. 21. № 2. P. 203–218.
Воробейчик Е.Л., Ермаков А.И., Гребенников М.Е. Начальные этапы восстановления сообществ почвенной мезофауны после сокращения выбросов медеплавильного завода // Экология. 2019. № 2. С. 133–148. https://doi.org/10.1134/S0367059719020112
Михайлова И.Н. Динамика сообществ эпифитных лишайников в начальный период после снижения выбросов медеплавильного завода // Экология. 2020. № 1. С. 43–50. https://doi.org/10.31857/S0367059720010072
Мухачева С.В. Многолетняя динамика сообществ мелких млекопитающих в период снижения выбросов медеплавильного завода. I. Состав, обилие и разнообразие // Экология. 2021. № 1. С. 66–76. https://doi.org/10.31857/S0367059721010108
Трубина М.Р., Воробейчик Е.Л., Хантемирова Е.В. и др. Динамика лесной растительности после снижения промышленных выбросов: быстрое восстановление или продолжение деградации? // Докл. РАН. 2014. Т. 458. № 6. С. 721–725. https://doi.org/10.7868/S0869565214300252
Berglund A.M.M., Ingvarsson P.K., Danielsson H. et al. Lead exposure and biological effects in pied flycatchers (Ficedula hypoleuca) before and after the closure of a lead mine in northern Sweden // Environ. Pollut. 2010. V. 158. № 5. P. 1368–1375. https://doi.org/10.1016/j.envpol.2010.01.005
Berglund Å.M., Nyholm N. Slow improvements of metal exposure, health- and breeding conditions of pied flycatchers after decreased industrial heavy metal emissions // Sci. Tot. Environ. 2011. V. 409. № 20. P. 4326–4334. https://doi.org/10.1016/j.scitotenv.2011.07.004
Berglund Å.M.M., Rainio M.J., Eeva T. Decreased metal accumulation in passerines as a result of reduced emissions // Environ. Toxicol. Chem. 2012. V. 31. № 6. P. 1317–1323. https://doi.org/10.1002/etc.1814
Sheffield S.R., Sawicka-Kapusta K., Cohen J.B. et al. Rodentia and Lagomorpha // Ecotoxicology of Wild Mammals / Shore R.F., Rattner B.A. Eds. Wiley: Chichester et al., 2001. P. 215–314. 22.
Talmage S.S., Walton B.T. Small mammals as monitors of environmental Contaminants // Rev. Environ. Contam. Toxicol. 1991. V. 119. P. 47–145. https://doi.org/10.1007/978-1-4612-3078-6_2
Мухачева С.В. Многолетняя динамика концентрации тяжелых металлов в корме и организме рыжей полевки (Myodes glareolus) в период снижения выбросов медеплавильного завода // Экология. 2017. № 6. С. 461–471. https://doi.org/10.31857/S0367059721010108
Pankakoski E., Koivisto I., Hyvärinen H. et al. Shrews as indicators of heavy metal pollution // Advances in the biology of Shrews. Carnegie Museum of Natural History Special Publication. 1994. P. 137–149.
Ma W.C., Denneman W., Faber J. Hazardous exposure of ground-living small mammals to Cd and Pb in contaminated terrestrial ecosystems // Arch. Environ. Contam. Toxicol. 1991. V. 20. P. 266–270. https://doi.org/10.1007/BF01055914
Ma W.C., Talmage S. Insectivora / Shore R.F., Rattner B.A. Eds. Ecotoxicology of Wild Mammals. Ecological and Environmental Toxicology Series. John Wiley and Sons Ltd., New York, 2001. P. 123–158.
Bezel V.S., Koutchenogii K.P., Mukhacheva S.V. et al. Using of synchrotron radiation for study of multielemental composition of the small mammal diet and tissues // Nucl. Instr. and Meth. A. 2007. V. 575. № 1–2. P. 218–220. https://doi.org/10.1016/j/nima.2007.01.072
Tomaskova L., Bejček V., Sedlaček F. et al. Population biology of shrews (Sorex araneus and Sorex minutus) from a polluted area in central Europe // Advances in the Biology of Shrews II. New York, 2005. P. 189–198.
Dmowski K., Kozakiewicz M., Kozakiewicz A. Ecological effects of heavy metal pollution (Pb, Cd, Zn) on small mammal populations and communities // Bull. Polish Acad. of Sci. Biological Sciences. 1995. V. 43. P. 1–10.
Sánchez-Chardi A., Nadal J. Bioaccumulation of metals and effects of landfill pollution in small mammals. Part I. The greater white-toothed shrew, Crocidura russula // Chemosphere. 2007. V. 68. № 4. P. 703–711. https://doi.org/10.1016/j.chemosphere.2007.01.042
Sánchez-Chardi A., Marques C.C., Gabriel S.I. et al. Haematology, genotoxicity, enzymatic activity and histopathology as biomarkers of metal pollution in the shrew Crocidura russula // Environ. Pollut. 2008. V. 156. P. 1332–1339. https://doi.org/10.1016/j.envpol.2008.02.026
Pankakoski E., Koivisto I., Hyvärinen H. et al. Experimental accumulation of lead from soil through earthworms to common shrews // Chemosphere. 1994b. V. 29. № 8. P. 1639–1649. https://doi.org/10.1016/0045-6535(94)90311-5
Reinecke S.A., Reinecke D.E., Musilbono A.C et al. The transfer of lead (Pb) from earthworms to shrews (Myosorex varius) // Arch. Environ. Contam. Toxicol. 2000. V. 39. P. 392–397. https://doi.org/10.1007/s002440010120
Swiergosz-Kowalewska R., Gramatyka M., Reczynski W. Metals distribution and interactions in tissues of shrews (Sorex spp.) from copper- and zinc-contaminated areas in Poland // J. Environ. Qual. 2005. V. 34. P. 1519–1529. https://doi.org/10.2134/jeq2004.0167
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024. https://doi.org/10.7868/S0032180X17080135
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локальный уровень). Екатеринбург: УИФ “Наука”, 1994. 280 с.
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В. и др. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458.
Карасева Е.В., Телицына А.Ю., Жигальский О.А. Методы изучения грызунов в полевых условиях. М.: Изд-во ЛКИ, 2008. 416 с.
Зайцев М.В., Войта Л.Л., Шефтель Б.И. Млекопитающие фауны России и сопредельных территорий. Насекомоядные. СПб.: ЗИН РАН, 2014. 321 с.
Юдин Б.С. Насекомоядные млекопитающие Сибири. Новосибирск: Наука, 1989.176 с.
Mammal Species of the World. A Taxonomic and Geographic Reference. Wilson D.E., Reeder D.M. Eds. 3rd ed. Baltimore: Johns Hopkins Univ. Press, 2005. 2142 p.
Мухачева С.В. Население мелких насекомоядных млекопитающих в градиенте техногенного загрязнения среды обитания // Биология насекомоядных млекопитающих: Мат-лы Всерос. науч. конф. Новосибирск: Изд-во “ЦЭРИС”, 2007. С. 81–84.
Тупикова Н.В. Питание и характер активности землероек средней полосы СССР // Зоол. журн. 1949. Т. 28. Вып. 6. С. 561–572.
Ходашева К.С., Елисеева В.И. Землеройки в экосистемах Центральной лесостепи Русской равнины. М.: Наука, 1992. 112 с.
Шварц Е.А., Демин Д.В., Замолодчиков Д.Г. Экология сообществ мелких млекопитающих лесов умеренного пояса // Современные проблемы зоогеографии. М.: Наука, 1980. С. 31–58.
Gębczyński M. Seasonal and age changes in the metabolism and activity of Sorex araneus Linnaeus 1758 // Acta Theriologica. 1965. V. 10. № 22. P. 303–331.
Wołk E. Body weight and daily food intake in captive shrews // Acta Theriologica. 1969. V. 14. № 4. P. 35–47.
Hanski I. Food consumption, assimilation and metabolic rate in six species of shrew (Sorex and Neomys) // Annales Zoologici Fennici. 1984. V. 21. № 2. P. 157–165. https://www.jstor.org/stable/23734858
Докучаев Н.Е. Питание землероек-бурозубок и оценка их роли в горно-таежных системах Северо-Восточной Сибири // Экология млекопитающих Северо-Восточной Сибири. М.: Наука, 1981. С. 3–22.
Ивантер Э.В., Макаров А.М. Территориальная экология землероек-бурозубок (Insectivora, Sorex). Петрозаводск: ПетрГУ, 2001. 271 с.
Ивантер Э.В., Коросов А.В., Макаров А.М. К изучению трофических связей мелких насекомоядных млекопитающих // Зоол. журн. 2015. Т. 94. Вып. 6. С. 711–721. https://doi.org/10.7868/S0044513415060100
Churchfield S. Natural history of shrews. Ithaca, New York: Cornell University Press, 1990. 178 p.
Carver R. Practical data analysis with JMP. Cary, NC: SAS Institute, 2014. 232 p.
Core Team, R: A Language and Environment for Statistical Computing, Vienna, Austria: R Foundation for Statistical Computing, 2022. https: //www.R-project.org
Bates D., Maechler M., Bolker B. et al. Fitting Linear Mixed-Effects Models Using lme4 // J.Stat. Software. 2015. V 67. № 1. P. 1–48. https://doi.org/10.18637/jss.v067.i01
Read H.J., Martin M.H. The effect of heavy metals on populations of small mammals from woodlands in Avon (England); with particular emphasis on metal concentrations in Sorex araneus L. and Sorex minutus L. // Chemosphere. 1993. V. 27. №. 11. P. 2197–2211. https://doi.org/10.1016/0045-6535(93)90132-O
Нестеркова Д.В., Воробейчик Е.Л., Резниченко И.С. Тяжелые металлы в пищевой цепи “почва–дождевые черви–европейский крот” в условиях загрязнения среды выбросами медеплавильного завода // Сиб. экол. журн. 2014. № 5. С. 777–788.
Безель В.С. Экологическая токсикология: популяционный и биоценотический аспекты. Екатеринбург: Изд-во “Гощицкий”, 2006. 280 с.
Brueske C.C., Barrett G.W. Dietary heavy metal uptake by the least shrew, Cryptotis parva // Bull. Environ. Contam. Toxicol., 1991. V. 47. P. 845–849 https://doi.org/10.1007/BF01689514
Nyholm N., Rühling Å. Effects of decreased atmospheric heavy metal deposition in South Sweden on terrestrial birds and small mammals in natural populations // Water, Air and Soil Pollution: Focus, 2001. V. 1. № 3–4. P. 439–448. https://doi.org/10.1023/A:1017582305685
Tête N., Durfort M., Rieffel D. et al. Histopathology related to cadmium and lead bioaccumulation in chronically exposed wood mice, Apodemus sylvaticus, around a former smelter // Sci. Total Environ. 2014. V. 481. № 1. P. 167–177. https://doi.org/10.1016/j.scitotenv.2014.02.029
Дополнительные материалы отсутствуют.


