Экология, 2022, № 5, стр. 362-369
Дефаунирование почвы циперметрином в полевых экспериментах и его влияние на продукцию мицелия микоризных грибов
А. Г. Зуев a, *, А. Ю. Акулова b, А. И. Зуева a
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
b Московский государственный университет имени М.В. Ломоносова
119991 Москва, ГСП-1, Ленинские горы, 1, Россия
* E-mail: agzuev.sevin@gmail.com
Поступила в редакцию 02.03.2022
После доработки 20.03.2022
Принята к публикации 20.03.2022
- EDN: TQBTGF
- DOI: 10.31857/S0367059722050122
Аннотация
Одна из важных методических задач при изучении взаимодействий почвенных грибов и беспозвоночных – разработка методов, позволяющих исключить или снизить обилие целевой группы в условиях полевого эксперимента. В двух модельных хвойных лесах (в заповедниках “Кивач” и Центрально-Лесном государственном заповеднике) исследована возможность применения циперметрина в качестве средства снижения обилия беспозвоночных при изучении их взаимодействия с микоризными грибами. В краткосрочном (30 сут) эксперименте показано значительное снижение численности почвенных беспозвоночных и отсутствие различий в биомассе мицелия микоризных грибов. В более продолжительном эксперименте (90 сут) эффект дефаунирования почвы был аналогичным, но продукция мицелия микоризных грибов снизилась по сравнению с контролем. Метод дефаунирования почвы циперметрином эффективен, но может быть рекомендован к применению только в краткосрочных полевых экспериментах.
Почвенные беспозвоночные влияют на интенсивность роста, обилие и разнообразие почвенных грибов, в том числе формирующих микоризу. Пертурбация почвы беспозвоночными может быть причиной механического повреждения и разрушения мицелия либо, напротив, стимулирования его развития, формируя в почве новые местообитания грибов и вызывая компенсаторный рост гиф [1, 2]. Кроме того, воздействие почвенных беспозвоночных на грибные сообщества может быть трофическим [2, 3]. Однако, несмотря на высокое обилие микоризного мицелия во многих почвах, питание почвенных животных микоризными грибами зафиксировано лишь в очень немногих экспериментах [4].
Взаимодействие беспозвоночных и почвенного микобиома часто изучают путем сравнения обилия беспозвоночных в вариантах с наличием или отсутствием грибов. Так, в бореальных лесах численность некоторых видов панцирных клещей (Oribatida) увеличивалась в присутствии микоризных грибов [5, 6], а в эксперименте с подрезкой флоэмы ели показано сокращение численности грибоядных нематод при угнетении микоризных грибов [7].
Не менее важно понимание закономерностей влияния почвенных животных на грибные сообщества. При изучении таких воздействий используют дефаунирование почвы, т.е. удаление беспозвоночных из исследуемого субстрата. Дефаунирование широко применяют при изучении колонизации почвы беспозвоночными [8], трансформации почвенного органического вещества [9], анализе взаимодействий между почвенными и надземными сообществами [10], а также при разработке методов переработки органических материалов, в частности технологий вермикультивирования [11].
Для оценки продукции микоризного мицелия часто используют метод вегетационных мешочков, заполненных кварцевым песком [12]. Размер ячеи подобран таким образом, что позволяет гифам прорасти внутрь субстрата, но препятствует проникновению беспозвоночных и корней, обеспечивая получение практически чистой биомассы микоризных грибов [4, 13]. Несмотря на широкое применение метода вегетационных мешочков, у него есть ряд ограничений. Размер ячеи исключает из эксперимента беспозвоночных определенных размерных классов, но не обеспечивает полного отсутствия воздействия мезофауны на грибы и обладает размерной, а не таксономической специфичностью [14].
Наиболее часто применяемые методы дефаунирования – просеивание почвы через сито, промораживание субстрата или его высушивание при высоких температурах [8–10]. Однако для исследований, связанных с изучением грибных сообществ почв, такие способы не подходят: промораживание, нагревание и высушивание почвенных образцов исключают из анализа группы грибов, чувствительные к перепадам температуры и недостатку влаги [15]; просеивание изменяет агрегатный состав почвы, что также влияет на почвенную микобиоту [16].
Еще один возможный способ дефаунирования почвы – применение инсектицидов. При выборе биоцида необходимо учитывать нецелевые эффекты его использования: привнесение дополнительного источника питания микроорганизмов, стимуляция или, напротив, ингибирование их роста [14, 17]. Кроме того, действие инсектицидов может по-разному проявляться в условиях лабораторных и полевых экспериментов [14].
Циперметрин – один из перспективных биоцидов, рассматриваемых в качестве агента химического дефаунирования [18]. Это синтетический пиретроид, широко применяемый в сельском хозяйстве для защиты растений и животных от насекомых-вредителей. Циперметрин малоопасен для человека, поскольку обладает слабой способностью к кожной абсорбции и накоплению в тканях; кроме того, он быстро метаболизируется в организме [19, 20]. Стойкость циперметрина в почве достигает четырех недель [21]. Вещество входит в Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации [22].
Хотя в сельском хозяйстве циперметрин применяют в качестве акарицида [23], в экспериментах зафиксировано его воздействие на разные группы почвенных беспозвоночных. Добавление циперметрина в почву в разных дозах вызывало проявление избегающего поведения, гибель особей и снижение репродукции коллембол Folsomia candida [19]. Непосредственно после внесения в почву циперметрин оказывал токсическое воздействие на энхитреид (Enchytraeus crypticus), однако со временем токсический эффект снижался [24]. Показана эффективность циперметрина в борьбе с вредителем Popillia japonica Newman: его использование значимо снизило численность личинок жука в условиях питомника [25]. В то же время влияние циперметрина на микробное сообщество почвы неоднозначно: оно может быть как положительным, так и отрицательным в зависимости от таксона или штамма микроорганизма или дозы биоцида [26, 27].
Цель данной работы – оценка возможности применения циперметрина в качестве агента дефаунирования почвы при проведении полевых экологических экспериментов. Тестировали гипотезу: циперметрин эффективно снижает обилие беспозвоночных, но не влияет на грибы, образующие микоризу.
МАТЕРИАЛ И МЕТОДЫ
Исследования проведены на базе двух модельных экосистем: 1) сосняка-беломошника на подзоле иллювиально-железистом (Rustic Podzol (Arenic), IUSS Working Group WRB, 2017) в ядре заповедника “Кивач”, Кондопожский район, Карелия [28]; 2) ельника зеленомошно-травянистого на дерново-среднеподзолистой слабооглеенной почве (Albic Retisol Loamic; WRB, 2017), расположенного на территории Центрально-Лесного государственного заповедника (ЦЛГЗ), Нелидовский район, Тверская область [29]. В Тверской области работы проводили на базе биостанции ИПЭЭ РАН “Оковский лес”, расположенной на территории ЦЛГЗ.
В каждой модельной экосистеме в первой половине июня 2021 г. на расстоянии 20–25 м друг от друга были заложены четыре экспериментальные площадки. На каждой площадке с помощью стальной рамки были извлечены 6 почвенных монолитов размером 10 × 10 × 10 см. Три монолита с каждой площадки были насыщены до полной полевой влагоемкости 2%-ным раствором циперметрина (препарат “Клещевит Супер”, АО “Август”, Россия) в полевых условиях. Почвенный монололит вместе с металлической рамкой помещался на мелкое металлическое сито, вставленное в пластиковое ведро, и насыщался раствором биоцида под высотой столба раствора приблизительно 1 см до тех пор, пока избыток раствора не начинал сочиться с нижней стороны монолита. Использованный в эксперименте препарат соответствует ГОСТ Р 51247-99 [30, 31]. Контрольные монолиты были насыщены до полной полевой влагоемкости водопроводной водой.
Почвенные монолиты были изолированы от окружающей почвы мелкоячеистой (размер ячеи 50 мкм) сеткой из нержавеющей стали (далее – мезокосмы). Выбранный размер ячеи препятствует проникновению в мезокосмы корней деревьев и большинства размерных групп почвенных беспозвоночных, но не мицелия [12]. В каждый мезокосм было помещено по одному вегетационному мешочку (6 × 6 см) из полиамидной ситовой ткани (размер ячеи 46 мкм), наполненному 20 г прокаленного кварцевого песка с размером частиц 0.5–0.8 мм [32]. Мезокосмы были немедленно помещены в лунки, образовавшиеся после их изъятия. По три аналогичных мешочка были заложены в окружающую почву вне мезокосмов на каждой площадке (всего 72 мешка).
Для оценки краткосрочного и пролонгированного действия циперметрина на обилие почвенных животных и продукцию мицелия микоризных грибов изъятие мезокосмов на двух модельных площадках было проведено через разные промежутки времени: 30 сут для заповедника “Кивач” и 90 сут – для ЦЛГЗ. По три контрольные почвенные пробы размеров, аналогичных размерам мезокосмов, были извлечены с каждой площадки одновременно с изъятием мезокосмов.
Почвенные животные были экстрагированы из извлеченных мезокосмов с использованием сухих эклекторов Тульгрена в течение 7 сут и зафиксированы в 70%-ном этаноле. Численность и групповой состав почвенных беспозвоночных определяли с помощью бинокулярной лупы.
Биомассу микоризного мицелия оценивали с использованием модифицированного метода эпифлуоресцентной микроскопии [33, 34]. Содержимое вегетационного мешочка (20 г кварцевого песка + мицелий) помещали в пробирку с 40 мл стерильного физиологического раствора и встряхивали в течение 60 с. Аликвоту объемом 100 мкл фильтровали на вакуумной установке через черный нефлуоресцирующий мембранный фильтр Whatmann Cyclopore с диаметром пор 0.22 мкм. Окраску проводили нанесением на фильтр 10%-ного водного раствора калькофлуора белого в течение 5 мин. Длину гиф измеряли подсчетом числа пересечений с сеткой известного шага (grid-intersection method [35]) при увеличении ×400 эпифлуоресцентного микроскопа Микромед № 1709 393, оснащенного системой визуализации ToupCam 5.1 MP (Hangzhou ToupTek Photonics Co., Ltd.). Шаг сетки составлял 20 мкм. Для каждого образца измеряли диаметр от 20 до 50 гиф (20 полей зрения) с использованием утилиты ToupTek View. Для расчета объема грибного мицелия приняли среднее значение диаметра мицелия для каждого образца. Для пересчета объема мицелия в биомассу использовали среднее значение плотности грибного мицелия (0.001063 г/мм3 [36]), а также среднее содержание углерода в мицелии макромицетов (40.96% [37]).
Статистической единицей была пробная площадь (n = 4), т.е. среднее значение для трех мезокосмов в каждом из вариантов эксперимента или трех контрольных монолитов. Всего проанализировано 72 пробы (48 мезокосмов и 24 контрольных монолита). Результаты экспериментов со сроками экспозиции 30 и 90 сут, проведенных в заповеднике “Кивач” и ЦЛГЗ, не сравнивали друг с другом.
Статистический анализ выполнен в среде R 3.6.1 [38]. Все базовые манипуляции с табличными данными произведены с использованием пакета dplyr [39]. Влияние дефаунирования на обилие беспозвоночных, а также продукцию мицелия оценивали при помощи линейных моделей с вариантами “дефаунирование” (ДФ), “контрольные мезокосмы” (К, контроль – почвенные монолиты, насыщенные водой) и “окружающая почва” (ВК – внешний контроль, т.е. пробы, не изолированные металлической сеткой). Для каждой таксономической группы использовали отдельную линейную модель. При низкой численности беспозвоночных во всех сравниваемых вариантах (суммарная численность во всех повторностях менее 8 особей; <2n) данные были трансформированы в биномиальные (0 и 1) и применяли модели для биномиального распределения (пакет lme4 [40]).
Статистическую значимость влияния дефаунирования на каждую отдельную группу почвенных беспозвоночных оценивали с помощью функции Anova пакета car [41]. Различия биомассы мицелия оценивали методом наименьших квадратов (Tukey-adjusted least-squares means test), функция lsmeans пакета emmeans [42]. Графическая обработка данных выполнена с использованием пакетов ggplot2 [43] и cowplot [44].
РЕЗУЛЬТАТЫ
Численность почвенных беспозвоночных. В результате 30-дневного эксперимента в заповеднике “Кивач” обнаружено выраженное действие раствора циперметрина на почвенных беспозвоночных. В дефаунированных мезокосмах полностью отсутствовали пауки (Araneae), а также некоторые группы насекомых – полужесткокрылые (Hemiptera) и перепончатокрылые (Hymenoptera). Черви и энхитреиды (Oligochaeta) отсутствовали как в дефаунированных, так и в контрольных мезокосмах при единичной встречаемости в окружающей почве.
Численность наиболее обильных представителей почвенной мезофауны – клещей (Acari) и коллембол (Collembola) – значимо снижалась в дефаунированных мезокосмах (t = –2.990, p = = 0.0173 и t = –7.170, p < 0.001 соответственно). Несмотря на присутствие этих групп в дефаунированных образцах, их численность была резко сокращена: клещей – до 6 раз, коллембол – до 19 раз по сравнению с контролем (табл. 1), причем значимые различия между контрольными мезокосмами (К) и окружающей почвой (ВК) отсутствовали. Численность протур (Protura) также значимо снижалась при дефаунировании (t = –2.346, p = = 0.0470), хотя отдельные особи протур, а также единичные личинки двукрылых и жуков были отмечены в дефаунированных мезокосмах.
Таблица 1.
Численность различных групп почвенных беспозвоночных в 30- и 90-дневных экспериментах по дефаунировании почвы раствором циперметрина (ВК – окружающая почва, К – контрольные мезокосмы, ДФ – дефаунированные мезокосмы)
| Таксономическая группа | Заповедник “Кивач”, 30 сут | ЦЛГЗ, 90 сут | ||||||
|---|---|---|---|---|---|---|---|---|
| ВК | К | ДФ | p | ВК | К | ДФ | p | |
| Oligochaeta | 1.3 ± 1.3 | 0.3323* | 0.8 ± 0.3 | 2.5 ± 1.2 | 0.0823 | |||
| Myriapoda | 0.3 ± 0.3 | 0.3 ± 0.3 | 0.4033* | |||||
| Acari | 121.8 ± 12.3 | 142.0 ± 47.1 | 24.3 ± 12.6 | 0.0180 | 218.0 ± 58.3 | 285.0 ± 92.2 | 57.0 ± 20.0 | 0.0818 |
| Araneae | 0.8 ± 0.3 | 1.3 ± 0.3 | 0.0485* | 1.3 ± 0.5 | 1.8 ± 0.8 | 0.0958 | ||
| Collembola | 26.8 ± 1.9 | 28.3 ± 4.9 | 1.5 ± 0.9 | 0.0001 | 203.3 ± 29.7 | 149.8 ± 15.7 | 41.0 ± 16.2 | 0.0015 |
| Coleoptera (imago) | 1.0 ± 0.4 | 0.5 ± 0.3 | 0.0438* | |||||
| Coleoptera (larvae) | 3.3 ± 1.3 | 2.3 ± 0.9 | 0.3 ± 0.3 | 0.1153 | 1.0 ± 0.4 | 3.8 ± 0.9 | 0.5 ± 0.5 | 0.0101 |
| Diptera (larvae) | 4.8 ± 2.5 | 5.0 ± 2.0 | 0.5 ± 0.5 | 0.2107 | 4.0 ± 1.3 | 8.8 ± 1.7 | 0.3 ± 0.3 | 0.0027 |
| Hemiptera | 0.8 ± 0.8 | 2.7 ± 0.9 | 0.0512 | 0.5 ± 0.5 | 6.5 ± 2.2 | 0.0117 | ||
| Hymenoptera | 0.5 ± 0.3 | 0.3 ± 0.3 | 0.1715* | |||||
| Protura | 3.3 ± 1.0 | 8.7 ± 1.7 | 0.3 ± 0.3 | 0.0015 | ||||
В 90-дневном эксперименте в ЦЛГЗ дефаунирование почвы циперметрином также было эффективным. Групповой состав населения дефаунированных мезокосмов совпадал с результатами 30-дневного эксперимента: в них полностью отсутствовали пауки, имаго жуков, многоножки и олигохеты, а также полужесткокрылые, отмеченные в контрольных вариантах (см. табл. 1). Численность личинок двукрылых и жуков была значимо выше в контрольных мезокосмах по сравнению с другими вариантами (t = 3.146, p = 0.0118 и t = 2.755, p = 0.0223).
Снижение численности коллембол в дефаунированных мезокосмах было значимым после 90 сут экспозиции (t = –5.322, p = 0.0005) и составляло до 6 раз по сравнению с контрольными вариантами. Численность коллембол в контрольных мезокосмах в среднем была на четверть ниже по сравнению с окружающей почвой. Снижение численности клещей в эксперименте в среднем составляло до 5 раз по сравнению с контрольными мезокосмами, однако данный эффект был статистически незначим.
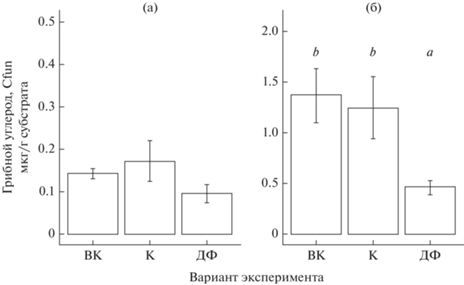
Биомасса мицелия микоризных грибов. Диапазон средних значений диаметра грибного мицелия составил от 1.6 до 4.2 мкм, биомасса мицелия, в основном септированного, – от 0.143 до 4.979 мг C/г субстрата. Такие морфологические характеристики дополнительно указывают на преобладание мицелия макромицетов в вегетационных мешочках. Продукция мицелия микоризных грибов значимо не различалась между экспериментальным и контрольным вариантами после 30 сут экспозиции (рис. 1). После экспозиции 90 сут продукция мицелия в дефаунированных мезокосмах была значимо меньше, чем в контрольных (t = 3.281, p = = 0.0110) и окружающей почве (t = 3.771, p = = 0.0038), а между контрольными мезокосмами (К) и окружающей почвой (ВК) не различалась.
Рис. 1.
Продукция микоризного мицелия (количество “грибного” углерода, мкг/г субстрата) в различных вариантах эксперимента: в почве вне мезокосмов (окружающая почва, ВК), в контрольных (К) и дефаунированных (ДФ) мезокосмах: а – экспозиция 30 сут, заповедник “Кивач”; б – экспозиция 90 сут, ЦЛГЗ. Показаны средние значения и стандартные ошибки среднего (SE; для всех случаев n = 4). Разные буквы указывают на статистически значимые различия (Least-squared means test, p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Несмотря на различный таксономический состав почвенных беспозвоночных в контрольных вариантах двух исследованных лесов, в экспериментальных мезокосмах были обнаружены только представители некоторых групп, а именно Acari, Collembola, Protura (в эксперименте на территории заповедника “Кивач”), личинки Coleoptera и Diptera. Низкая численность олигохет, по-видимому, связана с использованием сухих эклекторов, и действие циперметрина на эту группу почвенных беспозвоночных требует дополнительных исследований. Для обильных групп (Acari, Collembola) показано снижение численности на порядок по сравнению с контрольными вариантами для обоих сроков экспозиции (30 и 90 сут). В случаях исходно низкой численности таксона или высокой гетерогенности пространственного распределения снижение численности под действием биоцида было статистически незначимо, но также заметно (см. табл. 1). Это соответствует известным данным о широком спектре действия циперметрина [45].
Пиретроиды, в том числе циперметрин, могут по-разному влиять на различные таксоны беспозвоночных. Их эффективность зависит в том числе от способности проникать через кутикулу [46], поэтому выживание определенных групп почвенных беспозвоночных может быть связано с особенностями их покровов. Для ряда представителей двукрылых показана возможность формирования устойчивости к циперметрину за счет особенностей структуры и состава протеинов кутикулы, что представляет проблему при контроле их численности [47, 48]. Для некоторых жесткокрылых отмечена большая восприимчивость взрослых особей к инсектицидам по сравнению с личинками [49].
Представители Acari, а также Collembola и Protura – небольшие организмы, обитающие в основном в почвенных порах [50]. Помимо малых размеров, они обладают определенными морфологическими и поведенческими особенностями. У Oribatida (Acari) отмечена реализация нескольких путей защиты от намокания: гидрофобность поверхности тела достигается в результате сочетания структурных и химических особенностей их покровов [51]. Protura ведут скрытный образ жизни и перемещаются внутри почвенного профиля в ответ на неблагоприятные факторы [52, 53]. Для Collembola ранее отмечалось избегающее поведение в присутствии циперметрина [19]. Небольшие размеры в сочетании с водоотталкивающими покровами Oribatida, скрытным образом жизни Protura и особенностями реакции Collembola на присутствие пиретроида, вероятно, могли позволить отдельным представителям этих групп почвенных беспозвоночных избежать воздействия раствора циперметрина.
Биомасса мицелия микоризных грибов в дефаунированных мезокосмах не отличалась от контрольных вариантов после 30 сут экспозиции, но была значимо меньше после 90 сут, тогда как контрольные мезокосмы и окружающая почва в обеих модельных экосистемах не отличались. Абсолютные значения биомассы мицелия микоризных грибов сопоставимы с некоторыми опубликованными данными [7], однако в целом оказались на один–два порядка ниже, чем в аналогичных биотопах [32], в том числе с использованием такого же метода определения биомассы [54]. Мы предполагаем, что это связано с необходимостью для грибных гиф преодолеть дополнительное расстояние от стенки мезокосма до стенки вегетационного мешочка. Скорость преодоления краем зоны роста мицелия микоризных грибов 3–4 см почвы, разделяющих стенки вегетационного мешочка и мезокосма, соотносится с известными темпами роста экстраматрикального мицелия в хвойных лесах [55]. Наши результаты показывают, что кратковременное изъятие почвенного монолита, его экспозиция в мезокосме из металлической сетки, а также сам материал сетки не оказывают существенного воздействия на мицелий микоризных грибов и его проникающую способность. Следовательно, использованная конструкция мезокосмов применима в экспериментах по исследованию грибных сообществ почв.
Снижение обилия грибов после 90 дней экспозиции в присутствии циперметрина соответствует некоторым опубликованным данным. Добавленный в питательную среду циперметрин подавлял вегетативный рост отдельных штаммов микромицетов Beauveria bassiana (Bals.-Criv.) Vuill. и Hirsutella citriformis Speare [17]. Показано, что циперметрин может проявлять спороцидные свойства [56]. В другом лабораторном эксперименте по изучению влияния различных пестицидов на микоризные грибы эффект циперметрина проявился по-разному: инсектицид подавлял рост 25% штаммов, относящихся к разным видам, но в низких концентрациях, напротив, стимулировал рост одного из них [57]. Для точной оценки реакции каждого конкретного сообщества на внесение биоцида целесообразно изучение возможности использования разных концентраций циперметрина для дефаунизации почвы.
Вместе с тем при непосредственной обработке почвенных образцов различными инсектицидами циперметрин не оказывал значительного влияния на количество грибных колониеобразующих единиц [18]. В эксперименте по совместному применению пестицидов и энтомопатогенных грибов смесь циперметрина и хлорпирифоса оказалась единственным препаратом, не снизившим жизнеспособность гриба Metarhizium anisopliae (Metschn.) в суспензии [23].
Следовательно, циперметрин способен отрицательно влиять на рост мицелиальных, в том числе микоризных, грибов, что могло привести к снижению биомассы их мицелия в 90-суточном эксперименте. Отсутствие стимуляции роста мицелия микоризных грибов в результате снижения численности беспозвоночных – потенциальных микофагов – хорошо соотносится с данными о низкой трофической активности почвенной мезофауны в отношении микоризных грибов [4, 58].
ЗАКЛЮЧЕНИЕ
Таким образом, в двух параллельно проведенных экспериментах обнаружены схожие по интенсивности негативные эффекты обработки почвы циперметрином на численность почвенных беспозвоночных. Показано, что при кратковременной экспозиции (30 сут) однократная обработка почвы циперметрином резко снизила численность большинства групп беспозвоночных, а биомасса мицелия микоризных грибов была не отличима от контрольных значений. На основе этих результатов циперметрин можно рекомендовать к использованию в кратковременных полевых экспериментах для дефаунирования почвы. При более длительной экспозиции (90 сут) эффект дефаунирования сохранился, но проявилось нецелевое отрицательное влияние циперметрина на продукцию мицелия микоризных грибов.
Исследование выполнено при финансовой поддержке РФФИ (проект № 20-34-90088) и в рамках Программы развития Междисциплинарной научно-образовательной школы Московского государственного университета имени М.В. Ломоносова “Будущее планеты и глобальные изменения окружающей среды”.
Авторы выражают благодарность А.В. Тиунову (ИПЭЭ РАН) за помощь в разработке дизайна полевых экспериментов, Д.И. Коробушкину (ИПЭЭ РАН) за помощь в полевых работах, а также дирекциям заповедника “Кивач”, Центрально-Лесного заповедника и лично А.К. Сараевой (Институт леса КарНЦ РАН) за содействие в проведении полевых работ.
В ходе проведения исследования соблюдались применимые этические нормы. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Crowther T.W., A’Bear A.D. Impacts of grazing soil fauna on decomposer fungi are species-specific and density-dependent // Fungal Ecology. 2012. V. 5. № 2. P. 277–281. https://doi.org/10.1016/j.funeco.2011.07.006
Janoušková M., Kohout P., Moradi J. et al. Microarthropods influence the composition of rhizospheric fungal communities by stimulating specific taxa // Soil Biology and Biochemistry. 2018. V. 122. P. 120–130. https://doi.org/10.1016/j.soilbio.2018.04.016
Pollierer M.M., Dyckmans J., Scheu S., Haubert D. Carbon flux through fungi and bacteria into the forest soil animal food web as indicated by compound-specific 13 C fatty acid analysis // Functional Ecology. 2012. V. 26. № 4. P. 978–990. https://doi.org/10.1111/j.1365-2435.2012.02005.x
Bluhm S.L., Potapov A.M., Shrubovych J. et al. Protura are unique: first evidence of specialized feeding on ectomycorrhizal fungi in soil invertebrates // BMC Eco-logy. 2019. V. 19. № 1. P. 1–7. https://doi.org/10.1186/s12898-019-0227-y
Remén C., Persson T., Finlay R., Ahlström K. Responses of oribatid mites to tree girdling and nutrient addition in boreal coniferous forests // Soil Biology and Biochemistry. 2008. V. 40. № 11. P. 2881–2890. https://doi.org/10.1016/j.soilbio.2008.08.006
Remén C. Unravelling the feeding habits of fungivores. Doctoral Thesis, Uppsala: Swed. Univ. Agricult. Sci., 2010. 80 p.
Kudrin A.A., Zuev A.G., Taskaeva A.A. et al. Spruce girdling decreases abundance of fungivorous soil nematodes in a boreal forest // Soil Biology and Biochemistry. 2021. V. 155. № P. 108184. https://doi.org/10.1016/j.soilbio.2021.108184
Любечанский И.И., Залиш Л.В., Марченко И.И., Беспалов А.Н. Колонизация почвенными микроартроподами образцов с разными эдафическими свойствами на каменноугольных выработках в Кузбассе (Западная Сибирь) // Евразиатский энтомол. журн. 2019. Т. 18. № 2. С. 84 – 90.
Mordkovich V.G., Berezina O.G., Lyubechanskii I.I. et al. Transformation of soil organic matter in microarthropod community from the northern taiga of west Siberia // Biology Bulletin. 2006. V. 33. № 1. P. 81–86. https://doi.org/10.1134/S1062359006010122
Scheu S., Theenhaus A., Jones T.H. Links between the detritivore and the herbivore system: effects of earthworms and Collembola on plant growth and aphid development // Oecologia. 1999. V. 119. № 4. P. 541–551. https://doi.org/10.1007/s004420050817
Пат. 2707630 С1 Российская Федерация, МПК A01K 67/033. Способ разведения дождевых червей / Князев С.Ю., Голованова Е.В., заявитель и патентообладатель Федеральное государственное бюджетное образовательное учреждение высшего образования “Омский государственный педагогический университет”. № 2019112475; заявл. 24.04.2019; опубл. 28.11.2019: Бюл. № 34. 8 с.
Wallander H., Nilsson L.O., Hagerberg D., Erland B. Estimation of the biomass and seasonal growth of external mycelium of ectomycorrhizal fungi in the field // New Phytologist. 2001. V. 151. №. 3. P. 753–760. https://doi.org/10.1046/j.0028-646x.2001.00199.x
Ekblad A., Wallander H., Godbold D.L. et al. The production and turnover of extramatrical mycelium of ectomycorrhizal fungi in forest soils: role in carbon cycling // Plant and Soil. 2013. V. 366. № 1. P. 1–27. https://doi.org/10.1007/s11104-013-1630-3
Lan L., Zhang L., Shen Y. et al. Naphthalene exerts non-target effects on the abundance of active fungi by stimulating basidiomycete abundance // J. of Mountain Science. 2020. V. 17. № 8. P. 2001–2010. https://doi.org/10.1007/s11629-020-5985-7
Magan N. Fungi in extreme environments // Environmental and Microbial Relationships. The MYCOTA IV, 2-nd edn. / Eds. Kubicek C.P., Druzhinina I.S. Berlin, Germany: Springer Verlag, 2007. P. 85–103. https://doi.org/10.1007/978-3-540-71840-6
Penton C.R., Gupta V.V., Yu J., Tiedje J.M. Size matters: assessing optimum soil sample size for fungal and bacterial community structure analyses using high throughput sequencing of rRNA gene amplicons // Frontiers in Microbiology. 2016. V. 7. P. 1–11. https://doi.org/10.3389/fmicb.2016.00824
Pérez-González O., Sánchez-Peña S.R. Compatibility in Vitro and in Vivo of the Entomopathogenic Fungi Beauveria bassiana and Hirsutella citriformis with Selected Insecticides // Southwestern Entomologist. 2017. V. 42. № 3. P. 707–718. https://doi.org/10.3958/059.042.0309
Vig K., Singh D.K., Agarwal H.C. et al. Soil microorganisms in cotton fields sequentially treated with insecticides // Ecotoxicology and Environmental Safety. 2008. V. 69. № 2. P. 263–276. https://doi.org/10.1016/j.ecoenv.2006.12.008
Zortéa T., Baretta D., Maccari A.P. et al. Influence of cypermethrin on avoidance behavior, survival and reproduction of Folsomia candida in soil // Chemosphere. 2015. V. 122. P. 94–98.https://doi.org/10.1016/j.chemosphere.2014.11.018
Al-Smadi B.M., Al Oran E.H., Hajar H.A.A. Adsorption-desorption of cypermethrin and chlorfenapyr on Jordanian soils // Arabian J. of Geosciences. 2019. V. 12. №. 15. P. 1 – 8. https://doi.org/10.1007/s12517-019-4614-7
Максименко Л.В., Гурова А.И. Эколого-токсикологическая характеристика пестицидов класса синтетических пиретроидов // Вестник Российского ун-та дружбы народов. Серия: Медицина. 2004. № 2. С. 102–107.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. Информация в “Государственном каталоге пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации”, приведена по состоянию на 20 июля 2021 г. Пестициды. Ч.1. М., 2021.
Webster A., Reck J., Santi L. et al. Integrated control of an acaricide-resistant strain of the cattle tick Rhipicephalus microplus by applying Metarhizium anisopliae associated with cypermethrin and chlorpyriphos under field conditions // Veterinary Parasitology. 2015. V. 207. № 3–4. P. 302–308. https://doi.org/10.1016/j.vetpar.2014.11.021
Testa M., da Silva A.S., Segat J.C. et al. Impacts on reproduction of Enchytraeus crypticus in fertilized soils with chicken litter treated with synthetic and natural insecticide // Environmental Toxicology and Pharmacology. 2020. V. 78. P. 103386. https://doi.org/10.1016/j.etap.2020.103386
Mori N., Santoiemma G., Glazer I. et al. Management of Popillia japonica in container-grown nursery stock in Italy // Phytoparasitica. 2022. V. 50. № 1. P. 83–89. https://doi.org/10.1007/s12600-021-00948-2
Srinivasulu M., Ortiz D.R. Effect of pesticides on bacterial and fungal populations in Ecuadorian tomato cultivated soils // Environ. Process. 2017. V. 4. P. 93–105.
Dalma K.E., Teodor R., Lech W.S. et al. Cypermethrin non-target impact on soil microbial communities: laboratory artificial incubation experiment // Agricultura. 2019. V. 109–110. № 1–2. P. 132–139.
Тихомиров А.А. Растительность и флора заповедника “Кивач” // Флористические исследования в Карелии. Петрозаводск, 1988. С. 62–95.
Пузаченко Ю.Г. Центрально-Лесной государственный природный биосферный заповедник // Деловой мир. М., 2007. 80 с.
ГОСТ Р 51247-99. Пестициды. Общие технические условия. М.: Изд-во стандартов, 1999. 11 с.
Система сертификации ГОСТ Р Федеральное агентство по техническому регулированию и метрологии. Сертификат соответствия № РОСС RU.F:33/Y00932 Клещевит супер/Комароед. Серийный выпуск / Испытательная лаборатория ООО “ТЕСТИСПЫТАНИЯ”, изготовитель Акционерное общество Фирма “Август”. № 0232935, с 03.06.2019 по 02.06.2022.
Zuev A.G., Khmeleva M.V., Tiunov A.V. Collecting fungal mycelium using in-growth mesh bags: Effects of the sand particle size and seasonality // Pedobiologia. 2019. V. 77. P. 150591. https://doi.org/10.1016/j.pedobi.2019.150591
Федоров В.Д. Практическая гидробиология. Пресноводные экосистемы. М.: ПИМ, 2006. 367 с.
Tiunov A.V., Scheu S. Microbial respiration, biomass, biovolume and nutrient status in burrow walls of Lumbricus terrestris L. (Lumbricidae) // Soil Biology and Biochemistry. 1999. V. 31. № 14. P. 2039–2048. https://doi.org/10.1016/S0038-0717(99)00127-3
Olson F.C.W. Quantitative estimates of filamentous algae // Transactions of the American Microscopical Society. 1950. V. 69. № 3. P. 272–279. https://doi.org/10.2307/3223098
Bakken L.R., Olsen R.A. Buoyant densities and dry-matter contents of microorganisms: conversion of a measured biovolume into biomass // Applied and Environmental Microbiology. 1983. V. 45. № 4. P. 1188–1195. https://doi.org/10.1128/aem.45.4.1188-1195.1983
Högberg M.N., Högberg P. Extramatrical ectomycorrhizal mycelium contributes one-third of microbial biomass and produces, together with associated roots, half the dissolved organic carbon in a forest soil // New Phytologist. 2002. V. 154. № 3. P. 791–795. https://doi.org/10.1046/j.1469-8137.2002.00417.x
R Core Team. R: A Language and Environment for Statistical Computing // R Foundation for Statistical Computing. Vienna, Austria, 2019.
Wickham H. Data manipulation with dplyr // Proceedings of the R User Conference. Los Angeles, CA, USA, 2014. V. 30. 81 p.
Bates D., Maechler M., Bolker B., Walker S. Fitting linear mixed-effects models using lme4 // J. Stat. Softw. 2015. V. 67. № 1. P. 1–48.
Fox J., Weisberg S., Price B. et al. Package “car”. Vienna: R Foundation for Statistical Computing, 2021. 152 p.
Lenth R.V. Estimated marginal means, aka least-squares means [R Package Emmeans Version 1.6. 0]. Comprehensive R Archive Network (CRAN), 2021.
Wickham H. ggplot2: Elegant Graphics for Data Analysis. New York: Springer-Verlag, 2016. 260 p.
Wilke C.O. cowplot: streamlined plot theme and plot annotations for “ggplot2”. R package version 1.0.0. 2020. V. 9.
Stanley J., Preetha G. Pesticide toxicity to non-target organisms: Exposure, Toxicity and Risk Assessment Methodologies. Berlin, Germany: Springer, 2016. 502 p. https://doi.org/10.1007/978-94-017-7752-0
Еремина О.Ю., Ибрагимхалилова И.В. Синергическое действие бинарных смесей неоникотиноидов и пиретроидов на насекомых // Агрохимия. 2010. № 2. С. 37–44.
Scott J.G., Yoshimizu M.H., Kasai S. Pyrethroid resistance in Culex pipiens mosquitoes // Pesticide Biochemistry and Physiology. 2015. V. 120. P. 68–76. https://doi.org/10.1016/j.pestbp.2014.12.018
Balabanidou V., Grigoraki L., Vontas J. Insect cuticle: a critical determinant of insecticide resistance // Current Opinion in Insect Science. 2018. V. 27. P. 68–74. https://doi.org/10.1016/j.cois.2018.03.001
Athanassiou C.G., Kavallieratos N.G., Boukouvala M.C. et al. Efficacy of alpha-cypermethrin and thiamethoxam against Trogoderma granarium Everts (Coleoptera: Dermestidae) and Tenebrio molitor L. (Coleoptera: Tenebrionidae) on concrete // J. of Stored Products Research. 2015. V. 62. P. 101–107. https://doi.org/10.1016/j.jspr.2015.04.003
Ertiban S.M. Soil fauna as webmasters, engineers and bioindicators in ecosystems: Implications for conservation ecology and sustainable agriculture // Amer. J. of Life Sciences. 2019. V. 7. № 1. P. 17–26. https://doi.org/10.11648/j.ajls.20190701.14
Raspotnig G., Matischek T. Anti-wetting strategies of soil-dwelling Oribatida (Acari) // Acta Soc. Zool. Bohem. 2010. V. 74. P. 91–96.
Pass G., Szucsich N.U. 100 years of research on the Protura: many secrets still retained // Soil Organisms. 2011. V. 83. № 3. P. 309–334.
Galli L. Capurro M., Colasanto E. et al. A synopsis of the ecology of Protura (Arthropoda: Hexapoda) // Revue suisse de Zoologie. 2020. V. 126. № 2. P. 155–164. https://doi.org/10.5281/zenodo.3463443
Tiunov A.V., Scheu S. Microbial biomass, biovolume and respiration in Lumbricus terrestris L. cast material of different age // Soil Biol. and Biochem. 2000. V. 32. № 2. P. 265–275. https://doi.org/10.1016/S0038-0717(99)00165-0
Read D.J. The mycorrhizal mycelium // Mycorrhizal functioning. New York: Chapman and Hall, 1992. P. 102–133.
Cazorla D., Morales Moreno P. Compatibility of 13 Beauveria bassiana isolates pathogenic to Rhodnius prolixus (Triatominae) with insecticides // Boletín de Malariología y Salud Ambiental. 2010. V. 50. № 2. P. 261–270.
Laatikainen T., Heinonen-Tanski H. Mycorrhizal growth in pure cultures in the presence of pesticides // Microbiological Research. 2002. V. 157. № 2. P. 127–137. https://doi.org/10.1078/0944-5013-00139
Potapov A.M., Tiunov A.V. Stable isotope composition of mycophagous collembolans versus mycotrophic plants: do soil invertebrates feed on mycorrhizal fungi? // Soil Biol. Biochem. 2016. V. 93. P.115–118. https://doi.org/10.1016/j.soilbio.2015.11.001
Дополнительные материалы отсутствуют.


