Экология, 2022, № 6, стр. 421-429
Динамика сообществ криптогамных организмов на мертвой древесине после снижения выбросов медеплавильного завода
М. Р. Трубина a, *, И. Н. Михайлова a, А. П. Дьяченко b
a ФГБУН Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
b Уральский государственный педагогический университет
620091 Екатеринбург, просп. Космонавтов, 26, Россия
* E-mail: mart@ipae.uran.ru
Поступила в редакцию 20.06.2022
После доработки 12.07.2022
Принята к публикации 14.07.2022
- EDN: YSINVC
- DOI: 10.31857/S0367059722060166
Аннотация
Исследована динамика видового состава мхов и лишайников на мертвой древесине пихты и ели в южнотаежных лесах Среднего Урала после почти полного прекращения выбросов Среднеуральского медеплавильного завода (г. Ревда Свердловской обл.). По сравнению с периодом высоких выбросов (1993–1994 гг.) число видов мхов в непосредственной близости от завода (1–2 км) к 2019 г. увеличилось с 1 до 27, лишайников – с 1 до 30. Тем не менее по сравнению с фоновой территорией видовое богатство мхов и лишайников остается сниженным, а видовой состав существенно отличается: отсутствуют многие виды, типичные для фоновой территории, и присутствуют виды, специфичные для нарушенной. В загрязненных местообитаниях выше доля видов с преимущественно половым воспроизводством.
Оценка способности природных экосистем к восстановлению после сокращения/прекращения внешнего воздействия – одна из актуальных проблем современной экологии. Процессы реколонизации деградированных территорий после сокращения выбросов промышленных предприятий существенно различаются как между группами организмов [1], так и между видами в пределах конкретной группы из-за различий в способности к расселению [2, 3]. Криптогамные организмы имеют высокую колонизирующую способность благодаря огромному количеству образуемых мелких диаспор и значительной дальности их распространения [4, 5]. Однако успех колонизации зависит не только от характеристик диаспор (размер, дальность распространения) и расстояния от их источника [6], но и от ширины экологической ниши видов [7] и репродуктивной стратегии – преимущественного расселения с помощью генеративных или вегетативных диаспор, которые существенно различаются по выживаемости [8].
Мертвая древесина (МД) играет огромную роль в поддержании разнообразия криптогамных организмов в лесных экосистемах: число видов на ней может составлять до 84% от общего видового богатства [9, 10]. В то же время специальных исследований колонизации крупных древесных остатков после сокращения выбросов металлургических заводов не проводилось. Немногочисленные работы по восстановлению криптогамных организмов на загрязненных территориях посвящены изменению разнообразия в напочвенном покрове [11, 12], на стволах живых деревьев [2] или без учета субстратной приуроченности [13–15].
Цель данной работы – анализ закономерностей заселения мхами и лишайниками мертвой древесины в елово-пихтовых лесах после почти полного прекращения выбросов крупного медеплавильного завода на Среднем Урале. Район исследований удобен для изучения восстановительной динамики рассматриваемых групп тем, что для него имеются данные о состоянии мохово-лишайниковых сообществ в период высоких выбросов (1993–1994 гг.). Надежно установлено, что в этот период в радиусе 1–2 км от завода эпиксильные сообщества криптогамных организмов на упавших стволах были представлены всего двумя видами – мхом Pohlia nutans (Hedw.) Lindb. [16] и лишайником Placynthiella uliginosa (Schrader) Coppins & P. James [17]. Еще два вида лишайников (Scoliciosporum chlorococcum (Graewe ex Stenh.) Vězda, Trapeliopsis flexuosa (Fr.) Coppins & P. James) были зарегистрированы на других типах МД – сухостое и пнях [17].
В течение первого десятилетия после почти полного прекращения выбросов в зоне максимального загрязнения в целом сохранялось крайне низкое видовое разнообразие мхов, хотя обнаруживали локальные участки с большим числом видов [15]. Показано также активное заселение живых стволов деревьев эпифитными лишайниками в зоне бывшей “лишайниковой пустыни” вблизи завода [2]. Сведения о реколонизации мхами и лишайниками почвы и живых деревьев в сочетании с данными о более низком содержании тяжелых металлов в МД по сравнению с лесной подстилкой [18] позволили выдвинуть гипотезу о вероятном быстром заселении мхами и лишайниками МД на загрязненной территории, которая тестируется в настоящей работе.
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена на территории, подверженной длительному (с 1940 г.) атмосферному загрязнению выбросами Среднеуральского медеплавильного завода (СУМЗ), расположенного возле г. Ревды Свердловской области, в елово-пихтовых лесах подзоны южной тайги. Основные компоненты выбросов завода – оксиды серы и пылевые частицы с сорбированными на них металлами (Сu, Fe, Zn, Pb, Cd и др.) и металлоидами (As). В конце 1980-х годов объем выбросов (сернистый ангидрид и тяжелые металлы) составлял 140 тыс. т/год, в 1995–1998 гг. – 71–96 тыс. т/год, а после реконструкции предприятия в 2010 г. – 3–5 тыс. т/год [19]. Детальное описание района исследований, степени деградации и восстановительной динамики ряда компонентов экосистем опубликовано ранее [19–21].
В 2019 г. на четырех участках, заложенных в импактной (1 и 2 км от завода) и фоновой (30 и 31 км) зонах были обследованы поваленные деревья ели (Picea obovata Ledeb.) и пихты (Abies sibirica Ledeb.) 2-й и 3-й стадий разложения (по шкале П.В. Гордиенко). Эти стадии характеризуются следующими признаками: 2-я стадия – кора в основном сохранилась, древесина плотная с первыми признаками разложения; 3-я стадия – кора местами отпала, верхний слой древесины мягкий, наличие выраженного гниения. Характер и сила связи между диагностируемой стадией разложения валежа и его плотностью не зависят от зоны загрязнения, что позволяет использовать шкалы стадий разложения не только в фоновых условиях, но и в техногенно преобразованных лесах [22]. Выбор этих стадий обусловлен тем, что для них характерно наибольшее число эпиксильных видов мхов и лишайников [23, 24]. Всего обследовано 95 фрагментов МД: 56 – в импактной зоне (25 пихт и 31 ель) и 39 – в фоновой (21 пихта и 18 елей).
Виды мхов и лишайников регистрировали на стволе, ветвях и пне упавшего дерева как на остатках коры, так и на обнаженной древесине. Не идентифицируемые в полевых условиях образцы собирали для определения видовой принадлежности в лаборатории. Для этого использовали стандартные методики и определительные ключи [25–37].
Виды мхов и лишайников были разделены на две группы: с преимущественно половым и вегетативным типом воспроизводства. Для мхов подразделение выполнено на основе частоты образования спорофитов (виды с частым образованием спорофитов отнесены к видам преимущественно полового типа воспроизводства, с редким – к видам преимущественно вегетативного воспроизводства) [27, 28, 38]. Виды лишайников, формирующие соредии и/или изидии, отнесены к видам преимущественно вегетативного воспроизводства, виды без соредий и/или изидий, но формирующие апотеции – к видам полового воспроизводства.
Статистический анализ выполнен в программе PAST 4.12. Для сравнения видового состава сообществ использовали коэффициент сходства Жаккара. Дендрограммы сходства построены методом UPGMA.
РЕЗУЛЬТАТЫ
Характеристика исследованных древесных остатков. В табл. 1 приведены размерные характеристики обследованного валежа пихты и ели. В фоновой зоне средний диаметр стволов ели значимо превышал диаметр стволов пихты (непараметрический t-тест с перестановками, 10 000 перестановок, P = 0.014), но распределения были сходными (тест Колмогорова–Смирнова, D = 0.37; Р = 0.116). Средняя длина стволов ели также превосходила длину стволов пихты (P = 0.014), но распределения значимо не различались (D = 0.38; Р = 0.088). В импактной зоне средние значения и распределения по размерам между фрагментами разных видов деревьев значимо не различались.
Таблица 1.
Размеры исследованных древесных остатков
| Размерные характеристики | Фоновая зона | Импактная зона | ||
|---|---|---|---|---|
| пихта | ель | пихта | ель | |
| Длина ствола, м | ||||
| среднее арифметическое ± SE | 10.5 ± 1.0 | 20.6 ± 2.4 | 12.5 ± 0.9 | 13.4 ± 1.3 |
| размах | 5.2–20.0 | 4.4–29.9 | 4.2–24.7 | 5.2–28.8 |
| Диаметр ствола, см | ||||
| среднее арифметическое ± SE | 14.4 ± 1.6 | 25.1 ± 3.8 | 16.9 ± 1.9 | 20.6 ± 2.4 |
| размах | 5.3–29.0 | 7.0–56.1 | 7.0–44.6 | 7.2–55.4 |
Число видов и видовой состав. Всего в районе исследований на МД обнаружено 50 видов мхов (табл. 2) и 52 вида лишайников (табл. 3), в фоновой зоне – 47 и 42 вида соответственно, причем 46% всех видов мхов и 42.3% видов лишайников специфичны для фоновой зоны.
Таблица 2.
Список видов мхов на мертвой древесине пихты (П) и ели (Е) на разных удалениях от СУМЗа
| Вид | Тип воспро-изводства | Удаление от завода и субстрат | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 км | 2 км | 30 км | 31 км | ||||||
| П | Е | П | Е | П | Е | П | Е | ||
| Amblystegium serpens (Hedw.) Bruch, Schimp. et W. Gümbel | 1 | – | – | + | + | – | – | + | – |
| Atrichum undulatum (Hedw.) P. Beauv. | 1 | – | – | – | – | – | – | – | + |
| Aulacomnium palustre (Hedw.) Schwägr. | 2 | – | – | – | – | + | – | – | – |
| Brachytheciastrum velutinum (Hedw.) Ignatov et Huttunen | 1 | – | – | + | + | + | + | + | + |
| Brachythecium salebrosum (Hoffm. ex F. Weber et D. Mohr) Bruch, Schimp. et W. Gümbel | 1 | – | – | + | + | + | + | + | + |
| Bryum caespiticium Hedw. | 1 | – | – | – | – | + | – | – | – |
| B. pallescens Schleich. ex Schwägr. | 1 | – | – | + | + | – | – | – | – |
| B. rubens Mitt. | 2 | – | – | – | – | – | + | – | – |
| Callicladium haldanianum (Grev.) H.A. Crum | 1 | – | – | – | + | + | + | + | + |
| Calliergon cordifolium (Hedw.) Kindb. | 2 | – | – | – | – | – | – | – | + |
| Campylophyllopsis sommerfeltii (Myrin) Ochyra | 1 | – | – | – | + | + | – | – | – |
| Ceratodon purpureus (Hedw.) Brid. | 1 | – | – | – | + | – | + | – | – |
| Cirriphyllum piliferum (Hedw.) Grout | 2 | – | – | – | – | + | – | + | + |
| Climacium dendroides (Hedw.) F. Weber et D. Mohr | 2 | – | – | – | – | + | – | + | + |
| Dicranum fuscescens Turner | 2 | – | – | – | – | + | + | + | + |
| D. majus Turner | 2 | – | – | – | – | – | – | + | – |
| D. montanum Hedw. | 2 | – | – | – | + | + | + | + | + |
| D. polysetum Sw. | 2 | – | – | – | – | + | + | + | + |
| D. scoparium Hedw. | 1 | – | – | – | + | + | + | + | + |
| Drepanocladus polygamus (Bruch, Schimp. et W. Gümbel) Hedenäs | 2 | – | – | – | – | – | – | + | – |
| Herzogiella turfacea (Lindb.) Z. Iwats. | 1 | – | – | + | – | – | + | – | – |
| Hylocomiadelphus triquetrus (Hedw.) Ochyra et Stebel | 2 | – | – | – | + | + | + | + | + |
| Hylocomium splendens (Hedw.) Bruch, Schimp. et W. Gümbel | 2 | – | – | – | + | + | + | + | + |
| Jochenia pallescens (Hedw.) Hedenäs | 1 | – | – | – | – | + | + | + | + |
| Oncophorus wahlenbergii Brid. | 1 | – | – | – | + | + | + | + | + |
| Physcomitrella patens (Hedw.) Bruch, Schimp. et W. Gümbel | 1 | – | – | + | – | – | – | – | – |
| Plagiomnium cuspidatum (Hedw.) T.J. Kop. | 1 | – | – | – | + | + | + | + | + |
| P. drummondii (Bruch et Schimp.) T.J. Kop. | 1 | – | – | – | – | + | + | + | + |
| P. elatum (Bruch et Schimp.) T.J. Kop. | 2 | – | – | – | – | + | – | + | + |
| P. ellipticum (Brid.) T.J. Kop. | 2 | – | – | – | – | – | – | + | + |
| P. medium (Bruch et Schimp.) T.J. Kop. | 1 | – | – | – | – | + | + | + | – |
| Plagiothecium denticulatum (Hedw.) Bruch, Schimp. et W. Gümbel | 2 | – | – | + | + | + | + | + | + |
| P. laetum Bruch, Schimp. et W. Gümbel | 2 | – | – | + | + | + | + | + | + |
| P. latebricola Bruch, Schimp. et W. Gümbel | 2 | – | – | – | – | – | – | + | – |
| Pleurozium schreberi (Brid.) Mitt. | 2 | + | – | – | + | + | + | + | + |
| Pohlia nutans (Hedw.) Lindb. | 1 | + | + | + | + | + | + | + | + |
| Polytrichum longisetum Sw. ex Brid. | 2 | – | – | – | – | + | – | – | – |
| Ptilium crista–castrensis (Hedw.) De Not. | 2 | – | – | – | + | + | + | + | + |
| Pylaisia polyantha (Hedw.) Bruch, Schimp. et W. Gümbel | 1 | – | – | – | – | – | – | + | – |
| Rhizomnium punctatum (Hedw.) T.J. Kop. | 1 | – | – | – | – | – | – | + | + |
| Rhodobryum roseum (Hedw.) Limpr. | 2 | – | – | – | – | + | + | – | – |
| Rhytidiadelphus subpinnatus (Lindb.) T.J. Kop. | 2 | – | – | – | – | + | + | – | + |
| Sanionia uncinata (Hedw.) Loeske | 1 | + | – | + | + | + | + | + | + |
| Sciuro–hypnum oedipodium (Mitt.) Ignatov et Huttunen | 1 | – | – | + | + | + | + | + | + |
| S. populeum (Hedw.) Ignatov et Huttunen | 1 | – | – | – | + | + | – | + | + |
| S. reflexum (Starke) Ignatov et Huttunen | 1 | – | – | + | + | + | + | + | + |
| S. starkei (Brid.) Ignatov et Huttunen | 1 | – | – | – | + | + | + | + | + |
| Sphagnum squarrosum Crome | 1 | – | – | – | – | – | + | – | – |
| Tayloria tenuis (Dicks. ex With.) Schimp. | 1 | – | – | – | + | – | – | – | – |
| Tetraphis pellucida Hedw. | 2 | + | – | + | + | + | + | + | + |
| Всего видов | 4 | 1 | 13 | 25 | 34 | 30 | 35 | 32 | |
Примечание. Здесь и в табл. 3 типы воспроизводства: 1 – преимущественно половое, 2 – преимущественно вегетативное.
Таблица 3.
Список видов лишайников на мертвой древесине пихты (П) и ели (Е) на разных удалениях от СУМЗа
| Вид | Тип воспро-изводства | Удаление от завода и субстрат | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 км | 2 км | 30 км | 31 км | ||||||
| П | Е | П | Е | П | Е | П | Е | ||
| Absconditella lignicola Vězda & Pišút | 1 | + | – | – | + | + | + | + | + |
| Amandinea punctata (Hoffm.) Coppins & Scheid. | 1 | – | – | – | + | – | – | – | – |
| Bacidina phacodes (Körb.) Vězda | 1 | – | + | – | – | – | – | – | – |
| Bryoria nadvornikiana (Gyeln.) Brodo et D. Hawksw. | 2 | – | – | – | – | – | – | – | + |
| Catinaria atropurpurea (Schaer.) Vezda & Poelt | 1 | – | – | – | + | + | – | + | – |
| Chaenotheca ferruginea (Turner ex Sm.) Mig. | 1 | – | – | + | – | – | + | – | + |
| Cladonia botrytes (Hag.) Willd. | 1 | + | + | – | – | – | – | + | – |
| C. cenotea (Ach.) Schaerer | 2 | – | – | – | – | – | + | + | + |
| C. chlorophaea (Flörke ex Sommerf.) Spreng. | 2 | + | + | + | + | – | – | + | – |
| C. coniocraea (Flörke) Spreng. | 2 | + | + | + | + | + | + | + | + |
| C. crispata (Ach.) Flot. | 1 | – | + | – | – | – | – | – | – |
| C. fimbriata (L.) Fr. | 2 | + | + | + | + | + | + | + | + |
| C. furcata (Huds.) Schrad. | 1 | – | + | – | – | – | – | – | – |
| C. gracilis (L.) Willd. | 1 | + | + | – | – | – | – | – | – |
| C. ochrochlora Flk. | 2 | + | – | + | + | – | – | – | – |
| C. rei Schaer. | 2 | + | + | + | + | – | + | + | – |
| Dimerella pineti (Ach.) Vězda | 1 | – | – | + | – | – | – | – | – |
| Evernia mesomorpha Nyl. | 2 | – | – | – | – | – | + | – | + |
| Fuscidea arboricola Coppins & Tønsberg | 2 | – | – | – | – | + | + | + | + |
| F. pusilla Tønsberg | 2 | – | – | – | – | – | + | + | + |
| Hypocenomyce caradocensis (Leight. ex Nyl.) P. James & Gotth. Schneid. | 1 | + | + | + | + | + | – | – | – |
| H. leucococca R. Sant. | 2 | – | – | – | – | – | + | – | – |
| Hypogymnia physodes (L.) Nyl. | 2 | + | + | + | + | + | + | + | + |
| H. tubulosa (Schaer.) Hav. | 2 | – | – | – | – | – | – | – | + |
| Lecanora pulicaris (Pers.) Ach. | 1 | – | – | – | – | – | + | – | + |
| Lepraria elobata Tønsberg | 2 | – | – | – | – | – | + | – | + |
| L. incana (L.) Ach. | 2 | – | – | – | – | – | – | – | + |
| Lepraria sp. | 2 | – | – | – | – | – | – | + | + |
| Micarea denigrata (Fr.) Hedl. | 1 | – | – | – | – | – | – | + | – |
| M. myriocarpa V. Wirth and Vĕzda ex Coppins | 1 | – | – | – | – | – | – | + | – |
| M. prasina s.l. | 1 | + | + | + | + | + | + | + | + |
| Mycobilimbia carneoalbida (Müll. Arg.) S. Ekman et Printzen | 1 | – | – | + | – | – | – | – | – |
| Mycoblastus alpinus (Fr.) Hellb. | 2 | – | – | – | – | – | – | + | – |
| M. fucatus (Stirt.) Zahlbr. | 2 | – | – | – | – | – | + | – | – |
| Parmelia sulcata Tayl. | 2 | – | – | + | + | – | + | + | + |
| Parmeliopsis ambigua (Wulfen) Nyl. | 2 | – | – | – | – | – | + | + | – |
| P. hyperopta (Ach.) Vain. | 2 | – | – | – | – | – | + | – | – |
| Peltigera canina (L.) Willd. | 1 | – | – | – | – | – | – | + | – |
| P. polydactylon (Neck.) Hoffm. | 1 | – | – | – | – | + | + | + | + |
| P. praetextata (Flörke ex Sommerf.) Zopf. | 2 | – | – | – | – | + | + | – | + |
| Pycnora sorophora (Vain.) Hafellner | 2 | – | – | – | – | – | + | – | – |
| Placynthiella dasaea (Stirton) Tønsberg | 2 | – | + | – | – | – | + | – | – |
| P. icmalea (Ach.) Coppins & P. James | 1 | + | + | + | + | – | – | – | + |
| P. uliginosa (Schrader) Coppins& P. James | 1 | + | + | + | + | – | – | – | – |
| Rinodina degeliana Coppins | 2 | – | – | + | – | – | + | + | + |
| Ropalospora viridis (Tønsberg) Tønsberg | 2 | + | – | – | + | – | + | – | – |
| Scoliciosporum chlorococcum (Graewe ex Stenh.) Vězda | 1 | + | + | + | + | – | + | + | – |
| Trapeliopsis flexuosa (Fr.) Coppins & P. James | 2 | + | + | + | + | – | – | + | – |
| T. granulosa (Hoffm.) Lumbsch | 2 | + | + | – | + | – | – | – | + |
| Tuckermanopsis chlorophylla (Willd.) Hale | 2 | – | – | – | – | – | – | – | + |
| T. sepincola (Ehrh.) Hale | 1 | + | + | – | – | – | – | – | – |
| Vulpicida pinastri (Scop.) J.–E. Mattsson & M.J. Lai | 2 | + | + | – | + | – | + | + | + |
| Всего видов | 19 | 20 | 17 | 19 | 10 | 26 | 24 | 24 | |
В фоновой зоне состав сообществ мхов несколько различается между МД разных видов деревьев (коэффициент сходства 0.68), хотя число видов сходно (41 и 38 на МД пихты и ели соответственно). Специфичных для пихты видов 9 (Pylaisia polyantha, Plagiothecium latebricola и др.), для ели – 6 (Bryum rubens, Calliergon cordifolium и др.).
В фоновой зоне число видов лишайников на ели (33) выше, чем на МД пихты (26, коэффициент сходства 0.41), что во многом определяется высоким разнообразием сохраняющихся после падения дерева эпифитов на ветвях: для МД ели на фоновой территории специфичны 16 видов, из которых 7 обнаружены именно на ветвях (Bryoria nadvornikiana, Evernia mesomorpha, Hypocenomyce leucococca, Hypogymnia tubulosa, Lecanora pulicaris, Mycoblastus fucatus, Tuckermanopsis chlorophylla).
В импактной зоне выявлено 27 видов мхов и 30 видов лишайников. Число видов лишайников на удалениях 1 и 2 км не различается (по 23 вида на каждом участке), тогда как видовое богатство мхов на удалении 1 км существенно ниже, чем на удалении 2 км (4 и 27 видов соответственно, см. табл. 2). Коэффициенты сходства фоновой и импактной зон составили 0.48 (мхи) и 0.39 (лишайники).
Вблизи завода отсутствует целый ряд типичных для фоновой территории эпиксильных мхов (Dicranum fuscescens, Rhizomnium punctatum, Jochenia pallescens и др.). Интересно, что лишь в импактной зоне отмечены два редких для Урала вида мхов, которые в обычных условиях произрастают либо только на сырой почве (Physcomitrella patens), либо на почве и экскрементах (Tayloria tenuis), а также Bryum pallescens – типичный для Южного Урала, но редкий для Среднего [39]. В отличие от фоновой территории в импактной зоне число видов мхов на МД ели (25) значительно выше, чем на МД пихты (14), коэффициент сходства равен 0.44.
В импактной зоне не обнаружены очень чувствительные к загрязнению эпифитные лишайники, сохраняющиеся на фоновой территории на ветвях валежа (B. nadvornikiana, E. mesomorpha, Fuscidea arboricola, H. tubulosa) и остатках коры (Lepraria spp.), а также эпибриофитные лишайники рода Peltigera. В то же время здесь выше разнообразие видов рода Cladonia, многие из которых известны как эпигейные, типичные для сухих местообитаний (C. crispata, C. furcata, С. gracilis, C. ochrochlora, C. rei) [32]. Среди этих видов С. rei – вид, предпочитающий антропогенные местообитания [32]. Только на импактной территории обнаружен высокотолерантный вид P. uliginosa, переходящий на МД с отмершего мха, а также эксплерент Tuckermanopsis sepincola, характерный для открытых местообитаний и активно заселяющий живые стволы на бывших загрязненных территориях [2]. В импактной зоне МД ели и пихты по числу видов почти одинаковы (26 и 24 вида соответственно).
Описанные закономерности хорошо отражены на дендрограммах сходства (рис. 1). Как для мхов, так и лишайников выделяется кластер фоновой территории. Значительная доля видов лишайников, специфичных для импактной территории, определила образование кластера импактной зоны, т.е. сходство внутри зон загрязнения выше, чем сходство на МД одного вида дерева в разных зонах. Видовой состав мхов на МД ели в импактной зоне ближе к фоновой зоне, а наименее богатые видами сообщества МД пихты импактной зоны обособлены. Для мхов сходство между МД разных видов деревьев выше на фоновой территории, а для лишайников – на импактной.
Рис. 1.
Дендрограммы сходства видового состава мхов (а) и лишайников (б) на мертвой древесине ели и пихты в разных зонах нагрузки (I – импактная, II – фоновая). Использован коэффициент Жаккара и метод UPGMA. В основаниях кластеров показаны цифры бутстреп-поддержки (% от 1000 повторностей).

Вклад видов с разной репродуктивной стратегией. В фоновой зоне мхи с разным типом воспроизводства представлены почти одинаковым числом видов: первая группа (преимущественно половое воспроизводство) – 24 вида, вторая (преимущественно вегетативное воспроизводство) – 23. Соотношение групп не зависит от видовой принадлежности МД (рис. 2а). В импактной зоне преобладают виды 1-й группы (19 видов), тогда как из 2-й отмечены только 8 видов. Доля видов первой группы в импактной зоне на МД пихты составила 71.4%, ели – 68%. Все специфичные для импактной зоны виды мхов принадлежат к первой группе.
Рис. 2.
Число видов мхов (а) и лишайников (б) на мертвой древесине ели и пихты в разных зонах нагрузки. Черная заливка – число видов с преимущественно половым типом воспроизводства, без заливки – число видов с преимущественно вегетативным типом воспроизводства.
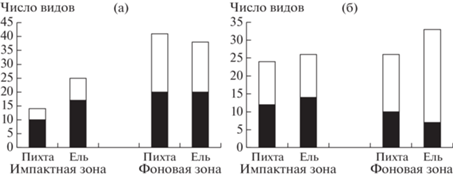
В сообществах лишайников фоновой территории преобладают виды второй группы (69%) (см. рис. 1б). Однако на загрязненной территории соотношение меняется на противоположное: доля видов первой группы составляет 57%. При этом в импактной зоне доля типов размножения примерно одинакова на МД обоих видов деревьев, а в фоновой зоне на МД ели отмечена более высокая доля вегетативно размножающихся видов (см. рис. 2б). Это обусловлено упоминавшимся выше присутствием эпифитов на ветвях, большинство которых – соредиозные виды (B. nadvornikiana, E. mesomorpha, F. arboricola, H. tubulosa), и видами рода Lepraria. Из 10 специфичных для импактной зоны видов 9 принадлежат к первой группе.
ОБСУЖДЕНИЕ
В фоновой зоне видовое богатство мхов (42 вида) и лишайников (47) сходно. Хотя детальный анализ взаимодействий мхов и лишайников не входил в наши задачи, необходимо отметить их разнонаправленность. С одной стороны, относительно быстро растущие мхи, формирующие высокую биомассу, очевидно являются и более сильными конкурентами за субстрат по сравнению с лишайниками. С другой стороны, мхи могут быть субстратом для эпибриофитных видов лишайников [40]. В нашем исследовании это лишайники рода Peltigera, которые отмечены на МД только в фоновых местообитаниях.
Влияние вида дерева на состав эпиксильных сообществ в пределах одного биотопа изучено недостаточно. Описанные в литературе различия между субстратами [10, 23] связывают не столько с видом дерева, сколько с комплексом факторов местообитания (тип растительного сообщества, высота над уровнем моря, продолжительность стадии разложения и др.). Наши данные свидетельствуют о большей субстратной дифференциации лишайников по сравнению с мхами на фоновой территории. Пихта и ель принадлежат к одной группе – хвойные деревья с кислой корой, поэтому лихенобиота живых деревьев этих видов форофитов сходна [41, 42]. Обнаруженные нами субстратные различия в видовом составе лишайников в значительной степени обусловлены большим количеством ветвей на валеже ели по сравнению с пихтой. Скорость биологического разложения ветвей низка по сравнению со стволовой древесиной, что связано с расположением субстрата относительно поверхности земли [43]. Поэтому после падения дерева именно на ветвях дольше сохраняются сформировавшиеся при жизни дерева сообщества эпифитов. Кроме того, большее видовое богатство лишайников на МД ели может быть связано с более крупными размерами фрагментов по сравнению с пихтой.
Ключевой результат работы заключается в том, что после сокращения, а затем почти полного прекращения выбросов завода произошло быстрое увеличение видового богатства эпиксильных сообществ криптогамных организмов. По сравнению с периодом высоких выбросов (1993–1994 гг.) к 2019 г. число видов мхов увеличилось с 1 до 27, лишайников – с 1 до 30. Такая высокая скорость восстановления контрастирует со стабильно низким видовым разнообразием травяно-кустарничкового яруса на загрязненной территории, несмотря на сокращение выбросов [19]. Вероятно, в загрязненных местообитаниях МД – это более “привлекательный” субстрат для криптогамных организмов благодаря более низким концентрациям металлов и более высокому содержанию воды в древесных остатках по сравнению с лесной подстилкой [18]. Присутствие редких видов мхов в импактной зоне может быть связано с низкой заселенностью стволов, т.е. отсутствием межвидовой конкуренции.
Число видов лишайников на МД в импактной зоне (30 видов) выше, чем на живых деревьях: на стволах пихты на удалениях 1 и 2 км в 2018 г. было зарегистрировано 8 и 13 видов эпифитных лишайников соответственно [2]. Все эти эпифитные виды отмечены и на МД, за исключением очень чувствительного E. mesomorpha.
Представляет интерес разница в скорости реколонизации МД мхами и лишайниками наиболее загрязненного участка (1 км от завода). Число видов мхов на удалении 1 км существенно уступает таковому на удалении 2 км, тогда как число видов лишайников на этих удалениях сходно. Возможно, определенную роль в замедлении заселения играет более высокий уровень токсикантов в субстрате и большее расстояние до ближайших источников диаспор. Однако ведущая роль, вероятно, принадлежит микроклимату. На удалении 1 км значительно сильнее выражено разрушение древесного и травяно-кустарничкового ярусов [19]. Показано [44], что там происходит некоторая аридизация микроклимата: среднесуточная температура, измеренная на высоте 2 м, на 0.7–1.0°С превышает фоновые значения. В травяном ярусе этот эффект еще более выражен: максимальная суточная температура на 3°С, а суточный диапазон температур на 4.3°С превышают аналогичные показатели для фоновой территории [45]. Это приводит к снижению содержания воды в МД на импактной территории по сравнению с фоновой, что показано для древесных остатков 4-й стадии разложения [18]. Вполне вероятно, что именно дефицит влаги лимитирует развитие мхов. Лишайниковые же сообщества отвечают на аридизацию ростом доли ксерофитов (например, многие виды рода Сladonia, а также и T. sepincola – вид, часто встречающийся на обработанной древесине в открытых местообитаниях). Несмотря на пойкилогидридность и мхов, и лишайников, различия в степени их толерантности к высыханию велики [46]. Анализ градиентов увлажненности разного масштаба (от уровня ствола до высотных градиентов) показал преобладание мхов в наиболее влажных местообитаниях, которое сменяется доминированием лишайников в более сухих [40, 47].
Субстратная дифференциация мхов и лишайников в импактной зоне разнонаправлена: эпиксильные сообщества лишайников на разных типах субстрата характеризуются близким числом видов и более сходным видовым составом, чем в фоновой зоне, тогда как дифференциация сообществ мхов на разных типах субстрата в этой зоне, наоборот, резко выражена. Поскольку, как уже упоминалось, различия видового состава лишайников на МД ели и пихты в фоновой зоне в первую очередь определяются наличием эпифитов на ветвях ели, большинство из которых очень чувствительны к загрязнению, их отсутствие в импактной зоне автоматически ведет к повышению сходства между МД разных видов деревьев.
Можно предположить, что причины более высокого видового богатства мхов на МД ели связаны с особенностями ее коры: значительная часть мхов предпочитает грубую кору с высоким содержанием воды [8]. В условиях аридизации деградированных территорий различия во влагоемкости между грубой корой ели и гладкой корой пихты могут возрастать, что влияет на формирование сообществ мхов.
Роль репродуктивной стратегии видов в успешности реколонизации деградированных территорий неоднозначна. С одной стороны, споры полового размножения имеют меньшие размеры и соответственно большую дальность рассеивания, с другой – их выживаемость ниже, чем выживаемость вегетативных пропагул [8]. Спорам лишайников, кроме того, для развития таллома необходимо наличие совместимого фотобионта. По нашим данным, на импактной территории эпиксильные сообщества и мхов, и лишайников характеризуются более высоким участием видов с преимущественно половым воспроизводством, при этом большинство специфичных для импактной зоны видов – с преимущественно половым воспроизводством. На первый взгляд это противоречит данным, полученным для окрестностей цинкоплавильного завода в г. Палмертон, США: после прекращения выбросов заселение сильно загрязненных участков происходило преимущественно вегетативно размножающимися видами лишайников (58% от общего числа видов) [13]. Однако в районе Палмертона рассматривали эпифитные, эпигейные и эпилитные лишайники, а эпиксильных видов обнаружено не было. В то же время именно для эпиксильных лишайников в целом характерно преобладание видов с половым воспроизводством, особенно выраженное для облигатных эпиксилов, у которых доля таких видов достигает 75% [48]. Для анализа преимуществ разных репродуктивных стратегий при реколонизации деградированных территорий пока недостаточно данных и необходимо дальнейшее накопление информации.
ЗАКЛЮЧЕНИЕ
Тестируемая гипотеза полностью подтвердилась: сокращение выбросов на загрязненной территории инициировало значительное увеличение видового богатства эпиксильных мхов (с 1 до 27) и лишайников (с 1 до 30). Однако, несмотря на положительные сдвиги, число видов на МД в импактной зоне остается сниженным по сравнению с фоновой, а видовой состав сообществ существенно отличается от фонового как за счет отсутствия многих видов, типичных для фоновых местообитаний, так и присутствия видов, специфичных для импактных территорий.
Данное исследование следует рассматривать лишь как первый этап изучения закономерностей реколонизации мертвой древесины криптогамными организмами. Для дальнейшего анализа необходима детальная оценка влияния физико-химических факторов МД (в том числе содержания токсикантов) на качественные и количественные характеристики эпиксильных сообществ, а также комплексные исследования, рассматривающие восстановление местообитания в целом.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН (проект № 122021000076-9).
Выражаем глубокую признательность О.В. Дуле, В.С. Микрюкову и И.Е. Бергману за предоставление характеристик древесных остатков, а также Е.Л. Воробейчику за ценные замечания в ходе работы над рукописью.
Авторы заявляют об отсутствии конфликта интересов.
Работа выполнена без участия людей или животных в качестве объектов исследования.
Список литературы
Воробейчик Е.Л. Естественное восстановление наземных экосистем после прекращения промышленного загрязнения. 1. Обзор современного состояния исследований // Экология. 2022. № 1. С. 3–41. [Vorobeichik E.L. Natural recovery of terrestrial ecosystems after the cessation of industrial pollution: 1. A state-of-the-art review // Russ. J. Ecol. 2022. V. 53. № 1. P. 1–39. doi: 10.1134/S1067413622010118]https://doi.org/10.31857/S0367059722010115
Михайлова И.Н. Динамика сообществ эпифитных лишайников в начальный период после снижения выбросов медеплавильного завода // Экология. 2020. №1. С. 43–45. [Mikhailova I.N. Dynamics of epiphytic lichen communities in the initial period after reduction of emissions from a copper smelter // Russ. J. Ecol. 2020. V. 51. № 1. P. 38–45. doi: 10.1134/S10 67413620010075]https://doi.org/10.31857/S0367059720010072
Трубина М.Р. Уязвимость видов травяно-кустарничкового яруса к загрязнению выбросами медеплавильного завода: роль различий в способе распространения диаспор // Экология. 2020. № 2. С. 90–100. [Trubina M.R. Vulnerability to copper smelter emissions in species of the herb-dwarf shrub layer: role of differences in the type of diaspore dispersal // Russ. J. Ecol. 2020. V. 51. № 2. Р. 107–117. doi: 10.1134/S1067413620020125]https://doi.org/10.31857/S0367059720020122
Frahm J.-P. Diversity, dispersal and biogeography of bryophytes (mosses) // Biodiversity and Conservation. 2008. V. 17. № 2. P. 277–284. https://doi.org/10.1007/978-90-481-2801-3_4
Barbé M., Fenton N. J., Bergeron Y. So close and yet so far away: long-distance dispersal events govern bryophyte metacommunity reassembly // Journal of Ecology. 2016. V. 104. № 6. P. 1707–1719. https://doi.org/10.1111/1365-2745.12637
Hutsemekers V., Dopagne C., Vanderpoorten A. How far and how fast do bryophytes travel at the landscape scale? // Diversity and Distributions. 2008. V. 14. P. 483–492. https://doi.org/10.1111/j.1472-4642.2007.00454.x
Johansson V., Ranius T., Snäll T. Epiphyte metapopulation dynamics are explained by species traits, connectivity, and patch dynamics // Ecology. 2012. V. 93. P. 235–241. https://doi.org/10.2307/23143903
Löbel S., Rydin H. Trade-off and habitat constraints in the establishment of epiphytic bryophytes // Functional Ecology. 2010. V. 24. P. 887–897. https://doi.org/10.1111/j.1365-2435.2010.01705.x
Dittrich S., Jacob M., Bade C. et al. The significance of deadwood for total bryophyte, lichen, and vascular plant diversity in an old-growth spruce forest // Plant Ecology. 2014. V. 215. № 10. P. 1123–1137. https://doi.org/10.1007/s11258-014-0371-6
Staniaszek-Kik M., Chmura D., Żarnowiec J. What factors influence colonization of lichens, liverworts, mosses and vascular plants on snags? // Biologia. 2019. V. 4. P. 375–384. https://doi.org/10.2478/s11756-019-00191-5
Черненькова Т.В., Кабиров Р.Р., Басова Е.В. Восстановительные сукцессии северотаежных ельников при снижении аэротехногенной нагрузки // Лесоведение. 2011. № 6. С. 49–66.
Урбанавичюс Г.Р., Боровичев Е.А., Ершов В.В. Криптогамные организмы – пионеры восстановления северотаежных лeсов при снижении промышленного загрязнения // Лесоведение. 2021. № 2. С. 195–207. https://doi.org/10.31857/S0024114821020108
Howe N.M., Lendemer J.C. The recovery of a simplified lichen community near the Palmerton zinc smelter after 34 years // Bibliotheca Lichenologica. 2011. V. 106. P. 120–136.
Schram L.J., Wagner C., McMullin R.T., Anand M. Lichen communities along a pollution gradient 40 years after decommissioning of a Cu–Ni smelter // Environ. Sci. Pollut. Res. 2015. V. 22. № 12. P. 9323–9331. https://doi.org/10.1007/s11356-015-4088-4
Трубина М.Р., Дьяченко А.П. Современное состояние мохового покрова лесов после сокращения выбросов Среднеуральского медеплавильного завода // Поволжский экологич. журн. 2020. № 4. С. 477–491. https://doi.org/10.35885/1684-7318-2020-4-477-491
Гольдберг И.Л. Изменение мохового покрова южнотаежных темнохвойных лесов в условиях техногенного загрязнения // Экология. 1997. № 6. С. 468–470. [Gol’dberg I.L. Changes in the moss layer of southern taiga dark coniferous forests under conditions of technogenic pollution // Russ. J. Ecol. 1997. № 6. P. 168–170.]
Пауков А.Г. Закономерности стациального распределения лишайников в условиях антропогенной нагрузки // Механизмы поддержания биологического разнообразия: Мат-лы конф. Екатеринбург: Изд-во “Екатеринбург”, 1995. С. 116–118.
Mikryukov V.S., Dulya O.V., Bergman I.E. et al. Sheltering role of well-decayed conifer logs for forest floor fungi in long-term polluted boreal forests // Frontiers in Microbiology. 2021. V. 12. P. 729244. https://doi.org/10.3389/fmicb.2021.729244
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В., Бергман И.Е. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458. [Vorobeichik E.L., Trubina M.R., Khantemirova E.V., Bergman I.E. Long-term dynamic of forest vegetation after reduction of copper smelter emissions // Russ. J. Ecol. 2014. V. 45. № 6. P. 498–507. doi: 10.1134/S1067413614060150]https://doi.org/10.7868/S0367059714060158
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локальный уровень). Екатеринбург: Наука, 1994. 280 с.
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024. [Vorobeichik E.L., Kaigorodova S.Yu. Long-term dynamics of heavy metals in the upper horizons of soils in the region of a copper smelter impacts during the period of reduced emission // Eurasian Soil Science. 2017. V. 50. № 8. P. 977–990. doi: 10.1134/S1064229317080130]https://doi.org/10.7868/S0032180X17080135
Бергман И.Е. Применимость шкал разложения валежа на техногенно-загрязненных территориях Среднего Урала // Лесоведение. 2020. № 3. С. 250–264. https://doi.org/10.31857/S0024114820020047
Харпухаева Т.М., Мухортова Л.В. Динамика взаимодействия лишайников и стволового валежа в лесных экосистемах Восточного Прибайкалья // Сибирский экологич. журн. 2016. Т. 23. №. 1. С. 148–163. https://doi.org/10.15372/SEJ20160115
Рыковский Г.Ф., Малько М.С., Сакович А.А. Эпиксильный компонент бриофлоры Полесского региона // Разнообразие растительного мира. 2021. № 3 (10). С. 5–27.
Абрамова А.Л., Савич-Любицкая Л.И., Смирнова З.Н. Определитель листостебельных мхов Арктики СССР. М., Л.: Изд-во АН СССР, 1961. 715 с.
Бардунов Л.В. Определитель листостебельных мхов Центральной Сибири. Л.: Наука, 1969. 319 с.
Игнатов М.С., Игнатова Е.А. Флора мхов средней части Европейской России. Т. 1. M.: KMK, 2003. С. 1–608.
Игнатов М.С., Игнатова Е.А. Флора мхов средней части Европейской России. Т. 2. M.: KMK, 2004. С. 609–960.
Игнатов М.С., Игнатова Е.А., Федосов В.Э. и др. Флора мхов России. Т. 2. Oedipodiales – Grimmiales. M.: KMK, 2017. 560 с.
Мельничук В.М. Определитель лиственных мхов средней полосы и юга европейской части СССР. Киев, 1970. 442 с.
Савич-Любицкая Л.И., Смирнова З.Н. Определитель листостебельных мхов СССР. Верхоплодные мхи. Л.: Наука, 1970. 824 с.
Определитель лишайников СССР. Вып. 5. Л.: Наука, 1978. 305 с.
Определитель лишайников России. Вып. 7. СПб.: Наука, 1998. 166 с.
Определитель лишайников России. Вып. 8. СПб.: Наука, 2003. 277 с.
Пауков А.Г., Трапезникова С.Н. Определитель лишайников Среднего Урала. Екатеринбург: Изд-во Уральского гос. ун-та им. А.М. Горького, 2005. 207 с.
Coppins B.J. A taxonomic study of the lichen genus Micarea in Europe // Bull. of the British Museum (Natural History). Botany series. 1983. V. 11. № 2. P. 17–214.
Tønsberg T. The sorediate and isidiate, corticolous, crustose lichens in Norway // Sommerfeltia. 1992. V. 14. №. 1. P. 1–336.
Hill M.O., Preston C.D., Bosanquet S.D.S., Roy D.B. BRYOATT – Attributes of British and Irish Mosses, liverworts and hornworts – with information on native status, size, life form, life history, geography and habitat. Abbots Ripton, UK: The Centre of Ecology and Hydrology (CEH), 2007. 88 p.
Дьяченко А.П., Дьяченко Е.А. Мхи горных экосистем Урала. Екатеринбург: Изд-во “Раритет”, 2016. 648 с.
Sillett S.C., Antoine M.E. Lichens and bryophytes in forest canopies / Eds. Lowman M.D., Rinker H.B. Forest canopies. Elsevier Academic Press, 2004. P. 151–174.
Шаяхметова З.М. Эпифитные лишайники Предуралья и Урала в пределах Пермского края: Автореф. дис. … канд. биол. наук. Пермь, 2011. 24 с.
Скирин Ф.В., Скирина И.Ф. Эколого-субстратная приуроченность эпифитных лишайников пихтово-еловых и кедрово-широколиственных лесов Южного Сихотэ-Алиня // Turczaninowia. 2012. Т. 15. №. 1. С. 70–79.
Капица Е.А., Трубицына Е.А., Шорохова Е.В. Биогенный ксилолиз стволов, ветвей и корней лесообразующих пород темнохвойных северотаежных лесов //Лесоведение. 2012. № 3. С. 51–58.
Belskii E., Belskaya E. Thermal effect of the Middle Ural copper smelter (Russia) and growth of birch leaves // Environ. Sci. Pollut. Res. 2021. V. 28. P. 26064–26072. https://doi.org/10.1007/s11356-020-12327-1
Золотарев М.П., Нестерков А.В. Паукообразные (Aranei, Opiliones) лугов: реакция на загрязнение выбросами Среднеуральского медеплавильного комбината // Экология. 2015. №1. С. 48–56. [Zolotarev M.P., Nesterkov A.V. Arachnids (Aranei, Opiliones) in meadows: response to pollution with emissions from the Middle Ural copper smelter // Russ. J. Ecol. 2015. V. 46. №1. P. 81–88. https://doi.org/10.1134/S1067413614060162]10.1134/S1067413614060162] https://doi.org/10.22281/2686-9713-2021-3-5-2710.22281/2686-9713-2021-3-5-27https://doi.org/0.7868/S036705971406016X
Lakatos M. Lichens and Bryophytes: Habitats and Species / Eds. Lüttge U., Beck E., Bartels D. Plant Desiccation Tolerance. Ecological Studies. V.215. Berlin, Heidelberg: Springer, 2011. P. 65–87. https://doi.org/10.1007/978-3-642-19106-0_5
Frahm J.-P. Climatic habitat differences of epiphytic lichens and bryophytes // Cryptogamie–Bryologie. 2003. V. 24. №. 1. P. 3–14.
Spribille T., Thor G., Bunnell F. et al. Lichens on dead wood: species-substrate relationships in the epiphytic lichen floras of the Pacific Northwest and Fennoscandia // Ecography. 2008. V. 31. №. 6. P. 741–750. https://doi.org/10.1111/j.1600-0587.2008.05503.x
Дополнительные материалы отсутствуют.


