Экология, 2023, № 5, стр. 396-400
О площади растительных сообществ, обеспечивающей сохранение их видового богатства в условиях воздействия доминирующих видов
В. В. Акатов a, b, *, Т. В. Акатова b, Д. Ф. Афанасьев c, d, Т. Г. Ескина b, Н. М. Сушкова c, С. Г. Чефранов a
a Майкопский государственный технологический университет
385000 Майкоп, ул. Первомайская, 191, Россия
b Кавказский государственный природный биосферный заповедник
385000 Майкоп, ул. Советская, 187, Россия
c Азово-Черноморский филиал Всероссийского научно-исследовательского института рыбного хозяйства
и океанографии (“АзНИИРХ”)
344002 Ростов-на-Дону, ул. Береговая, 21б, Россия
d Донской государственный технический университет
344000 Ростов-на-Дону, пл. Гагарина, 1, Россия
* E-mail: akatovmgti@mail.ru
Поступила в редакцию 14.12.2022
После доработки 21.03.2023
Принята к публикации 11.04.2023
- EDN: JVISEJ
- DOI: 10.31857/S0367059723050037
Глобальные изменения среды, например смена способов землепользования, потепление климата или эвтрофирование местообитаний, могут оказаться благоприятными для некоторых аборигенных видов растений и будут способствовать росту их численности и степени доминирования в сообществах [1, 2]. Распространение чужеродных видов растений может иметь те же последствия – все большее их число будет доминировать в растительном покрове [3]. Высказывается опасение, что эти процессы могут представлять угрозу для существования других видов растений, а соответственно и для фиторазнообразия регионов в целом [1, 2, 4].
Но способны ли доминанты влиять на видовое богатство крупных участков растительного покрова? Результаты некоторых исследований [5–7] не подтверждают это опасение. Они свидетельствуют о том, что доминанты, достигающие высокого проективного покрытия, обычно снижают видовое богатство сообществ на небольших участках, но сила этого эффекта ослабевает по мере увеличения пространственного масштаба исследования. Предполагается, что это может быть связано с характером их воздействия на сопутствующие виды растений – неизбирательным либо избирательным, но при условии, что менее устойчивыми к этому фактору являются обычные, а не редкие виды [6–8]. При этом универсальность данной закономерности была оспорена [9].
Мы оценили характер воздействия чужеродных и аборигенных доминантов на сопутствующие виды растений на примере нескольких десятков участков природных и синантропных травяных сообществ юга России и макрофитобентоса Черного и Азовского морей [8, 10]. Был сделан вывод, что доминанты, способные избирательно воздействовать на другие виды, не имеют широкого распространения в растительном покрове этого региона [8, 10].
Если воздействие доминантов на сопутствующие виды растений является неизбирательным (т. е. виды исключаются из небольших участков сообществ случайным образом), то каждый из этих видов имеет определенную вероятность быть обнаруженным на участках с любой степенью доминирования. В этом случае сообщества с низкой и высокой степенью доминирования (LD и HD) должны характеризоваться сходным размером видового пула и соответственно включать сходное число видов, если их площадь достаточно велика. Как следует из работы М. Gaertner et al. [5], для растительных сообществ средиземноморского типа воздействие чужеродных доминантов становится малозаметным на участках площадью более 100 м2. Другие работы, касающиеся этой проблемы, нам не известны.
В настоящем сообщении мы рассмотрели данный вопрос на примере пяти участков наземных травяных сообществ (полян, залежей и пустырей) и одного участка макрофитобентоса с доминированием аборигенных и чужеродных видов, способных образовывать густые и высокие заросли: Calamagrostis epigejos, Glycyrrhiza glabra, Pteridium aquilinum, Zostera noltei и Z. marina (аборигенные виды), Solidago сanadensis и Silphium perfoliatum (родина Северная Америка). Краткая информация о сообществах и местах их расположения приведена в табл. 1. Номенклатура сосудистых растений дана по [11], макроводорослей – по [12].
Таблица 1.
Характеристика участков растительных сообществ
| Доминанты (константные виды) | Месторасположение (высота над ур. м., координаты) | SHD/SLD/Q | |
|---|---|---|---|
| 4 м2 | 100 м2 | ||
| Pteridium aquilinum (Astrantia maxima, Betonica macrantha, Brachypodium pinnatum, Galega orientalis, Ranunculus caucasicus) | Поляна на хр. Азиш-Тау, бас. р. Белая, Краснодарский край (1340 м, 44°09′14″ с.ш., 40°04′33″ в.д.) | 21.6/33.5/0.64 | 74/80/0.93 |
| Silphium perfoliatum (Poa angustifolia, Brachypodium pinnatum, Elymus repens, Cruciata laevipes, Pentanema aspera) | Старая залежь на террасе р. Белая в окрестностях пос. Каменномостский, Республика Адыгея (370 м, 44°21′19″ с.ш., 40°11′58″ в.д.) | 11.6/16.3/0.71 | 49/53/0.93 |
| Calamagrostis epigejos (Poa angustifolia, Agrimonia eupatoria, Holcus lanatus, Agrostis gigantea, Convolvulus arvensis) | Старая залежь на террасе р. Белая в окрестностях пос. Каменномостский, Республика Адыгея (279 м, 44°31′05″ с.ш., 40°08′29″ в.д.) | 12.8/24.6/0.54 | 50/63/0.79 |
| Solidago сanadensis (Elymus repens, Poa angustifolia, Rubus caesius, Potentilla reptans, Cruciata laevipes) | Пустырь в окрестностях г. Майкопа, бас. р. Белая, Республика Адыгея (201 м, 44°38′11″ с.ш., 40°04′22″ в.д.) | 12.7/18.3/0.69 | 54/60/0.90 |
| Glycyrrhiza glabra (Thinopyrum elongatum, Elymus repens, Poa angustifolia, Ambrosia artemisiifolia, Galium humifusum) | Пустырь в окрестностях хут. Прорвенский, Краснодарский край, Приазово-Кубанская низменность (0 м, 45°32′38″ с.ш., 37°42′22″ в.д.) | 7.3/11.2/0.69 | 22/27/0.81 |
| Zostera noltei и Z. marina (Chara baltica, Chaetomorpha linum, Pneophyllum fragile, Vertebrata reptabunda) | Мелководье Таманского залива Азовского моря около пос. Сенной, Краснодарский край (глубина 0.7–0.8 м, 45°16′48″ с.ш., 36°58′33″ в.д.) | 3.4/5.3/0.64 | 12/13/0.92 |
Сбор фактического материала был выполнен в летний полевой сезон 2022 г. В пределах каждого участка наземной растительности, выбранного нами в качестве объекта исследования, мы по возможности максимально равномерно заложили и описали по 50 пробных площадок размером 2 × 2 м. Из них 25 площадок (их общая площадь 100 м2) были заложены на участках с относительно низким проективным покрытием доминирующего вида (20–50%) и 25 – с высоким (75–99%). Заложить существенно большее число пробных площадок оказалось затруднительно из-за отсутствия на местности достаточных по размеру пространственно однородных участков растительного покрова с доминированием определенного вида.
Для каждой группы описаний отдельно с LD и HD путем последовательного их объединения мы построили по десять рядов накопления видов (число видов в одном описании – на 4 м2, в двух – на 8 м2, … в 25 – на 100 м2). Порядок объединения описаний для каждого из 10 вариантов определяли на основе генератора случайных чисел. Для каждого выборочного усилия (суммарной площади пробных площадок – А) рассчитали среднее число видов (формирование рядов накопления видового богатства выполнено по [13, 14]). В итоге определили отношение значений этой характеристики для групп описаний сообществ с HD (SHD) к ее значениям для таких же по объему групп описаний сообществ с LD (SLD). Аналогичная работа была выполнена на участке макрофитобентоса с разным суммарным проективным покрытием Z. noltei и Z. marina: были отобраны и обработаны пробы с 30 площадок размером 0.5 × 0.5 м на участках с относительно высоким общим покрытием этих видов и с 30 площадок такого же размера – с относительно низким; построены по 10 рядов накопления видов; оценены значения соотношения SHD/SLD (Q). Максимальное выборочное усилие было определено опытным путем.
Так как соотношение SHD/SLD (Q) имеет предел роста (Qmax), его зависимость от выборочного усилия (А) была аппроксимирована логистической функцией:
Параметры данного уравнения (N, C, a, b) определяли методом общего понижающего градиента (ОПГ) в среде Excel 2013. Их значения, которые приводятся в табл. 2, позволяют определить характеристики, существенные для решения поставленной задачи, в частности
Таблица 2.
Значения параметров модели (1), описывающей соотношение между Q (SHD/SLD) и площадью участков сообществ (А) с доминированием определенных видов
| Доминанты | Параметры уравнения (1) | ||||||
|---|---|---|---|---|---|---|---|
| a | b | C | N | R2 | Qmax | AE | |
| Pteridium aquilinum | –1.23 | –0.03 | –5.20 | 6.12 | 0.98 | 0.91 | 48.5 |
| Silphium perfoliatum | –1.27 | –0.01 | –4.96 | 5.91 | 0.97 | 0.95 | 127.2 |
| Clamagrostis epigejos | –1.30 | –0.02 | –5.15 | 5.94 | 0.99 | 0.80 | 100.1 |
| Solidago canadensis | –0.34 | –0.01 | 0.00 | 1.00 | 0.95 | 1.00 | 237.4 |
| Glycyrrhiza glabra | 1.30 | –0.03 | 0.59 | 0.22 | 0.96 | 0.81 | 105.2 |
| Zostera noltei и Z. marina | –1.82 | –0.29 | –23.13 | 24.04 | 0.93 | 0.92 | 5.6 |
Примечание: Q (SHD/SLD) – соотношение между числом видов на участках сообществ с равной площадью, но при этом с низким (SLD) и высоким (SHD) покрытием доминирующего вида; a, b, C и N – константы; Qmax = C + N – прогнозируемое максимально высокое значение Q; AE – ожидаемая площадь (м2), для которой рассматриваемое соотношение (Q) будет отличаться от его предельного значения (Qmax) не более чем на 1%.
Кроме того, характер зависимости Q(A), установленный на основе фактических данных, позволяет оценить (прогнозировать) ожидаемую площадь (AE), для которой рассматриваемое отношение (Q) будет отличаться от его предельного значения (Qmax) не более чем на 1%.
Характер изменения фактического соотношения SHD/SLD (Q) на градиенте суммарной площади участков (A) показан на рис. 1 и в табл. 1. Видно, что для отдельных пробных площадок, заложенных в наземных сообществах (участков сообществ площадью 4 м2), значения Q варьируют в пределах 0.54–0.71; для групп площадок с общей площадью 100 м2 – 0.79–0.93. В частности, для участков сообществ с доминированием Calamagrostis epigejos и Glycyrrhiza glabra – 0.54 и 0.61 (4 м2), а также 0.79 и 0.81 (100 м2); с доминированием Solidago сanadensis, Silphium perfoliatum и Pteridium aquilinum – 0.64–0.71 и 0.90–0.93. Таким образом, наши данные подтверждают предположение, что различие в видовом богатстве участков сообществ с LD и HD сокращается по мере увеличения их размеров [5–7]. Причем в 3 из 5 случаев участки наземных сообществ площадью 100 м2 с LD и HD характеризуются близким видовым богатством, по крайней мере число видов в них различается не более чем на 10% (см. табл. 1 и рис. 1). На участке макрофитобентоса с доминированием Z. noltei и Z. marina фактические значения SHD/SLD составили в среднем 0.64 для 0.25 м2 и 0.92 для 7.5 м2.
Рис. 1.
Соотношение между Q (SHD/SLD) и площадью участков сообществ с доминированием определенных видов.
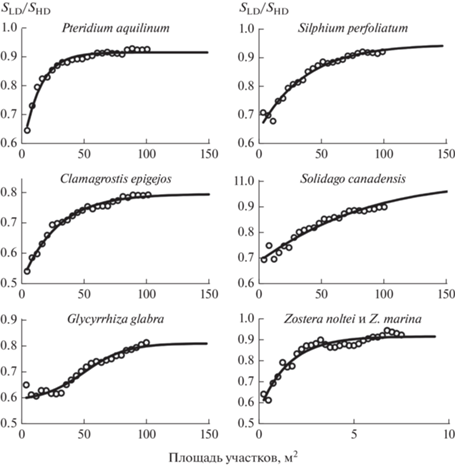
Из рис. 1 и табл. 2 видно, что регрессионные модели логистического типа объясняют долю дисперсии соотношения SHD/SLD (Q) на 93–99% (в среднем на 96%), соответственно могут быть использованы для прогноза на основе экстраполяции наиболее вероятных предельных значений этой характеристики (Qmax), а также площади участков растительных сообществ (AE), на которой они могут быть достигнуты. Из табл. 1 и 2 видно, что для большинства участков наземных сообществ (кроме участка с доминированием Solidago сanadensis) расчетные значения Qmax близки к фактическим значениям Q для площади 100 м2. Это касается и сообществ с доминированием Calamagrostis epigejos и Glycyrrhiza glabra, хотя расчетные значения Qmax для их участков, как и фактические для площади 100 м2, ниже, чем для участков сообществ с доминированием других видов. Применительно к участку сообщества с доминированием Glycyrrhiza glabra такой результат не является неожиданным, поскольку ранее нами были обнаружены признаки избирательного вытеснения этим доминантом других видов [8, 10]. В сообществах макрофитобентоса с доминированием Z. noltei и Z. marina расчетные значения Qmax оказались равными 0.92, т.е., как и на большинстве наземных участков сообществ, близкими к максимальным фактическим значениям Q. При этом AE составляет 5.5 м2 (см. табл. 1 и 2).
Таким образом, наши результаты показывают, что при значительном росте проективного покрытия доминирующих видов участки наземных травяных сообществ суммарной площадью 100 м2 и макрофитобентоса площадью 5–6 м2 позволяют во многих случаях сохранить более 90% их видового богатства. При этом характер зависимости Q(A), установленный на основе фактических данных, позволяет прогнозировать, что более крупные по размеру участки сообществ не являются более эффективными в этом отношении. Применительно к наземным сообществам наши выводы в целом согласуются с результатами, полученными ранее для растительных сообществ средиземноморского типа [6]. Чтобы оценить их правомерность для сообществ других типов местообитаний, необходимы дальнейшие исследования.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (грант № 20-04-00364).
Список литературы
Hillebrand H., Bennett D.M., Cadotte M.W. Consequences of dominance: a review of evenness effects on local and regional ecosystem processes // Ecology. 2008. V. 89. № 6. P. 1510–1520.https://doi.org/10.1890/07-1053.1
Czarniecka‑Wiera M., Kącki Z., Chytry M., Palpurina S. Diversity loss in grasslands due to the increasing dominance of alien and native competitive herbs // Biodiversity and Conservation. 2019. V. 28. P. 2781–2796.https://doi.org/10.1007/s10531-019-01794-9
Rejmánek M., Richardson D.M., Pyšek P. Plant invasions and invasibility of plant communities // Vegetation Ecology, Second Edition. Eddy van der Maarel and Janet Franklin. Chichester, United Kingdom: Wiley & Sons, Ltd., 2013. P. 387‒424.
Vila M., Ibanez I. Plant invasions in the landscape // Landsc. Ecol. 2011. V. 26. P. 461–472. https ://doi.org/ 0-011-9585-3https://doi.org/10.1007/s1098
Gaertner M., Breeyen A.D., Hui C., Richardson D.M. Impacts of alien plant invasions on species richness in Mediterranean-type ecosystems: A meta-analysis // Progress in Physical Geography. 2009. V. 33. P. 319–338. https://doi.org/10.1177/0309133309341607
Powell K.I., Chase J.M., Knight T.M. A synthesis of plant invasion effects on biodiversity across spatial scales // Amer. J. Bot. 2011. V. 98. № 3. P. 539–548. https://doi.org/10.3732/ajb.1000402
Powell K.I., Chase J.M., Knight T.M. Invasive plants have scale-dependent effects on diversity by altering species-area relationships // Science. 2013. V. 339. P. 316–318. https://doi.org/10.1126/science.1226817
Akatov V.V., Akatova T.V., Afanasyev D.F. et al. Result of impact of dominants on species richness of plant communities: ordered or random species loss? // Russ. J. of Ecology. 2021. V. 52. № 4. P. 257–266. https://doi.org/10.1134/S1067413621040032
Stohlgren T.J., Rejmánek M. No universal scale-dependent impacts of invasive species on native plant species richness // Biol. Lett. 2014. V. 10: 20130939. https://doi.org/10.1098/rsbl.2013.0939
Акатов В.В., Акатова Т.В., Афанасьев Д.Ф. и др. Воздействие доминантов на видовое богатство растительных сообществ в контексте энергетической гипотезы // Журн. общ. биол. 2022. Т. 83. № 5. С. 336–345. https://doi.org/10.31857/S0044459622040030
Plants of the World Online. https://powo.science.kew.org.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication. Galway: National University of Ireland, 2020. https://www.algaebase.org.
Magurran A.E. Measuring biological diversity. Oxford: Blackwell Publishing, 2004. 256 p.
Гелашвили Д.Б., Иудин Д.И., Розенберг Г.С., Якимов В.Н. Степенной характер накопления видового богатства как проявление фрактальной структуры биоценоза // Журн. общ. биол. 2007. Т. 68. № 3. С. 170–179.
Дополнительные материалы отсутствуют.


