Электрохимия, 2019, T. 55, № 1, стр. 60-69
Квантово-химическое изучение адсорбции ионов Pb2+ на Au(111)Н. А. Рогожников
a Институт химии твердого тела и механохимии СО РАН
630128 Новосибирск, ул. Кутателадзе, 18, Россия
b Новосибирский государственный технический университет
630073 Новосибирск, просп. К. Маркса, 20, Россия
* E-mail: rogna@mail.ru
Поступила в редакцию 14.08.2017
После доработки 14.08.2017
Принята к публикации 10.04.2018
Аннотация
На основе кластерной модели поверхности металла методом функционала плотности исследовано взаимодействие иона Pb2+ с золотом. Оценены геометрические и энергетические характеристики взаимодействия этого иона с поверхностью золота. Ион Pb2+ существует на поверхности скорее в ад-ионной, чем в ад-атомной форме. Проанализировано электронное строение системы Au–${\text{Pb}}_{{{\text{ads}}}}^{{2 + }}.$ Оценено участие адсорбированного иона свинца и ближайших к нему атомов золота в формировании молекулярных орбиталей системы. Установлено, что вклад в их образование обеспечивают преимущественно s-орбитали свинца и d-орбитали золота. Взаимодействие с растворителем уменьшает перенос заряда с адсорбированного иона свинца на золото. Показано, что способность иона свинца гидролизоваться уменьшается при его переходе из фазы электролита на поверхность.
ВВЕДЕНИЕ
Взаимодействие катионов металлов с инородной металлической подложкой, начинающееся при потенциалах более анодных, чем соответствующий равновесный потенциал осаждаемого металла, получившее название “underpotential deposition (UPD)” или “осаждение при недонапряжении”, известно уже более полувека [1]. При этом имеет место субмонослойное заполнение поверхности осаждаемым металлом [2–4]. Адсорбция чужеродных металлов приводит к значительному изменению адсорбционных и каталитических свойств субстрата [5–7].
Одной из систем, для которой известен такой каталитический эффект, является поверхность золотого электрода, на которой предварительно адсорбирован свинец [8–14]. Исследования, выполненные традиционными электрохимическими методами для системы золото/раствор, содержащий ионы Pb2+, продемонстрировали сложную форму циклических вольтамперограмм и их зависимость от кристаллографической ориентации субстрата [4, 15, 16]. В [17] предполагается, что свинец существует на поверхности в двух состояниях при сильном взаимодействии Pb с подложкой. В [18], напротив, предполагается относительно слабое взаимодействие между свинцом и золотом. В [19] говорится о двух состояниях свинца – в субмонослое и в полностью заполненном слое с сильным взаимодействием адсорбат–адсорбат. Согласно [20], при менее отрицательных потенциалах на поверхности образуется субмонослой свинца с эффективным атомным зарядом значительно меньше, чем +2, который при более отрицательных потенциалах переходит в монослой нейтральных атомов. По данным [15] адсорбированные в области недонапряжения ионы свинца разряжаются полностью. Выполненный на основе измерений тока [21] анализ взаимодействия ионов свинца с поверхностью золота также предполагает почти полный перенос заряда с ионов свинца на золото для всего интервала потенциалов, что, по мнению авторов, ставит вопрос об обоснованности разделения механизма осаждения на фарадеевский и нефарадеевский. В [22] на основе модельных расчетов адсорбированным на золоте ионам свинца приписывается эффективный заряд 1.5.
Теоретический анализ адсорбции свинца на золоте проведен только для атомарного свинца. В [23] расширенным методом Хюккеля (EHT) выполнены вычисления адсорбции атомов Pb в трехкоординационном и однокоординационном положениях на поверхности, давшие близкие значения энергий адсорбции около –25 кДж/моль. Эффективные атомные заряды свинца имели величины 0.61 для первого положения и 1.14 для второго при расстояниях между атомом свинца и поверхностью 0.322 и 0.350 нм и длинах связи золото–свинец RAu–Pb 0.363 и 0.350 нм. Исследование димеров Au–Pb при использовании методики функционала плотности [24] дало более высокую энергию связи – около –200 кДж/моль при RAu–Pb = = 0.264 нм и эффективном атомном заряде свинца 0.18. Исследование адсорбции атомарного свинца на кластере Au(111) из 94–120 атомов с применением аналогичного метода [25] показало, что наиболее устойчивой является координация свинца 2 и 3 с величиной энергии адсорбции около –230 кДж/моль для обоих положений и расстоянием между атомом свинца и поверхностью 0.229–0.235 нм. В [26] вычисленная энергия взаимодействия атома свинца с кластером из 16–19 атомов золота составляла около –200 кДж/моль. Исследования подобного рода, касающиеся взаимодействия катионной формы свинца с золотом, в литературе отсутствуют.
Цель данной работы – методами квантовой химии проанализировать взаимодействие ионов Pb2+ с незаряженной поверхностью золота для изучения свойств системы Au/Pb2+ на микроскопическом уровне.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Квантово-химические вычисления проводились с помощью программного пакета GAMESS-US [27]. Расчеты выполнялись на основе метода функционала плотности [28] с использованием гибридного B3LYP функционала [29, 30], который довольно широко используется для вычисления в молекулярных системах, включающих в себя атомы переходных элементов. Для атомов Au и Pb вычисления проводились с использованием псевдопотенциала LANL2DZ и соответствующего ему расщепленного базисного набора для внешних и предвнешних электронных оболочек [31]. Атомы кислорода и водорода описывались с помощью расширенного базисного набора 6‑311+G(d, p) [32, 33], который включал в себя диффузные и поляризационные функции. GAMESS-US включает в себя анализы заселенностей по Малликену и по Левдину, как требующие небольших вычислительных ресурсов. Поскольку малликеновский анализ имеет больше всего недостатков [34], эффективные атомные заряды на адсорбированных ионах определялись на основе анализа заселенностей по Левдину [35].
Применение использованного расчетного уровня для оценки потенциалов ионизации атомов свинца и золота и сродства к электрону атома золота дало значения этих параметров 680, 908 и 209 кДж/моль. Полученные значения близки к аналогичным экспериментальным данным 716, 890 и 223 кДж/моль [36].
Для вычисления взаимодействия ионов свинца с поверхностью металла фрагмент последней моделировался кластером. В качестве объекта исследования была выбрана грань золота (111). Эта грань менее склонна к изменениям вследствие ее большей термодинамической стабильности [37]. Исследования проводились на двухслойном 18‑атомным кластере, содержащем 12 атомов в первом и 6 атомов во втором поверхностных слоях. На рис. 1 показан вид сверху на точки локализации адсорбированного иона для однокординационного взаимодействия иона с кластером (1), двухкоординационной адсорбции (2) и трехкоординационных положений (3 ') и (3 ''). Два последних положения отличаются расположением адсорбированного иона относительно атомов второго слоя кластера. Адсорбированная частица находится либо над атомом второго слоя (3 '), либо над точкой между тремя атомами этого слоя (3 '').
Рис. 1.
Модель фрагмента грани (111) металла в виде 18-атомного кластера. Атомы второго слоя показаны более темным цветом. Точками показана локализация адсорбированного иона в вершинном однокоординационном положении (1), в мостиковом двухкоординационном положении (2) и трехкоординационном положении (3 ') и (3 '').

Положение атомов металла в кластере было принято фиксированным и соответствующим их положению в объеме металла. Межатомное расстояние для золота было принято равным экспериментальной величине 0.288 нм, соответствующей кристаллам этого металла [38]. Координаты атомов свинца в процессе вычислений варьировались.
Для расчетов, в которых рассматривалось влияние растворителя на поверхностные процессы, учет взаимодействия частиц с растворителем проводился на основе модели поляризуемого континуума C-PCM [39–41], в которой диэлектрическая полость в растворителе формируется в соответствии с молекулярной поверхностью находящейся в растворителе частицы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Взаимодействие ионов свинца с поверхностью кластера
Энергия газофазной адсорбции ионов Pb2+ ΔEads на незаряженной поверхности, характеризующая свойства связи металл–ион свинца вычислялись как
(1)
$\Delta {{E}_{{{\text{ads}}}}} = {{E}_{{{\text{M}}{{{\text{e}}}_{{{\text{18}}}}} - {\text{P}}{{{\text{b}}}^{{2 + }}}}}} - {{E}_{{{\text{M}}{{{\text{e}}}_{{{\text{18}}}}}}}} - {{E}_{{{\text{P}}{{{\text{b}}}^{{2 + }}}}}},$Результаты вычислений энергии взаимодействия ионов Pb2+ с кластером золота для четырех положений приведены в табл. 1. В ней представлены также геометрические и зарядовые параметры, соответствующие газофазной адсорбции ионов свинца на золоте.
Как следует из табл. 1, катион свинца образует очень прочную связь с золотом (энергия ‒722…‒773 кДж/моль). Полученные величины энергий показывают, что наиболее выгодным местом адсорбции катиона Pb2+ на кластере является трехцентровое положение (3 ''), наименее же выгодным местом адсорбции – вершинное положение (1). При этом разница энергий взаимодействия для мест с координацией иона свинца от 3 до 2 очень невелика – около 10 кДж/моль. Энергетическое преимущество этих мест над однокоординационным местом (1) более значительно (около 50 кДж/моль).
Из литературных данных, например [44–47], известно, что модельно вычисляемые параметры демонстрируют зависимость от количества атомов в кластере. При этом наиболее чувствительной величиной оказывается энергия адсорбции, в ряде случаев флуктуирующая с количеством атомов металла. Для того, чтобы оценить, как влияет размер кластера на модельную энергию адсорбции, были проведены вычисления энергии взаимодействия иона Pb2+ в наиболее энергетически выгодном положении (3 '') с более крупным кластером золота из 30 атомов. Верхний слой такого кластера содержал 18 томов Au, нижний – 12. Вычисленная энергия адсорбции на таком кластере несколько возрастала – до –840 кДж/моль. Приводимые в литературе изменения модельной энергии адсорбции для серий из большого количества кластеров в основном демонстрируют осцилляцию энергии при вариации размеров и формы кластеров [44–47]. Вариация величины модельной энергии при изменении размеров и формы кластеров указывает на то, что значения энергии адсорбции, полученные при использовании кластерных моделей, вряд ли следует рассматривать, как абсолютные данные. Более целесообразно использовать эти величины для сравнительного анализа.
При адсорбции ионов свинца происходит значительный перенос заряда на поверхность золота – около 1. Величина перенесенного заряда δQPb изменяется в зависимости от места локализации свинца на поверхности и увеличивается с ростом энергии взаимодействия ион–золото. Следовательно, при адсорбции ионов Pb2+ на золоте перенос электронов на металл далек от полного, что предполагается в [15, 21].
Межатомная длина связи золото–свинец RMe–Pb растет при увеличении координации иона свинца на поверхности. Расстояние между ионом свинца и поверхностью z при этом, напротив, уменьшается. Найденные геометрические величины RMe–Pb и z оказались несколько большими, чем при адсорбции атомарного свинца на золоте из [25, 26]. Последний факт можно связать с тем, что межъядерное отталкивание в системе при адсорбции катионов в меньшей степени компенсируется взаимодействием между ядрами и электронами по сравнению с вариантом адсорбции атомарного свинца и катиону Pb2+ энергетически более выгодно немного отодвинуться от поверхности золота.
Для сравнения был проведен анализ взаимодействия атомарного свинца с золотом в наиболее устойчивом положении 3''. Вычисленная энергия такой связи составляет –254 кДж/моль. По своей величине она занимает промежуточное положение между вычисленной в [25, 26] модельной энергией (–200…–230 кДж/моль) и экспериментальной теплотой адсорбции свинца на золоте [48] (–295 кДж/моль), но значительно уступает энергии адсорбции иона Pb2+ (см. табл. 1). Эффективный атомный заряд адсорбированного атома свинца составляет 0.80. Смещение электронной плотности со свинца на золото и эффективный положительный заряд адсорбированного атома свинца представляются вполне естественными, поскольку разность электроотрицательностей свинца и золота составляет 0.6, а первый потенциал ионизации свинца заметно превосходит работу выхода электрона золота [36], и сопоставима с такой разницей, например, для сульфидов многих переходных металлов. Эффективный заряд свинца заметно выше, чем в димере Au–Pb [24], поскольку свинец взаимодействует не с одним, а с несколькими атомами золота, которое обладает наибольшей электроотрицательностью среди металлов [36]. Геометрические величины RMe–Pb и z несколько меньше, чем при адсорбции Pb2+.
Таблица 1.
Энергии адсорбции иона и атома свинца (ΔEads), геометрические параметры (RAu–Pb – расстояние свинец – ближайший поверхностный атом золота, z – расстояние по нормали от поверхности до адсорбата) и эффективные заряды свинца по Левдину (QPb) для четырех мест адсорбции. В скобках приведены значения энергий адсорбции и эффективных атомных зарядов иона свинца, вычисленные с учетом влияния растворителя
| Место адсорбции | ΔEads, кДж/моль | z, нм | RAu–Pb, нм | QPb |
|---|---|---|---|---|
| 1 (Pb2+) | –722 (–44) | 0.268 | 0.268 | 1.01 (1.59) |
| 2 (Pb2+) | –765 (–49) | 0.247 | 0.286 | 0.94 (1.46) |
| 3' (Pb2+) | –762 (–51) | 0.242 | 0.293 | 0.95 (1.45) |
| 3'' (Pb2+) | –773 (–54) | 0.243 | 0.294 | 0.92 (1.42) |
| 3'' (Pb0) | –254 | 0.234 | 0.287 | 0.80 (1.00) |
Сравнение геометрических и зарядовых параметров для иона и атома свинца позволяет предположить, что различие между ними в адсорбированном состоянии не так уж велико. О близости аналогичных параметров при адсорбции заряженных и нейтральных частиц одинакового состава сообщается, например, в [49–53], на основании чего заключается, что для адсорбированного состояния не имеет большого значения природа исходного состояния.
Для анализа электронного строения системы Pb2+/Au(111) и для более детального сопоставления свойств ионного и атомарного свинца в адсорбированном состоянии были рассмотрены спектры плотности состояний для обеих систем. Понятие плотности состояний D(E) используется для анализа распределения молекулярных орбиталей по энергетическим уровням при их большом количестве и определяется как количество таких уровней N, находящихся в интервале энергий между E и E + dE: D(E) = dN/dE [54]. График D(E) строился на основе данных, полученных в результате обработки результатов вычислений с помощью программы GaussSum [55] для поверхности золота с адсорбированным ионом в положении (3'') и атомом свинца, для которого это положение является также оптимальным. При построении D(E)-графиков обычно представляют область энергий относящуюся только к заполненной области перекрывания атомных орбиталей. Орбитали с более низкими значениями энергии, относящиеся к внутренним орбиталям элементов и не участвующие в образовании связей, традиционно в спектре плотности состояний не демонстрируются. При сравнении D(E),E-зависимостей для различающихся по природе адсорбата или адсорбента систем нередко вместо оси E используется разность между данной энергией E и энергией высшей занятой молекулярной орбитали (ВЗМО) или энергией Ферми [56] EВЗМО. Однако две системы, рассматриваемые в данной части сообщения, отличаются в первую очередь величиной заряда. Последнее, как продемонстрировано, например, в [52], сказывается на положении D(E)-графика относительно оси E. По этой причине для сопоставления профилей спектров плотности состояний для адсорбированного иона и атома свинца при выборе горизонтальной оси следует коснуться некоторых вопросов.
Различие между свободным атомом свинца и его двухзарядным ионом состоит в том, что, во-первых, две ВЗМО атома Pb, занимаемые двумя неспаренными p-электронами, после их удаления приобретают смысл низших свободных молекулярных орбиталей (НСМО) для иона свинца. Во-вторых, потеря двух электронов приводит к тому, что заряд электронов не компенсирует заряд ядра, притяжение электронов к ядру усиливается и электронные орбитали иона свинца находятся на более низких уровнях относительно соответствующих орбиталей атома свинца (в данном случае энергия ВЗМО атома, которая после удаления электронов становится НСМО иона, понижается на 12.3 эВ). При адсорбции атома свинца на золоте система, в которой все электроны спарены, оказывается на 17 кДж/моль устойчивее системы в триплетном состоянии. При адсорбции иона свинца синглетное состояние так же более устойчиво. Избыточный заряд при этом не сосредоточен полностью на свинце, а (хотя и неравномерно) распределен по всей системе. При этом эффективные атомные заряды адсорбированных ионного и атомарного свинца, как видно из табл. 1, довольно близки. Вероятно эти эффекты приводят к тому, что разница энергий между ВЗМО адсорбированного Pb и НСМО адсорбированного Pb2+ уменьшается до 6.3 эВ. Тем не менее разница между энергиями этих орбиталей остается значительной, хотя и не такой большой, как у свободных частиц. Поэтому при сравнении D(E)-зависимостей двух систем использование в качестве горизонтальной оси значения E – EВЗМО для адсорбированного атома и E – EНСМО для адсорбированного иона навряд ли будет оптимальным решением.
Для сравнения спектров плотности состояний при адсорбции иона и атома свинца на золоте был применен следующий прием. Для золота с адсорбированным ионом свинца, поскольку эта система является основным объектом исследования, D(E)-зависимость строилась без каких-либо трансформаций при использовании в качестве горизонтальной оси значений Е. Для системы с адсорбированным атомом свинца, поскольку эта система используется только для сравнения, с целью сопоставления хода этих двух D(E)-кривых горизонтальная ось была смещена. Смещение производилось вдоль горизонтальной оси до максимального сближения D(E)-зависимости для адсорбированного атома с аналогичной кривой для адсорбированного иона в области средних энергий, в которой располагается большинство орбиталей. Наилучшее сближение кривых имело место при сдвиге D(E)-кривой для адсорбированного атома на 5.286 эВ в отрицательном направлении. Посредством такого приема удалось сблизить D(E)-зависимости для обеих систем в области от –17 до –11 эВ – в некоторых областях энергий кривые практически дублировали свой ход. Результат такого преобразования представлен на рис. 2а, на котором кривая 1 соответствует варианту с адсорбированным ионом, а кривая 2 – с адсорбированным атомом. За пределами области сближения кривые расходятся, причем одновременного совпадения пиков в области энергий –20.5, –12.6 и –11.4 эВ никаким смещением кривой 2 вдоль оси Е получить не удается. Появление третьего пика на кривой 2 при Е > –11 эВ связано с тем, что при адсорбции атома в системе на два электрона больше и они располагаются именно на этой орбитали. Однако и в области –17…–11 эВ идеального совпадения не наблюдается. В частности в области около –17 эВ потеря свинцом двух электронов приводит к значительному слиянию двух пиков. В области ‒16…–15 эВ ход кривых довольно заметно различается. В районе –14.7 эВ четкий пик для адсорбированного атома заменяется минимумом для адсорбированного иона. В области энергий от –14.5 до –13.5 эВ замена адсорбированного атома на ион приводит к уширению раздвоенного пика, его превращению в тройной и понижению его высоты примерно на 13%. Хотя кривые 1 и 2 на рис. 2а демонстрируют значительное подобие, назвать такое сходство абсолютно полным вряд ли возможно. Поэтому, если исходить из анализа спектров плотности состояний, природа начального состояния адсорбата все же в какой-то степени может проявиться и в свойствах адсорбированного состояния.
Рис. 2.
а – Полный спектр плотности состояний при адсорбции свинца на золоте. б – Локальная плотность состояний для трех атомов золота, связанных со свинцом. в – Локальная плотность состояний для адсорбированного свинца. Линия 1 соответствует адсорбированному иону, линия 2 – адсорбированному атому. Кривая 2 смещена на 5.286 эВ в отрицательном направлении.
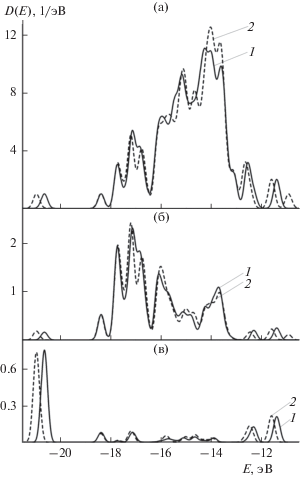
Для оценки вклада атома или группы атомов в полную плотность состояний используется локальная плотность состояний. На рис. 2б показана локальная плотность состояний для трех ближайших к атому или иону свинца атомов золота, т.е. атомов Au непосредственно связанных со свинцом. На рис. 2в показана локальная плотность состояний для адсорбированного атома и иона свинца. Атомы золота, непосредственно связанные со свинцом, проявляют заметное различие во взаимодействии с атомарным и ионным свинцом, что следует из хода кривых 1 и 2. Вклад этих трех атомов золота наиболее значителен в области более отрицательных энергий. Их вклад в полный спектр плотности состояний в области от –18.0 до –16.4 эВ (в значениях координат рис. 2) составляет около 50%. Из сравнения рис. 2а и 2б следует, что в области энергий положительнее ‒16 эВ электронное строение системы определяется в основном остальными атомами золота и они, как и непосредственно связанные со свинцом атомы золота, оказываются чувствительными к заряду системы. Различие между адсорбированным ионным и ионным свинцом (рис. 2в) проявляется в основном в сдвиге относительно оси энергий для наиболее и наименее отрицательных величин. В средней области вклад свинца невелик и кривые 1 и 2 довольно схожи. Примечательной деталью является то, что в области энергий отрицательнее –20 эВ пик полного спектра плотности состояний на 75% обусловлен свинцом как атомарным, так и ионным. Значителен вклад свинца в спектр плотности состояний и в области двух пиков на D(E)-зависимости при Е > –13 эВ. В этой области он составляет 11–13% для обеих форм адсорбированного свинца. В промежуточной области между –20 и 13 эВ доля свинца относительно невелика и не превышает 8%. Как видно из рис. 2в количество пиков для ионного и атомарного свинца одинаково. На рис. 2а и 2б в области наименее отрицательных энергий для адсорбированного атома свинца на один пик больше. Это означает, что при адсорбции атома свинца ВЗМО системы образована исключительно атомами золота.
Рис. 3 демонстрирует вклад s-, p- и d-орбиталей непосредственно связанных со свинцом трех атомов золота (рис. 3а) и s- и p-орбиталей адсорбированного иона свинца (рис. 3б) в общую плотность состояний. Орбиталь при E = –20.62 эВ на 75% сформирована s-орбиталью свинца при 16%‑ном участии s-орбиталей и небольшом вкладе d-орбиталей трех атомов золота. При образовании орбитали при E = –18.37 эВ связанные со свинцом атомы золота предоставляют d- и s-орбитали (22 и 19%). Участие их p-орбиталей менее значительно – 11%. Доля свинца сведена до 9% за счет s-орбиталей. Участие остальных атомов золота при этом довольно значительно (39%).
Рис. 3.
Адсорбция Pb2+ на золоте. а – Вклад в плотность состояний d-орбиталей (1), s-орбиталей (2) и p‑орбиталей (3) трех ближайших к свинцу атомов золота. б – Вклад в плотность состояний s-орбиталей (4) и p-орбиталей (5) иона свинца. в – Заселенность перекрывания кристаллических орбиталей COOP для адсорбированного иона свинца и связанных с ним атомов золота.
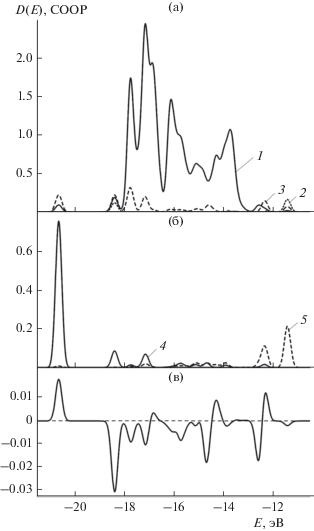
В формировании основной области молекулярных орбиталей между –17.8 и –13.1 эВ со стороны связанного со свинцом золота участвуют в основном его d-орбитали, доля которых наиболее значительна при E < –16.0 эВ (в ряде случаев 50% и более). Вклад s-орбиталей трех атомов золота существенно меньше. p-орбитали золота во всей этой области практически не участвуют в формировании электронной структуры. Со стороны свинца наблюдается участие s-орбиталей, которое наиболее значительно при E = –17.1 эВ (7%). Далее оно уменьшается с колебаниями между 3 и 0%. Вклад p-орбиталей свинца в этой области энергий весьма мал и не превышает 2%. В группе орбителей, предшествующих ВЗМО (между –14 и –13 эВ), вклад d- и s-орбиталей рассматриваемой части золота не превышает 8%. Свинец участвует в основном благодаря своим p-орбиталям – 9%. ВЗМО формируется в основном остальными атомами золота (77%). Участие иона свинца и связанных с ним атомов золота в формировании ВЗМО обеспечивается p-орбиталями свинца (11%), а также s- и p-орбиталями золота (4 и 8% соответственно). Доля d-орбиталей, напротив, очень незначительна.
Дополнительную информацию о связи между атомами можно получить из анализа малликеновской заселенности связи между ними, получившей название “заселенность перекрывания кристаллических орбиталей” и обозначаемую как “COOP” (от англ. crystal orbital overlap population). Положительные значения COOP соответствуют связывающему характеру орбиталей, отрицательные – разрыхляющему. Зависимость COOP для взаимодействия между адсорбированным ионом свинца и ближайшими тремя атомами золота от энергии Е показана на рис. 3в. Как следует из него, орбиталь при Е = –20.6 эВ, образованная практически полностью свинцом и тремя атомами золота является связывающей. Орбиталь при Е = –18.4 эВ, вклад этих атомов в формирование которой понижается до 61% по отношению к ним является разрыхляющей. В интервале между ‒17.7 и –12.4 эВ за небольшим исключением (около –16.8 и –14.3 эВ) орбитальное взаимодействие между ионом свинца и его ближайшими соседями носит разрыхляющий характер, причем в ряде случаев весьма значительный. В области ‒12.3 эВ это взаимодействие становится в значительной степени связывающим. Для ВЗМО взаимодействие свинца с его ближайшими соседями с небольшим преимуществом разрыхляющее.
Влияние растворителя на адсорбцию ионов свинца
Рассмотрение взаимодействия адсорбированных ионов Pb2+ со своим гидратным окружением было выполнено по модели поляризуемого континуума C-PCM [39–41]. Использование континуальной модели для отображения влияния растворителя на энергетику процессов, протекающих на поверхности, представляется достаточно оправданным. В качестве недостатка такой модели нередко называют пренебрежение образованием первичной сольватной оболочки. Но за исключением простейших континуальных моделей их более развитые варианты учитывают образование первичной оболочки посредством разбиения области растворителя на ближайшую к иону зону и более дальнюю зону, которые различаются величиной диэлектрической постоянной растворителя [39, 41, 57, 58]. Вклад формирования первичной оболочки в процесс сольватации учитывается посредством параметризации, основанной на сопоставлении с экспериментальными данными. Важность правильного подбора количественных характеристик для отдельных атомов при выполнении такой параметризации подчеркивается, например, в публикациях [39, 40], в которых излагается также и методология ее проведения. К числу достоинств континуальных моделей следует отнести учет взаимодействия с удаленными слоями растворителя. Эти слои могут оказать значительное влияние на первичную сольватную оболочку вплоть до перевода ее в разупорядоченное состояние [59]. Такое явление проявляется, например, в стоксовских радиусах, величины которых могут оказаться меньше соответствующих кристаллографических радиусов [60], или в положительных энергиях гидратации [61]. Если при описании гидратации одноатомных ионов молекулярная модель представляется дающей приемлемые результаты, то в случае сольватации многоатомных систем, когда заряд в большей или меньшей мере оказывается перераспределенным по системе большего объема, игнорирование вторичной сольватной оболочки может существенно исказить результат. Эти соображения представляются существенными при описании состояния адсорбированных ионов, даже многозарядных, когда заряд, после перехода иона на поверхность, принадлежит не только этому иону, а уже большому количеству атомов. Поэтому при описании электрохимической адсорбции на электродах влияние растворителя на процесс адсорбции необходимо учитывать в виде взаимодействия с растворителем как самого иона, так и металлического кластера.
При вычислениях по модели C-PCM использовалась параметризация на основе метода UAHF [39, 40]. Для атомов неметаллов параметры подбирались в соответствии с методикой, описание которой приведено в [39]. Вычисленные по методу UAHF энергии гидратации H2O и H3O+ составляли соответственно –27 и –441 кДж/моль и были близки к экспериментальным величинам –26 и –435 кДж/моль, которые приводятся в сводке из [39]. Для нейтральных атомов золота и свинца в вычислениях использовался ван-дер-ваальсов радиус по [62]. Что касается параметризации для ионов свинца, то в [39] подчеркивается, что, если в системе присутствуют заряженные атомы, то требуется коррекция радиусов соответствующих элементов, обусловленная величиной формального заряда. Поскольку в литературе отсутствуют сведения о параметрической поправке на заряд для ионов Pb2+, для расчетов по модели С-РСМ, был проведен поиск величины радиуса, дающего величину вычисленной энергии гидратации наиболее близкой к экспериментальному значению для иона свинца –1425 кДж/моль [61]. Наилучшее согласие между экспериментальной и расчетной энергиями имело место при использовании радиуса 0.162 нм. Данная величина использовалась далее в расчетах гидратационных эффектов по модели С-РСМ.
Процесс адсорбции иона из водного раствора сопровождается частичным разрушением его гидратной оболочки и вытеснением с поверхности молекул воды. Оба эти эффекта, особенно первый, требуют затрат энергии. В результате энергия адсорбции из раствора становится значительно меньше энергии адсорбции из газовой фазы. Вычисления энергии адсорбции из раствора проводились по уравнению (1), с тем отличием, что все три слагаемых этого уравнения вычислялись с использованием метода С-РСМ. Как это видно из табл. 1, энергия адсорбции понижается примерно на 720–680 кДж/моль. Кроме того, взаимодействие с растворителем сильно нивелирует энергию адсорбции на разных местах поверхности.
Вычисления также показали, что растворитель препятствует изменению заряда катиона при его переходе из раствора на поверхность. Результаты, представленные в таблице, говорят о том, что величина перенесенного на поверхность золота заряда в зависимости от места адсорбции уменьшается до 0.4…0.6, т.е. становится почти в два раза меньше, чем при адсорбции из газовой фазы. Можно полагать, что при электрохимической адсорбции ионов Pb2+ из водного раствора свинец существует на незаряженной поверхности скорее в ад-ионной, чем в ад-атомной форме.
Растворитель влияет также и на адсорбированный атомарный свинец. Эффективный заряд повышается от 0.80 до 1.00. Это означает, что если в контакт с электролитом вступает золото, на поверхность которого предварительно (например, напылением в вакууме) нанесен субмонослой свинца, то поляризация в поверхностном слое такой системе под воздействием растворителя увеличится.
Ион Pb2+, будучи катионом слабого основания, способен в результате гидролиза образовывать гидроксосоединения в водных растворах [63]. В разбавленных кислых и нейтральных растворах свинец преобладает в виде простых катионов Pb2+. Однако появление небольшой части свинца в виде катиона PbOH+ возможно даже в слабокислых растворах (доля этих ионов составляет около 20% при рН 7) [63]. Поэтому возникает вопрос о возможности реакции гидролиза адсорбированного на поверхности золота катиона свинца. Для оценки возможности такого явления были рассчитаны энергии взаимодействия с молекулами H2O катиона свинца в форме иона в фазе раствора и в форме адсорбированного в точке (3'') иона по реакциям (2) и (3). Энергетические эффекты (с учетом влияния растворителя по модели C-PCM) соответствующих реакций обозначены, как ΔЕh:
(2)
$\begin{gathered} {\text{P}}{{{\text{b}}}^{{2 + }}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{PbO}}{{{\text{H}}}^{{\text{ + }}}} + {{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{{\text{ + }}}}, \\ \Delta {{Е }_{{\text{h}}}} = {\text{ --}}13\,\,{\text{к Д ж /м о л ь ,}} \\ \end{gathered} $(3)
$\begin{gathered} {\text{A}}{{{\text{u}}}_{{{\text{18}}}}}{\text{--P}}{{{\text{b}}}^{{{\text{2 + }}}}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O }} \to {\text{ A}}{{{\text{u}}}_{{{\text{18}}}}}{\text{--PbO}}{{{\text{H}}}^{{\text{ + }}}} + {{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{{\text{ + }}}}{\text{,}} \\ \Delta {{Е }_{{\text{h}}}} = {\text{ }}7\,\,{\text{к Д ж /м о л ь }}{\text{.}} \\ \end{gathered} $Положительное значение энергии реакции (3) говорит о том, что адсорбированный на золоте катион Pb2+ является достаточно стабильным состоянием свинца на поверхности. Разница энергий этих реакций в 20 кДж/моль указывает на то, что адсорбированный ион свинца значительно менее склонен к гидролизу, чем катион в растворе.
ЗАКЛЮЧЕНИЕ
Исследование взаимодействия ионов свинца с поверхностью золота показало большую величину химической составляющей энергии связи свинец–золото. При адсорбции простых катионов Pb2+ происходит значительный перенос заряда (около половины в случае адсорбции из газовой фазы) на поверхность золота. Проанализированы спектры плотности состояний и локальные D(E)-зависимости для адсорбированного иона свинца и непосредственно связанных с ним трех атомов золота. Их участие в формировании молекулярных орбиталей системы более значительно в области более отрицательных энергий. Свинец участвует в образовании общей электронной системы благодаря в основном s-орбиталям, соседние атомы золота – d-орбиталям. Растворитель препятствует смещению положительного заряда на электрод, вдвое уменьшая перенос заряда и свинец существует на поверхности скорее в ад-ионной, чем в ад-атомной форме. В кислых и нейтральных средах свинец может присутствовать на поверхности в виде простых одноатомных ионов. Их гидролиз в таких средах маловероятен.
Список литературы
Haissinsky, M., Mécanisme des dépots électrolytiques et expériences avec les radioéléments, J. Chim. Phys., 1946. vol. 43, p. 21.
Kolb, D.M., Przasnycky, M., and Gerischer, H., Underpotential deposition of metals and work function differences, J. Electroanal. Chem., 1974, vol. 54, p. 25.
Kolb, D.M., Leutloff, D., and Przasnycky, M., Optical properties of gold electrode surfaces covered with metal monolayers, Surf. Sci., 1975, vol. 47, p. 622.
Takamura, T., Watanabe, F., and Takamura, K., Electro-optical studies of submonolayers of lead formed on gold electrodes by faradaic adsorption in 1 M HClO4, Electrochim. Acta., 1974, vol. 19, p. 933.
Adžić, R.R. and Despić, A.R., Catalytic effect of metal adatoms deposited at underpotential, J. Chem. Phys., 1974, vol. 61, p. 3482.
Петрий, О.А., Лапа, А.С., Электрохимия адатомных слоев, в Итоги науки, Электрохимия, Полукаров, Ю.М., Ред., М.: ВИНИТИ, 1987, Т. 24, С. 96. [Petrii, O.A., and Lapa, A.S., Electrochemistry of adatomic layers, in Itogi nauki, Electrochemistry (in Russian), Polukarov, Yu.M., Ed, Moscow: VINITI, 1987, vol. 24, p. 96.]
Rhodes, A., Feliu, J.M., Aldaz, A., and Clavilier, J. The influence of polyoriented gold electrodes modified by reversibly and irreversibly adsorbed ad-atoms on the redox behaviour of the Cr(III)/Cr(II), J. Electroanal. Chem., 1989, vol. 271, p. 127.
Paliteiro, C. and Martins, N., Electroreduction of oxygen on a (100)-like polycrystalline gold surface in an alkaline solution containing Pb(II), Electrochim. Acta., 1998, vol. 44, p. 1359.
Oh, I., Gewirth, A.A., and Kwak, J., Electrocatalytic dioxygen reduction on underpotentially deposited Pb on Au(111) studied by an active site blocking strategy, J. Catal., 2003, vol. 213, p. 17.
Hsieh, S.-J. and Gewirth, A.A., Poisoning the catalytic reduction of peroxide on Pb underpotential deposition modified Au surfaces with iodine, Surf. Sci., 2001, vol. 498, p. 147.
McJntyre, J.D.E. and Peck, W.F., Electrodeposition of gold, J. Electrochem. Soc., 1976, vol. 123, p. 1800.
Бек, Р.Ю., Шураева, Л.И. Влияние ионов свинца на кинетику электроосаждения золота из цианистых электролитов. Электрохимия. 2004. Т. 40. С. 805. [Bek, R.Yu. and Shuraeva, L.I., Effect of lead ions on the kinetics of gold deposition from cyanide electrolytes, Russ. J. Electrochem., 2004. vol. 40, p. 704.]
Nikol, M.J., The anodic behaviour of gold. P. II. Oxidation in alkaline solutions, Gold. Bull., 1980, vol. 7, p. 105.
Бек, Р.Ю. Сопоставление каталитической активности адатомов таллия и свинца при электроосаждении и растворении золота в цианистых растворах. Электрохимия. 2008. Т. 44. С. 1160. [Bek, R.Yu., Comparison of catalytic activity of thallium and lead adatoms at the gold electrodeposition and dissolution in cyanide solutions, Russ. J. Electrochem., 2008, vol. 44, p. 1078.]
Hamelin, A. and Lipkowskii, J., Underpotential deposition of lead on gold single crystal faces. Part II. General discussion, J. Electroanal. Chem., 1984, vol. 171, p. 317.
Schmidt, U., Vinzelberg, S., and Staikov, G., Pb UPD on Ag(100) and Au(100) – 2D phase formation studied by in situ STM, Surf. Sci., 1995, vol. 348, p. 261.
Horkans, J., Cahan, B.D., and Yeager, E., An ellipsometric investigation of the underpotential deposition of lead on gold, J. Electrochem. Soc., 1975, vol. 122, p. 1585.
Leung, L.-W.H. and Weaver, M.J., Extending the metal interface generality of surface-enhanced Raman spectroscopy: Underpotential deposited layers of mercury, thallium, and lead on gold electrodes, J. Electroanal. Chem., 1987, vol. 217, p. 367.
Motheo, A.J., Gonzalez, E.R, Tremilliosi-Filho, G., Racotondrainibe, A., Léger, J.-M., Beden, B., and Lamy, C., A study of the underpotential deposition of lead on gold by UV-visible differential reflectance spectroscopy, J. Braz. Chem. Soc., 1997, vol. 1, p. 31.
Adžić, R., Yeager, E., and Cahan, B.D., Optical and electrochemical studies of underpotential deposition of lead on gold evaporated and single-crystal electrodes, J. Electrochem. Soc., 1974, vol. 121, p. 474.
Swathirajan, S., Mizota, H., and Bruckenstein, S., Thermodynamic properties of monolayers of silver and lead deposited on polycrystalline gold in the underpotential region, J. Phys. Chem., 1982, vol. 86, p. 2480.
Sudha, V. and Sangaranarayanan, M.N., Underpotential deposition of metals – Progress and prospects in modeling, J. Chem. Sci., 2005, vol. 117, p. 207.
Rojas, M.I., Dassie, S.A., and Leiva, E.P.M., Theore-tical study about the adsorption of lead on (111), (100), (110) monocrystalline surfaces of gold, Z. Phys. Chem., 1994, bd. 185, s. 33.
Pershina, V., Anton, J., and Fricke, B., Intermetallic compounds of the heaviest elements and their homologs: The electronic structure and bonding of MM', where M = Ge, Sn, Pb, and element 114, and M' = Ni, Pd, Pt, Cu, Ag, Au, Sn, Pb, and element 114, J. Chem. Phys., 2007, vol. 127, p. 134310.
Pershina, V., Anton, J., and Jacob, T., Theoretical predictions of adsorption behavior of elements 112 and 114 and their homologs Hg and Pb, J. Chem. Phys., 2009, vol. 131, p. 084713.
Zaitsevskii, A., Wüllen, C. van, Rykova, E.A., and Titov, A.V., Two-component relativistic density functional theory modeling of the adsorption of element 114(eka-lead) on gold, Phys. Chem. Chem. Phys., 2010, vol. 12, p. 4152.
Schmidt, M.W., Baldridge, K.K., Boatz, J.A., Elbert, S.T., Gordon, M.S., Jensen, J.H., Koseki, S., Matsunaga, N., Nguyen, K.A., Su, S.J., Windus, T.L., Dupuis, M., and Montgomery, J.A., General atomic and molecular electronic structure system, J. Comput. Chem., 1993, vol. 14, p. 1347.
Koch, W. and Holthausen, M.C., A chemist’s guide to density functional theory, Weinheim: Wiley-VCH and John Wiley & Sons, 2001. 293 p.
Becke, A.D., Density-functional thermochemistry. III. The role of exact exchange, J. Chem. Phys., 1993, vol. 98, p. 5648.
Stephens, P.J, Devlin, F.J., Chablowski, C.F., and Frisch, M.J., Ab initio calculation of vibrational absorption and circular dichroism spectra using density functional force fields, J. Phys. Chem., 1994, vol. 98, p. 11623.
Hay, P.J. and Wadt, W.R., Ab initio effective core potentials for molecular calculations. Potentials for K to Au including the outermost core orbitals, J. Chem. Phys., 1985, vol, 82. p. 299.
McLean, A.D. and Chandler, G.S., Contracted gaussian basis sets for molecular calculations. I. Second row atoms, Z = 11–18, J. Chem. Phys., 1980, vol. 72, p. 5639.
Krishnan, R., Binkley, J.S., Seeger, R., and Pople, J.A. Self-consistent molecular orbital methods. XX. A basis set for correlated wave functions, J. Chem. Phys., 1980, vol. 72, p. 650.
Leach, A.R., Molecular modeling: principles and applications, Harlow: Pearson Education, 2001. p. 80.
Löwdin, P.-O., On the nonorthogonality problem, Adv. Quantum Chem., 1970, vol. 5, p. 185.
Dean, J.A., Lange’s Handbook of Chemistry, N.Y.: McGraw-Hill, 1999. pp. 4.7, 4.24, 4.29, 4.80.
Titmuss, S., Wander, A., and King, D.A., Reconstruction of clean and adsorbate-covered metal surfaces, Chem. Rev., 1996, vol. 96, p. 1291.
Greenwood, N.N. and Earnshow, A., Chemistry of Elements, Oxford: Butterworth-Heinemann, 1998. p. 1176.
Barone, V., Cossi, M., and Tomasi, J., A new definition of cavities for the computation of solvation free energies by the polarizable continuum model, J. Chem. Phys., 1997, vol. 107, p. 3210.
Barone, V. and Cossi, M., Quantum calculation of molecular energies and energy gradients in solution by a conductor solvent model, J. Phys. Chem. A., 1998, vol. 102, p. 1995.
Cossi, M., Rega, N., Scalmani, G., and Barone, V., Energies, structures, and electronic properties of molecules in solution with the C-PCM solvation model, J. Comp. Chem., 2003, vol. 24, p. 669.
Boys, S.F. and Bernardi, F., The calculation of small molecular interactions by the differences of separate total energies. Some procedures with reduced errors, Mol. Phys., 1970, vol. 19, p. 553.
Jensen, F., Introduction to computational chemistry, Chichester: John Wiley & Sons, 2007. p. 227.
Назмутдинов, Р.Р., Манюров, И.Р., Зинкичева, Т.Т., Джанг, Д., Ульструп, Й. Адсорбция цистеина на поверхности Au(111) и перенос электрона в конфигурации сканирующего туннельного микроскопа: квантовохимический подход. Электрохимия. 2007. Т. 43. С. 346. [Nazmutdinov, R.R., Manyurov, I.R., Zinkicheva, T.T., Jang, J., and Ulstrup, J., Cysteine adsorption on the Au (111) surface and the electron transfer in configuration of a scanning tunneling microscope: a quantum-chemical approach, Russ. J. Electrochem., 2007, vol. 43. p. 328.]
Tang, H.-R., Wang, W.-N., Li, Z.-H., Dai, W.-L., Fan, K.-N., and Deng, J.-F., Chemisorption of iodine on Ag(110): a density-functional theory approach, Surf. Sci., 2000, vol. 450, p. 133.
Yoon, B., Koskinen, P., Huber, B., Kostko, O., Issendorff, B. von, Häkkinen, H., Moseler, M., and Landman, U., Size-Dependent Structural Evolution and Chemical Reactivity of Gold Clusters, Chem. Phys. Chem., 2007, vol. 8, p. 157.
Stromsnes, H., Jusuf, S., Bagatur’yants, A., Gropen, O., and Wahlgren, U., Model studies of the chemisorption of hydrogen and oxygen on the Au(100) surface, Theor. Chem. Acc., 2001, vol. 106, p. 329.
Muther, B., Eichler, R., and Gäggeler, H. W., Thermochormatography of 212Pb and 200–202Tl on quartz and gold, PSI Annual Report 2007, Bern: Paul Scherrer Institut, 2008, p. 9.
Sellers, H., Patrito, E.M., and Olivera, P.P., Thermodynamic and ab initio calculations of chemisorption energies of ions, Surf. Sci., 1996, vol. 356, p. 222.
Markovits, A., Garcıa-Hernandez, M., Ricart, J.M., and Illas, F., Theoretical study of bonding of carbon trioxide and carbonate on Pt(111): relevance to the interpretation of “in situ” vibrational spectroscopy, J. Phys. Chem. B, 1999, vol. 103, p. 509.
Ample, F., Clotet, A., and Ricart, J.M., Structure and bonding mechanism of cyanide adsorbed on Pt(111), Surf. Sci., 2004, vol. 558, p. 111.
Nazmutdinov, R.R., Zinkicheva, T.T., Probst, M., Lust, K., and Lust, E., Adsorption of halide ions from aqueous solutions at a Cd(0001) electrode surface: quantum chemical modelling and experimental study, Surf. Sci., 2005, vol. 577, p. 112.
Liu, S., Ishimoto, T., and Koyama, M., First-principles calculation of OH–/OH adsorption on gold nanoparticles, Int. J. Quantum Chem., 2015, vol. 115, p. 1597.
Encyclopedia of Computational Chemistry, Schleyer, P.v.R., Allinger, N.L., Clark T., Gasteiger, J., Kollman, P.A., Schaefer, H.F., and Schreiner, P.R., Eds, Chichester: John Willey & Sons, 1998. vol. 1, p. 700.
O’Boyle, N.M., Tenderholt, A.L., and Langner, K., Software news and updates CCLIB: a library for package-independent computational chemistry algorithms, J. Comput. Chem., 2008, vol. 29, p. 839.
Bligaard, T., and Nørskov, J.K., Heterogeneous catalysis, in Chemical bonding surfaces and interfaces, Nilsson, A., Petersson, L.G.M., and Nørskov, J.K., Eds, Amsterdam: Elsevier, 2008. p. 258.
Chambers, C.C., Hawkins, G.D., Cramer, C.J., and Truhlar, D.C., Model for aqueous solvation based on class IV atomic charges and first solvation shell effects, J. Phys. Chem., 1996, vol. 100, p. 16385.
Da Silva, E.F., Svendsen, H.F., and Merz, K.M., Explicitly representing the solvation shell in continuum solvent calculations, J. Phys. Chem. A, 2009, vol. 113, p. 6404.
Desnoyers, J.E., and Jolicoeur, C., Hydratation effects and thermodynamic properties of ions, in Modern aspects of electrochemistry, Bockris, J.O’M., and Conway, B.E., Eds, N. Y.: Plenum Press, 1969. vol. 5, p. 26.
Robinson, R.A., and Stokes, R.H., Electrolyte solutions, London: Butterworth scientific publications, 1959. p. 125.
Marcus, Y., Thermodynamics of solvation of ions. Part 5. Gibbs free energy of hydration at 298.15 K, J. Chem. Soc. Trans. Farad., 1991, vol. 87, p. 2995.
Bondi, A., Van der waals volumes and radii, J. Phys. Chem., 1964, vol. 68, p. 441.
Powell, K.J., Brown, P.L., Byrne, R.H., Gajda, T., Hefter, G., Leuz, A.-K., Sjöberg, S., and Wanner, H., Chemical speciation of environmentally significant metals with inorganic ligands. Part 3: The Pb2+ + OH–, Cl–, ${\text{CO}}_{3}^{{2 - }},$ ${\text{SO}}_{4}^{{2 - }},$ and ${\text{PO}}_{4}^{{3 - }}$ systems (IUPAC Technical Report). Pure Appl. Chem., 2009, vol. 81, p. 2425.
Дополнительные материалы отсутствуют.


