Электрохимия, 2019, T. 55, № 1, стр. 70-77
Электродиализное извлечение и электроосаждение свинца(II) в системах с жидкими мембранамиТ. Ж. Садырбаева
Т. Ж. Садырбаева *
Институт неорганической химии Рижского технического университета
Рига, Латвия
* E-mail: sadyrbaeva@hotmail.com
Поступила в редакцию 19.09.2017
После доработки 07.06.2018
Принята к публикации 08.06.2018
Аннотация
Исследован процесс извлечения ионов свинца(II) из азотнокислых растворов через жидкие мембраны в условиях гальваностатического электродиализа с электроосаждением металла из принимающего раствора хлорной, азотной или уксусной кислот. В качестве жидких мембран использовали растворы ди(2-этилгексил)фосфорной кислоты с добавками три-н-октиламина в 1,2-дихлорэтане. Изучено влияние плотности тока электродиализа, состава исходного водного раствора и принимающего раствора (католита), а также состава органических жидких мембран на скорость трансмембранного переноса и электроосаждения ионов свинца(II). Определены оптимальные условия процесса. Получены мелкокристаллические, хорошо сцепленные с основой осадки свинца на платиновом катоде при осаждении из хлорнокислых растворов. Показано, что в изученном процессе степень извлечения ионов свинца(II) из исходного водного раствора превышает 90%, а степень электроосаждения достигает 60% в течение 5 ч электродиализа.
ВВЕДЕНИЕ
Свинец – тяжелый, мягкий, ковкий и устойчивый к коррозии металл, до настоящего времени широко применяющийся в промышленности. Свинец используется для производства пластин аккумуляторов, оболочек электрических кабелей, изготовления кислотоупорной аппаратуры, а также для защиты от ионизирующих излучений [1]. Сплавы свинца применяют в производстве подшипников, электрических предохранителей, типографских шрифтов и в качестве припоев. Соединения свинца используются для изготовления устойчивых к коррозии красок, стекол, глазурей, а также в пиротехнике. Таким образом, свинец(II) содержится в сточных водах различных предприятий тяжелой и легкой промышленности. Все растворимые соединения свинца(II) токсичны для человека, животных и растений, они вызывают изменения в нервной системе, крови и сосудах [2]. Поэтому разработка новых эффективных методов извлечения ионов Pb(II) из водных растворов и получения металлического свинца имеет важное практическое значение.
Для извлечения свинца(II) из водных растворов разработаны различные процессы: адсорбция, экстракция, ионный обмен, электролиз, обратный осмос, осаждение, коагуляция [3]. Эти методы имеют некоторые недостатки, такие как затрудненная десорбция, большие количества органических реагентов и растворителей, высокая стоимость сорбентов, ионообменных материалов и обратноосмотических мембран, высокий расход реагентов, отсутствие специфичности, ограничения по концентрации извлекаемого металла. Метод мембранной экстракции перспективен для извлечения, разделения и концентрирования токсичных и редких элементов [4]. Жидкие мембраны имеют ряд преимуществ по сравнению с традиционной жидкостной экстракцией: возможность обработки разбавленных растворов, одновременная экстракция и реэкстракция, минимальное количество органических веществ. Метод электродиализа с жидкими мембранами был впервые применен Б.А. Пуриным для концентрирования рения [5]. В процессах электродиализа через жидкие мембраны при наложении постоянного электрического поля интенсифицируется перенос ионов через мембрану. При этом появляется возможность выделения извлекаемого металла из катодного раствора в виде электродного осадка.
Ди(2-этилгексил)фосфорная кислота (Д2ЭГФК) широко используется в гидрометаллургии как катионообменный экстрагент для извлечения ионов металлов из нейтральных и слабокислых растворов [6]. Д2ЭГФК часто применяется и в процессах мембранной экстракции в качестве переносчика ионов различных металлов [4]. Извлечение свинца(II) с помощью Д2ЭГФК исследовали в системах с эмульсионными [7, 8], импрегнированными [9, 10] жидкими мембранами, в системах с полыми волокнами [11, 12] и полимерными мембранами [13, 14]. Движущей силой переноса ионов металла через жидкие мембраны является градиент рН между водными растворами, поэтому в этих процессах используются сильнокислые принимающие растворы.
Метод электродиализа с жидкими мембранами успешно применялся нами ранее для извлечения ионов серебра(I) из азотнокислых растворов [15] и кобальта(II) из сернокислых растворов [16] в системах, содержащих Д2ЭГФК, c электроосаждением металлов из катодных хлорнокислых растворов. Целью данной работы является исследование процесса электродиализного транспорта ионов свинца(II) из азотнокислых растворов через жидкие мембраны на основе Д2ЭГФК с добавками три-н-октиламина (ТОА) и определение оптимальных условий извлечения и электроосаждения свинца в католите.
МЕТОДИКА ЭКСПЕРИМЕНТА
Процесс мембранной экстракции ионов Pb(II) изучали с помощью четырехкамерной ячейки из фторопласта с жидкой мембраной, заключенной между вертикальными целлофановыми пленками, в системе:
Объем жидкой мембраны составлял 2 см3, ее толщина – 0.2 см, площадь контакта фаз – 7.1 см2. Электродные камеры имели объем 17 см3, объем отдающего раствора – 13 см3. Анодная камера была отделена от камеры отдающего раствора твердой катионообменной мембраной МК-40. Целлофановые пленки и твердые катионообменные мембраны предварительно вымачивали в дистилированной воде. В качестве катодного раствора в большинстве экспериментов использовали растворы 0.2 М HClO4. Постоянный ток подавали на плоские платиновые электроды в гальваностатическом режиме. В качестве источника тока использовали потенциостат П-5827M. Эксперименты проводили при комнатной температуре, без перемешивания.
Жидкими мембранами служили растворы технической Д2ЭГФК с добавками три-н-октиламина (марка “чистый”) в 1,2-дихлорэтане. Содержание основного вещества в технической Д2ЭГФК составляет приблизительно 63%, кроме того экстрагент содержит ~16% моноалкилфосфорной кислоты и около 6% триалкилфосфорной кислоты, а также спирты. В большинстве экспериментов в качестве жидких мембран использовали 0.38 М (20% об.) растворы Д2ЭГФК с добавкой 0.1 M ТОА. Отдающий раствор готовили растворением навески нитрата свинца Pb(NO3)2 (марка “х. ч.”) в азотной кислоте нужной концентрации, как правило 0.01 М HNO3. Исходная концентрация нитрата свинца(II) обычно составляла 0.01 M. Содержание ионов свинца(II) в водных растворах определяли спектрофотометрическим методом с соляной кислотой по светопоглощению анионов [PbCl6]4– при 267 нм [1]. Измерения оптической плотности проводили на спектрофотометре СФ-46.
Степень экстракции ионов свинца(II) в жидкую мембрану Е определяли как:
(1)
$E = \left( {1 - {{{{C}_{{\text{f}}}}} \mathord{\left/ {\vphantom {{{{C}_{{\text{f}}}}} {{{C}_{0}}}}} \right. \kern-0em} {{{C}_{0}}}}} \right) \times 100\% ,$Степень реэкстракции металла R рассчитывали в соответствии с выражением:
(2)
$R = \left( {{{{{C}_{{\text{r}}}}} \mathord{\left/ {\vphantom {{{{C}_{{\text{r}}}}} {{{C}_{0}}}}} \right. \kern-0em} {{{C}_{0}}}}} \right)\left( {{{{{V}_{{\text{r}}}}} \mathord{\left/ {\vphantom {{{{V}_{{\text{r}}}}} {{{V}_{{\text{f}}}}}}} \right. \kern-0em} {{{V}_{{\text{f}}}}}}} \right) \times 100\% ,$Эффективность катодного осаждения свинца характеризовали степенью электроосаждения D:
(3)
$D = {{\left( {m \times 100\% } \right)} \mathord{\left/ {\vphantom {{\left( {m \times 100\% } \right)} {\left( {M{{C}_{0}}{{V}_{{\text{f}}}}} \right)}}} \right. \kern-0em} {\left( {M{{C}_{0}}{{V}_{{\text{f}}}}} \right)}},$Скорость трансмембранного переноса свинца(II) определяли как величину потока J:
где S – видимая площадь жидкой мембраны (м2), t – продолжительность процесса (с).МЕХАНИЗМ МАССОПЕРЕНОСА
В смеси органической кислоты с органическим основанием образуется бинарный экстрагент. Взаимодействие Д2ЭГФК с три-н-октиламином сопровождается переносом протона и образованием ионной пары R3NH+A− [17]:
(5)
${{{\text{R}}}_{{\text{3}}}}{\text{N}} + {\text{HA}} \leftrightarrow {{{\text{R}}}_{{\text{3}}}}{\text{N}}{{{\text{H}}}^{{\text{ + }}}}{{{\text{A}}}^{{\text{--}}}},$Извлечение катионов свинца(II) в жидкую мембрану протекает по механизму бинарной экстракции, при которой в органическую фазу совместно извлекаются катионы металла и анионы кислоты:
(6)
$\begin{gathered} {\text{Pb}}_{{\left( {\text{в }} \right)}}^{{2 + }} + 2{\text{NO}}_{{3\left( {\text{в }} \right)}}^{ - } + 2{{{\text{R}}}_{3}}{\text{NH}}{{{\text{A}}}_{{({\text{o}})}}} \leftrightarrow {\text{Pb}}{{{\text{A}}}_{{2({\text{o}})}}} + \\ + \,\,2{{{\text{R}}}_{3}}{\text{NHN}}{{{\text{O}}}_{{3({\text{o}})}}}, \\ \end{gathered} $В условиях избытка экстрагента в органическом растворе часть ионов свинца(II) извлекается Д2ЭГФК по механизму катионообменной экстракции. Известно, что Д2ЭГФК существует в димерной форме в малополярных растворителях, образует мономеры в спиртах и промежуточные комплексы в хлороформе и ацетоне [18]. В полярном растворителе 1,2-дихлорэтане (ε > 10) наиболее вероятно присутствие мономеров и димеров Д2ЭГФК в сравнимых количествах. Без учета частичной димеризации экстрагента извлечение ионов свинца(II) Д2ЭГФК можно записать как:
(7)
${\text{Pb}}_{{\left( {\text{в }} \right)}}^{{2 + }} + 2{\text{H}}{{{\text{A}}}_{{({\text{o}})}}} \leftrightarrow {\text{Pb}}{{{\text{A}}}_{{2({\text{o}})}}} + 2{\text{H}}_{{\left( {\text{в }} \right)}}^{ + }.$Экстрагируемый комплекс свинца(II) может частично диссоциировать в полярном органическом растворителе [19]:
(8)
${\text{Pb}}{{{\text{A}}}_{{2\left( {\text{о }} \right)\quad}}} \leftrightarrow {\text{Pb}}_{{\left( {\text{о }} \right)}}^{{2 + }} + 2{\text{А }}_{{\left( {\text{o}} \right)}}^{ - }.$Катионы Pb2+ за счет диффузии транспортируются из объема отдающего раствора к границе раздела фаз с жидкой мембраной и взаимодействуют с переносчиком. Экстрагируемый комплекс PbA2 диффундирует через слой жидкой мембраны и диссоциирует на границе с принимающим раствором по реакциям обратным (6, 7). Катионы Pb2+, которые появляются в органической фазе в результате частичной диссоциации экстрагируемого комплекса, переносятся через жидкую мембрану за счет электромиграции. Молекулы переносчика диффундируют обратно к границе раздела фаз с отдающим раствором по градиенту их концентрации. Ионы водорода транспортируются через жидкую мембрану в принимающий раствор в том же направлении, что и катионы свинца(II), взаимодействуя с переносчиком по межфазной реакции:
(9)
$\begin{gathered} {\text{H}}_{{\left( {\text{в }} \right)}}^{ + } + {\text{NO}}_{{3\left( {\text{в }} \right)}}^{ - } + {{{\text{R}}}_{3}}{\text{NH}}{{{\text{A}}}_{{\left( {\text{o}} \right)}}} \leftrightarrow {\text{ }}2{\text{H}}{{{\text{A}}}_{{({\text{o}})}}} + \\ + \,\,{{{\text{R}}}_{3}}{\text{NHN}}{{{\text{O}}}_{{3({\text{o}})}}}. \\ \end{gathered} $В условиях электродиализа не требуется ни высокая кислотность принимающего раствора, ни корректировка pH отдающего раствора, необходимые в процессах диализа [4], которые протекают по механизму противоположно направленных потоков ионов металла и катионов водорода.
Если в катодном растворе содержится кислота HClO4, перхлорат-ионы взаимодействуют с переносчиком на границе жидкой мембраны с катодным раствором, транспортируются через органическую фазу в обратном направлении по отношению к катионам свинца(II) и водорода, и переходят в отдающий раствор:
(10)
$\begin{gathered} {\text{ClO}}_{{4\left( {\text{в }} \right)}}^{ - } + {\text{H}}_{{\left( {\text{в }} \right)}}^{ + } + {{{\text{R}}}_{3}}{\text{NH}}{{{\text{A}}}_{{({\text{o}})}}} \leftrightarrow \\ \leftrightarrow {{{\text{R}}}_{3}}{\text{NHCl}}{{{\text{O}}}_{{4({\text{o}})}}}\quad + {\text{H}}{{{\text{А }}}_{{\left( {\text{o}} \right)}}}. \\ \end{gathered} $Окислительно-восстановительные реакции на электродах сопряжены с переносом ионов через жидкую мембрану. На катоде в хлорнокислом растворе происходит выделение водорода и электроосаждение свинца:
(11)
${\text{2}}{{{\text{H}}}^{{\text{ + }}}} + {\text{2}}{{{\text{e}}}^{--}}\quad \to {{{\text{H}}}_{{\text{2}}}} \uparrow ,$(12)
${\text{P}}{{{\text{b}}}^{{{\text{2 + }}}}} + {\text{ 2}}{{{\text{e}}}^{ - }}\quad \to {\text{Pb}} \downarrow .$На инертном платиновом аноде в азотнокислом растворе выделяется кислород в результате окисления молекул воды:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние состава катодного раствора
В предварительных экспериментах было установлено, что при использовании в ячейке твердых анионообменных мембран для отделения анодной камеры в ходе электродиализа наблюдается выпадение осадков нерастворимой в воде соли свинца на целлофановой пленке на границе отдающего раствора с жидкой мембраной. Поэтому в данной работе применяли твердые катионообменные мембраны, несмотря на возможную частичную абсорбцию катионов Pb2+ из исходного раствора.
Было установлено, что в отсутствие электрического поля за 100 мин в органическую фазу, содержащую 0.38 М Д2ЭГФК и 0.1 М ТОА, извлекается примерно 20% свинца(II) из исходного раствора 0.01 М Pb(NO3)2; при этом перенос металла через жидкую мембрану незначителен, составляет менее 2.5%. В условиях электродиализа транспорт ионов свинца(II) интенсифицируется, и наблюдается электроосаждение металла на платиновом катоде из разбавленных растворов хлорной, азотной и уксусной кислот. В системе с азотной кислотой получена более низкая скорость электроосаждения и худшее сцепление осадка свинца с катодом, чем в случае использования хлорной кислоты. Система, содержащая уксусную кислоту, отличается высоким напряжением электродиализа и сильным образованием осадков нерастворимой в воде соли свинца, вероятно PbA2, на целлофановых пленках. Таким образом, для изучения закономерностей электродиализа был выбран хлорнокислый католит.
Осадки свинца, полученные из растворов хлорной кислоты, имеют вид серых, мелкокристаллических, прочно сцепленных с электродом покрытий. Повышение концентрации хлорной кислоты в катодном растворе в пределах 0.1–1.0 М приводит к снижению скорости извлечения свинца(II) в органическую фазу (табл. 1). Это связано, по-видимому, с интенсификацией потока анионов ${\text{ClO}}_{4}^{ - }$ через жидкую мембрану. Максимальная степень электроосаждения металла была достигнута в системе с 0.1 М HClO4, однако при низких (<0.2 М) концентрациях кислоты в катодном растворе наблюдалось образование осадка белого цвета PbA2 на целлофановой пленке на границе жидкой мембраны с католитом, а также возможно помутнение католита из-за выхода органических катионов R3NH+ в объем водной фазы. Поэтому в последующих экспериментах в качестве католита использовали раствор 0.2 М HClO4.
Таблица 1.
Влияние состава катодного раствора на степень извлечения ионов свинца(II) в жидкую мембрану (Е), в катодный раствор (R), степень электроосаждения (D) и поток (J) СPb = 0.01 М; CHNO3 = 0.01 М; i = 10.6 мА/см2; СД2ЭГФК = 0.38 М; СTOA = 0.1 М; t = = 100 мин
| Катодный раствор | С, М | Е | R | D | J, мкмоль/(м2 с) |
|---|---|---|---|---|---|
| % | |||||
| HClO4 | 0.05 | 88 | 4 | 21 | 8 |
| HClO4 | 0.1 | 89 | 7 | 33 | 12 |
| HClO4 | 0.2 | 81 | 12 | 27 | 12 |
| HClO4 | 0.3 | 74 | 13 | 24 | 11 |
| HClO4 | 0.5 | 69 | 10 | 27 | 11 |
| HClO4 | 1.0 | 62 | 9 | 28 | 11 |
| HNO3 | 0.2 | 80 | 16 | 17 | 10 |
| CH3COOH | 0.2 | 96 | 16 | 22 | 12 |
Влияние плотности тока
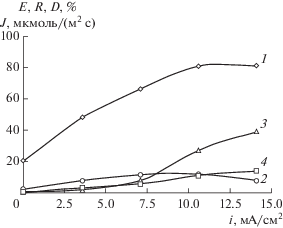
Скорость извлечения свинца(II) из отдающего раствора в органическую фазу пропорционально возрастает при повышении плотности тока от 0 до 10 мА/см2, в дальнейшем зависимость выходит на плато (рис. 1, кривая 1). Содержание свинца(II) в католите проходит через максимум (кривая 2), а поток ионов металла через жидкую мембрану и степень электроосаждения возрастают во всем изученном интервале плотностей тока 0–14 мА/см2 (кривые 3, 4). Наиболее высокая скорость трансмембранного переноса свинца(II), полученная при плотности тока 14 мА/см2, достигает 14 мкмоль/(м2 с).
Рис. 1.
Зависимости степени извлечения свинца(II) в жидкую мембрану Е (1), в катодный раствор R (2), степени электроосаждения D (3) и скорости переноса металла J (4) от плотности тока. СД2ЭГФК = 0.38 М; СТОА = 0.1 M; СPb = 0.01 M; t = 100 мин.
Напряжение в системе в ходе экспериментов постепенно или скачкообразно снижается, в зависимости от величины плотности тока (рис. 2). Иногда на хронопотенциограммах наблюдается непродолжительное повышение напряжения в начальном периоде электродиализа (кривая 3). Электропроводность системы с жидкой мембраной, как правило, определяется составом органической фазы. Повышение электропроводности и снижение напряжения связано с увеличением общей концентрации ионов в органической фазе вследствие извлечения ${\text{ClO}}_{4}^{ - }$ и ${\text{NO}}_{3}^{ - },$ а также с накоплением воды в фазе жидкой мембраны. Вода переносится в жидкую мембрану в составе гидратно-сольватных оболочек экстрагируемых ионов и за счет электроосмоса [20]. В течение электродиализа вода накапливается в жидкой мембране в количестве до 0.5 мл при общем объеме органической фазы 2 мл. В начале процесса, когда содержание воды в органической фазе незначительно, может наблюдаться повышение напряжения в системе вследствие экстракции свинца(II) и образования в органической фазе нейтрального комплекса PbA2 (кривая 3).
Рис. 2.
Кинетические зависимости изменения напряжения при разных плотностях тока электродиализа. СPb = 0.01 M; i (мА/см2): 1 – 3.5; 2 – 7.1; 3 – 10.6; 4 ‒ 14.1.

Рис. 3.
Кинетические зависимости изменения содержания свинца(II) в исходном растворе (1), в катодном растворе (2) и осаждения на катоде (3). СPb = 0.01 М, СД2ЭГФК = 0.38 М, СТОА = 0.1 M, i = 10.6 мА/см2.
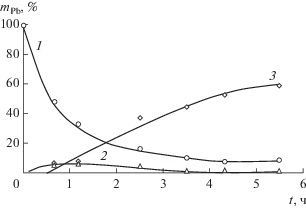
Кинетические зависимости извлечения и электроосаждения катионов свинца(II) из раствора 0.2 М HClO4 при плотности тока 10.6 мА/см2 приведены на рис. 3. В этих экспериментальных условиях за 4–5 ч электродиализа из отдающего раствора извлекается более 90% свинца(II), а электроосаждение металла на катоде достигает 60%. После электродиализа около 30% свинца(II) остается в жидкой мембране и, возможно, некоторая часть этого количества абсорбируется твердой катионообменной мембраной. Масса катодного осадка свинца в ходе процесса непрерывно возрастает, в то время как концентрация металла в катодном растворе достигает максимальной величины через 40–70 мин электродиализа, после чего содержание свинца(II) в католите уменьшается и в конце эксперимента составляет менее 1% (рис. 3, кривая 2).
Надо отметить, что в ходе длительных (более 4 ч) экспериментов в условиях высокой плотности тока или низкой концентрации HClO4 в католите может наблюдаться помутнение катодного раствора в результате выхода органических ионов из жидкой мембраны в водную фазу. При недостаточном количестве ионов водного электролита у границы жидкой мембраны с катодным раствором в переносе тока через эту границу начинают участвовать органические катионы три-н-октил-аммония.
Измерения рН растворов
Было показано, что извлечение свинца(II) через жидкую мембрану сопровождается значительным изменением величины pH отдающего и катодного растворов, при этом кислотность анодного азотнокислого раствора практически не изменяется (табл. 2). Снижение величины pH исходного раствора, содержащего свинец(II), свидетельствует о накоплении ионов водорода в результате их переноса из анодной камеры через твердую катионообменную мембрану в отдающий раствор. Ионы водорода генерируются на аноде в ходе электродной реакции (13). В отдающем растворе накапливается хлорная кислота, так как транспорт ионов водорода сопряжен с переносом перхлорат-ионов через жидкую мембрану. Присутствие перхлорат-ионов в исходном растворе после электродиализа было доказано качественной реакцией на ионы ${\text{ClO}}_{4}^{ - }$ c раствором CsNO3 [21]. Повышение величины pH и снижение кислотности катодного раствора обусловлено расходом катионов H+ в электродной реакции выделения газообразного водорода (11).
Таблица 2.
Изменение величины pH водных растворов в ходе электродиализа СPb = 0.01 М; ${{C}_{{{\text{HCl}}{{{\text{O}}}_{4}}}}}$ = 0.2 М; ${{C}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ = 0.01 М; i = 10.6 мА/см2
| t, ч | Исходный раствор (PbNO3)2 | Католит HClO4 | Анолит HNO3 |
|---|---|---|---|
| 0 | 2 | 1 | 1.2 |
| 2 | 1.2 | 1.2 | 1.2 |
| 4 | 1 | 1.8 | 1.2 |
Влияние состава исходного раствора
Повышение концентрации свинца(II) в отдающем растворе от 5 × 10–3 до 0.1 М приводит к пропорциональному увеличению потока ионов Pb2+ через жидкую мембрану и массы катодного осадка, однако степени извлечения и электроосаждения при этом снижаются (рис. 4). Выход по току для переноса катионов Pb2+, рассчитанный по видимой площади жидкой мембраны, возрастает при увеличении начальной концентрации свинца(II), но в условиях высокой плотности тока не превышает 8%. Ток через жидкую мембрану переносится в основном катионами водорода из отдающего раствора и анионами ${\text{ClO}}_{4}^{ - }$ из катодного раствора.
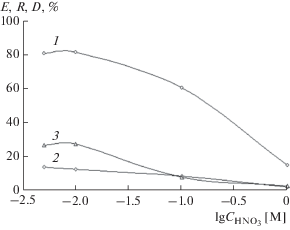
Рис. 4.
Зависимости степени извлечения свинца(II) в жидкую мембрану Е (1), в принимающий раствор R (2), степени электроосаждения D (3) и скорости переноса J (4) от исходной концентрации металла. ${{C}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ = = 0.01 М; i = 10.6 мА/см2; t = 100 мин.

При увеличении концентрации азотной кислоты в исходном растворе в интервале 0.01–1.0 М значительно снижается степень извлечения ионов свинца(II) в жидкую мембрану, а также скорость трансмембранного переноса и степень электроосаждения (рис. 5). Негативное влияние избытка кислоты на транспорт катионов Pb2+ обусловлено повышением потока катионов водорода через жидкую мембрану, а также снижением экстракционной способности Д2ЭГФК при повышении кислотности водной фазы [6]. Оптимальная кислотность исходного раствора свинца(II) – 5 × 10–3 – 0.01 М HNO3. В таких системах за 100 мин электродиализа извлечение катионов Pb2+ из отдающего раствора достигает 80%, и реэкстракция в принимающий хлорнокислый раствор составляет около 40%.
Влияние состава жидкой мембраны
Повышение концентрации переносчика Д2ЭГФК в органической фазе от 0.19 до 0.77 М (10–40 об. %) при постоянной концентрации амина приводит к увеличению степени извлечения свинца(II) в жидкую мембрану, но скорости трансмембранного переноса и электроосаждения металла снижаются (табл. 3). Это свидетельствует о том, что скорость мембранной экстракции свинца(II) не определяется стадией переноса катионов Pb2+ через границу отдающий раствор/жидкая мембрана. Известно, что экстракция свинца(II) в системах с Д2ЭГФК протекает быстро [22], но перенос металла через жидкую мембрану в отсутствие электрического поля незначителен, поэтому наиболее вероятная скоростьопределяющая стадия мембранной экстракции это реэкстракция ионов Pb(II) в катодный раствор. Негативное влияние избытка переносчика на скорость транспорта металла может быть связано с повышением вязкости органической фазы.
Таблица 3.
Влияние состава жидкой мембраны на скорость извлечения и электроосаждения ионов свинца(II) СPb = 0.01 М; ${{C}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}}$ = 0.01 М; ${{C}_{{{\text{HCl}}{{{\text{O}}}_{4}}}}}$ = 0.2 М; i = = 10.6 мА/см2; t = 100 мин
| СД2ЭГФК, М | СTOA, М | Е | R | D | J, мкмоль/(м2 с) |
|---|---|---|---|---|---|
| % | |||||
| 0.19 | 0.1 | 76 | 8 | 30 | 11 |
| 0.38 | 0.1 | 81 | 12 | 27 | 12 |
| 0.58 | 0.1 | 81 | 9 | 23 | 10 |
| 0.77 | 0.1 | 84 | 8 | 19 | 8 |
| 0.38 | 0.05 | 81 | 10 | 29 | 12 |
| 0.38 | 0.2 | 71 | 7 | 11 | 6 |
| 0.38 | 0.4 | 58 | 6 | 3 | 3 |
Растворы технической Д2ЭГФК, использующиеся в качестве жидких мембран, обладают низкой электропроводностью из-за содержания значительного количества сильно ассоциированной моноалкилфосфорной кислоты [6]. Для их применения в электродиализе необходимо введение повышающих электропроводность добавок, например солей аминов. Повышение концентрации ТОА в жидкой мембране приводит к увеличению электропроводности и значительно снижает величину начального напряжения в системе (рис. 6). При низкой концентрации амина на хронопотенциограмме наблюдаются участки резкого падения напряжения (кривая 1), связанные с образованием в органической фазе перхлората триоктиламмония, а также c накоплением воды. Увеличение электропроводности жидких мембран при появлении в органической фазе липофильных анионов, таких как перхлорат-ион, наблюдалось авторами [23].
Рис. 6.
Влияние концентрации добавки три-н-октиламина в жидкой мембране на кинетику изменения напряжения. СД2ЭГФК = 0.38 М; i = 10.6 мА/см2; СТОА (М): 1 – 0.05; 2 – 0.2; 3 – 0.4.

Было установлено, что увеличение содержания ТОА в жидкой мембране в интервале 0.1–0.4 М при постоянной концентрации Д2ЭГФК приводит к снижению скоростей извлечения ионов свинца(II) в органическую фазу, в принимающий раствор и скорости электроосаждения (табл. 3). Транспорт анионов ${\text{ClO}}_{4}^{ - }$ из катодного раствора через жидкую мембрану интенсифицируется при повышении концентрации бинарного переносчика R3NHA и снижении содержания катионообменного переносчика – свободной Д2ЭГФК в органической фазе. Усиление потока перхлорат-ионов через жидкую мембрану приводит к снижению выхода по току для ионов свинца(II). Оптимальная концентрация добавки ТОА – 0.1 М.
Таким образом, изучение закономерностей электродиализной мембранной экстракции свинца(II) показало возможность применения этого метода для извлечения ионов Pb2+ из водных растворов через жидкие мембраны с одновременным получением катодных осадков свинца из разбавленных растворов хлорной кислоты. Процесс обеспечивает одностадийную экстракцию, реэкстракцию и катодное электроосаждение металла. Наложение электрического поля интенсифицирует перенос свинца(II) через мембрану по сравнению с традиционной мембранной экстракцией, и применение жидкой мембраны повышает скорость переноса ионов металла по сравнению с обычным электродиализом. В предложенном процессе не требуется градиент рН между отдающим и принимающим растворами. Жидкие мембраны, ограниченные целлофановыми пленками, стабильнее чем импрегнированные и эмульсионные жидкие мембраны, использующиеся в настоящее время [4]. В отличие от традиционного электролиза метод электродиализа позволяет проводить электроосаждение из католита, отличающегося по составу от исходного раствора, содержащего извлекаемый металл.
ЗАКЛЮЧЕНИЕ
Наложение постоянного электрического поля позволяет осуществить перенос ионов Pb2+ из азотнокислых растворов через жидкие мембраны, содержащие Д2ЭГФК с добавками ТОА в 1,2-дихлорэтане, и электроосаждение свинца из разбавленных растворов различных кислот. Скорости извлечения ионов свинца(II) в растворы хлорной, азотной и уксусной кислот сравнимы. Наиболее высокая скорость электроосаждения свинца(II) достигается в системе с HClO4 в катодном растворе. В ходе электродиализа получены осадки свинца на платиновом катоде в виде мелкокристаллических покрытий, прочно сцепленных с основой. Скорость трансмембранного переноса ионов Pb2+ возрастает при увеличении исходной концентрации металла в отдающем растворе и плотности тока. Изменение концентрации HClO4 в католите слабо влияет на величину потока ионов свинца(II). Увеличение содержания азотной кислоты в отдающем растворе, а также повышение концентраций Д2ЭГФК и ТОА в органической фазе оказывают негативное влияние на скорость извлечения ионов свинца(II) через жидкую мембрану.
Список литературы
Полянский, Н.Г. Свинец, М.: Наука, 1986. 357 с. [Polansky, N.G., Lead (in Russian), Moscow: Nauka, 1986. 357 p.]
Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Т. 3. Неорганические и элементоорганические соединения, под ред. Лазарева Н.В., Гадаскиной И.Д., Л.: Химия, 1977. 608 с. [Harmful substances in industry: A handbook for chemists, engineers and physicians. vol. 3. Inorganic and elementorganic compounds, Lazarev N.V. and Gadaskina I.D., Eds (in Russian), Leningrad: Khimiya, 1977. 608 p.]
Arbabi, M., Hemati, S., and Amiri, M., Removal of lead ions from industrial wastewater: A review of removal methods, Intern. J. Epidemiol. Res., 2015, vol. 2, no. 2, p. 105.
Ивахно, С.Ю., Юртов, Е.В. Мембранная экстракция, М.: ВИНИТИ, 1990. 174 с. [Ivakhno, S.Yu. and Yurtov, E.V., Membrane extraction (in Russian), Moscow: VINITI, 1990. 174 p.]
Пурин, Б.A. Экстракционно-электрохимический метод получения особо чистых металлов и их соединений. Изв. АН ЛатвССР. 1971. № 5 (286). С. 31. [Purin, B.A., Electrochemical extraction as the method of production of pure metals and their compounds, Izvestiya AN LatvSSR (in Russian), 1971, no. 5 (286), p. 31.]
Ягодин, Г.А., Каган, С.З., Тарасов, В.В. и др. Основы жидкостной экстракции, М.: Химия, 1981. 400 с. [Yagodin, G.A., Kagan, S.Z., Tarasov, V.V. et al, Fundamentals of liquid-liquid extraction (in Russian), Moscow: Khimiya, 1981. 400 p.]
Raghuraman, B.J., Tirmizi, N.P., Kim, B.S., and Wiencek, J.M., Emulsion Liquid Membranes for Wastewater Treatment: Equilibrium Models for Lead and Cadmium Di-2-ethylhexyl Phosphoric Acid Systems, Environ. Sci. Technol., 1995, vol. 29, № 4, p. 979.
Sabry, R., Hafez, A., Khedr M., and El-Hassanin, A., Removal of lead by an emulsion liquid membrane. Part I, Desalination, 2007, vol. 212, no. 1–3, p. 165.
Azzoug, S., Arous, O., and Kerdjoudj, H., Metallic ion extraction and transport in supported liquid membrane using organo-phosphoric compounds as mobile carriers, J. Environ. Chem. Eng., 2014, vol. 2, no. 1, p. 154.
Bhatluri, K.K., Manna, M.S., Ghosal A.K., and Saha, P., Supported liquid membrane based removal of lead(II) and cadmium(II) from mixed feed: Conversion to solid waste by precipitation, J. Hazard. Mater., 2015, vol. 299, p. 504.
Suren, S., Wongsawa, T., Pancharoen, U. et al., Uphill transport and mathematical model of Pb(II) from dilute synthetic lead-containing solutions across hollow fiber supported liquid membrane, Chem. Eng. J., 2012, vol. 191, p. 503.
Suren, S., Pancharoen, U., and Kheawhom, S., Simultaneous extraction and stripping of lead ions via a hollow fiber supported liquid membrane: Experiment and modelling, J. Ind. Eng. Chem., 2014, vol. 20, no. 4, p. 2584.
Kozlowska, J., Kozlowski, C.A., and Koziol, J.J., Transport of Zn(II), Cd(II) and Pb(II) across CTA plasticized membranes containing organophosphorous acids as an ion carriers, Separ. Purif. Technol., 2007, vol. 57, no. 3, p. 430.
Gherasim, C.-V.I., Bourceanu, G., Olariu, R.-I., and Arsene, C., Removal of lead(II) from aqueous solutions by a polyvinyl-chloride inclusion membrane without added plasticizer, J. Membr. Sci., 2011, vol. 377, no. 1–2, p. 167.
Sadyrbaeva, T.Zh., Liquid membrane system for extraction and electrodeposition of silver(I), J. Electroanal. Chem., 2010, vol. 648, no. 2, p. 105.
Sadyrbaeva, T.Zh., Recovery of cobalt(II) by the hybrid liquid membrane—electrodialysis—electrolysis process, Electrochim. Acta., 2014, vol. 133, p. 161.
Kholkin, A.I., Belova, V.V., Pashkov G.L. et al., Solvent binary extraction, J. Molec. Liq., 1999, vol. 82, no. 1–2, p. 131.
Михайлов, В.А. Химия экстракции металлов диалкилфосфорными кислотами и их солями, в сб.: Современные проблемы химии и технологии экстракции. М.: РАН, 1999. Т. 1. С. 72. [Mikhailov, V.A., Chemistry of extraction of metals by dialkyl phosphoric acids and their salts, in: Modern problems of extraction chemistry and technology (in Russian), Moscow: RAN, 1999. vol. 1, p. 72.]
Гиндин, Л.М. Экстракционные процессы и их применение, М.: Наука, 1984. 144 с. [Gindin, L.M., Extraction Processes and their Application (in Russian), Moscow: Nauka, 1984. 144 p.]
Голубев, В.Н., Пурин, Б.А. Исследование электрического пробоя жидкостных мембран при переносе через них некоторых анионов, ДАН СССР. 1977. Т. 232. № 6. С. 1340. [Golubev, V.N. and Purin, B.A., Investigation of the Electrical Breakdown of the Liquid Membranes during Anions Transfer, Doklady AN SSSR (in Russian), 1977, vol. 232, no. 6, p. 1340]
Шумахер, И. Перхлораты: свойства, производство и применение, М.: ГНТХИЛ, 1963. 276 с. [Schuma-cher, J.C., Perchlorates: their properties, manufacture, and uses, New York: Reinhold Pub Corp, 1960. 257 p.]
Holdich, R.G. and Lawson, G.J., The solvent extraction of lead from chloride solutions using di(2-ethylhexyl) phosphoric acid, Hydrometallurgy, 1985, vol. 14, no. 3, p. 387.
Попов, А.Н., Тимофеева, С.К., Серга, В.Э. Вольтамперометрия жидких мембран. IX. Растворы солей н-триоктиламина в 1,2-дихлорэтане. Влияние неперемешиваемых слоев на селективность транспорта анионов. Latvijas Kimijas Zurnals. 1991. № 6. С. 675. [Popov, A.N., Timofeyeva, S.K., and Serga, V.E., Voltammetry of liquid membranes. IX. Solutions of n‑trioctylamine salts in 1,2-dichloroethane. Influence of nonintermixing layers on the selectivity of anion transfer, Latvijas Kimijas Zurnals (in Russian), 1991, no. 6, p. 675.]
Дополнительные материалы отсутствуют.