Электрохимия, 2019, T. 55, № 10, стр. 1236-1247
Масштабируемый синтез и характеристики пироуглеродов на основе эпоксидно-фенольных композиций в качестве высокопроизводительных анодов литий-ионных аккумуляторов
Ч. Ге a, b, c, Ж. Фан b, c, Л. Шен b, c, Ё. Квиао b, c, Л. Лин d, Ж. Ван a, *
a Чжэцзянский университет
310027 Ханчжоу, КНР
b Шанхайская технологическая компания Шаншан
201209 Шанхай, КНР
c Научно-техническая компания новых материалов Нинбо Шаншан
315177 Чжэцзян, КНР
d Восточно-китайский научно-технологический университет
200237 Шанхай, КНР
* E-mail: wjm@zju.edu.cn
Поступила в редакцию 04.09.2018
После доработки 03.12.2018
Принята к публикации 02.02.2019
Аннотация
Описан масштабируемый синтез уникальных пироуглеродов путем легкой вулканизации (отверждения) и пиролиза допированных фосфором эпоксидно-фенольных композиций, с высоким выходом (около 48%). Полученные углеродистые материалы исследованы методами сканирующей электронной микроскопии, просвечивающей электронной микроскопии, рентгенодифракционного анализа, рамановской спектроскопии и адсорбции азота. Рассмотрена возможность их применения в качестве анодов литий-ионных аккумуляторов. Нанокристаллическая структура, количество дефектных мест и пористость (нанополости) полученных углеродистых материалов сильно зависят от температуры пиролиза, которая таким образом влияет на их электрохимические свойства. Эпоксидно-фенольные углеродистые материалы, подвергнутые пиролизу при 900○C (EPN900), демонстрируют наибольшую обратимую емкость около 420 мА ч г–1 при токе 0.1 C, что выше теоретической емкости графита, наблюдаемой обычно при внедрении ионов лития в турбостратные нанолистки и адсорбции на дефектных местах. Эпоксидно-фенольный углеродистый материал, подвергнутый пиролизу при 2800○C (EPN2800), демонстрирует сбалансированные эксплуатационные характеристики запасания энергии при внедрении ионов лития, с относительно высокой обратимой емкостью 343 мА ч г–1, высокой начальной кулоновской эффективностью (~86%) и замечательной циклируемостью (299 мА ч г–1 после 100 циклов при токе 0.3 C). В настоящей работе найдено реально выполнимое решение проблемы широкомасштабного производства высокопроизводительного анодного материала, а также эффективной утилизации основных эпоксидных отходов.
ВВЕДЕНИЕ
Быстрое истощение запасов традиционного ископаемого топлива и растущие проблемы загрязнения окружающей среды ставят неотложную задачу разработки экономичных, высокопроизводительных устройств и технологий для запасания энергии с высокой емкостью [1, 2]. В современном мире большое внимание привлекают литий-ионные аккумуляторы, благодаря своей высокой плотности энергии, высокой энергетической эффективности, хорошей циклируемости и гибкому устройству [3]. Они становятся все более важными источниками тока для портативной электроники и электромобилей [4].
Одним из ключевых параметров, определяющих эксплуатационные характеристики литий-ионных аккумуляторов, является тип материала, используемого для анода [5]. С этой целью были разработаны многочисленные типы материалов, такие как сплавы лития [6], композиты на основе кремния [7, 8], углеродистые материалы [9, 10] и соединения металлов [11–14], среди которых углеродистые материалы показали себя наиболее эффективными “соединениями-хозяевами” для захвата ионов лития благодаря своим преимуществам. Эти преимущества – структурная устойчивость, высокая надежность, хорошая циклируемость, относительная дешевизна и распространенность их запасов в мире [15]. Такие углеродистые материалы – природный и синтетический графиты, углеродное нановолокно и микробусинки мезоуглерода – в настоящее время используются на коммерческой основе в промышленном производстве [16]. Тем не менее, сам факт ограниченной теоретической емкости (372 мА ч г–1) и медленная кинетика диффузии ионов лития сквозь высокоориентированную углеродную структуру не может удовлетворить все более жестким требованиям современных электрических устройств – относительно высокой плотности энергии и мощности. Для того, чтобы преодолеть эти проблемы, были созданы и предложены различные углеродистые материалы, среди которых большое внимание привлек пироуглерод (называемый также твердым углеродом), благодаря своей высокой теоретической удельной емкости, устойчивости при циклировании и способности работать при больших скоростях заряжения–разряда [17, 18].
Обычно пироуглерод, состоящий главным образом из турбостратных наноструктур, может быть приготовлен пиролизом полимеров, таких как смолы [19–21] и биомасса [22, 23]. Описываемую структуру можно сконструировать путем подбора индивидуальных условий пиролиза или сплавления с другими соединениями [24, 25]. В отличие от графита, в графеновые листки ионы Li могут не только интеркалироваться, но и адсорбироваться на ребрах нанокристаллов или сохраняться в порах в процессе заряда [26], обеспечивая пироуглероду хорошие эксплуатационные характеристики, что особенно важно для энергетических установок. Однако из-за некоторых недостатков, таких как высокая стоимость процесса синтеза, низкие обратимая емкость и начальная кулоновская эффективность, пироуглерод все еще не получил широкого распространения в коммерческих литий-ионных аккумуляторах. Таким образом, для того, чтобы пироуглерод стал практически полезным продуктом, помимо хороших эксплуатационных характеристик, он должен стать еще и недорогим.
В настоящей работе описан простой метод крупномасштабного производства нового типа пироуглерода с использованием коммерческих эпоксифенолов в качестве сырья. Эти эпоксифенолы выбраны в качестве прекурсоров благодаря их распространенности в химической промышленности, низкой цене, высокому выходу углерода (около 50% по весу) и возможности регулирования свойств путем химического модифицирования. Однако непосредственный пиролиз эпоксифенолов обычно протекает с низким выходом и низкой начальной кулоновской эффективностью [27]. Для того, чтобы решить эту проблему, была принята стратегия “структурного допирования”, согласно которой смешивают эпоксифенол, отвердитель и источник допанта (фосфорную кислоту), эту смесь вначале превращают в твердое состояние, а затем подвергают пиролизу для получения конечных продуктов. Полученные углеродистые материалы демонстрируют многообещающую способность запасать литий с большой начальной обратимой емкостью (до 420 мА ч г–1), высокой начальной кулоновской эффективностью – выходом по току (свыше 80%), прекрасной работоспособностью электрода при высоких токах заряда и хорошей циклируемостью. Эти в высшей степени обнадеживающие результаты позволят с выгодой реализовать утилизацию ключевого эпоксидного продукта и являются альтернативным решением проблемы высокопроизводительного производства пироуглерода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление материалов
Основным сырьем служил коммерческий эпоксифенол, полученный от торговой фирмы Jiangyinnanhui (Цзяньсу, КНР). Фосфорная кислота квалификации “ч. д. а.” (водный раствор, 85 вес. %, Aladdin) и фталевый ангидрид (Aladdin) использовались соответственно в качестве допанта и отвердителя для застывания эпоксидной смолы перед пиролизом. На рис. 1 изображена схема процесса приготовления материала. В типичном опыте около 3000 г эпоксифенола расплавляли на масляной бане при помешивании в пятилитровом цилиндрическом сосуде из нержавеющей стали (316 L). Затем добавляли 40 вес. % отвердителя и перемешивали при 80○C до получения однородной смеси. После этого к смеси быстро добавляли 10 вес. % фосфорной кислоты при интенсивном перемешивании. Затем смесь отверждалась при 130○C в течение 4 ч в сушильном шкафу. Отвержденный образец разбивали на куски размером около 1 cм3 и подвергали предварительной карбонизации при 600○C в течение 1 ч в шахтной электропечи в потоке N2. Затем полученный предварительно карбонизированный образец размалывали в вертикальной шаровой мельнице (SY-10L, шары из оксида циркония) в порошок с размером частиц не больше 50 мкм. Наконец, полученный порошок подвергали пиролизу при 900, 1100 и 1300○C в промышленной печи с контролируемой атмосферой и при 2800○C в дуговой электропечи Ачесона в течение 2 ч в потоке сверхчистого (UHP-grade) аргона (99.999%). Полученные таким образом образцы пироуглерода мы обозначили, соответственно, как EPN900, EPN1100, EPN1300 и EPN2800.
Характеристики материалов
Термогравиметрический анализ (TGA) проводили нa приборе NETZSCHSTA449 F3 при температурах от комнатной до 1000○C со скоростью нагрева 5°C мин–1 в атмосфере азота. Исследование морфологии и элементный микроанализ проводили на сканирующем электронном микроскопе (FEI Quanta-200), скомбинированном с детектором для электронной энергодисперсионной рентгеновской спектроскопии (EDAX, Apollo XP). Исследования методом просвечивающей электронной микроскопии (TEM) проводили на микроскопе JEOL 2100F. Рентгеновские дифрактограммы записывали на дифрактометре Bruker D8 Advance с CuKα-излучением (λ = 1.54056 Å) в диапазоне углов 2θ от 10° до 90°. Рамановские спектры (Renishaw MKI-2000) для изучения микроструктуры образцов снимали на Labram HR800 с лазером на ионах аргона (514 нм). Электропроводность измеряли при комнатной температуре четырехзондовым методом. Для определения пористости образцов снимали изотермы адсорбции–десорбции азота при 77 K на анализаторе Micromeritics ASAP 2460. Перед измерениями образцы обезгаживали в вакууме при 473 K в течение, по крайней мере, 12 ч. Удельную площадь поверхности (SBET) вычисляли, используя общепринятый метод Брунауэра–Эмметта–Теллера (БЭТ), а общий объем пор (Vt) оценивали в одной точке при максимальном относительном давлении 0.996.
Электрохимические измерения
Электрохимические испытания проводили на круглых элементах CR2032 (“таблетка”). Рабочие электроды готовили, смешивая эпоксифенольный пироуглерод, сажу (Super-P, Timcal) и связующий агент – поливинилиденфторид (Arkema) – в N-метил-2-пирролидоне (Aldrich) в весовом отношении 85 : 12 : 3 до получения однородной кашицы. Затем эту кашицу наносили на медную фольгу-токоотвод, используя прибор для нанесения микронных пленок, и сушили при 120°C в течение 10 мин. Удельную массу активного материала установили равной ~6 мг cм–2. Свежеприготовленные электроды прессовали при вальцевании, вырубали круглые образцы и сушили при 80°C в течение ночи в вакуумной печи. Таблеточные элементы CR2032 собирали из рабочих электродов и противоэлектродов из литиевой фольги. Сепаратором служила пористая полипропиленовая мембрана Celgard 2400, а электролитом – 1 M раствор LiPF6 в смеси этилкарбоната и диэтилкарбоната (1 : 1, по объему). Элементы собирали в перчаточном боксе в атмосфере сухого аргона. Гальваностатические кривые заряда–разряда снимали на многоканальной системе для тестирования аккумуляторов LAND CT2001A в области напряжений 0.005–2.5 В (относительно Li/Li+-электрода сравнения). Циклические вольтамперограммы в интервале 0.005–2.5 В и спектры электрохимического импеданса снимали с помощью электрохимического комплекса Zahner IM6ex. Циклические вольтамперограммы записывали на скорости развертки потенциала 0.5 мВ с–1; спектры импеданса измеряли в области частот от 100 кГц до 100 мГц при амплитуде сигнала 5.0 мВ. Все электрохимические измерения проводили при комнатной температуре.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Процесс пиролиза допированного фосфором эпоксифенола вначале исследовали методом термогравиметрического анализа в атмосфере азота, как показано на рис. 2. Согласно дифференциальной термогравиметрической кривой, быструю потерю веса в области температур от 100 до 320°C можно объяснить, главным образом, испарением воды и других соединений с низким молекулярным весом. В то же время потеря веса в области температур от 350 до 650°C связана, главным образом, с удалением легких молекул, производимых в многочисленных и сложных реакциях (например, распад, полимеризация и конденсация) [28]. Когда температура достигает 750°C, смола уже превратилась в коксоподобный твердый продукт, и потеря веса может быть связана главным образом с разложением ароматических колец и частичным удалением неустойчивых фосфидных групп [29]. Возникшие допированные фосфором структуры предотвращают дальнейшее разложение в результате повышения температур разложения, что приводит к увеличению выхода по углероду [30]. Как результат, выход пиролиза, проводимого при 1000○C, достигает 47.7 вес. %, что намного выше, чем в случае пиролиза биомассы и других синтетических органических прекурсоров [31]. Это указывает на необходимость использования преимуществ эпоксифенола в качестве возможного прекурсора при производстве анодных материалов для литий-ионных аккумуляторов.
Продукт отверждения был сразу подвергнут предварительной карбонизации при 600°C в атмосфере азота, затем измельчен в порошок в мельнице и подвергнут пиролизу при 900, 1100, 1300 и 2800°C. На рис. 3a–3г представлены морфология и текстура полученных образцов пироуглерода. Мы наблюдаем нерегулярную морфологию гранулярного типа и гладкую поверхность. Углеродные частицы имеют средний размер около 10 мкм, между ними распределены многочисленные более мелкие частицы. Следует отметить, что термообработка не привела к агрегированию частиц. На рис. 3д–3з приведены кривые энергодисперсионного рентгеновского дифракционного микроанализа для полученных образцов пироуглерода. Видно, что основные элементы в образцах – это углерод (C), кислород (O) и фосфор (P). Распределение этих элементов дано в табл. 1. В частности, содержание P в образцах EPN900, EPN1100, EPN1300 и EPN2800 составляет соответственно вес. %: 4.13, 2.44, 1.05 и 0, т.е. оно резко падает с ростом температуры пиролиза. Ясно, что содержание остаточного фосфора можно легко задавать, регулируя условия пиролиза, что благоприятствует созданию различных “спроектированных” углеродистых материалов, допированных фосфором.
Рис. 3.
SEM-микрофотографии образцов: (a) EPN900, (б) EPN1100, (в) EPN1300 и (г) EPN2800; (д), (е), (ж) и (з) – рентгеноспектральный электронно-зондовый микроанализ образцов, соответственно, (a), (б), (в) и (г).

Таблица 1.
Элементный состав и физические параметры приготовленных образцов пироуглерода
| Образец | Элементный состав | Характеристики пористости | ||||
|---|---|---|---|---|---|---|
| C | O | P | SBETa | Vtb | VMicroc | |
| (вес. %) | (вес. %) | (вес. %) | (м2 г–1) | (cм3 г–1) | (cм3 г–1) | |
| EPN900 | 86.51 | 9.00 | 4.13 | 2.7 | 0.0082 | 0.00043 |
| EPN1100 | 86.55 | 10.57 | 2.44 | 4.4 | 0.0104 | 0.00060 |
| EPN1300 | 86.89 | 11.69 | 1.05 | 2.4 | 0.0087 | 0.00012 |
| EPN2800 | 88.27 | 11.41 | 0 | 2.8 | 0.0092 | 0.00003 |
Наноструктуры пироуглеродов, приготовленных из эпоксифенола, исследовали методом просвечивающей электронной микроскопии (рис. 4). Полученные ТЭМ-микрофотографии демонстрируют значительное упорядочение локальной структуры с ростом температуры пиролиза. В случае EPN900 наблюдается только структура турбостратного графита (типичная разупорядоченность дальнего порядка), см. рис. 4a, согласующаяся с типичной моделью “карточного домика” для гиперплотного углерода [32]. В то же время у EPN1100 и EPN1300 легко просматриваются локальные упорядоченные структуры, содержащие хорошо выраженные нанографеновые домены (рис. 4б), которые с ростом температуры увеличиваются в размере и числе (рис. 4в), что указывает на увеличение степени графитизации. Более того, если температура пиролиза достигает 2800°C, бóльшая часть разупорядоченного материала преобразуется в слоистые структуры (рис. 4г), напоминающие типичную модель упорядоченности дальнего порядка в графите [33]. В соответствии с результатами прежних исследований [25, 34], эти графеновые домены и аморфная сетчатая структура в пироуглероде могут служить эффективными центрами захвата Li+, так что у этих пироуглеродов на основе эпоксифенолов, пиролизованных при различных температурах, может быть различное электрохимическое поведение.
На рис. 5a показаны изотермы адсорбции–десорбции азота для полученных углеродистых материалов. При повышении температуры пиролиза с 900 до 1100°C наблюдается типичная I–V-изотерма с хорошо выраженной петлей гистерезиса при относительном давлении P/P0, равном 0.45–0.95, что указывает на эволюцию открытых мезопор. Однако, если температура пиролиза последовательно увеличивается до 1300 и 2800○C, эта петля гистерезиса постепенно сжимается до минимального уровня, что позволяет предположить явное изменение наноструктуры при высоких температурах пиролиза. В сочетании с результатами просвечивающей электронной микроскопии (рис. 4), это изменение следует приписать образованию упорядоченной наноструктуры. На рис. 5б показано распределение пор по размеру в полученных образцах. Можно заключить, что бóльшая часть этих пор имеет размер ~3 нм. Вычисленные параметры пор приведены в табл. 1. Удельная площадь поверхности (SBET) образцов EPN900, EPN1100, EPN1300 и EPN2800 составляет, соответственно, 2.7, 4.4, 2.4 и 2.8 м2 г–1. Следует отметить, что пироуглерод EPN1100 обладает наибольшим общим объемом пор (1.04 × 10–2 cм3 г–1), а также наибольшим объемом микропор (6.0 × × 10–4 cм3 г–1). Это можно рассматривать, как выгоду от образования открытых пор и удачного разложения функциональных групп (образование микропор можно объяснить высвобождением газов [35, 36]).
Рис. 5.
(a) Изотермы адсорбции–десорбции азота и (б) распределение пор по размеру, определенное по модели Баррета–Джойнера–Халенды для образцов EPN900, EPN1100, EPN1300 и EPN2800.

Для подтверждения структурных особенностей полученных материалов был проведен рентгенодифракционный анализ. На рис. 6a приведены рентгеновские дифрактограммы, из которых следует, что интенсивности пика (002) при 22° и пика (100) при 44° возрастают в соответствии с ростом температуры пиролиза. Это указывает на то, что происходит эволюция упорядоченной наноструктуры. В особенности, после пиролиза при 2800○C все широкие пики становятся узкими, свидетельствуя о большой степени графитизации. Эта большая степень графитизации, возможно, есть следствие каталитического эффекта со стороны фракции P, который облегчает удаление дефектов и перестройку углеродной структуры в ходе пиролиза [37]. Следует отметить, что на рентгеновских дифрактограммах отсутствуют пики, относящиеся к композитам P. Это означает, что после пиролиза допант (P) равномерно распределен в конечных продуктах. По уравнению Брэгга было вычислено межслойное расстояние d(002); в EPN900, EPN1100, EPN1300 и EPN2800 оно равняется, соответственно, 0.3741, 0.3716, 0.3676 и 0.3365 нм (см. табл. 2), что заметно превышает соответствующую величину для идеального графита (d(002) = 0.335 нм) [38].
Рис. 6.
(a) Рентгеновские дифрактограммы и (б) рамановские спектры для образцов пироуглерода EPN900, EPN1100, EPN1300 и EPN2800.
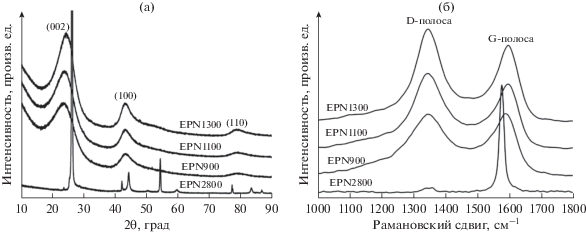
Таблица 2.
Структурные параметры и электрохимические свойства образцов пироуглерода, полученного на основе эпоксифенола
| Образец | d(002) | Lc | La | ID/IGa | RCb | ICEc | RE1d | RE2e |
|---|---|---|---|---|---|---|---|---|
| (нм) | (нм) | (нм) | (мА ч г–1) | (%) | (%) | (%) | ||
| EPN900 | 0.3741 | 1.42 | 3.97 | 1.85 | 416.1 | 80.3 | 46.1 | 81.3 |
| EPN1100 | 0.3716 | 1.44 | 4.31 | 1.49 | 320.2 | 82.2 | 55.0 | 89.2 |
| EPN1300 | 0.3676 | 1.56 | 4.59 | 1.41 | 232.4 | 83.1 | 41.5 | 89.3 |
| EPN2800 | 0.3365 | 34.43 | 73.19 | 0.09 | 342.9 | 86.0 | 13.9 | 89.4 |
a Отношение интегральных интенсивностей пиков D и G. b Разрядная емкость первого цикла. c Начальная кулоновская эффективность. d Отношение зарядной емкости первого цикла при скорости 3 C к зарядной емкости второго цикла при начальной скорости 0.1 C. e Отношение зарядной емкости первого цикла при конечной скорости 0.1 C к зарядной емкости второго цикла при начальной скорости 0.1 C.
Микроструктуру образцов исследовали также, снимая Рамановские спектры (рис. 6б). Видно, что на спектрах всех образцов имеется полоса D при ~1350 cм–1 и пик G при ~1600 cм–1, относящиеся, соответственно, к разупорядоченному углероду и графиту [39]. Хорошо известно, что отношение полных интенсивностей полосы D и пика G (ID/IG) есть критерий порядка локальных слоев углерода в углеродистых материалах [40]. Вычисленные значения отношения ID/IG для EPN900, EPN1100, EPN1300 и EPN2800 равняются, соответственно, 1.85, 1.49, 1.41 и 0.09, т.е. с ростом температуры пиролиза это отношение падает, что опять-таки свидетельствует об уменьшении числа дефектов и локальном увеличении упорядоченности дальнего порядка.
Для лучшего понимания особенностей процесса запасания Li+ были исследованы электрохимические свойства полученных образцов пироуглерода. На рис. 7a–7г показаны циклические вольтамперограммы этих образцов. На первом цикле для образцов EPN900, EPN1100 и EPN1300 ясно видны два пика тока окисления вблизи 0.32 и 0.95 В и два пика тока восстановления вблизи 0 и 0.56 В. Обычно заметный необратимый пик восстановления при ~0.56 В на первом катодном скане объясняют образованием межфазного слоя твердого электролита (SEI) [41], который дает вклад в необратимую емкость первого цикла. На последующих циклах эти вольтамперограммы почти совпадают друг с другом, указывая на хорошую циклируемость пироуглеродных электродов. Более того, с ростом температуры пиролиза широкий пик тока окисления вблизи 0.32 В, связанный с удалением лития из межзеренных границ между графитовыми нанокристаллитами [42], постепенно становится более острым. В то же время широкий пик тока окисления вблизи 0.95 В, связанный с удалением лития из дефектных центров (включая композиции допанта P и углерода [43]), постепенно уменьшается по высоте при уменьшении содержания P. В случае образца EPN2800 пик тока восстановления при 0.95 В исчезает (рис. 7г), что является следствием отсутствия дефектных центров, содержащих P, и образования большего числа графитовых доменов при температуре 2800°C.
Рис. 7.
(a–г) Циклические вольтамперограммы при скорости развертки потенциала 0.5 мВ с–1 и (д–з) кривые заряда–разряда первых трех циклов для приготовленных образцов пироуглерода.
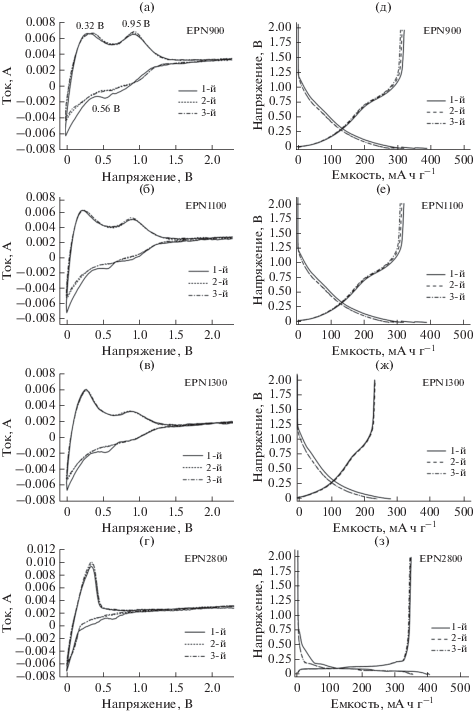
На рис. 7д–7з показаны гальваностатические кривые заряда–разряда образцов, снятые при скорости 0.1 C (25 мA г–1). У всех образцов похожий профиль кривой заряда, содержащий наклонный участок и плато, отвечающие, соответственно, запасанию лития в дефектных центрах и интеркаляции его в пространства между графеновыми слоями, а также адсорбции Li+ в микропорах [37]. Ясно видно, что с ростом температуры пиролиза вклад в емкость по литию наклонного участка постепенно уменьшается, что соответствует уменьшению дефектности при более высоких температурах. В табл. 2 суммированы результаты гальваностатических испытаний для первого цикла. Видно, что зарядная/разрядная емкости образцов EPN900, EPN1100 и EPN1300 составляют, соответственно, 518.2/416.1, 389.5/320.2 и 279.7/232.4 мА ч г–1, а начальная кулоновская эффективность (ICE) – 80.3, 82.2 и 83.1%. При дальнейшем увеличении температуры пиролиза до 2800○C начальная обратимая емкость увеличивается до 342.9 мА ч г–1; величина ICE составляет ~86.0%. Удлиненное плато и почти исчезнувший наклонный участок на кривых заряда–разряда образца EPN2800 характерны больше для графита.
Для дальнейшей оценки пироуглерода, полученного из эпоксифенола, была исследована способность работать при различных (в частности, высоких) скоростях заряда–разряда. Как показано на рис. 8a, зарядные емкости образцов EPN900, EPN1100 и EPN1300 при различных скоростях заряда–разряда постепенно уменьшаются с ростом температуры пиролиза. Подобные же емкости получены при скорости заряда–разряда 3 C в случае EPN1100 и EPN900. Что важно, у образца EPN2800 способность работать при различных скоростях заряда–разряда хуже, поскольку емкость резко падает, если скорость заряда–разряда превышает 1 C. При скорости 3 C для EPN900, EPN1100, EPN1300 и EPN2800 получены емкости 158.8, 160.1, 97.4 и 27.7 мА ч г–1, что соответствует снижению емкости соответственно на 46.1, 55.0, 41.5 и 13.9% (RE1, как показано в табл. 2). Это говорит о том, что чрезмерно высокая температура пиролиза (в частности, 2800°C) не продуктивна для улучшения работоспособности при высоких скоростях заряда–разряда пироуглерода, полученного на основе эпоксифенола. При уменьшении скорости обратно к 0.1 C емкости возвращаются к значениям 335.3, 277.2, 217.1 и 309.4 мА ч г–1, т.е. снижение емкости равняется 81.3, 89.2, 89.3 и 89.4% (RE2, см. табл. 2) соответственно для образцов EPN900, EPN1100, EPN1300 и EPN2800.
Рис. 8.
(a) Циклирование при скорости от 0.1 до 3 C, (б) кривые разряда при скорости 3 C, (в) годографы, снятые до циклирования, (г) циклируемость образцов пироуглерода при скорости 0.3 C.

На рис. 8б показаны профили заряда полученных образцов пироуглерода при скорости 3 C. Видно, что сохраняется только наклонный участок, что говорит о хорошей диффузионной кинетике Li+ в дефектных местах при быстром заряде. В особенности, образец EPN2800 демонстрирует резкое падение напряжения, и кривая почти теряет исходный вид при скорости 3 C, как следствие сильнейшей электрохимической поляризации – это следствие вялой кинетики. Динамический процесс в образцах пироуглерода перед циклированием может быть выявлен методом спектроскопии электрохимического импеданса (рис. 8в). Приплюснутые полуокружности в области высоких и средних частот дают полное межфазное сопротивление SEI и сопротивление переноса заряда (Rct) [44]. В нашем случае у самой маленькой полуокружности наименьшее сопротивление Rct. В общем случае, чем ниже Rct, тем выше стабильность электрода и лучше кинетика литирования [45]. Образец EPN2800 показал самое большое сопротивление Rct, возможно, из-за его высокоупорядоченной структуры. В то же время у EPN1100 самое маленькое значение Rct, что можно объяснить его богатой структурой мезопор, обеспечившей больше каналов для диффузии Li+ [46].
Рисунок 8г иллюстрирует циклируемость наших образцов при скорости 0.3 C. Как EPN900, так и EPN1100 демонстрируют быстрый спад емкости за пять первых циклов, как следствие образования пленки SEI и расхода емкости на активных местах. Напротив, у EPN1300 и EPN2800 вполне хорошая циклируемость. После 100 циклов емкости образцов EPN900, EPN1100, EPN1300 и EPN2800 остаются равными, соответственно, 277.8, 247.8, 206.2 и 298.9 мА ч г–1;, процент сохранения емкости (по сравнению с начальной обратимой емкостью) равняется 66.1, 77.4, 88.0 и 88.0%. В соответствии со своими прекрасными характеристиками, образец пироуглерода EPN1100 можно считать привлекательным кандидатом для применения в литий-ионных аккумуляторах с высокой плотностью мощности. В то же время образец пироуглерода EPN2800 с его хорошей циклируемостью с сочетании с высокими емкостью и кулоновской эффективностью является перспективным анодным материалом для аккумуляторов с высокой плотностью энергии.
ЗАКЛЮЧЕНИЕ
Новый дешевый тип пироуглерода успешно приготовлен из допированного фосфором эпоксифенола в двухстадийном процессе отверждения и пиролиза. Содержание введенного фосфора постепенно уменьшается с ростом температуры пиролиза. Образец EPN900 демонстрирует обратимую емкость 420 мА ч г–1 при скорости заряда 0.1 C, что выше теоретической емкости графита. Образец EPN2800 показал сбалансированные характеристики запасания лития, обеспечивающие относительно высокую обратимую емкость 343 мА ч г–1, высокую начальную кулоновскую эффективность (~86%) и прекрасную циклируемость (299 мА ч г–1 после 100 циклов при скорости 0.3 C). Структурный анализ показал, что это привлекательное электрохимическое поведение можно объяснить синергическим эффектом допирования фосфором, сочетания графитовой и аморфной микроструктур и пористости. С учетом преимуществ простоты синтеза, высокого выхода и хорошего электрохимического поведения можно считать пироуглерод, полученный на основе эпоксифенола, перспективным анодным материалом для литий-ионных аккумуляторов.
ФИНАНСИРОВАНИЕ РАБОТЫ
Настоящее исследование поддержано Министерством науки и технологии КНР (проект № 2016YFB0100400), научно-технологическим планом провинции Чжэцзян (проект № 2017C31078) и Национальным Фондом естественных наук КНР (проект № 21373182).
ЭТИЧЕСКИЕ АСПЕКТЫ
Эта статья не содержит результатов исследований, проведенных авторами на людях или животных.
ОТКРЫТЫЙ ДОСТУП
Эта статья распространяется на условиях лицензии Creative Commons 4.0 “С указанием авторства – некоммерческая” (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение в любом издательстве, при условии правильной ссылки на авторов и источник, ссылки на лицензию Creative Commons license и указаний на возможные сделанные изменения.
Список литературы
Chen, H., Cong, T.N., Yang, W., Tan, C., Li, Y., and Ding, Y., Progress in electrical energy storage system: A critical review, Prog. Nat. Sci., 2009, vol. 19, p. 291.
Larcher, D. and Tarascon, J.M., Towards greener and more sustainable batteries for electrical energy storage, Nature Chem., 2015, vol. 7, p. 19.
Scrosati, B. and Garche, J., Lithium batteries: Status, prospects and future, J. Power Sources, 2010, vol. 195, p. 2419.
Schipper, F. and Aurbach, D., A brief review: Past, present and future of lithium ion batteries, Russ. J. Electrochem., 2016, vol. 52, p. 1095.
Lu. J., Chen, Z., Pan, F., Cui, Y., and Amine, K., High-performance anode materials for rechargeable lithium-ion batteries, Electrochem. Energy Rev., 2018, vol. 1, p. 1.
Zhang, W.J., A review of the electrochemical performance of alloy anodes for lithium-ion batteries, J. Power Sources, 2011, vol. 196, p. 13.
Xiang, H., Zhang, K., Ji, G., Lee, J.Y., Zou, C., Chen, X., and Wu, J., Graphene/nanosized silicon composites for lithium battery anodes with improved cycling stability, Carbon, 2011, vol. 49, p. 1787.
Zhang, Y.L., Chen, H., Bai, N.B., Xiang, K.X., and Zhou, W., Preparation and lithium storage performance of silicon and carbon microrods by chemical vapor co-deposition, Russ. J. Electrochem., 2016, vol. 52, p. 181.
Choi, D.I., Lee, J.N., Song, J., Kang, P.H., Park, J.K., and Lee, Y.M., Fabrication of polyacrylonitrile/lignin-based carbon nanofibers for high-power lithium ion battery anodes, J. Solid State Electrochem., 2013, vol. 17, p. 2471.
Tran, T.D., Feikert, J.H., Song, X., and Kinoshita, K., Commercial carbonaceous materials as lithium intercalation anodes, J. Electrochem. Soc., 1995, vol. 142, p. 3297.
Hao, Q., Lei, D., Yin, X., Zhang, M., Liu, S., Li, Q., Chen, L., and Wang, T., 3-D mesoporous nano/micro-structured Fe3O4/C as a superior anode material for lithium-ion batteries, J. Solid State Electrochem., 2011, vol. 15, p. 2563.
Qiu, D., Xu, Z., Zheng, M., Zhao, B., Pan, L., Pu, L., and Shi, Y., Graphene anchored with mesoporous NiO nanoplates as anode material for lithium-ion batteries, J. Solid State Electrochem., 2012, vol. 16, p. 1889.
Baji, D.S., Nair, S.V., and Rai, A.K., Highly porous disk-like shape of Co3O4 as an anode material for lithium ion batteries, J. Solid State Electrochem., 2017, vol. 21, p. 2869.
Poizot, P., Laruelle, S., Grugeon, S., Dupont, L., and Tarascon, J.M., Nano-sized transition-metal oxides as negative-electrode materials for lithium-ion batteries, Nature, 2000, vol. 407, p. 496.
Wu, Y.P., Rahm, E., and Holze, R., Carbon anode materials for lithium ion batteries, J. Power Sources, 2003, vol. 114, p. 228.
Kumar, T.P., Kumari, T.S.D., and Stephan, M.A., Carbonaceous anode materials for lithium-ion batteries-the road ahead, J. Indian I. Sci., 2012, vol. 89, p. 393.
Yang, X., Li, C., Zhang, G., and Yang, C., Polystyrene-derived carbon with hierarchical macro-meso-microporous structure for high-rate lithium-ion batteries application, J. Mater. Sci., 2015, vol. 50, p. 6649.
Zhao, P.Y., Tang, J.J., and Wang, C.Y., A low-cost attempt to improve electrochemical performances of pitch-based hard carbon anodes in lithium-ion batteries by oxidative stabilization, J. Solid State Electrochem., 2017, vol. 21, p. 555.
Lee, K.T., Lytle, J.C., Ergang, N.S., Oh, S.M., and Stein, A., Synthesis and rate performance of monolithic macroporous carbon electrodes for lithium-ion secondary batteries, Adv. Funct. Mater., 2005, vol. 15, p. 547.
Azuma, H., Imoto, H., Yamada, S., and Sekai, K., Advanced carbon anode materials for lithium ion cells, J. Power Sources, 1999, vol. 81, p. 1.
Liu, Y., Xue, J.S., Zheng, T., and Dahn, J.R., Mechanism of lithium insertion in hard carbons prepared by pyrolysis of epoxy resins, Carbon, 1996, vol. 34, p. 193.
Liu, T., Luo, R., Yoon, S.H., and Mochida, I., Effect of vacuum carbonization treatment on the irreversible capacity of hard carbon prepared from biomass material, Mater. Lett., 2010, vol. 64, p. 74.
Stephan, A.M., Kumar, T.P., Ramesh, R., Thomas, S., Jeong, S.K., and Nahm, K.S., Pyrolitic carbon from biomass precursors as anode materials for lithium batteries, Mater. Sci. Eng. A, 2006, vol. 430, p. 132.
Buiel, E., George, A.E., and Dahn, J.R., On the reduction of lithium insertion capacity in hard-carbon anode materials with increasing heat-treatment temperature, J. Electrochem. Soc., 1998, vol. 145, p. 2252.
Schönfelder, H.H., Kitoh, K., and Nemoto, H., Nanostructure criteria for lithium intercalation in non-doped and phosphorus-doped hard carbons, J. Power Sources, 1997, vol. 68, p. 258.
Ni, J., Huang, Y., and Gao, L., A high-performance hard carbon for Li-ion batteries and supercapacitors application, J. Power Sources, 2013, vol. 223, p. 306.
Zheng, T., Zhong, Q., and Dahn, J.R., High-capacity carbons prepared from phenolic resin for anodes of lithium-ion batteries, J. Electrochem. Soc., 1995, vol. 142, p. L211.
Wu, C.S., Liu, Y.L., Chiu, Y.C., and Chiu, Y.S., Thermal stability of epoxy resins containing flame retardant components: an evaluation with thermogravimetric analysis, Polym. Degrad. Stab., 2002, vol. 78, p. 41.
Liu, Y.L., Hsiue, G.H., Chiu, Y.S., Jeng, R.J., and Ma, C., Synthesis and flame-retardant properties of phosphorus-containing polymers based on poly (4-hydroxystyrene), J. Appl. Polym. Sci., 1996, vol. 59, p. 1619.
Liu, Y.L., Flame-retardant epoxy resins from novel phosphorus-containing novolac, Polymer, 2001, vol. 42, p. 3445.
Choi, D.I., Lee, J.N., Song, J., Kang, P.H., Park, J.K., and Lee, Y.M., Fabrication of polyacrylonitrile/lignin-based carbon nanofibers for high-power lithium ion battery anodes, J. Solid State Electrochem., 2013, vol. 17, p. 2471.
Zheng, T., Xue. J.S., and Dahn, J.R., Lithium insertion in hydrogen-containing carbonaceous materials, Chem. Mater., 1996, vol. 8, p. 389.
Shi, H., Barker, J., Saidi, M.Y., and Koksbang, R., Structure and lithium intercalation properties of synthetic and natural graphite, J. Electrochem. Soc., 1996, vol. 143, p. 3466.
Wu, Y.P., Wan, C.R., Jiang, C.Y., Fang, S.B., and Jiang, Y.Y., Mechanism of lithium storage in low temperature carbon, Carbon, 1999, vol. 37, p. 1901.
Wang, Q., Li, H., Chen, L., and Huang, X., Monodispersed hard carbon spherules with uniform nanopores, Carbon, 2001, vol. 39, p. 2211.
Hu, Z., Srinivasan, M.P., and Ni, Y., Novel activation process for preparing highly microporous and mesoporous activated carbons, Carbon, 2001, vol. 39, p. 877.
Imamura, R., Matsui, K., Takeda, S., Ozaki, J., and Oya, A., A new role for phosphorus in graphitization of phenolic resin, Carbon, 1999, vol. 37, p. 261.
Huang, H., Liu, W., Huang, X., Chen. L., Kelder, E.M., and Schoonman, J., Effect of a rhombohedral phase on lithium intercalation capacity in graphite, Solid State Ionics, 1998, vol. 110, p. 173.
Sun, X., Wang, X., Feng, N., Qiao, L., Li, X., and He, D., A new carbonaceous material derived from biomass source peels as an improved anode for lithium ion batteries, J. Anal. Appl. Pyrol., 2013, vol. 100, p. 181.
Sato, Y., Kikuchi, Y., Nakano, T., Okuno, G., Kobayakawa, K., Kawai, T., and Yokoyama, A., Characteristics of coke carbon modified with mesophase-pitch as a negative electrode for lithium ion batteries, J. Power Sources, 1999, vol. 81, p. 182.
Verma, P., Maire, P., and Novák, P., A review of the features and analyses of the solid electrolyte interphase in Li-ion batteries, Electrochim. Acta, 2010, vol. 55, p. 6332.
Stevens, D.A. and Dahn, J.R., The mechanisms of lithium and sodium insertion in carbon materials, J. Electrochem. Soc., 2001, vol. 148, p. A803.
Qian, J., Qiao, D., Ai, X., Cao, Y., and Yang, H., Reversible 3-Li storage reactions of amorphous phosphorus as high capacity and cycling-stable anodes for Li-ion batteries, Chem. Commun., 2012, vol. 48, p. 8931.
Kolosnitsyn, V.S., Kuzmina, E.V., Karaseva, E.V., and Mochalov, S.E., A study of the electrochemical processes in lithium-sulphur cells by impedance spectroscopy, J. Power Sources, 2011, vol. 196, p. 1478.
Yang, S., Song, H., and Chen, X., Electrochemical performance of expanded mesocarbon microbeads as anode material for lithium-ion batteries, Electrochem. Commun., 2006, vol. 8, p. 137.
Piedboeuf, M.L.C., Léonard, A.F., Deschamps, F.L., and Job, N., Carbon xerogels as model materials: toward a relationship between pore texture and electrochemical behavior as anodes for lithium-ion batteries, J. Mater. Sci., 2016, vol. 51, p. 4358.
Дополнительные материалы отсутствуют.





