Электрохимия, 2019, T. 55, № 10, стр. 1226-1235
Исследование магнитных и электрохимических свойств нанокристаллов CoFe2O4, синтезированных легким гидротермальным методом
Х. Ли a, Ф.-Б. Су a, Л.-Ж. Ву a, Т.-Л. Хан a, Л.-К. Фан a, Ж.-В. Дон a, Ч.-Й. Чао a, *
a Сюйчанский университет
461000 Хэнань, КНР
* E-mail: chaochunying@zju.edu.cn
Поступила в редакцию 06.10.2018
После доработки 14.01.2019
Принята к публикации 31.01.2019
Аннотация
Магнитные наночастицы CoFe2O4@углерод синтезированы гидротермальным методом с использованием глюкозы в качестве источника углерода. Исследованы их магнитные и электрохимические свойства. Значения намагниченности насыщения Ms и остаточной намагниченности Mr наночастиц CoFe2O4@C меньше, чем для образцов чистого CoFe2O4. Это изменение магнитных свойств можно объяснить наличием слоя углерода, гасящего поверхностный магнитный момент за счет опрокидывания спина. Благодаря аморфной структуре и хорошей электронной проводимости углеродных оболочек, электрод “CoFe2O4@C 20 вес. %” имеет емкость 201 мА ч г–1 при плотности тока 500 мA г–1 и большую обратимую емкость до 353 мА ч г–1 после 100 циклов при плотности тока 50 мА г–1.
ВВЕДЕНИЕ
Быстрое развитие портативной электроники и электромобилей все настойчивее требует разработки высокопроизводительных устройств для запасания энергии, таких как суперконденсаторы [1], аккумуляторы [2, 3] и топливные элементы [4]. Среди различных типов аккумуляторов литий-ионные аккумуляторы привлекают внимание благодаря большой плотности энергии и большой плотности мощности, а также хорошей циклируемости. Вышеприведенные характеристики есть следствие, главным образом, качества используемых материалов и процесса сборки аккумулятора. Материалы, отличающиеся большой емкостью и хорошей стабильностью, очень важны для разработки мощных литий-ионных аккумуляторов следующего поколения [5, 6]. Однако широко используемые графитовые аноды имеют удельную емкость, равную всего лишь 372 мА ч г–1, что далеко не дотягивает до требуемой величины [7]. При разработке анодов для литий-ионных аккумуляторов, отличающихся высокой плотностью энергии и мощности, очень важно отвечать требованиям автомобильной промышленности. Заменить графит пытались, используя многие материалы, такие как металлы, неметаллы, оксиды металлов, смешанные оксиды металлов и их композиты [8–11]. Смешанные оксиды металлов, такие как CuFe2O4 [12], CuCo2O4 [13], NiCo2O4 [14], FeCo2O4 [15], привлекают большое внимание благодаря их широкой распространенности, дешевизне и высокой теоретической емкости. В частности, CoFe2O4 [16–19] с высокой теоретической емкостью 916 мА ч г–1 широко исследуется в качестве одного из перспективных анодных материалов. К сожалению, подобно другим оксидам переходных металлов, его практическому применению в литий-ионных аккумуляторах все еще препятствует неспособность работать в широком диапазоне скоростей заряда–разряда и плохая циклируемость – следствие низкой ионной проводимости и большого изменения объема при внедрении Li+ и его экстракции.
Для того чтобы ответить на требования автомобильной промышленности, наиболее перспективная стратегия – это уменьшение размеров частиц до наномасштаба и создание композитов из частиц CoFe2O4, энкапсулированных в углеродную оболочку. Композит CoFe2O4/C в форме волокон, как анодный материал, был приготовлен [18] методом “золь–гель” с использованием электроспиннинга. Частицы CoFe2O4 были распределены в углеродной матрице, а композитные волокна – переплетены так, чтобы получилась 3D‑сетка с ячейками размером от 200 до 300 нм. Внешний пористый углерод может дать достаточно пространства для изменения объема и повышает электрохимическую эффективность, обеспечивая хорошую обратимую емкость и способность заряда–разряда с высокой скоростью. Пытались улучшить работу CoFe2O4-анода и с помощью других проводящих добавок – углеродных нанотрубок и графена. В работе [20] сообщалось о получении композита CoFe2O4/графен в гидротермальном процессе “жидкость–твердый раствор”. Наночастицы CoFe2O4 могут закрепляться на графеновых листках по механизму электростатической адсорбции. Эти композиты демонстрируют высокую удельную емкость 1102 мА ч г–1 при плотности тока 0.2 A г–1 после 100 циклов, а также хорошую циклируемость. Композит CoFe2O4/углеродные нанотрубки был синтезирован с использованием альгината со структурой клеточного контейнера в качестве прекурсора [21]. Он имел 3D-структуру, в которой было достаточно пространства для расширения, к тому же содержавшую короткие пути для ионного транспорта. Удельная емкость этого композита при оптимальном содержании углеродных нанотрубок (20 вес. %) составила 874 мА ч г–1 при плотности тока 1 A г–1.
CoFe2O4 – это хорошо известный магнитно-твердый материал с высокой коэрцитивной силой и умеренной намагниченностью [22, 23]. Тем не менее, основные исследования композитов CoFe2O4/C были сосредоточены на их электрохимических свойствах при их использовании в качестве электродов. Их магнитные свойства определяются состоянием распределения электронов; они могут быть также полезны и при электрохимическом применении, хотя бы и не непосредственно. В настоящей работе типичные нанокристаллы CoFe2O4@C были синтезированы гидротермальным методом с применением глюкозы в качестве источника углерода. Для более глубокого понимания прекрасных электрохимических свойств наночастиц CoFe2O4@C мы исследовали магнитные и электрохимические свойства CoFe2O4. Насколько нам известно, очень мало работ посвящены детальному исследованию как магнитных, так и электрохимических свойств CoFe2O4@C.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Реактивы FeCl3 · 6H2O (99 вес. %), CoCl2 · 6H2O (99 вес. %), NaOH и NaBH4 были приобретены у компании Sinopharm Chemical Reagent Company (КНР). Поливинилиденфторид (HSV 900) был любезно предоставлен компанией Arkema Ltd. Раствор электролита (1 М LiPF6 в смеси этилкарбонат/диметилкарбонат/этилметилкарбонат в весовом отношении 1/1/1) был приобретен у компании Guotai Huarong Company (КНР).
Синтез наночастиц CoFe2O4
Типичный синтез нанокристаллов CoFe2O4@C проводили следующим образом: CoCl2 · 6H2O (6 мM) и FeCl3 · 6H2O (12 мM) добавляли в деионизованную воду (20 мл); затем к полученной суспензии прибавляли 1.5 мM NaOH (10 мл). После перемешивания в течение 10 мин при комнатной температуре добавляли 10 мл раствора NaBH4 (60 мM), и эту смесь продолжали перемешивать в течение еще 10 мин. Затем к полученной смеси прибавляли глюкозу и перемешивали еще 30 мин до получения однородной суспензии. Ее переносили в автоклав из нержавеющей стали, выстланный тефлоном, объемом 50 мл. Гидротермальная реакция в автоклаве продолжалась 12 ч при 200°С. Свежеприготовленные образцы отфильтровывали и промывали деионизованной водой, после чего сушили при 60°С на воздухе в течение 24 ч. Полученные продукты прокаливали при 350°С в течение 2 ч в токе N2 в муфельной печи, быстро поднимая температуру со скоростью 10°С мин–1 для того, чтобы образовались нанокристаллы CoFe2O4@C. Массовая доля C в нанокристаллах CoFe2O4@C составляла 7–30 вес. %.
Снятие характеристик продукта
Рентгеновские дифрактограммы были получены на порошковом дифрактометре Thermo ARLXTRA с геометрией Брэгга–Брентано с излучением CuKα (λ = 1.54056 Å); его разрешение 0.82 Å. Исследования методами просвечивающей электронной микроскопии (TEM) и просвечивающей электронной микроскопии высокого разрешения (HRTEM) записывали на просвечивающем электронном микроскопе FEI F20 (200 кВ). Термостойкость нанокристаллов CoFe2O4@C изучали методом термогравиметрического анализа на приборе NETZSCH TG 209 (КНР) в токе N2 при скорости сканирования 10°С мин–1. Магнитные свойства свежеприготовленного CoFe2O4 и их температурную зависимость изучали с помощью системы измерения магнитных свойств (Quantum Design) и магнетометра с вибрирующим образцом. Изотермы адсорбции и десорбции N2 получали на автоматической газосорбционной системе Quantachrome Autosorb. Удельную площадь поверхности и распределение пор по размеру определяли методом БЭТ.
Электрохимические измерения
Для приготовления рабочих электродов смешивали приготовленный активный материал, ацетиленовую сажу и поливинилиденфторид в весовом отношении 8 : 1 : 1, и полученную кашицу наносили на медную фольгу. Нагрузка активным материалом составила приблизительно 1.0 мг см–2. В качестве противоэлектрода и электрода сравнения использовался чистый металлический литий. Сепаратором служила мембрана из полипропилена (Cellgard 2500). Полуэлементы таблеточного типа CR2025 собирали в перчаточном боксе. Их электрохимическое поведение оценивали методом циклической вольтамперометрии, используя электрохимический комплекс Autolab PGSTAT302N (Швейцария). Циклические вольтамперограммы снимали в области потенциалов от 0.01 до 3.0 В при скорости развертки потенциала 0.2 мВ с–1. Циклирование полуэлементов проводили при напряжении между 0.01 и 3.0 В при различных плотностях тока. Для циклирования использовали электрохимический анализатор Neware BTS (КНР). Спектры электрохимического импеданса снимали при частотах от 0.1 МГц до 0.1 Гц, используя электрохимический комплекс Autolab PGSTAT302N.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
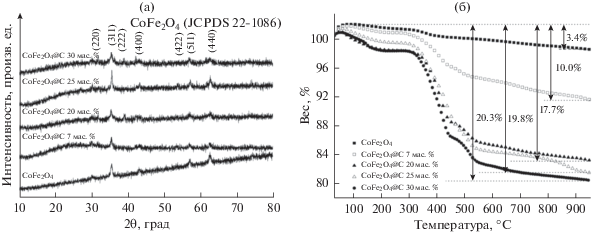
Кристаллическую структуру свежеприготовленных образцов исследовали методом рентгеновской дифракции. Рентгеновские дифрактограммы (рис. 1a) демонстрируют различные кристаллические грани: (220), (311), (222), (400), (422), (511) и (440). Они показывают, что CoFe2O4 имеет кубическую структуру шпинели (JCPDS 22-1086). Не обнаружено пиков каких-нибудь примесей. Все это означает, что наночастицы CoFe2O4@C высокой степени чистоты хорошо закристаллизованы. Для определения содержания CoFe2O4 и углерода в образцах CoFe2O4@C мы использовали термогравиметрический анализ. Термогравиметрические кривые показаны на рис. 1б. В случае наночастиц чистого CoFe2O4 полная потеря веса при температуре 950°С составляет около 3.4%. Ее можно объяснить испарением воды, разложением или сгоранием органического вещества (метаборная кислота) и испарением кристаллизационной воды. По сравнению с наночастицами чистого CoFe2O4, полная потеря веса наночастиц CoFe2O4@C составляет 10.0, 17.7, 19.8 и 20.3% и объясняется сгоранием углерода. Все эти результаты подтверждают, что наночастицы CoFe2O4@C с различным содержанием углерода успешно синтезированы.
Рис. 1.
(a) Типичные рентгеновские дифрактограммы свежеприготовленных образцов: для чистого CoFe2O4, CoFe2O4@C 7 вес. %, CoFe2O4@C 20 вес. %, CoFe2O4@C 25 вес. % и CoFe2O4@C 30 вес. %. (б) Кривые термогравиметрического анализа тех же свежеприготовленных образцов.
Для наблюдения морфологии и структуры наночастиц CoFe2O4@C мы использовали метод просвечивающей электронной микроскопии. Полученные TEM-микрофотографии представлены на рис. 2. Для образца CoFe2O4@C 20 вес. % видны наночастицы размером 5–10 нм (рис. 2a, большое увеличение).
Рис. 2.
TEM- и HRTEM-микрофотографии свежеприготовленных наночастиц CoFe2O4@C; (a) и (б) CoFe2O4@C 20 вес. %, (в) и (г) CoFe2O4@C 25 вес. %.

Согласно HRTEM-микрофотографии (рис. 2б), межплоскостное расстояние кристаллической решетки равняется 0.487 нм, что соответствует кристаллической грани (111) в CoFe2O4. В части 1 виден слой аморфного углерода между наночастицами CoFe2O4. Для образца CoFe2O4@C 25 вес. %, наночастицы CoFe2O4 показывают узкое распределение по размеру, средний размер частиц – около 10 нм. По сравнению с CoFe2O4@C 20 вес. %, на поверхности наночастиц CoFe2O4 находится большое количество аморфного углерода. Межплоскостное расстояние кристаллической решетки здесь равняется 0.254 нм, что соответствует среднему значению для кристаллической грани (311) в CoFe2O4 (рис. 2г). В части 2 наблюдается слой аморфного углерода большей площади, чем в части 1. Эти результаты подтверждают данные термогравиметрического анализа.
На рис. 3 показаны изотермы адсорбции–десорбции N2, снятые для того, чтобы охарактеризовать удельную площадь поверхности CoFe2O4@C-электродов. Удельная площадь поверхности образцов CoFe2O4@C 20 вес. % и CoFe2O4@C 25 вес. % составляет, соответственно, 54.6 и 40.7 м2 г–1. Эти значения приближаются к соответствующему значению для нанопластинок CoFe2O4, описанных, например, в работе [17]. Эта изотерма с петлей гистерезиса принадлежит к типу IV, описывающему структуру мезопор [16]. Полученные результаты показывают, что синтезированные CoFe2O4@C-электроды обладают рыхлой структурой мезопор, которая не только облегчает доступность для жидкого электролита, но также и демпфирует изменение объема во время циклов заряда–разряда [17].
Рис. 3.
Изотермы адсорбции–десорбции азота для электродов (a) CoFe2O4@C 20 вес. %, (б) CoFe2O4@C 25 вес. %.

На рис. 4a показаны петли гистерезиса намагниченности при комнатной температуре чистого CoFe2O4, CoFe2O4@C 7 вес. % и CoFe2O4@C 20 вес. %. Все эти образцы демонстрируют гистерезис намагниченности при комнатной температуре. В табл. 1 даны соответствующие значения намагниченности насыщения (Ms), остаточной намагниченности (Mr) и коэрцитивного поля (Hc) для чистого CoFe2O4, CoFe2O4@C 7 вес. % и CoFe2O4@C 20 вес. %. Значения Ms (3.70 эме/г) [эме = электромагнитная единица] и Mr (2.89 эме/г) для наночастиц чистого CoFe2O4 больше, чем для образцов CoFe2O4@C. А значение Hc для наночастиц чистого CoFe2O4 меньше, чем для образцов CoFe2O4@C. При увеличении содержания углерода значения Ms, Mr и Hc для образцов CoFe2O4@C 7 вес. % и CoFe2O4@C 20 вес. % почти одинаковы. К тому же при использовании аморфного углерода в качестве источника углерода значение Ms меньше, чем для других композитов на основе углерода, таких как углеродные нанотрубки/CoFe2O4 (29.6 эме/г) [24], многостенные углеродные нанотрубки/CoFe2O4 (23 эме/г) [25], электроспряденное C/CoFe2O4-нановолокно (42.8 эме/г) [21]. Это можно объяснить меньшим размером зерна и поверхностными дефектами CoFe2O4, присутствием аморфного углерода и внутренними напряжениями между наночастицами CoFe2O4 и аморфным углеродом [26, 27].
Рис. 4.
(a) Петли гистерезиса намагниченности при комнатной температуре, (б) температурная зависимость намагниченности в условиях охлаждения полем, измеренная при 500 Э, (в) температурная зависимость обратной магнитной восприимчивости, измеренная при 500 Э и частоте 15.2 Гц для чистого CoFe2O4, CoFe2O4@C 7 вес. % и CoFe2O4@C 20 вес. %.

Таблица 1.
Значения намагниченности насыщения (Ms), остаточной намагниченности (Mr) и коэрцитивного поля (Hc) для чистого CoFe2O4, CoFe2O4@C 7 вес. % и CoFe2O4@C 20 вес. %
| Образец | Ms, эме/г | Mr, эме/г | Hc, кЭ |
|---|---|---|---|
| CoFe2O4 | 3.70 | 2.89 | 11.18 |
| CoFe2O4@C 7 вес. % | 2.03 | 1.35 | 12.08 |
| CoFe2O4@C 20 вес. % | 1.89 | 1.12 | 13.14 |
На рис. 4б показана температурная зависимость намагниченности в условиях охлаждения полем, измеренная при 500 Э для чистого CoFe2O4, CoFe2O4@C 7 вес. % и CoFe2O4@C 20 вес. %. для наночастиц чистого CoFe2O4 температура блокирования (TB) выше ~300 K, что соответствует тепловому переходу от блокированного ферромагнитного состояния к суперпарамагнитному состоянию [28, 29]. Было показано в условиях охлаждения полем, что магнитный момент непрерывно уменьшается вплоть до 400 K. Из рис. 4в видно, что обратная магнитная восприимчивость непрерывно увеличивается вплоть до 400 K. Более того, обратная магнитная восприимчивость CoFe2O4@C выше, чем чистого CoFe2O4. Обратная магнитная восприимчивость увеличивается с ростом содержания углерода. Существенное различие в магнитных параметрах между образцами чистого CoFe2O4 и CoFe2O4@C вызвано, главным образом, слоем аморфного углерода, который гасит поверхностный магнитный момент, опрокидывая спин, и содержанием CoFe2O4 [29, 30]. Это может быть важно, хотя и в неявном виде, для электрохимического поведения CoFe2O4@C, в случае применения его в качестве анодного материала.
На рис. 5a, 5б показаны циклические вольтамперограммы электродов из чистого CoFe2O4 и CoFe2O4@C 20 вес. % для первых трех циклов в интервале напряжений от 0.01 до 3.0 В, снятые при скорости развертки потенциала 0.2 мВ с–1. На первом цикле широкий пик тока в области от 0.3 до 0.7 В для чистого CoFe2O4 соответствует восстановлению Fe3+ и Co2+ до их металлического состояния, сопровождаемому образованием слоя твердого электролита на границе раздела (SEI) в результате разложения жидкого электролита [17, 21]. При последующей анодной развертке потенциала наблюдается широкий пик тока в области от 1.3 до 1.6 В, который отвечает окислению металлических Co и Fe до их оксидов. В последующих циклах не наблюдается острых окислительно-восстановительных пиков тока ни на катодных, ни на анодных сканах, что говорит о слабой обратимости реакций на электроде из чистого CoFe2O4. Подобно кривой первого цикла для электрода из чистого CoFe2O4, электрод из композита CoFe2O4@C 20 вес. % демонстрирует широкие пики в области 0.3–0.5 В на катодном скане и 1.4–1.6 В на анодном скане. В последующих циклах катодные пики тока сдвигаются к 0.7 и 1.4 В. Явственное различие между первым и последующими циклами вызвано, главным образом, устойчивостью пленки SEI, образованной в первом цикле. Начиная со второго цикла, окислительно-восстановительные пики тока остаются почти неизменными, указывая на хорошую обратимость композитов CoFe2O4@C [17, 31, 32].
Рис. 5.
Циклические вольтамперограммы электродов из чистого CoFe2O4 (a) и CoFe2O4@C 20 вес. % (б) для трех первых циклов, снятые при скорости развертки потенциала 0.2 мВ с–1 в интервале напряжений между 0.01 и 3 В. (в) Циклируемость электродов из CoFe2O4@C при различных плотностях тока и (г) при плотности тока 50 мA г–1.

Рисунок 5в демонстрирует способность электродов из композитов CoFe2O4@C 7 вес. % и CoFe2O4@C 20 вес. % работать при различных скоростях заряда–разряда. В целом, у композита CoFe2O4@C 20 вес. % самая хорошая разрядная емкость при всех плотностях тока. С ростом плотности тока от 50 до 100, 200 и 500 мA г–1 электрод из CoFe2O4@C 20 вес. % демонстрирует емкости, соответственно, 1019, 453, 310 и 201 мА ч г–1. Если вернуть плотность тока назад к 50 мA г–1, то емкость возвращается к 302 мАч г–1. Это означает, что структура электрода из CoFe2O4@C 20 вес. % поддерживается постоянной даже после того, как он подвергается циклированию при больших токах заряда–разряда. Это явление связано главным образом с аморфной структурой и хорошей электронной проводимостью углеродных оболочек, которые представляют собой совершенные барьеры, защищающие находящиеся внутри активные материалы (CoFe2O4) и поддерживающие высокую емкость [33–35].
Далее, на рис. 5г представлена циклируемость электродов из композитов CoFe2O4@C 7 вес. % и CoFe2O4@C 20 вес. % при плотности тока 50 мA г–1. обратимая емкость электрода из CoFe2O4@C 20 вес. % после 100 циклов равна 353 мА ч г–1. У электрода из CoFe2O4@C 7 вес. % емкость ниже, но он так же стабилен, как и электрод из CoFe2O4@C 20 вес. %. Эти результаты показывают, что создание углеродного покрытия помогает улучшить циклируемость электродов. Однако оказалось, что обратимая емкость наших электродов ниже, чем в других работах [18, 19, 36–39]. Этот результат может быть следствием высокого содержания углеродной компоненты в электродах из CoFe2O4@C; определение оптимального отношения CoFe2O4/C требует более глубокого изучения в будущей работе.
На рис. 6a показаны типичные циклические вольтамперограммы электрода из CoFe2O4@C 20 вес. %, снятые при различных скоростях развертки потенциала. Площадь под кривыми представляет собой полный запасенный заряд, который можно разделить на три составляющих: фарадеевский вклад от процесса внедрения Li+, фарадеевский вклад от псевдоемкости и нефарадеевский вклад от заряжения двойного слоя [40]. Две последние емкостные компоненты можно выделить, анализируя циклические вольтамперограммы, снятые при различных скоростях развертки потенциала (v), с использованием следующих уравнений:
где a и b – подгоночные параметры, которые можно найти путем линейного фитинга зависимостей lg i от lg v. Теоретически, при b = 0.5 ток можно считать относящимся к фарадеевскому процессу внедрения, а при b = 1.0 ток имеет емкостную природу. Как показано на рис. 6б, значения b, вычисленные при скоростях развертки потенциала 0.2–0.8 и 1.0–5.0 мВ с–1, равны соответственно 0.29 и 0.45. Это означает, что при скорости развертки потенциала 0.2–5.0 мВ с–1 токи вызваны главным образом фарадеевским процессом.Рис. 6.
Электрохимические свойства электрода из CoFe2O4@C 20 вес. %: (a) циклические вольтамперограммы, снятые при различных скоростяхи развертки потенциала между 0.2 и 1.0 мВ с–1. (б) Фитинг значения b для пиковых токов. (в) Доля вкладов в емкость при различных скоростях развертки потенциала. (г) Годографы, снятые до и после записи циклических вольтамперограмм.

Вклад емкости в измеряемый ток может быть количественно выделен путем анализа циклических вольтамперограмм, снятых при различных скоростях развертки потенциала, с помощью следующего уравнения [40–42]:
(3)
$i\,\,\left( {\text{V}} \right) = {{k}_{1}}v + {{k}_{2}}{{v}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}.$Для анализа его можно записать в следующем виде:
(4)
${{i\,\,\left( {\text{V}} \right)} \mathord{\left/ {\vphantom {{i\,\,\left( {\text{V}} \right)} {{{v}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}}} \right. \kern-0em} {{{v}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}} = {{k}_{1}}{{v}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} + {{k}_{2}}.$В уравнении (3) k1v и k2${{v}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ отвечают соответственно вкладам емкостного процесса и фарадеевского процесса внедрения. Значения k1 и k2 были получены из наклона прямой и отрезка, отсекаемого ею на оси y, с использованием уравнения (4). Основываясь на вышеприведенном анализе, мы демонстрируем на рис. 6в вклады от двух типов запасания энергии при различных скоростях развертки потенциала. С ростом скорости развертки потенциала от 0.2 до 1.0 мВ с–1 доля емкости, контролируемой фарадеевским процессом внедрения, сокращается с 81.0 до 65.6%, в то время как доля емкости электрода “емкостного” происхождения выросла с 29.0 до 34.4%. Таким образом, электрод из композита CoFe2O4@C 20 вес. % показал наилучшую циклируемость при высоких скоростях заряда–разряда.
Далее, причины улучшения электрохимических характеристик электрода из композита CoFe2O4@C 20 вес. % были исследованы методом спектроскопии электрохимического импеданса. На рис. 6г показаны годографы этого электрода в высокочастотной области до и после снятия циклических вольтамперограмм при различных скоростях развертки потенциала. Импеданс до снятия циклических вольтамперограмм намного больше, чем после их снятия, что, возможно, объясняется образованием пленки SEI в ходе заряда и разряда [43].
ЗАКЛЮЧЕНИЕ
Типичные нанокристаллы CoFe2O4@C синтезированы гидротермальным методом с использованием глюкозы в качестве источника углерода. Исследованы их магнитные и электрохимические свойства с целью выяснить факторы, влияющие на их электрохимическое поведение. Значения Ms (1.89 эме/г) и Mr (1.12 эме/г) наночастиц CoFe2O4@C меньше, чем для образцов чистого CoFe2O. Это изменение магнитных свойств можно объяснить наличием слоя углерода, гасящего поверхностный магнитный момент за счет опрокидывания спина. Благодаря аморфной структуре и хорошей электронной проводимости углеродных оболочек, электрод CoFe2O4@C 20 вес. % демонстрирует хорошую циклируемость и высокую обратимую емкость: до 353 мА ч г–1 после 100 циклов при плотности тока 50 мA г–1.
ФИНАНСИРОВАНИЕ РАБОТЫ
Настоящая работа поддержана Национальным фондом естественных наук КНР (проекты № 51502258 и 51503176), Научно-технологическим проектом провинции Хэнань (проект № 182102210503) и Отделением ключевых проектов в области образования, наук и технологиии провинции Хэнань (проекты № 16A430007 и 18B150027).
Список литературы
Mourad, E., Coustan, L., Lannelongue, P., Zigah, D., Mehdi, A., Vioux, A., Freunberger, Stefan A., Favier, F., and Fontaine, O., Biredox ionic liquids with solid-like redox density in the liquid state for high-energy supercapacitors, Nat. Mater, 2016, vol. 16, p. 446.
Christudas Dargily, N., Thimmappa, R., Manzoor Bhat, Z., Devendrachari, M.C., Kottaichamy, A.R., Gautam, M., Shafi, S.P., and Thotiyl, M.O., A Rechargeable Hydrogen Battery, J. Phys. Chem. Lett., 2018, vol. 9, p. 2492.
Thimmappa, R., Paswan, B., Gaikwad, P., Devendrachari, M.C., Makri Nimbegondi Kotresh, H., Rani Mohan, R., Pattayil Alias, J., and Thotiyl, M.O., Chemically Chargeable Photo Battery, J. Phys. Chem. C, 2015, vol. 119, p. 14010.
Bhat, Z.M., Thimmappa, R., Devendrachari, M.C., Shafi, S.P., Aralekallu, S., Kottaichamy, A.R., Gautam, M., and Thotiyl, M.O., A Direct Alcohol Fuel Cell Driven by an Outer Sphere Positive Electrode, J. Phys. Chem. Lett., 2017, vol. 8, p. 3523.
Xu, J., Ma, J., Fan, Q., Guo, S., and Dou, S., Recent Progress in the Design of Advanced Cathode Materials and Battery Models for High-Performance Lithium-X (X = O2, S, Se, Te, I2, Br2) Batteries, Adv. Mater, 2017, vol. 29, p. 1606454.
Sun, C., Liu, J., Gong, Y., Wilkinson, D.P., and Zhang, J., Recent advances in all-solid-state rechargeable lithium batteries, Nano Energy, 2017, vol. 33, p. 363.
Zhang, Y., Jiao, Y., Liao, M., Wang, B., and Peng, H., Carbon nanomaterials for flexible lithium ion batteries, Carbon, 2017, vol. 124, p. 79.
Wei, Q., Xiong, F., Tan, S., Huang, L., Lan, E.H., Dunn, B., and Mai, L., Porous One-Dimensional Nanomaterials: Design, Fabrication and Applications in Electrochemical Energy Storage, Adv. Mater, 2017, vol. 29, p. 1602300.
Cong, L., Xie, H., and Li, J., Hierarchical Structures Based on Two-Dimensional Nanomaterials for Rechargeable Lithium Batteries, Adv. Energy Mater., 2017, vol. 7, p. 1601906.
Sun, Y., Liu, N., and Cui, Y., Promises and challenges of nanomaterials for lithium-based rechargeable batteries, Nature Energy, 2016, vol. 1, p. 16071.
Sheng, T., Xu, Y.F., Jiang, Y.X., Huang, L., Tian, N., Zhou, Z.Y., Broadwell, I., and Sun, S.G., Structure Design and Performance Tuning of Nanomaterials for Electrochemical Energy Conversion and Storage, Acc. Chem. Res., 2016, vol. 49, p. 2569.
Ding, Y., Yang, Y., and Shao, H., Synthesis and characterization of nanostructured CuFe2O4 anode material for lithium ion battery, Solid State Ionics, 2012, vol. 217, p. 27.
Sharma, Y., Sharma, N., Rao, G.V.S., and Chowdari, B.V.R., Lithium recycling behaviour of nano-phase-CuCo2O4 as anode for lithium-ion batteries, J. Power Sources, 2007, vol. 173, p. 495.
Nuli, Y., Zhang, P., Guo, Z., Liu, H., and Yang, J., NiCo2O4 /C Nanocomposite as a Highly Reversible Anode Material for Lithium-Ion Batteries, Electrochem. Solid-State Lett., 2008, vol. 11, p. A64.
Sharma, Y., Sharma, N., Subbarao, G., and Chowdari, B., Studies on spinel cobaltites, FeCo2O4 and MgCo2O4 as anodes for Li-ion batteries, Solid State Ionics, 2008, vol. 179, p. 587.
Zhang, X., Li, D., Zhu, G., Lu, T., and Pan, L., Porous CoFe2O4 nanocubes derived from metal-organic frameworks as high-performance anode for sodium ion batteries, J. Colloid Interface Sci., 2017, vol. 499, p. 145.
Wang, Z., Fei, P., Xiong, H., Qin, C., Zhao, W., and Liu, X., CoFe2O4 nanoplates synthesized by dealloying method as high performance Li-ion battery anodes, Electrochim. Acta, 2017, vol. 252, p. 295.
Wu, L., Xiao, Q., Li, Z., Lei, G., Zhang, P., and Wang, L., CoFe2O4/C composite fibers as anode materials for lithium-ion batteries with stable and high electrochemical performance, Solid State Ionics, 2012, vol. 215, p. 24.
Li, Z.H., Zhao, T.P., Zhan, X.Y., Gao, D.S., Xiao, Q.Z., and Lei, G.T., High capacity three-dimensional ordered macroporous CoFe2O4 as anode material for lithium ion batteries, Electrochim. Acta, 2010, vol. 55, p. 4594.
Zhu, Y., Lv, X., Zhang, L., Guo, X., Liu, D., Chen, J., and Ji, J., Liquid-Solid-Solution Assembly of CoFe2O4/Graphene Nanocomposite as a High-Performance Lithium-Ion Battery Anode, Electrochim. Acta, 2016, vol. 215, p. 247.
Sun, X., Zhu, X., Yang, X., Sun, J., Xia, Y., and Yang, D., CoFe2O4/carbon nanotube aerogels as high performance anodes for lithium ion batteries, Green Energy Environment, 2017, vol. 2, p. 160.
Maaz, K., Mumtaz, A., Hasanain, S.K., and Ceylan, A., Synthesis and magnetic properties of cobalt ferrite (CoFe2O4) nanoparticles prepared by wet chemical route, J. Magnetism Magnetic Mater., 2007, vol. 308, p. 289.
Nabiyouni, G., Sharifi, S., Ghanbari, D., and Salavati-Niasari, M., A Simple Precipitation Method for Synthesis CoFe2O4 Nanoparticles, J. Nanostructures, 2014, vol. 4, p. 317.
Jiang, W., Liu, Y., Li, F., Chu, J., and Chen, K., Superparamagnetic cobalt-ferrite-modified carbon nanotubes using a facile method, Mater. Sci. Eng.: B, 2010, vol. 166, p. 132.
Gonzalez-Sandoval, M.P., Beesley, A.M., Miki-Yoshida, M., Fuentes-Cobas, L., and Matutes-Aquino, J.A., Comparative study of the microstructural and magnetic properties of spinel ferrites obtained by co-precipitation, J. Alloy Compd., 2004, vol. 369, p. 190.
Rajendran, M., Pullar, R.C., Bhattacharya, A.K., Das, D., Chintalapudi, S.N., and Majumdar, C. K., Magnetic properties of nanocrystalline CoFe2O4 powders prepared at room temperature: variation with crystallite size, J. Magnetism Magnetic Mater., 2001, vol. 232, p. 71.
Meng, Y., Chen, D., and Jiao, X., Synthesis and Characterization of CoFe2O4 Hollow Spheres, European J. Inorg. Chem., 2008, vol. 2008, p. 4019.
Nilmoung, S., Kidkhunthod, P., Pinitsoontorn, S., Rujirawat, S., Yimnirun, R., and Maensiri, S., Fabrication, structure, and magnetic properties of electrospun carbon/cobalt ferrite (C/CoFe2O4) composite nanofibers, Appl. Phys. A, 2015, vol. 119, p. 141.
Varma, P.C.R., Manna, R.S., Banerjee, D., Varma, M.R., Suresh, K.G., and Nigam, A.K., Magnetic properties of CoFe2O4 synthesized by solid state, citrate precursor and polymerized complex methods: A comparative study, J. Alloy Compd., 2008, vol. 453, p. 298.
García-Otero, J., Porto, M., Rivas, J., and Bunde, A., Influence of Dipolar Interaction on Magnetic Properties of Ultrafine Ferromagnetic Particles, Phys. Rev. Lett., 2000, vol. 84, p. 167.
Wang, J., Yang, G., Wang, L., Yan, W., and Wei, W., C@CoFe2O4 fiber-in-tube mesoporous nanostructure: Formation mechanism and high electrochemical performance as an anode for lithium-ion batteries, J. Alloy Compd., 2017, vol. 693, p. 110.
Zhao, S., Guo, J., Jiang, F., Su, Q., and Du, G., Porous CoFe2O4 nanowire arrays on carbon cloth as binder-free anodes for flexible lithium-ion batteries, Mater. Res. Bull., 2016, vol. 79, p. 22.
Zhang, W.-M., Wu, X.-L., Hu, J.-S., Guo, Y.-G., and Wan, L.-J., Carbon Coated Fe3O4 Nanospindles as a Superior Anode Material for Lithium-Ion Batteries, Adv. Functional Mater., 2008, vol. 18, p. 3941.
Zhu, T., Chen, J.S., and Lou, X.W., Glucose-Assisted One-Pot Synthesis of FeOOH Nanorods and Their Transformation to Fe3O4@Carbon Nanorods for Application in Lithium Ion Batteries, J. Phys. Chem. C, 2011, vol. 115, p. 9814.
Zhang, M., Yang, X., Kan, X., Wang, X., Ma, L., and Jia, M., Carbon-encapsulated CoFe2O4/graphene nanocomposite as high performance anode for lithium ion batteries, Electrochim. Acta, 2013, vol. 112, p. 727.
Qi, W., Li, P., Wu, Y., Zeng, H., Hou, L., Kuang, C., Yao, P., and Zhou, S., Facile synthesis of CoFe2O4 nanoparticles anchored on graphene sheets for enhanced performance of lithium ion battery, Progr. Natural Sci.: Mater. Int., 2016, vol. 26, p. 498.
Wang, B., Li, S., Liu, J., Yu, M., Li, B., and Wu, X., An efficient route to a hierarchical CoFe2O4@graphene hybrid films with superior cycling stability and rate capability for lithium storage, Electrochim. Acta, 2014, vol. 146, p. 679.
Ren, S., Zhao, X., Chen, R., and Fichtner, M., A facile synthesis of encapsulated CoFe2O4 into carbon nanofibres and its application as conversion anodes for lithium ion batteries, J. Power Sources, 2014, vol. 260, p. 205.
Xia, H., Zhu, D., Fu, Y., and Wang, X., CoFe2O4-graphene nanocomposite as a high-capacity anode material for lithium-ion batteries, Electrochim. Acta, 2012, vol. 83, p. 166.
Brezesinski, T., Wang, J., Polleux, J., Dunn, B., and Tolbert, S. H., Templated Nanocrystal-Based Porous TiO2 Films for Next-Generation Electrochemical Capacitors, J. Amer. Chem. Soc., 2009, vol. 131, p. 1802.
Wang, J., Polleux, J., Lim, J., and Dunn, B., Pseudocapacitive Contributions to Electrochemical Energy Storage in TiO2 (Anatase) Nanoparticles, J. Phys. Chem. C, 2007, vol. 111, p. 14925.
Liu, T.C., Pell, W.G., Conway, B.E., and Roberson, S.L., Behavior of Molybdenum Nitrides as Materials for Electrochemical Capacitors: Comparison with Ruthenium Oxide, J. Electrochem. Soc., 1998, vol. 145, p. 1882.
Wu, L., Li, H., Xie, X., Chai, K., Han, P., Zhang, C., and Yang, C., Study on the effect of liquid nitrogen cold-quenching on electrochemical characteristic of TiO2 complex flakes with edged-curled derived from MAX as anode for lithium ion batteries, J. Alloy Compd., 2019, vol. 780, p. 482.
Дополнительные материалы отсутствуют.


