Электрохимия, 2019, T. 55, № 10, стр. 1215-1225
О возможности определения термодинамических функций электрохимической системы Li–S методом ЭДС
Е. В. Кузьмина a, *, Е. В. Карасева a, Н. В. Чудова a, b, А. А. Мельникова a, b, В. С. Колосницын a, b, **
a Уфимский Институт химии – обособленное структурное подразделение
Федерального государственного бюджетного научного учреждения Уфимского федерального
исследовательского центра Российской академии наук
450054 Уфа, просп. Октября, 69, Россия
b ФГБОУ ВО Уфимский государственный нефтяной технический университет
450062 Уфа, ул. Космонавтов, 1, Россия
* E-mail: kuzmina@anrb.ru
** E-mail: kolos@anrb.ru
Поступила в редакцию 18.09.2018
После доработки 17.12.2018
Принята к публикации 29.01.2019
Аннотация
В работе оценена применимость метода ЭДС для определения величин термодинамических функций электрохимической системы Li–S в литий-серных ячейках, находящихся в различных зарядовых состояниях. Показано, что метод ЭДС может быть применен для определения величин термодинамических функций электрохимической системы Li–S для литий-серных ячеек, находящихся в различных разрядовых состояниях только на первом зарядно-разрядном цикле. На последующих зарядно-разрядных циклах из-за нарушения равновесности электрохимической системы в результате прямого химического взаимодействия серы и длинноцепных полисульфидов лития (Li2Sn, n > 4) с металлическим литиевым электродом метод ЭДС не применим. Термодинамические функции системы Li–S с различной степенью восстановления серы изменяются в диапазонах: ΔG = –480…–410 кДж/моль; ΔН = –490…–420 кДж/моль и ΔS = –120…–20 Дж/(моль К) при температуре 303 К. Выполнены квантово-химические расчеты величин термодинамических функций электрохимического восстановления серы и полисульфидов лития. Расчетные значения термодинамических функций удовлетворительно совпадают с измеренными величинами. Оценен термодинамический коэффициент полезного действия преобразования энергии при разряде литий-серных ячеек при 30°С, который изменяется в диапазоне 93–98%.
ВВЕДЕНИЕ
Электрохимическая система Li–S является одной из наиболее перспективных для создания аккумуляторов с рекордными энергетическими характеристиками. Теоретическая удельная энергия электрохимической системы литий-сера составляет 2300–2600 Вт ч/кг [1, 2], что более чем в 5 раз выше теоретической удельной энергии литий-ионных систем. Поскольку обычно удельная энергия аккумуляторных ячеек составляет 25–50% от теоретического значения используемой электрохимической системы, ожидается, что литий-серные аккумуляторы будут обладать удельной энергией до 600–700 Вт ч/кг.
Литий-серные аккумуляторы относят к аккумуляторам с жидким катодом, поскольку активные материалы положительного электрода – сера и полисульфиды лития – промежуточные продукты восстановления серы и окисления сульфида лития – растворены в электролитной системе [3, 4].
На разрядных и зарядных кривых литий-серных ячеек (ЛСЯ) наблюдаются две площадки: высоковольтная (2.5–2.3 В) и низковольтная (2.0–1.5 В) и два участка с большим наклоном, соответствующие переходу с высоковольтной площадки на низковольтную (2.3–2.0 В) и резкому понижению потенциала в конце разряда (2.0–1.5 В). Сложная форма разрядной кривой указывает на многостадийный процесс электрохимического восстановления серы при разряде до сульфида лития и окисления сульфида лития до элементарной серы при заряде.
При разряде литий-серных ячеек сера – активный компонент положительного электрода – электрохимически восстанавливается до сульфида лития через ряд промежуточных стадий (уравнения (1)–(6)) [4, 5]. Схема процесса электрохимического восстановления серы носит предположительный характер и не исключает протекание других реакций. Реальный механизм процессов, протекающих при разряде литий-серных ячеек, более сложен и до сих пор в полном объеме не изучен.
Высоковольтная стадия
(1)
${{{\text{S}}}_{8}} + 2{\text{L}}{{{\text{i}}}^{ + }} + 2{\text{e}} \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{8}}}},$(2)
${\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{8}}}} + 2{\text{L}}{{{\text{i}}}^{ + }} + 2{\text{e}} \to 2{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{4}}}}.$Низковольтная стадия
(3)
$2{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{4}}}} + 4{\text{L}}{{{\text{i}}}^{ + }} + 4{\text{e}} \to 2{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{S}} \downarrow + \,\,2{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{3}}}},$(4)
$2{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{3}}}} \leftrightarrow {\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{4}}}} + {\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}},$(5)
${\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{3}}}} + 2{\text{L}}{{{\text{i}}}^{ + }} + 2{\text{e}} \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{S}} \downarrow + \,\,{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}},$(6)
${\text{2L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}} + 4{\text{L}}{{{\text{i}}}^{ + }} + 4{\text{e}} \to {\text{4L}}{{{\text{i}}}_{{\text{2}}}}{\text{S}} \downarrow .$Из-за кинетических затруднений при разряде литий-серных ячеек сера полностью не восстанавливается до сульфида лития. Разрядная емкость литий-серных ячеек в расcчете на вес серы изменяется в диапазоне 800–1400 мА ч/г(S) [6]. Конечным продуктом восстановления серы является смесь коротко-цепных полисульфидов лития и серы. Например, при разрядной емкости 1350 мА ч/г(S) наиболее вероятным продуктом восстановления серы является смесь 2Li2S–Li2S2.
При заряде образовавшийся сульфид лития электрохимически окисляется до серы через ряд промежуточных стадий (уравнения (7)–(8)) [4, 7].
Низковольтная стадия
(7)
$n{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{S}} \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{n}} + \left( {2n - 1} \right){\text{L}}{{{\text{i}}}^{ + }} + 2\left( {n - 1} \right){\text{e}}.$Высоковольтная стадия
(8)
${\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{n}} \to n{\text{S}} + 2{\text{L}}{{{\text{i}}}^{ + }} + 2{\text{e}}{\text{.}}$Важным критерием, характеризующим электрохимические ячейки, является термодинамический коэффициент полезного действия (КПД) [8]. Этот коэффициент определяет ту часть химической энергии, которая может быть преобразована в работу в обратимом гальваническом элементе. Максимальный термодинамический КПД определяется термодинамическими свойствами электрохимических систем, используемых в электрохимических ячейках (далее ячейки), и может быть рассчитан по уравнению (9):
(9)
${\text{КПД}} = {{\Delta G} \mathord{\left/ {\vphantom {{\Delta G} {\Delta H}}} \right. \kern-0em} {\Delta H}} = 1 - {{T\Delta S} \mathord{\left/ {\vphantom {{T\Delta S} {\Delta H}}} \right. \kern-0em} {\Delta H}},$Существуют два основных метода определения термодинамических характеристик электрохимических реакций: калориметрический и метод ЭДС [8–12]. Более простым в исполнении и аппаратурном оформлении является метод ЭДС. Он широко используется для определения термодинамических свойств различных активных компонентов положительных и отрицательных электродов электрохимических источников тока с твердофазными активными компонентами электродов [13–17]. Метод ЭДС универсален и может быть использован для определения термодинамических свойств электрохимических систем и с растворимыми активными материалами электродов, например, таких как электрохимическая система литий–сера.
Следует отметить, что применимость метода ЭДС для определения термодинамических характеристик электрохимической системы Li–S может быть осложнена изменением окислительно-восстановительного состояния системы в результате прямого химического взаимодействия растворенных в электролите серы и полисульфидов лития с металлическим литиевым электродом в процессе измерения температурной зависимости ЭДС (уравнения (10), (11)) [18].
(10)
$n{\text{S}} + 2{\text{Li}} \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{n}}\,\,\left( {n \geqslant 1} \right),$(11)
${\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{n}} + 2k{\text{Li}} \to k{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{S}} + {\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{m}}\,\,\left( {n = m + k} \right).$Целью данной работы была оценка возможности применения метода ЭДС для определения значений величин ΔH, ΔG и ΔS системы Li–S при разной степени восстановления серы в литий-серных ячейках и эффективности преобразования химической энергии в электрическую.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования
Объектами исследования были призматические литий-серные ячейки в металополимерном герметичном корпусе (pouch cell).
В качестве отрицательного электрода использовали металлическую литиевую фольгу толщиной 120 мкм, изготовленную из лития марки ЛЭ‑1 (99.9%, ГОСТ 8774-75). Размер литиевого электрода составлял 25 × 25 мм.
Положительным электродом был серный электрод, представляющий собой однородную смесь 70 мас. % S (“ос. ч.” 15–3, Россия), 10 мас. % C (сажа Ketjenblack EC-600 JD, Akzo Nobel) и 20 мас. % ПЭО (полиэтиленоксид, ММ 4 млн, Sigma Aldrich), нанесенную на алюминиевую фольгу [19]. Размер серного электрода составлял 27 × 27 мм.
В работе использовался один слой сепарационного материала Celgard®3501. Размер сепаратора составлял 32 × 32 мм.
В качестве электролита использовали 1 M раствор LiSO3CF3 в сульфолане и 1 М раствор LiClO4 в сульфолане. Количество электролита составляло 4 мкл/мА ч(S).
Все операции по сборке ячеек выполняли в перчаточном боксе в атмосфере сухого воздуха (содержание воды не превышало 10 ppm).
После сборки ячейки выдерживали при 30°С 24 ч для установления равновесия в них. Точность стабилизации температуры составляла ±0.1°С.
Измерение термодинамических функций
Заряд и разряд осуществляли в гальваностатическом режиме с помощью многоканального потенциостата-гальваностата [20]. Плотность зарядного и разрядного тока составляла 0.1 мА/см2. Заряд и разряд ячеек осуществляли при температуре 30 ± 0.1°С. Для термостатирования электрохимических ячеек при разряде и измерения температурных зависимостей НРЦ использовали термостат ТСО-1/80 СПУ (Россия).
Температурную зависимость НРЦ ячеек измеряли в температурном диапазоне 10–40°С. Величины НРЦ ячеек регистрировали с помощью цифрового вольтметра В7-38 (пределы основной погрешности ±(0.07 + 0.02 Uп/Uх), входное сопротивление 10 МОм ±5%).
Регистрацию температурных зависимостей НРЦ проводили согласно схеме, приведенной на рис. 1. После сборки литий-серные ячейки помещали в термостат и выдерживали при 30°С, периодически измеряя НРЦ ячеек с интервалом 10–15 мин, до достижения стационарного состояния (скорость изменения НРЦ не превышала 0.2 мВ/ч). Затем фиксировали значение НРЦ и устанавливали новую температуру. Вновь дожидались стационарного состояния и фиксировали значение НРЦ ячеек. По окончании регистрации температурной зависимости НРЦ, литий-серные ячейки в гальваностатическом режиме при температуре 30°С разряжали на заданную глубину и повторяли процедуру регистрации температурной зависимости НРЦ ячеек.
Рис. 1.
Схема проведения эксперимента для измерения величин термодинамических функций потенциалобразующих реакций в процессе разряда литий-серных ячеек.

Порядок сканирования температуры был следующий: первоначально ячейки нагревали до 40°C и с шагом в 5°С охлаждали до 10°C, затем ячейки нагревали до 40°C с шагом в 10°С и снова охлаждали до 30°C.
Значения термодинамических функций рассчитывали на основании уравнений (12)–(14).
где ΔG – изменение энергии Гиббса, кДж/моль; ΔH – изменение энтальпии, кДж/моль; ΔS – изменение энтропии, Дж/(моль К); n – количество электронов, принимающих участие в электрохимической реакции; F – постоянная Фарадея, 96500 Кл/моль; E – НРЦ ячейки, В; (δE/δT)P – тангенс угла наклона зависимости НРЦ от температуры, В/К.Квантово-химические расчеты термодинамических функций системы Li–S при различных степенях восстановления серы (DFT-исследования)
Термодинамические функции электрохимического восстановления серы и полисульфидов лития также были рассчитаны методами квантовой химии.
Поиск равновесных геометрических параметров и расчет энергетических характеристик выполняли методом CAM-B3LYP/aug-CC-pVTZ с помощью программного продукта GAUSSIAN 09 [21].
Погрешность расчетов зависит от численного метода решения самосогласованного поля. В данной работе нами не изменялись параметры сходимости и использовались величины, заданные в программе Gaussian 09 по умолчанию. В частности, в единицах Хартри погрешность определения энергии составляет 0.000001.
Термодинамические функции образования полисульфидов лития рассчитывали при стандартных условиях при температуре 303 K, согласно [22]. Величины изменения энтальпии образования и энтропии образования полисульфидов лития приведены с учетом термической поправки и энергии нулевых колебаний.
Термодинамические функции восстановления серы и полисульфидов лития рассчитывали как разность термодинамических функций образования конечных продуктов и исходных реагентов, по закону Гесса.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка применимости метода ЭДС для определения термодинамических функций системы Li–S при различных степенях восстановления серы
Первоначально нами была оценена применимость метода ЭДС для определения термодинамических функций электрохимических реакций, протекающих при разряде и заряде литий-серных ячеек. Критерием применимости метода являлась воспроизводимость температурных зависимостей ЭДС ячеек при их нагреве и охлаждении.
Нами установлено, что предыстория литий-серных ячеек оказывает влияние на воспроизводимость температурных зависимостей НРЦ ячеек при нагреве и охлаждении. На первом цикле разряда ЛСЯ наблюдаются прямолинейные температурные зависимости НРЦ ячеек, разряженных на различную глубину. Эти зависимости хорошо воспроизводятся как при нагреве, так и при охлаждении (рис. 2а, 2б). На основании этого можно утверждать, что измеренные значения НРЦ ячеек равны ЭДС электрохимической системы Li–S.
Рис. 2.
Температурные зависимости НРЦ литий-серных ячеек на 1 цикле (а, б) и на 2 цикле (в, г). Высоковольтная стадия – глубина разряда 50–100 мА ч/г(S) (а, в) и низковольтная стадия – 500–600 мА ч/г(S) (б, г).
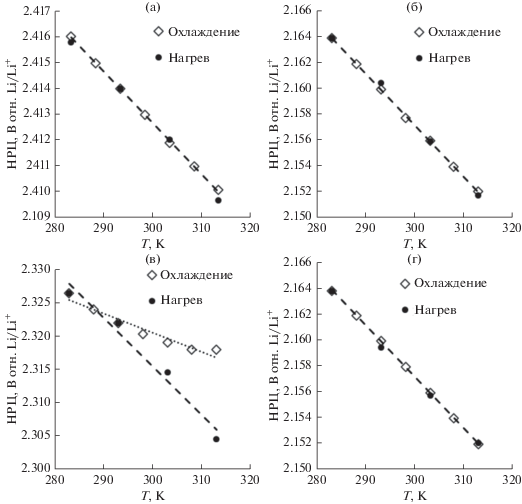
На 2-м зарядно-разрядном цикле температурные зависимости ЭДС ячеек, зарядовое состояние которых соответствует высоковольтной площадке на разрядных кривых, не совпадают (рис. 2в). В то же время температурные зависимости ЭДС литий-серных ячеек, зарядовое состояние которых соответствует низковольтной площадке на разрядных кривых литий-серных ячеек, хорошо воспроизводятся как при нагреве, так и охлаждении (рис. 2г).
Аналогичные различия в температурных зависимостях ЭДС литий-серных ячеек в различных зарядовых состояниях наблюдаются и на последующих зарядно-разрядных циклах.
Отсутствие воспроизводимости температурных зависимостей ЭДС литий-серных ячеек, зарядовое состояние которых соответствует высоковольтной стадии разряда, обусловлено прямым химическим взаимодействием серы и длинноцепных полисульфидов лития, растворенных в электролите, с металлическим литием (уравнения (10) и (11)).
Различия в поведении температурных зависимостей ЭДС литий-серных ячеек, зарядовое состояние которых соответствует высоковольтной и низковольтной стадии разряда, указывают на различия в химической активности полисульфидов лития, образующихся на высоковольтной и низковольтной стадиях разряда, по отношению к металлическому литию. На высоковольтных стадиях заряда и разряда литий-серных ячеек в электролите присутствуют сера и длинноцепные полисульфиды лития (Li2Sn, n > 4), а на низковольтных стадиях – короткоцепные полисульфиды лития (Li2Sn, n ≤ 4). Отсутствие воспроизводимости температурных зависимостей ЭДС (НРЦ) литий-серных ячеек, находящихся в зарядовых состояниях, соответствующих высоковольтной стадии, указывает на более высокую реакционную способность длинноцепных полисульфидов лития по отношению к металлическому литию, чем короткоцепных полисульфидов лития.
Таким образом, проведенные исследования показали, что потенциометрический метод может быть использован для определения термодинамических функций потенциалобразующих процессов, протекающих при разряде и заряде литий-серных ячеек. Однако применимость метода ЭДС имеет ограничения. Данный метод возможно использовать при разряде литий-серных ячеек на первом цикле во всех зарядовых состояниях, а на последующих зарядно-разрядных циклах – только на низковольтных стадиях.
ЭДС системы Li–S при различных степенях восстановления серы
При разряде литий-серных ячеек происходит постепенное увеличение степени восстановления серы, например: S0 → ${\text{L}}{{{\text{i}}}_{2}}{\text{S}}_{8}^{{ - 0.25}}$ → ${\text{L}}{{{\text{i}}}_{2}}{\text{S}}_{4}^{{ - 0.5}}$ → ${\text{L}}{{{\text{i}}}_{2}}{\text{S}}_{2}^{{ - 1}}$ → → Li2S–2.
Формы кривых изменения ЭДС от степени восстановления серы и напряжения при разряде литий-серных ячеек подобны, но не идентичны (рис. 3а, 3г). На первом участке формы кривых изменения величин ЭДС и напряжения полностью совпадают, а величины различаются на 5–10 мВ.
Рис. 3.
Зависимость величин термодинамических функций системы Li–S от степени восстановления серы (а–г) при 30°С. Разрядная кривая литий-серных ячеек (а, г). Состав электролитного раствора: 1 M LiSO3CF3 в сульфолане (а–в) и 1 M LiClO4 в сульфолане (г–е).

На втором участке кривых величины ЭДС и напряжения уменьшаются с разной скоростью. Наклон кривой изменения напряжения больше, чем наклон кривой изменения ЭДС. Напряжение литий-серных ячеек становится значительно меньше ЭДС (на ~100 мВ). На последнем третьем участке ЭДС системы Li–S не зависит от степени восстановления серы в отличии от напряжения: кривая изменения напряжения – выпуклая, и при глубоких конверсиях серы напряжение резко уменьшается. ЭДС системы значительно выше разрядного напряжения (~200 мВ). Отклонение напряжения разряда ячеек от ЭДС обусловлено кинетическими затруднениями электрохимического восстановления короткоцепных полисульфидов лития до сульфида лития. Кинетические затруднения электрохимического восстановления полисульфидов лития частично охарактеризованы методами гальваностатического прерывистого титрования [23] и спектроскопии электрохимического импеданса [24, 25]. Резкое уменьшение напряжения при больших глубинах конверсии серы объясняется пассивацией поверхности токопроводящего каркаса положительного электрода нерастворимыми продуктами восстановления серы – Li2S2 и Li2S [26, 27].
Величины термодинамических функций (ΔH, ΔG, ΔS) системы Li–S при различных степенях восстановления серы
Величины ΔH, ΔG, ΔS системы Li–S изменяются сложным образом в зависимости от степени восстановления серы (рис. 3). На кривых изменения величин ΔH, ΔG, ΔS от степени восстановления серы наблюдаются участки, на которых исследуемые величины не изменяются или изменяются скачкообразно или плавно. Излом на кривых изменения ΔG и скачкообразное изменение ΔS, ΔH указывают на фазовые переходы первого рода. Плавное изменение ΔG, ΔH и ΔS – на фазовые переходы второго рода. Различный характер изменения величин ΔH, ΔG, ΔS указывает на то, что в системе Li–S происходят фазовые переходы как 1-го, так и 2-го рода.
На начальных участках зависимостей величин термодинамических функций от степени восстановления серы при достижении средней степени восстановления серы –0.25 (разрядная емкость ≈200 мА ч/г(S)) наблюдается излом на кривой изменения ΔG и скачкообразное изменение величин ΔH, ΔS. Это указывает на фазовый переход 1‑го рода. Наиболее вероятно, он обусловлен полным растворением серы с образованием растворимого октасульфида лития (уравнение (1)).
На 2-м участке, выделенном на кривых изменения термодинамических функций от степени восстановления серы –0.25…–0.50 (разрядная емкость ≈200–400 мА ч/г(S)), наблюдается плавное изменение величин ΔG, ΔH и ΔS (рис. 3). Для данного состояния системы характерно присутствие полисульфидов лития различного состава в электролитном растворе [28–31].
На последнем 3-м участке величины ΔG, ΔH и ΔS практически не изменяются. Постоянство термодинамических величин может указывать на равновесие между наиболее устойчивыми полисульфидами лития, например между Li2S4/Li2S2 и Li2S2/Li2S.
DFT-исследование восстановления серы и полисульфидов лития
Поскольку восстановление серы при разряде ЛСЯ происходит через ряд промежуточных стадий (уравнения (1)–(6)), DFT методами были рассчитаны наиболее устойчивые конфигурации молекул полисульфидов лития и термодинамические функции их образования (рис. 4).
Рис. 4.
Оптимизированные структуры полисульфидов лития в газовой фазе и расчетные величины энтальпии и энтропии образования полисульфидов лития.

Рассчитанные структуры молекул полисульфидов лития хорошо согласуются с данными, опубликованными в работах [32–34]. Интересно отметить, что молекулы полисульфидов лития с количеством атомов серы в цепи более трех обладают двумя устойчивыми конфигурациями: “линейной” и “циклической”. На основании анализа рассчитанных величин энтальпии и энтропии образования полисульфидов лития можно заключить, что “циклические” конфигурации полисульфидов лития более устойчивы.
Были рассчитаны термодинамические функции восстановления серы и наиболее вероятных “циклических” полисульфидов лития по закону Гесса (табл. 1), исходя из величин термодинамических функций образования полисульфидов лития и серы (рис. 4).
Таблица 1.
Термодинамические функции восстановления серы и полисульфидов лития
| № | Реакция | ∆rH°(298 K), кДж/моль | ∆rG°(298 K), кДж/моль | ∆rS°(298 K), Дж/(моль К) | НРЦ, В |
|---|---|---|---|---|---|
| 1 | S8 + 2Li → Li2S8 | –501 | –450 | –169.3 | 2.33 |
| 2 | Li2S8 + 2Li → Li2S6 + Li2S2 | –470 | –444 | –86.3 | 2.30 |
| 3 | Li2S6 + 2Li → Li2S4 + Li2S2 | –476 | –449 | –90.6 | 2.32 |
| 4 | Li2S8 + 2Li → 2Li2S4 | –464 | –442 | –75.9 | 2.29 |
| 5 | Li2S4 + 2Li → Li2S3 + Li2S | –446 | –415 | –105.7 | 2.15 |
| 6 | Li2S3 + 2Li → Li2S2 + Li2S | –303 | –273 | –99.1 | 1.41 |
| 7 | Li2S2 + 2Li → 2Li2S | –268 | –237 | –103.7 | 1.23 |
Рассчитанные и измеренные величины термодинамических функций системы Li–S при различных степенях восстановления серы сопоставимы (табл. 1 и рис. 3). Это может указывать на корректность измеренных величин термодинамических функций восстановления серы до сульфида лития.
Термодинамический КПД преобразования химической энергии в электрическую при разряде литий-серных ячеек
На основании полученных данных были рассчитаны значения термодинамического КПД преобразования химической энергии в электрическую (уравнение (9)) при различных степенях восстановления серы в системе Li–S (при различной разрядной емкости литий-серных ячеек). Форма зависимости КПД преобразования энергии от степени восстановления серы (глубины разряда ячеек) (рис. 5) схожа с формой зависимости ΔG от степени восстановления серы (рис. 3). КПД преобразования энергии максимален (~98%) при средней степени восстановления серы –0.25 (электрохимическое восстановлении серы до октасульфида лития (реакция (1)) и минимален (~93%) при степени восстановления серы больше –0.5 (при электрохимическом восстановлении полисульфидов лития (реакции (2)–(6)).
ЗАКЛЮЧЕНИЕ
Двумя независимыми методами – экспериментальным (метод ЭДС) и теоретическим (DFT исследование) оценены величины термодинамических функций системы Li–S с различной степенью восстановления серы.
На основании полученных результатов можно заключить, что метод ЭДС определения величин термодинамических функций системы Li–S с различной степенью восстановления серы в литий-серных ячейках на первом разрядном цикле может быть применим для любой степени восстановления серы (любого зарядового состояния), а на последующих зарядно-разрядных циклах – только при степени восстановления серы меньше –0.25, т.е. при зарядовых состояниях, соответствующих низковольтным стадиям.
Расчетные и измеренные величины термодинамических функций удовлетворительно совпадают.
Изменение энергии Гиббса системы Li–S с различной степенью восстановления серы изменяется в диапазоне –480…–410 кДж/моль; изменение энтальпии – –490…–420 кДж/моль и изменение энтропии – –120…–20 кДж/(моль К) при 30°С.
Термодинамический КПД преобразования энергии изменяется в диапазоне 93–98%.
БЛАГОДАРНОСТИ
Авторы выражают глубокую благодарность рецензенту за внимательное прочтение рукописи и конструктивные замечания.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена по теме № АААА-А17-117011910031-7 государственного задания и при финансовой поддержке РФФИ (проект № 16-29-06190) и РНФ (проект № 17-73-20115).
В рамках выполнения государственного задания оценена применимость метода ЭДС определения термодинамических функций электрохимической системы литий–сера и измерены закономерности изменения термодинамических функций электрохимической системы Li–S в процессе разряда литий-серных ячеек с электролитной системой состава 1 М LiClO4 в сульфолане.
За счет средств гранта РФФИ были измерены закономерности изменения термодинамических функций электрохимической системы Li–S в процессе разряда литий-серных ячеек с электролитной системой состава 1 М LiCF3SO3 в сульфолане.
За счет средств гранта РНФ были выполнены квантово-химические расчеты термодинамических функций электрохимического восстановления серы.
Список литературы
Han, K.S., Chen, J., Cao, R., Rajput, N.N., Murugesan, V., Shi, L., Pan, H., Zhang, J.G., Liu, J., Persson, K.A., and Mueller, K.T., Effects of anion mobility on electrochemical behaviors of lithium-sulfur batteries, Chem. Mater., 2017, vol. 29, p. 9023. https://doi.org/10.1021/acs.chemmater.7b02105
Колосницын, В.С., Карасева, Е.В. Литий-серные аккумуляторы. Проблемы и решения. Электрохимия. 2008. Т. 44. № 5. С. 548. [Kolosnitsyn, V.S. and Karaseva, E.V., Lithium-sulfur batteries: problems and solutions, Russ. J. Electrochem., 2008, vol. 44, no. 5, p. 506. doi 10.1134/S1023193508050029]
Шиппер, Ф., Аурбах, Д. Прошлое, настоящее и будущее литий-ионных аккумуляторов: краткий обзор. Электрохимия. 2016. Т. 52. № 12. С. 1229. [Schipper, F. and Aurbach, D., A brief review: past, present and future of lithium ion batteries, Russ. J. Electrochem., 2016, vol. 52, no. 12, p. 1095. doi 10.1134/S1023193516120120]
Zheng, D., Wang, G., Liu, D., Si, J., Ding, T., Qu, D., Yang, X., and Qu, D., The progress of Li–S batteries—understanding of the sulfur redox mechanism: dissolved polysulfide ions in the electrolytes, Adv. Mater. Technol., 2018, vol. 3, no. 9, N. 1700233. https://doi.org/10.1002/admt.201700233
Kolosnitsyn, V.S., Kuzmina, E.V., and Karaseva, E.V., On the reasons for low sulphur utilization in the lithium-sulphur batteries, J. Power Sources, 2015, vol. 274, p. 203. https://doi.org/10.1016/j.jpowsour.2014.10.029
Chung, S.H., Chang, C.H., and Manthiram, A., Progress on the Critical Parameters for Lithium–Sulfur Batteries to be Practically Viable, Advanced Functional Materials, 2018, vol. 28, no 1801188. https://doi.org/10.1002/adfm.201801188
Zheng, D., Liu, D., Harris, J.B., Ding, T., Si, J., Andrew, S., Qu, D., Yang, X.Q., and Qu, D., Investigation of the Li-S battery mechanism by real-time monitoring of the changes of sulfur and polysulfide species during the discharge and charge, ACS Appl. Mater. Interfaces, 2017, vol. 9, p. 4326. https://doi.org/10.1021/acsami.6b08904
Лукомский, Ю.Я., Гамбург, Ю.Д. Физико-химические основы электрохимии, Долгопрудный: Издательский дом “Интеллект”, 2008. 424 с. [Lukomskii, Yu.Ya. and Gamburg, Yu.D., Physicochemical basis of electrochemistry (in Russian), Dolgoprudny: Publishing house “Intellect”, 2008. 424 p.].
Krause, L.J., Jensen, L.D., and Dahn, J.R., Measurement of parasitic reactions in Li ion cells by electrochemical calorimetry, J. Electrochem. Soc., 2012, vol. 159, no. 7, p. A937. https://doi.org/10.1149/2.021207jes
Wang, S., Entropy and heat generation of lithium cells/batteries, Chin. Phys. B., 2016, vol. 25, no. 1, p. 010509. https://doi.org/10.1088/1674-1056/25/1/010509
Bernardi, D., Pawlikowski, E., and Newman, J., A general energy balance for battery systems, J. Electrochem. Soc., 1985, vol. 132, no. 1, p. 5. https://doi.org/10.1149/1.211379
Thomas, K.E. and Newman, J., Thermal modeling of porous insertion electrodes, J. Electrochem. Soc., 2003, vol. 150, no. 2, p. A176. https://doi.org/10.1149/1.1531194
Thomas, K.E., Bogatu, C., and Newman, J., Measurement of the entropy of reaction as a function of state of charge in doped and undoped lithium manganese oxide, J. Electrochem. Soc., 2001, vol. 148, no. 6, p. A570. https://doi.org/10.1149/1.1369365
Giuliano, M.R., Advani, S.G., and Prasad, A.K., Thermal analysis and management of lithium-titanate batteries, J. Power Sources, 2011, vol. 196, no. 15, p. 6517. https://doi.org/10.1016/j.jpowsour.2011.03.099
Zaghib, K., Guerfi, A., Hovington, P., Vijh, A., Trudeau, M., Mauger, A., Goodenough, J.B., and Julien, C.M., Review and analysis of nanostructured olivine-based lithium recheargeable batteries: Status and trends, J. Power Sources, 2013, vol. 232, p. 357. https://doi.org/10.1016/j.jpowsour.2012.12.095
Delmas, C., Ménétrier, M., Crohuennec, L., Levasseur, S., Pérès, J.P., Pouillerie, C., Prado, G., Fournès, L., and Weill, F., Lithium batteries: a new tool in solid state chemistry, Intern. J. Inorganic Materials, 1999, vol. 1, p. 11–19. https://doi.org/10.1016/S1463-0176(99)00003-4
Jalkanen, K., Aho, T., and Vuorilehto, K., Entropy change effects on the thermal behavior of a LiFePO4/graphite lithium-ion cell at different states of charge, J. Power Sources, 2013, vol. 243, p. 354. https://doi.org/10.1016/j.jpowsour.2013.05.199
Колосницын, В.С., Иванов, А.Л., Карасева, Е.В., Кузьмина, Е.В., Мочалов, С.Э. Влияние полисульфидов лития на циклирование литиевого электрода в 1 М LiClO4 в сульфолане. Электрохимическая энергетика. 2013. Т. 13. № 3. С. 144. [Kolosnitsyn, V.S., Ivanov, A.L., Karaseva, E.V., Kuz’mina, E.V., and Mochalov, S.E., Effect of lithium polysulfides on cycling performance of lithium electrodes in 1M solution of LiClO4 in sulfolane, Electrochemical energy (in Russian), 2013, vol. 13, no. 3, p. 144.]
Kolosnitsyn, V.S., Kuzmina, E.V., and Mochalov, S.E., Determination of lithium sulphur batteries internal resistance by the pulsed method during galvanostatic cycling, J. Power Sources, 2014, vol. 252, p. 28. https://doi.org/10.1016/j.jpowsour.2013.11.099
Мочалов, С.Э., Антипин, А.В., Нургалиев, А.Р., Колосницын, В.С. Многоканальный потенциостат-гальваностат для циклических испытаний аккумуляторов и электрохимических ячеек. Электрохим. энергетика. 2015. Т. 15. № 1. С. 45. [Mochalov, S.E., Antipin, A.V., Nurgaliev, A.R., and Kolosnitsyn, V.S., Multichannel potentiostat-galvanostat for cycling of batteries and electrochemical cells, Electrochem. energy (in Russian), 2015, vol. 13, no. 3, p. 144.]
Gaussian 09, Revision C., Frisch, M.J., Trucks, G.W., Schlegel, H.B., Scuseria, G.E., Robb, M.A., Cheeseman, J.R., Scalmani, G., Barone, V., Petersson, G.A., Nakatsuji, H., Li, X., Caricato, M., Marenich, A., Bloino, J., Janesko, B.G., Gomperts, R., Mennucci, B., Hratchian, H.P., Ortiz, J.V., Izmaylov, A.F., Sonnenberg, J.L., Williams-Young, D., Ding, F., Lipparini, F., Egidi, F., Goings, J., Peng, B., Petrone, A., Henderson, T., Ranasinghe, D., Zakrzewski, V.G., Gao, J., Rega, N., Zheng, G., Liang, W., Hada, M., Ehara, M., Toyota, K., Fukuda, R., Hasegawa, J., Ishida, M., Nakajima, T., Honda, Y., Kitao, O., Nakai, H., Vreven, T., Throssell, K., Montgomery, J.A., Jr., Peralta, J.E., Ogliaro, F., Bearpark, M., Heyd, J.J., Brothers, E., Kudin, K.N., Staroverov, V.N., Keith, T., Kobayashi, R., Normand, J., Raghavachari, K., Rendell, A., Burant, J.C., Iyengar, S.S., Tomasi, J., Cossi, M., Millam, J.M., Klene, M., Adamo, C., Cammi, R., Ochterski, J.W., Martin, R.L., Morokuma, K., Farkas, O., Foresman, J.B., and Fox, D.J., Gaussian, Inc., Wallingford CT, 2016.
Ochterski, J.W., Thermochemistry in Gaussian Available at: http://gaussian.com/thermo/ (accessed 2 September 2018).
Dibden, J.W., Meddings, N., Owen, J.R., and Garcia-Araez, N, Quantitative Galvanostatic Intermittent Titration Technique for the Analysis of a Model System with Applications in Lithium−Sulfur Batteries, ChemElectroChem, 2018, vol. 5, no. 3, p. 445. https://doi.org/10.1002/celc.201701004
Raccichini, R., Furness, L., Dibden, J.W., Owen, J.R., and Garc’ıa-Araez, N., Impedance Characterization of the Transport Properties of Electrolytes Contained within Porous Electrodes and Separators Useful for Li‒S Batteries, J. Electrochem. Soc., 2018, vol. 165, no. 11, p. A2741–A2749. https://doi.org/10.1149/2.0631811jes
Condera, J., Villevieillea, C., Trabesingera, S., Nováka, P., Gublera, L., and Bouchet, R. Electrochemical impedance spectroscopy of a Li–S battery: Part 1. Influence of the electrode and electrolyte compositions on the impedance of symmetric cells, Electrochim. Acta, 2017, vol. 244, p. 61. https://doi.org/10.1016/j.electacta.2017.05.041
Canas, N.A., Hirose, K., Pascucci, B., Wagner, N., Friedrich, A., and Hiesge, R., Investigations of lithium–sulfur batteries using electrochemical impedance spectroscopy, Electrochimica Acta, 2013, vol. 97, no. 1, p. 42. https://doi.org/10.1016/j.electacta.2013.02.101
Kolosnitsyn, V.S., Kuzmina, E.V., Karaseva, E.V., and Mochalov, S.E., A study of the electrochemical processes in lithium–sulphur cells by impedance spectroscopy, J. Power Sources, 2011, vol. 196, no. 3, p. 1478. https://doi.org/10.1016/j.jpowsour.2010.08.105
Dominko, R., Patel, M.U.M., Lapornik, V., Vizintin, A., Kozelj, M., Tusar, N., Arcon, I., Stievano, L., and Aquilant, G., Analytical Detection of Polysulfides in the Presence of Adsorption Additives by Operando X-ray Absorption Spectroscopy, J. Phys. Chem. C 2015, vol. 119, p. 19001. https://doi.org/10.1021/acs.jpcc.5b05609
Barchasz, C., Molton, F., Duboc, F., Lepretre, J.C., Patoux, S., and Alloin, F., Lithium/Sulfur Cell Discharge Mechanism: An Original Approach for Intermediate Species Identification, Anal. Chem., vol. 2012, vol. 84, p. 39703. https://doi.org/10.1021/ac2032244
Wujcik, K.H., Wang, D.R., Raghunathan, A., Drake, M., Pascal, T.A., Prendergast, D., and Balsara, N.P., Lithium Polysulfide Radical Anions in Ether-Based Solvents, J. Phys. Chem. C, 2016, vol. 120, p. 18403. https://doi.org/10.1021/acs.jpcc.6b04264
Zou, Q. and Lu, Y.C., Solvent-Dictated Lithium Sulfur Redox Reactions: An Operando UV–vis Spectroscopic Study, J. Phys. Chem Lett., 2016, vol. 7, no. 8, p. 1518. https://doi.org/10.1021/acs.jpclett.6b00228
Wang, L., Zhang, T., Yang, S., Cheng, F., Liang, J., and Chen, J., A quantum-chemical study on the discharge reaction mechanism of lithium-sulfur batteries, J. Energy Chemistry, 2013, vol. 22, p. 72.
Liu, Q., Mu, D., Wu, B., Wang, L., Gai, L., and Wu, F., Insight on lithium polysulfide intermediates in a Li/S battery by density functional theory, RSC Adv., 2017, vol. 7, p. 33373. https://doi.org/10.1039/c7ra04673a
Sim, E.S., Yi, G.S., Je, M., Lee, Y., and Chung, Y.-C., Understanding the anchoring behavior of titanium carbide-based MXenes depending on the functional group in Li–S batteries: A density functional theory study, J. Power Sources, 2017, vol. 342, p. 64. https://doi.org/10.1016/j.jpowsour.2016.12.042
Дополнительные материалы отсутствуют.



