Электрохимия, 2019, T. 55, № 10, стр. 1207-1214
Влияние природы катиона на транспортные свойства бис(трифторметилсульфонил)имидных ионных жидкостей
Е. П. Гришина a, b, *, Н. О. Кудрякова a, **, Л. М. Раменская a, Ю. А. Фадеева a
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
b Ивановский государственный химико-технологический университет
153000 Иваново, просп. Шереметевский, 7, Россия
* E-mail: epg@isc-ras.ru
** E-mail: kno@isc-ras.ru
Поступила в редакцию 25.10.2018
После доработки 31.01.2019
Принята к публикации 19.04.2019
Аннотация
Методами вискозиметрии, кондуктометрии, денсиметрии и дифференциальной сканирующей калориметрии изучены физико-химические характеристики и показано влияние природы катиона (1‑бутил-3-метилимидазолия [BuMeIm]+, N-бутилметилпирролидиния [BuMePyrr]+ и метилтриоктиламмония [MeOc3Am]+) на транспортные свойства бис(трифторметилсульфонил)имидных ионных жидкостей (ИЖ). Показано, что ИЖ, образованные катионами – циклическими аминами ([BuMeIm]+ и [BuMePyrr]+), имеют близкие значения и температурные зависимости вязкости и электропроводности. Катион [MeOc3Am]+ предопределяет иную структуру ИЖ и, таким образом, существенное отличие изученных транспортных свойств расплава. Для солей [BuMeIm][Tf2N], [BuMePyrr][Tf2N] и [MeOc3Am][Tf2N] при 293 К получены следующие значения транспортных характеристик: вязкость 57.7, 88.1 и 726.5 мПа с; удельная электропроводность 0.376, 0.252 и 0.005 См м–1; энергия активации удельной электропроводности 21, 21 и 35 кДж моль–1; степень “ионности” 0.92, 0.94 и 1.00 соответственно. С использованием уравнения Вогеля–Фулчера–Таммана на основании температурных зависимостей удельной электропроводности и вязкости рассчитаны идеальные температуры стеклования исследуемых жидкостей. В области положительных температур установлена линейная корреляция между электропроводностью и объемом катиона изученных ионных жидкостей.
ВВЕДЕНИЕ
Ионные жидкости (ИЖ), представляющие собой соли с температурой плавления ниже 100°С, в настоящее время являются активно изучаемой обширной группой соединений, состоящих из крупного асимметричного органического катиона и крупного неорганического или органического аниона. Многообразие реализованных с помощью органического синтеза комбинаций катион–анион с присущими им особенностями делает возможным подбор ИЖ, наиболее подходящих для тех или иных практических задач. Наиболее типичными представителями ИЖ являются соли с катионами, образованными циклическими аминами – ароматическими (катионы N-алкилпиридиния, N,N'-диалкилимидазолия) и насыщенными (катионы N,N-диалкилпирролидиния, N-алкилпиперидиния), соли тетраалкиламмония [1, 2].
Существует большой интерес к изучению жидкой фазы таких солей. Было обнаружено, что в жидкой соли существует значительное упорядочение заряда, а локальный порядок в жидкости и твердом состоянии очень схож [3]. Физико-химические свойства ионных жидкостей в значительной степени определяются химической природой, строением и взаимодействием анионов и катионов. Такие низкотемпературные расплавы солей рассматриваются как сеть катионов и анионов, которые взаимодействуют не только через электростатические силы, но также образуют расширенную водородную связь [4].
Изменение параметров катиона, например увеличение длины цепи алкильного заместителя в катионах, непосредственно влияет на физико-химические свойства ИЖ – вязкость, электропроводность, плотность, химико-термическую и электрохимическую устойчивость [5–10]. Ослабленное взаимодействие громоздких анионов с крупными асимметричными катионами приводит к снижению температуры плавления солей.
Многократно показано, что химическая природа катиона и аниона определяет гидрофильно-гидрофобные свойства ИЖ. Гидрофильность солей обычно регулируют подбором аниона, причем галоидные ионы сообщают этим соединениям повышенную гидрофильность [11–14]. Галоидные соли, находящиеся в равновесии с атмосферной влагой, могут содержать более 10 мас. % воды [15–17]. Напротив, гидрофобные ИЖ в подобных условиях содержат примесь воды в количестве не более долей % [10, 18, 19]. Например, содержание примеси воды в N,N'-диалкил-имидазольных ионных жидкостях с бис(трифторметилсульфонил)имид-анионом ([N(CF3SO2)2]– = = [Tf2N]–), находящихся в условиях равновесия с атмосферной влагой, не превышает десятых долей мас. % при обычных условиях (комнатная температура, относительная влажность воздуха 60%) [10], благодаря чему они имеют важное практическое преимущество – низкую коррозионную активность [20, 21]. Гидрофобные ИЖ удобны в использовании, так как не требуют постоянного контроля содержания примеси воды при неизменных влажности и температуре воздуха.
Анион [Tf2N]− обычно считается слабо координирующим, а делокализация отрицательного заряда вдоль SNS-ядра иона, которое дополнительно защищено стерическими элементами с атомами сульфонильного кислорода и группами трифторметана, снижает катион-анионные взаимодействия в солях с этим анионом [22]. Ионные жидкости N,N'-диалкилимидазолия, N,N-диалкилпирролидиния с [Tf2N]– − являются предметом многочисленных исследований, в частности применительно к электрохимическим процессам и устройствам [23–25], так как имеют достаточно высокую электропроводность и широкий температурный интервал жидкого состояния. Некоторые соли метилтриалкиламмония с анионом [Tf2N]– также находятся в жидком состоянии при комнатной температуре, изучены значительно меньше, но перспективны как реакционные среды [9, 26]. Представляет интерес в одинаковых экспериментальных условиях установить влияние структурных особенностей перечисленных катионов на практически важные физико-химические свойства бис(трифторметилсульфонил)имидных ИЖ. Поэтому в данной работе были проведены сопоставительные исследования температурного поведения вязкости и электропроводности солей 1-бутил-3-метилимидазолия, 1‑бутил-1-метилпирролидиния и метилтриоктиламмония с анионом [Tf2N]–, а также рассмотрено влияние примеси воды на удельную электропроводность перечисленных ионных жидкостей. Расширенный температурный диапазон исследований позволяет, с одной стороны, выявить нижнюю температурную границу практического применения этих солей, с другой стороны, показать влияние выбираемого температурного диапазона на результаты расчета идеальной температуры стеклования исследуемых соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе были изучены ионные жидкости – соли с бис(трифторметилсульфонил)имид-анионом [Tf2N]– и катионами 1-бутил-3-метилимидазолия [BuMeIm]+ (Merck, ≥99%), 1-бутил-1-метилпирролидиния [BuMePyrr]+ (Merck, ≥98%) и метилтриоктиламмония [MeOc3Am]+ (ABCR, ≥99%). Содержание примеси воды определяли методом амперометрического титрования по К. Фишеру. Оно составляло 0.04 и 0.24 мас. % для [BuMeIm][Tf2N], 0.04 и 0.13 мас. % для [BuMePyrr][Tf2N] и 0.13 мас. % для [MeOc3Am][Tf2N]. Ионные жидкости с наименьшим содержанием примеси воды представляли собой соли, поставленные производителями. Увеличения концентрации Н2О достигали путем экспозиции образцов на воздухе. Насыщение ионных жидкостей атмосферной влагой происходило при комнатной температуре (296 ± 1 К) и относительной влажности воздуха 60%. Все исследуемые образцы ИЖ хранили в герметично закрытых сосудах в сухом боксе.
Электропроводность ионных жидкостей измеряли в герметичной кондуктометрической ячейке с гладкими платиновыми электродами при помощи измерителя иммитанса Е 7-20 в диапазоне частот переменного тока 1–100 кГц, напряжение на ячейке 10 мВ, точность измерения не ниже 0.2%. Постоянную кондуктометрической ячейки определяли с использованием 0.01 M раствора KCl [27]. Измерения электропроводности проводили в диапазоне от 233 до 353 К, температуру в ячейке поддерживали при помощи жидкостного криотермостата LIOP FT с точностью ±0.2 К. При измерении электропроводности ионных жидкостей было отмечено, что длительное термостатирование образцов в области отрицательных температур приводило к замерзанию ионных жидкостей в межэлектродном пространстве кондуктометрической ячейки: [MeOc3Am][Tf2N] – при T < 253 K, [BuMePyrr][Tf2N] – при T < 243 K, [BuMeIm][Tf2N] – при T < 233 K.
Динамическую вязкость (η) ионных жидкостей измеряли с помощью программируемого ротационного вискозиметра Brookfield DVII+, точность измерений ±1%. Температурный диапазон измерений 283–353 К.
Плотность (ρ), которая была использована для пересчета удельной электропроводности (κ) в молярную (Λ) и в данной статье не обсуждается, определяли с помощью денсиметра Anton Paar DMA 4500. Температурный диапазон измерений от 283 до 353 К. Погрешность определения величины ρ составляет 5 × 10–5 г см–3.
Также была определена температура стеклования (Tg) ИЖ (дифференциальный сканирующий калориметр NETZCH DSC 204 F1, материал капсулы Al, масса образца ≈20 мг, нагрев в атмосфере N2 от –110 до +100°С, скорость нагрева 10°С мин–1).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 приведены структурные формулы аниона [Tf2N]– и катионов исследованных соединений. Катионы являются производными ароматического циклического амина [BuMeIm]+ (а), насыщенного циклического амина [BuMePyrr]+ (б) и катиона аммония [MeOc3Am]+ (в). Некоторые физико-химические параметры рассматриваемых объектов, включая полученные в данной работе, в сопоставлении с литературными данными приведены в табл. 1. Следует отметить, что различие полученных значений и литературных данных обусловлено различным содержанием примеси воды.
Рис. 1.
Структурные формулы бис(трифторметилсульфонил)имид- аниона [Tf2N]– и катионов: 1-бутил-3-метилимидазолия [BuMeIm]+ (а), 1-бутил-1-метилпирролидиния [BuMePyrr]+ (б) и метилтриоктиламмония [MeOc3Am]+ (в).
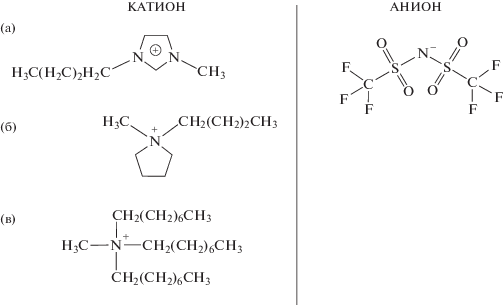
Таблица 1.
Некоторые физико-химические свойства исследуемых ионных жидкостей
| Физико-химический параметр | [BuMeIm][Tf2N] (0.24 мас. % Н2О) |
[BuMePyrr][Tf2N] (0.04 мас. % Н2О) |
[MeOc3Am][Tf2N] (0.13 мас. % Н2О) |
|---|---|---|---|
| Молярная масса, г моль–1 | 419.4 | 422.4 | 422.4 |
| Объем катиона, Å3 | 150[28] 153[29] |
167[28] 169[30] |
221[9] |
| ρ(293 К) , г см–3 | 1.4379 1.43927[31] 1.43889[32] |
1.3986 1.399[24] 1.409[33] |
1.1056 1.1098[9] 1.1048[34] |
| M(293 К) , моль см–3 | 3.430 | 3.310 | 1.705 |
| κ (293 К), См м–1 | 0.3755 0.39[35] |
0.2515 0.22[18] |
0.0046 |
| η(293 К), мПа с | 57.7 52[35] |
88.1 89[18] |
726.5 |
| *$T_{0}^{\kappa },$ К (расчет) | 161.3 ± 8.1 164.22[36] 178.2[37] 178 ± 2[28] |
167.4 ± 4.2 151.44[36] 171 ± 1[28] |
152.6 ± 2.3 |
| *$T_{0}^{\eta },$ К (расчет) | 157.6 ± 4.4 154.99[36] 180 ± 2[37] 180 ± 2[28] |
170.7 ± 11.9 148.54[36] 181 ± 3[28] |
161.6 ± 2.2 |
| Tg, К | 185 186[28] |
190 182[24] 190[28] |
186 |
| α | 0.92 0.92[36] |
0.94 0.91[36] |
1 |
Плотность [MeOc3Am][Tf2N] ожидаемо существенно ниже, чем плотность ионных жидкостей с циклическими катионами, что является следствием разветвленной структуры и длинноцепных алкильных заместителей в катионе [MeOc3Am]+ [9]. При возрастании температуры плотность исследованных ИЖ линейно снижается, но наклон зависимостей ρ(Т) неодинаков, и величина Δρ/ΔТ уменьшается при увеличении объема катиона.
Вязкость η и электропроводность κ. Температурные зависимости динамической вязкости и удельной электропроводности исследуемых ИЖ в координатах Аррениуса представлены на рис. 2.
Рис. 2.
Температурные зависимости вязкости (а) и удельной электропроводности (б) ионных жидкостей [BuMeIm][Tf2N] (1, 0.24 мас. % H2O), [BuMePyrr][Tf2N] (2, 0.04 мас. % Н2О) и [MeOc3Am][Tf2N] (3, 0.13 мас. % Н2О).

В области повышенных температур эти зависимости линейны. Нелинейность при расширении температурного диапазона исследований обусловлена склонностью ионных жидкостей к стеклованию при охлаждении. Вязкость [MeOc3Am][Tf2N] существенно выше, а электропроводность, соответственно, ниже, чем у двух других изученных солей. При 423 К удельная электропроводность ионной жидкости [MeOc3Am][Tf2N] на порядок ниже, чем у [BuMePyrr][Tf2N], причем это различие быстро нарастает при понижении температуры и при 253 К превышает 2 порядка. Расчет эффективной энергии активации электропроводности для линейных участков зависимостей lg κ–T–1 также показал существенное отличие значений для ИЖ с катионами – циклическими аминами и с тетраалкиламмоний-катионом: 21 и 35 кДж моль–1 соответственно.
К полученным температурным зависимостям электропроводности и динамической вязкости применимо уравнение Вогеля–Фулчера–Таммана (VFT) для суперохлажденных и стеклующихся систем [38, 39]:
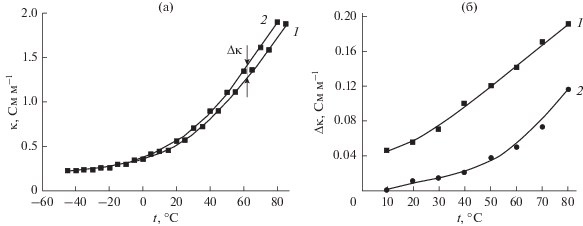
Хорошо известно, что с увеличением содержания воды электропроводность ИЖ возрастает (рис. 3а). Но величина Δκ = κ2 – κ1 (здесь κ1 и κ2 – значения удельной электропроводности с меньшим и бóльшим содержанием примеси воды, соответственно) стремится к нулю при понижении температуры и сильно возрастает в области повышенных температур. При сравнительно малом содержании воды в расплаве ее влияние ограничивается только областью положительных температур (рис. 3б).
Рис. 3.
Температурная зависимость: (а) величины κ для ионных жидкостей [BuMeIm][Tf2N] (1) с содержанием примеси воды 0.04 мас. % (1) и 0.24 мас. % (2); (б) Δκ для ионных жидкостей (1, в соответствии с рис. (а)) [BuMeIm][Tf2N] и [BuMePyrr][Tf2N] (2) с содержанием примеси воды 0.04 и 0.13 мас. %.
Правило Вальдена. К ионным жидкостям применимо дробное правило Вальдена Ληα =const, где Λ – молярная электропроводность, α – показатель степени, который для этого класса органических соединений, как правило, немного отличается от 1. Величина α характеризует степень “ионности” ИЖ, и значение α < 1 является следствием образования ионных ассоциатов в них [10, 15, 40]. Значения Λ в диапазоне температур 293–353 К рассчитывали по формуле Λ = κM/ρ, где М – молекулярная масса ИЖ. Зависимости молярной электропроводности Λ от текучести (1/η) в логарифмических координатах (рис. 4), на основе которых были получены значения α, расположены ниже “идеальной” линии с наклоном α = 1, характерной для разбавленного раствора KCl [36].
Рис. 4.
Зависимость lg Λ от lg 1/η для KCl [36] (1), [BuMeIm][Tf2N] (2), [BuMePyrr][Tf2N] (3) и [MeOc3Am][Tf2N] (4).

Величина α < 1 для [BuMeIm][Tf2N] (α = 0.92, совпадает с литературными данными [36]) и для [BuMePyrr][Tf2N] (α = 0.94), то есть эти ИЖ характеризуются близкими значениями “степени ионности”. Вместе с тем для [MeOc3Am][Tf2N] α = 1, что указывает на полную ионизацию этой соли в ее расплавленном состоянии, а изменения ионной проводимости соответствуют изменению текучести. Примечательно, что численное значение произведения Вальдена (Λη) в случае [MeOc3Am][Tf2N] значительно ниже среднего значения, присущего ионным жидкостям [2], практически не зависит от температуры и составляет 19.4 ± ± 0.2 (См см2/моль) (мПа с). В то же время величина Λη снижается с 66 до 56 (См см2/моль) (мПа с) для [BuMeIm][Tf2N] и с 70 до 60 (См см2/моль) (мПа с) для [BuMePyrr][Tf2N] при повышении температуры от 293 до 353 К.
Как показано выше, природа катиона, особенно в случае сильных структурных различий, заметно меняет температурное поведение ряда физико-химических свойств ионных жидкостей. Такое различие свойств обусловлено тем, что, благодаря разветвленной трехцепной структуре катиона и его большему объему, [MeOc3Am][Tf2N] имеет значительно более высокую степень структурного упорядочения и более сильно выраженные гидрофобные взаимодействия, чем у солей с катионами N,N'-диалкилимидазолия и N,N-диалкилпирролидиния [9]. Для всех изученных солей характерна ионно-гидрофобная сегрегация. Так, в работе [41] показано, что для имидазольных ионных жидкостей с алкильными боковыми цепями, равными C4 или длиннее, происходит агрегация алкильных цепей в неполярные домены, которые проникают в трехмерную сеть ионных каналов, образованных анионами и имидазолиевыми кольцами катионов. [MeOc3Am][Tf2N] показывает сильно выраженную сегрегацию ионных и гидрофобных областей с образованием структуры, подобной неупорядоченным смектическим (типа A) жидким кристаллам, имеющим слоистое строение [9]. Это может быть одним из факторов, обусловивших полную диссоциацию молекул данной соли, в отличие от солей, образованных циклическими аминами. Известно также, что в ИЖ наряду с электростатическим взаимодействием существует развитая система водородных связей катиона и аниона [42]. Для исследуемых ИЖ, например, возможно образование Н‑связи через атом водорода у α-атома С (ближайший к атому N) катиона и электронодонорными атомами O, F и N аниона. Катион [BuMeIm]+, кроме того, имеет активный атом водорода С(2)Н, через который, в основном, и образует водородную связь с анионом [43]. Катион [MeOc3Am]+ содержит три длинные углеродные цепи, которые взаимодействуют между собой за счет дисперсионных и ван-дер-ваальсовых сил [41], перекрывая при этом активный для связи атом водорода α‑СН3 группы. Таким образом, сила водородного взаимодействия катиона и аниона уменьшается в ряду [BuMeIm][Tf2N] > [BuMePyrr][Tf2N] > > [MeOc3Am][Tf2N], что, по-видимому, также является одним из факторов более высокой “степени ионности” последнего.
Вместе с тем, при анализе экспериментальных данных для ИЖ с тремя рассматриваемыми катионами (содержание примеси воды 0.04 мас. % в [BuMeIm][Tf2N], [BuMePyrr][Tf2N] и 0.13 мас. % в [MeOc3Am][Tf2N]) была установлена линейная корреляция между величиной удельной и молярной электропроводности и объемом катиона (коэффициент корреляции 0.991–0.999). Из этого следует, что в ионных жидкостях с одноименным анионом и с низким содержанием примеси воды объем катиона имеет определяющее влияние на величины κ и Λ, и увеличение размеров катиона приводит к снижению электропроводности. Аналогичная закономерность характерна для расплавов неорганических солей с однозарядными катионами (катионами щелочных металлов) и связана с высокой и почти постоянной степенью диссоциации этих солей [44].
ЗАКЛЮЧЕНИЕ
Проведенные исследования транспортных свойств представленных бис(трифторметилсульфонил)-имидных ионных жидкостей показали, что:
–структура катиона благодаря различиям в катион-анионных взаимодействиях влияет на “степень ионности” исследуемых соединений, и катион [MeOc3Am]+, имеющий разветвленную трехцепную структуру, препятствующую образованию водородных связей, в области положительных температур находится в полностью диссоциированном состоянии;
– существует линейная корреляция между электропроводностью ионной жидкости и объемом катиона, а именно, как и в расплавах неорганических солей с однозарядным катионом, с увеличением объема катиона электропроводность снижается;
– рассчитанные по уравнению VFT значения идеальной температуры стеклования ионных жидкостей существенно зависят от выбранного температурного интервала, при этом величины $T_{0}^{\kappa },$ рассчитанные по данным, охватывающим область умеренных положительных и отрицательных температур, дают значения, максимально приближенные к экспериментально найденным значениям температуры стеклования;
– в расплавах исследуемых солей влияние примеси воды на их электропроводность в целом ограничено областью положительных температур и возрастает при повышении температуры.
Список литературы
Chiappe, C. and Pieraccini, D., Ionic liquids: solvent properties and organic reactivity, J. Phys. Org. Chem., 2005, vol. 18, p. 275.
Galiński, M., Lewandowski, A., and Stępniak, I., Ionic liquids as electrolytes, Electrochimica Acta, 2006, vol. 51, p. 5567.
Hardacre, C., Holbrey, J.D., McMath, S.E.J., Bowron, D.T., and Soper, A.K., Structure of molten 1,3-dimethylimidazolium chloride using neutron diffraction, J. Chemical Physics, 2003, vol. 118, p. 273.
Consorti, C.S., Suarez, P.A.Z., de Souza, R.F., Burrow, R.A., Farrar, D.H., Lough, A.J., Loh, W., de Silva, L.H.M., and Dupont, J., Identification of 1,3-Dialkylimidazolium Salt Supramolecular Aggregates in Solution, J. Phys. Chem. B., 2005, vol. 109, p. 4341.
Zhao, H., Current studies on some physical properties of ionic liquids. Review, Phys. and Chem. of Liquids, 2003, vol. 41, p. 545.
Appetecchi, G.B., Montanino, M., Zane, D., Carewska, M., Alessandrini, F., and Passerini, S., Effect of the alkyl group on the synthesis and the electrochemical properties of N-alkyl-N-methyl-pyrrolidinium bis(trifluoromethanesulfonyl)imide ionic liquids, Electrochim. Acta, 2009, vol. 54, p. 1325.
Vila, J., Varela, L.M., and Cabeza, O., Cation and anion sizes influence in the temperature dependence of the electrical conductivity in nine imidazolium based ionic liquids, Electrochim. Acta, 2007, vol. 52, p. 7413.
Hawker, R.R., Haines, R.S., and Harper, J.B., Variation of the cation of ionic liquids: the effects on their physicochemical properties and reaction outcome, Targets in Heterocyclic Systems, 2014, vol. 18, p. 141.
Pott, T. and Meleard, P., New insight into the nanostructure of ionic liquids: a small angle X-ray scattering (SAXS) study on liquid tri-alkyl-methyl-ammonium bis(trifluoromethanesulfonyl)amides and their mixtures, PhysChemChemPhys., 2009, vol. 11, p. 5469.
Гришина, Е.П., Кудрякова, Н.О., Раменская, Л.М., Фадеева, Ю.А. Влияние температуры на транспортные свойства ионных жидкостей – бис(трифторметилсульфонил)имидов 1-алкил-3-метилимидазолия. Журнал физической химии. 2018. Т. 92. С. 614. [Grishina, E.P., Kudryakova, N.O., Ramens-kaya, L.M., and Fadeeva, Yu.A., The Temperature Effect on the Transport Properties of 1-Alkyl-3-methylimidazolium Bis(trifluoromethylsulfonyl)imide Ionic Liquids, Russ. J. Phys. Chem. A, 2018, vol. 92, p. 724.]
Wasserscheid, P. and Welton, T., Ionic liquids in synthesis, Wiley-VCH Verlag, Weinheim, 2003. 364 p.
Zhao, H., Are ionic liquids kosmotropic or chaotropic? An evaluation of available thermodynamic parameters for quantifying the ion kosmotropicity of ionic liquids, J. Chem Technol Biotechnol., 2006, vol. 81, p. 877.
Tomšík, E. and Gospodinova, N., Water in Ionic Liquids: Correlation between Anion Hydrophilicity and Near-Infrared Fingerprints, ChemPhysChem., 2016, vol. 17, p. 1586
Huddleston, J.G., Visser, A.E., Reichert, W.M., Willauer, H.D., Broker, G.A., and Rogers, R.D., Characterization and comparison of hydrophilic and hydrophobic room temperature ionic liquids incorporating the imidazolium cation, Green Chemistry, 2001, vol. 3, p. 156.
Гришина, Е.П., Пименова, А.М., Раменская, Л.М., Краева, О.В. Электрохимические свойства расплава 1-бутил-3-метилимидазолия бромида, содержащего примеси воды. Электрохимия. 2008. Т. 44. С. 1352. [Grishina, E.P., Pimenova, A.M., Ramenskaya, L.M., and Kraeva, O.V., Electrochemical Properties of 1-Butyl-3-Methylimidazolium Bromide Melt Containing Water Impurities, Russ. J. Electrochem., 2008, vol. 44, p. 1257.]
Раменская, Л.М., Гришина, Е.П., Пименова, А.М., Груздев, М.С. Влияние воды на физико-химические характеристики ионной жидкости бромида 1‑бутил-3-метилимидазолия. Журнал физической химии. 2008. Т. 82. С. 1246. [Ramenskaya, L.M., Grishina, E.P., Pimenova, A.M., and Gruzdev, M.S., The Influence of Water on the Physicochemical Characteristics of 1-Butyl-3-Methylimidazolium Bromide Ionic Liquid, Russ. J. of Phys. Chem. A., 2008, vol. 82, p. 1098.]
Гришина, Е.П., Кудрякова, Н.О. Электропроводность и электрохимическая устойчивость хлорида холина, насыщенного атмосферной влагой. Журнал физической химии. 2017. Т. 91. С. 1795. [Grishina, E.P. and Kudryakova, N.O., Conductivity and Electrochemical Stability of Concentrated Aqueous Choline Chloride Solutions, Russ. J. Physical Chem. A, 2017, vol. 91, p. 2024.]
O’Mahony, A.M., Silvester, D.S., Aldous, L., Hardacre, C., and Compton, R.G., Effect of Water on the Electrochemical Window and Potential Limits of Room-Temperature Ionic Liquids, J. Chem. Eng. Data, 2008, vol. 53, p. 2884.
Salminen, J., Papaiconomou, N., Kumar, R.A., Lee, J.-M., Kerr, J., Newman, J., and Prausnitz, J.M., Physicochemical properties and toxicities of hydrophobic piperidinium and pyrrolidinium ionic liquids, Fluid Phase Equilibria, 2007, vol. 261, p. 421.
Perissi, I., Caporali, S., Fossati, A., and Lavacchi, A., Corrosion Resistance of Metallic Materials in Ionic Liquids, Adv. Chem. Res., 2011, vol. 6, p. 315.
Гришина, Е.П., Пименова, А.М., Борзова, Е.В., Кудрякова, Н.О., Раменская, Л.М. Коррозионная стойкость высокоемкой алюминиевой фольги в имидазольных ионных жидкостях. Известия вузов. Хим. и хим. Технология. 2014. Т. 57. Вып. 9. С. 78. [Grishina, E.P., Pimenova, A.M., Borzova, E.V., Kudryakova, N.O., and Ramenskaya, L.M., Corrosion resistance of high-capacity aluminum foil in imidazole ionic liquids, Khimiya i khimicheskaya tekhnologiya, (in Russian), 2014, vol. 57, iss. 9, p. 78.]
Köddermann, T., Wertz, C., Heintz, A., and Ludwig, R., Ion-Pair Formation in the Ionic Liquid 1-Ethyl-3-methylimidazolium Bis(triflyl)imide as a Function of Temperature and Concentration, ChemPhysChem., 2006, vol. 7, p. 1944.
Best, A.S., Bhatt, A.I., and Hollenkamp, A.F., Ionic Liquids with the Bis(fluorosulfonyl)imide Anion: Electrochemical Properties and Applications in Battery Technology, J. Electrochem. Soc., 2010, vol. 157, p. A903.
Appetecchi, G.B., Montanino, M., Carewska, M., Moreno, M., Alessandrini, F., and Passerini, S., Chemical-physical properties of bis(perfluoroalkylsulfonyl)imide-based ionic liquids, Electrochim. Acta, 2011, vol. 56, p. 1300.
Deng, M.-J., Su, C.-J., Hsu, S.C.N., and Chen, P.-Y., The bis((trifluoromethyl)sulfonyl)imide-based room temperature ionic liquids used for several electrochemical applications, ECS Transactions, 2007, vol. 3, p. 297.
Bahadur, I., Osman, K., Coquelet, C., Naidoo, P., and Ramjugernath, D., Solubilities of Carbon Dioxide and Oxygen in the Ionic Liquids Methyl Trioctyl Ammonium Bis (trifuoromethylsulfonyl) imide, 1-Butyl-3-Methyl Imidazolium Bis (trifuoromethylsulfonyl) imide, and 1-Butyl-3-Methyl Imidazolium Methyl Sulphate, J. Phys. Chem. B., 2015, vol. 119, p. 1503.
Pratt, K.W., Koch, W.F., Wu, Y.C., and Berezansky, P.A., Molality-based primary standards of electrolytic conductivity (IUPAC Technical Report), Pure Appl. Chem., 2001, vol. 73, p. 1783.
Tokuda, H., Ishii, K., Susan, M.A.B.H., Tsuzuki, S., Hayamizu, K., and Watanabe, M., Physicochemical Properties and Structures of Room-Temperature Ionic Liquids. 3.Variation of Cationic Structures, J. Phys. Chem. B., 2006, vol. 110, p. 2833.
Xiao, D., Rajian, J.R., Cady, A., Li, S., Bartsch, R.A., and Quitevis, E.L., Nanostructural Organization and Anion Effects on the Temperature Dependence of the Optical Kerr Effect Spectra of Ionic Liquids, J. Phys. Chem. B, 2007, vol. 111, p. 4669.
Shirota, H., Funston, A.M., Wishart, J.F., and Castner, E.W., Ultrafast dynamics of pyrrolidinium cation ionic liquids, J. Chem. Phys., 2005, vol. 122, p. 184512.
Vraneš, M., Zec, N., Tot, A., Papović, S., Dožić, S., and Gadžurić, S., Density, electrical conductivity, viscosity and excess properties of 1-butyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide + propylene carbonate binary mixtures, J. Chem. Thermodynam., 2014, vol. 68, p. 98.
Troncoso, J., Cerdeirin, C.A., Sanmamed, Y.A., Romani, L., Paulo, L., and Robelo, N., Thermodynamic Properties of Imidazolium-Based Ionic Liquids: Densities, Heat Capacities, and Enthalpies of Fusion of [bmim][PF6] and [bmim][NTf2], J. Chem. Eng. Data, 2006, vol. 51, p. 1856.
Gardas, R.L., Costa, H.F., Freire, M.G., Carvalho, P.J., Marrucho, I.M., Fonseca, I.M. A., Ferreira, A.G.M., and Coutinho, J.A.P., Densities and Derived Thermodynamic Properties of Imidazolium-, Pyridinium-, Pyrrolidinium-, and Piperidinium-Based Ionic Liquids, J. Chem. Eng. Data, 2008, vol. 53, p. 805.
Froba, A. P., Kremer, H., and Leipertz, A., Density, Refractive Index, Interfacial Tension, and Viscosity of Ionic Liquids [EMIm][EtSO4], [EMIm][NTf2], [EMIm][N(CN)2], and [OMA][NTf2] in Dependence on Temperature at Atmospheric Pressure, J. Phys. Chem. B, 2008, vol. 112, p. 12420.
Bonhôte, P., Dias, A.P., Papageorgiou, N., Kalya-nasundaram, K., and Grätzel, M., Hydrophobic, Highly Conductive Ambient-Temperature Molten salts, Inorg. Chem., 1996, vol. 35, p. 1168.
Pan, Y., Boyd, L.E., Kruplak, J.F., Cleland, W.E., Jr., Wilkes, J.S., and Hussey, C.L., Physical and Transport Properties of Bis(trifluoromethylsulfonyl)imide-Based Room-Temperature Ionic Liquids: Application to the Diffusion of Tris(2,2′-bipyridyl)ruthenium(II), J. Electrochem. Soc., 2011, vol. 158, p. F1.
Tokuda, H., Hayamizu, K., Ishii, K., Md. Abu Bin Hasan Susan, and Watanabe, M., Physicochemical Properties and Structures of Room Temperature Ionic Liquids. 2. Variation of Alkyl Chain Length in Imidazolium Cation, J. Phys. Chem. B, 2005, vol. 109, p. 6103.
Gómez, E., Calvar, N., Macedo, and Dominguez, A., Effect of the temperature on the physical properties of pure 1-propyl 3-methylimidazolium bis(trifluoromethylsulfonyl)imide and characterization of its binary mixtures with alcohols, J. Chem. Thermodynam., 2012. vol. 45, p. 9.
Every, H.A., Bishop, A.G., MacFarlane, D.R., Oradd, G., and Forsyth, M., Transport properties in a family of dialkylimidazolium ionic liquids, Phys. Chem. Chem. Phys., 2004, vol. 6, p. 1758.
Xu, W., Cooper, E.I., and Angell, C.A., Ionic Liquids: Ion Mobilities, Glass Temperatures, and Fragilities, J. Phys. Chem. B., 2003, vol. 107, p. 6170.
Lopes, J.N.A.C. and Pádua, A.A.H., Nanostructural Organization in Ionic Liquids, J. Phys. Chem. B., 2006, vol. 110, p. 3330.
Dong, K., Zhang, S., and Wang, J., Understanding the hydrogen bonds in ionic liquids and their roles in properties and reactions, Chem. Commun., 2016, vol. 52, p. 6744.
Fumino, K., Wulf, A., and Ludwig, R., Strong, Localized, and Directional Hydrogen Bonds Fluidize Ionic Liquids, Angew. Chem. Int. Ed., 2008, vol. 47, p. 8731.
Делимарский, Ю.К. Электрохимия ионных расплавов, М.: Металлургия, 1978. 248 с. [Delimarskii, Yu.K., Electrochemistry ionic melts (in Russian), Moscow: Metallurgiya, 1978. 248 p.]
Дополнительные материалы отсутствуют.


