Электрохимия, 2019, T. 55, № 10, стр. 1261-1271
Платиновый наноструктурный катализатор, нанесенный на диоксид титана
В. А. Волочаев a, *, И. Н. Новомлинский a, **, Е. М. Баян a, В. Е. Гутерман a
a Южный федеральный университет
Ростов-на-Дону, Россия
* E-mail: v.a.volotchaev@mail.ru
** E-mail: novomlinskiy@sfedu.ru
Поступила в редакцию 01.09.2018
После доработки 12.02.2019
Принята к публикации 30.03.2019
Аннотация
Одной из важных проблем использования Pt/C-электрокатализаторов в низкотемпературных топливных элементах является их деградация из-за окисления углеродного носителя. Перспективным направлением для повышения стабильности является применение неуглеродных носителей, устойчивых к окислению, например оксидов некоторых металлов в высших степенях окисления. Синтезирован TiO2 с площадью удельной поверхности (104 м2/г), на основе которого получены нанесенные платиновые катализаторы. Для Pt/TiO2 и углеродсодержащего композита Pt/TiO2+C измерены площадь электрохимически активной поверхности платины и активность в реакции электровосстановления кислорода. Оценена стабильность полученных материалов, которая оказалась существенно выше, чем у коммерческих Pt/C-катализаторов.
ВВЕДЕНИЕ
Последние десятилетия разработка топливных элементов и используемых в них материалов вызывает повышенный интерес в связи с их высокой экологичностью, а также возможностями использования при решении задач сохранения и последующего использования энергии, полученной из чистых источников [1–4]. Наиболее эффективными электрокатализаторами (ЭК) для топливных элементов с полимерной мембраной (ТПТЭ) могут считаться наноструктурные композиционные материалы, содержащие наночастицы (НЧ) чистой платины, сплавов и другие сложноорганизованные наноструктуры на ее основе. Подобные НЧ, нанесенные на нано- или микрочастицы углеродного носителя [5–10], широко применяются в качестве катализаторов при коммерческом производстве ТПТЭ. Тем не менее, ТПТЭ имеют ряд ограничений, связанных с деградацией мембраны и каталитического слоя [11–16]. Актуальной задачей является поиск более стабильного носителя для НЧ платины [17]. Так, например, использование некоторых специфических типов углеродных носителей, существенно более устойчивых к окислению, чем простые углеродные сажи, позволяет увеличить срок службы мембранно-электродных блоков [18, 19] и, следовательно, повысить эффективность всей системы в целом. Однако сама природа материала-носителя, способного окисляться, при этом не меняется: деградация углеродного носителя на кислородном электроде ТПТЭ, катализируемая НЧ платины, по-прежнему является проблемой, требующей решения.
Неуглеродные носители, устойчивые к окислению, все больше привлекают внимание в качестве перспективных материалов для производства катализаторов. Широкий выбор доступных коммерческих прекурсоров, возможности применения и совершенствования методов синтеза неорганических материалов позволяют значительно расширить число объектов, пригодных для тестирования, стимулируя при этом поиск новых подходов к модификации уже известных материалов [20, 21]. Оксиды некоторых металлов в высшей степени окисления перспективны как носители для платиносодержащих ЭК по целому ряду параметров, таких как устойчивость, доступность, простота синтеза [22]. Тем не менее, результаты, опубликованные в этой области, недостаточно многочисленны, чтобы дать уверенность в хорошей воспроизводимости и правильной интерпретации экспериментальных данных, а также предложить реальную альтернативу Pt/C-электрокатализаторам. Относительно свежий обзор состояния современных исследований, связанных с платиновыми нанокатализаторами на подложках на основе оксидов металлов для ТПТЭ, сделан в [22]. В этом обзоре представлены наиболее часто используемые субстраты на основе оксидов. Основными проблемами исследуемых ныне оксидных материалов авторы считают относительно низкую удельную площадь поверхности, невысокие электронную проводимость данного рода соединений и активность в реакции электровосстановления кислорода (РВК).
Часть ранних работ, выполненных по тематике неуглеродных носителей, связана с выяснением принципиальной возможности их использования [23–26]. В работе [23] Л. Фролова и соавторы приводят результаты изучения платиновых электрокатализаторов на основе отдельных оксидов Pt/SnO2 и Pt/TiO2, а также их твердых растворов Pt/Ti1– xMxO2 (M = Ru, Nb) и Pt/Sn1 –x${\text{M}}_{x}^{'}$O2 – δ (M' = Sb, Ru). Наночастицы платины, нанесенные на частицы твердых растворов двуокиси олова Sn1 –xMxO2 – δ (M = Sb, Ru; x = 0.4–0.9) и Ti1 ‒ xMxO2 (M = Ru, Nb; x = 0.7), продемонстрировали более высокую устойчивость к отравлению CO. Исследованный в [24] электрокатализатор Pt/TiO2 показал удовлетворительную активность в сравнении с коммерческим Pt/C-катализатором, а после 2500 циклов ускоренного стресс-теста продемонстрировал на порядок более высокие удельные токи в РВК (1.20 мА см–2) по сравнению с Pt/C (0.13 мА см–2). Дело в том, что коммерческий материал деградировал после стресс-тестирования на 96% (очевидно, из-за сильной коррозии углерода), а платино-оксидный катализатор – лишь на 48%. Авторы [24] сделали вывод, что высокая стабильность катализаторов на основе оксидов делает подобные системы перспективными для повышения надежности и долговечности катодных катализаторов ТПТЭ.
В работе [25] авторы изучили процессы созревания и коалесценции НЧ платины, нанесенных на TiO2-носитель. Было установлено, что классический синтез по золь-гель технологии приводит к лучшим результатам в плане устойчивости к деградации, чем технология вакуумного напыления. Авторы [25] связали это с более равномерным распределением частиц платины как по поверхности носителя, так и по размеру, а также с их несколько более крупным средним размером. Работа [26] интересна описанием методики синтеза на основе золь-гель технологии равномерных по объему и высокопроводящих композитов, представляющих собой многостенные углеродные нанотрубки, покрытые диоксидом титана. Полученные материалы сохраняли высокую проводимость при использовании в качестве носителя для НЧ платины, демонстрируя более высокую удельную активность и стабильность по сравнению с материалами на основе чистых углеродных нанотрубок или коммерческого Pt/C-катализатора. Пожалуй, это одна из немногих публикаций, где все характеристики композиционных катализаторов (электрохимически активная поверхность (ЭХАП)), удельная и массовая активность в РВК, стабильность) превосходят таковые для коммерческих Pt/C-материалов. Авторы полагают, что высокая активность данных композитов в РВК связана с малым размером (1.6 нм) и равномерным распределением наночастиц платины по поверхности носителя, и отмечают при этом более сильное электронное взаимодействие металлических наночастиц с модифицированным носителем. По мнению авторов, такое взаимодействие может облегчать адсорбцию молекул О2 на поверхности платины. В то же время работа [26] содержит некоторые неточности как при описании методики проведения измерений, так и при аттестации материалов, что снижает доверие к полученным результатам. Близкие по составу композиционные материалы на основе многостенных углеродных нанотрубок и диоксида титана описаны в работе Esfahani с соавторами [27]. Установлено, что температура синтеза TiOx влияет на структуру и морфологию носителя, который может содержать различные типы субоксидов, начиная от TiO2–анатаза, TiO2–рутила, Ti3O и Ti3O5. Полученные катализаторы содержали 13.6–19.2 мас. % Pt с атомным отношением Pt/Ti 0.177–0.194. Авторы отмечают, что присутствие субоксида Ti3O5 повышает активность катализатора в реакции электровосстановления кислорода и его стабильность, превышающую стабильность коммерческого катализатора Pt/С. После 4000 циклов вольтамперометрического стресс-теста в диапазоне потенциалов от 0.06 до 1.26 В (по обратимому водородному электроду) значения площади электрохимически активной поверхности (ЭХАП) для Pt/TiOx выросли до 23 м2/г(Pt). Кроме того, по свидетельству авторов [27], Pt/TiOx-катализатор обладает высокой толерантностью к метанолу. Отметим, что несмотря на сходство состава и структуры катализаторов, описанных в [26] и [27], авторы этих работ получили существенно различающиеся результаты в части измерения ЭХАП и определения активности катализаторов на основе композитов “многостенные углеродные нанотрубки–диоксид титана”. Результаты использования композита углеродных нанотрубок и TiO2 в качестве носителя для НЧ Pt, полученные в [28], также подтверждают перспективность данного подхода для улучшения характеристик катализаторов: НЧ платины со специфической огранкой были размещены в полостях/неровностях между частицами диоксида титана. Изменения в электронных свойствах и носителя, и наночастиц платины, вызванные сильным взаимодействием металла и подложки, были подтверждены методом XPS. К сожалению, предложенные в [26–28] технологии синтеза вряд ли применимы для коммерческого производства катализаторов из-за дороговизны нанотрубок и прекурсоров на основе металлорганических соединений. К тому же, достоверность результатов, описанных в [26], вызывает определенные сомнения.
Синтезу и всестороннему изучению допированного диоксида титана в качестве носителя и электрокатализаторов на его основе посвящена работа [29]. Для получения устойчивого носителя авторы предлагают использовать допированный танталом диоксид титана, наночастицы которого были получены посредством золь-гель технологии. Показано, что Pt/Ta–TiO2 проявляет большую стабильность и сравнимую с Pt/C активность в РВК [29].
В работе [30] описан метод синтеза носителя (TiO2), защищенного слоем диоксида кремния. Тонкий слой SiO2 (<2 нм) был нанесен на TiO2 посредством нескольких циклов конденсации тетраэтилортосиликата. Далее, после пропитки хлорплатиновой кислотой, последующей сушки, нагревания и восстановления платины, был получен электрокатализатор. НЧ Pt со средним размером 1–2 нм хорошо сохраняли размер при отжиге материала до температуры 500°С, в то время как НЧ Pt на немодифицированном диоксиде титана при таком нагревании сильно агломерировали. Авторы сделали вывод, что модифицирование оксидов методами мягкой химии в сочетании с методом пропитки – подход пригодный для нанесения НЧ металлов на различные типы подложек. Однако относительная сложность масштабирования и продолжительность синтеза затрудняют реальное применение методики.
О высокой стабильности диоксида титана в качестве носителя для платины сообщают авторы [31, 32]. Первоначально активность нанесенных на оксид электрокатализаторов в РВК оказалась ниже, чем для Pt/С, однако за время ускоренного стресс-тестирования (20 000 циклов) Pt/TiO2 сохранял более 60% начальной ЭХАП, в то время как Pt/C после 10 000 циклов лишь 10% [31]. Катализаторы Pt/(TiO2+C) с различными загрузками Pt были получены в [32] путем электрохимического окисления/диспергирования титанового анода. Показано, что присутствие TiO2 в 2–5 раз увеличивает удельную (А/м2) электрокаталитическую активность в реакции окисления метанола по сравнению с Pt/C. Авторы полагают, что катализаторы Pt/(TiO2+C) с 10% содержанием TiO2 демонстрируют наиболее высокую стабильность из-за оптимального соотношения между электронной проводимостью субстрата TiOx+C и платины. Отметим, что значения ЭХАП платины на лучших катализаторах в этом исследовании не превышают 12 м2/г(Pt), что обусловливает низкую масс-активность и, конечно же, недостаточны для использования в ТПТЭ.
Влияние размера частиц носителя (TiO2) и содержания Pt на стабильность и активность в РВК Pt/TiO2-катализатора рассматривается в [33]. Средний размер наночастиц Pt увеличивается с увеличением размера частиц носителя и содержания Pt в катализаторе. Самую высокую активность в РВК продемонстрировал катализатор на основе 30 нм частиц TiO2 с содержанием 12 мас. % Pt. При этом масс-активность исходного, не подвергнутого стресс-тестированию катализатора ниже, чем у Pt/C. Результаты, полученные в [33], также подтвердили более высокую стабильность Pt/TiO2-катализаторов по сравнению с Pt/C.
Таким образом, публикации разных авторов, посвященные получению, а также изучению состава, структуры и электрохимического поведения Pt/TiO2-катализаторов, однозначно свидетельствуют о более высокой стабильности подобных материалов в условиях стресс-тестирования, по сравнению с Pt/C. В то же время количественные данные о величинах ЭХАП платины в таких материалах, их удельной и масс-активности в РВК существенно разнятся. В случае использования углеродсодержащих композиций Pt/TiO2+С остается много вопросов, связанных с ролью природы углеродного компонента, требованиями к его предобработке, условиям нанесения платины на диоксид титана или непосредственно на композит TiO2+С. На наш взгляд, решение вопроса о возможности замены Pt/C-катализаторов на Pt/TiO2- или Pt/TiO2+С-системы, поиск оптимальных путей синтеза и структур подобных материалов, выяснение причин влияния TiO2 на активность платины невозможны без накопления достаточного массива экспериментальных данных. При этом важным аспектом исследований является применение таких реагентов и технологий (методов) синтеза, которые в случае получения позитивного результата допускали бы масштабирование производства.
Целями настоящей работы являлись: отработка простого метода синтеза диоксида титана с высокоразвитой поверхностью, подходящего для последующего использования в качестве носителя НЧ платины; получение нанесенных платиновых катализаторов на его основе; изучение электрохимического поведения Pt/TiO2-катализатора и его смеси с графитизированной сажей Vulcan XC72. Важно было также понять, в какой степени введение в каталитическую композицию легко окисляемого углеродного компонента окажет влияние на стабильность электрокатализатора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза TiO2 использовали следующие исходные вещества: TiCl4 (х. ч.), 25%-ный раствор аммиака (ч. д. а.), 5%-ный раствор глюкозы, дистиллированную воду. На первой стадии получали очищенный гель гидроксида Ti(IV) по методике, выбранной на основании проведенных ранее исследований [35]. Затем его высушивали при 120°С в течение 48 ч и перетирали. Полученный порошок помещали в ячейку гидротермального синтеза, вводили раствор глюкозы, исходя из мольного соотношения С : TiO2 = 0.2 : 1. Далее при температуре 160°С в течение 24 ч с загрузкой ячейки на 80% проводили стадию гидротермального синтеза. Полученный материал высушивали и прокаливали при 600°С.
Pt-содержащие катализаторы получали химическим восстановлением Pt(IV) в суспензии носителя. Для приготовления суспензии полученные образцы носителя диспергировали ультразвуком в смеси вода-этиленгликоль в соотношении 1 : 1. Затем добавляли H2[PtCl6] · 6H2O из расчета массовой доли Pt в Pt/TiO2 40%. При постоянном перемешивании магнитной мешалкой в суспензию вносили последовательно 2 мл 37% HCOH и 1М раствор NaOH в смеси вода-этиленгликоль (1 : 1) до достижения рН 11. После 2-часовой выдержки при 90°С и самопроизвольного охлаждения перемешиваемой суспензии добавляли к ней 20 мл седиментационного агента – 1 М раствора NaCl. Через 30 мин отделяли твердую фазу фильтрованием. Осадок сушили в сушильном шкафу при 80°С до достижения постоянной массы.
Массовая доля платины в Pt/TiO2-катализаторе, наносимом на электрод в виде суспензии (см. далее), определена методом рентгенофлюоресцентного анализа (спектрометр РФС-001, напряжение – 50 кВ, ток – 150 мкА, молибденовый анод) и составляет 54 мас. %. Точность определения ±2.5%. Более высокое содержание платины в наносимом на электрод Pt/TiO2 по сравнению с расчетной массовой долей обусловлено наличием фракции крупных частиц носителя, слабо покрытых платиной. Такие частицы отделялись от суспензии Pt/TiO2 при нанесении катализатора на поверхность стеклографитового электрода.
Рентгеновские дифрактограммы получены на автоматическом дифрактометре ARL X’TRA с использованием медного Кα-излучения (λср = 1.5418 Å). Расчет среднего размера кристаллитов Dav проводили согласно методике, ранее описанной в [36].
Определение удельной площади поверхности и распределения пор по размерам выполняли с помощью анализатора удельной поверхности и пористости ASAP 2020 (Micromeritics Corp., США). Обработку данных проводили по методу БЭТ [37].
Морфологические характеристики материалов определяли методом просвечивающей электронной микроскопии (ПЭМ) с использованием микроскопа TEM Tecnai G2 Spirit Bio TWIN. Для проведения ПЭМ 0.5 г исследуемого материала помещали в емкость с 2 мл воды и обрабатывали ультразвуком мощностью 1 Вт в течение 15 мин. Полученную взвесь в виде капли помещали на подложку из тонкой пленки (~100 нм), которая далее была размещена на медную сетку-подложку для ПЭМ. Препарат оставляли при комнатной температуре до полного высыхания. Далее подложки помещали в трансмиссионный электронный микроскоп марки Tecnai G2 Spirit BioTWIN и изучали в проходящем пучке электронов с ускоряющим напряжением 100 кВ в светлопольном режиме. Исследуемый образец охлаждался жидким азотом для предотвращения нагрева. Разрешающая способность по точкам – 0.45 нм. Пределы допускаемой относительной погрешности измерений линейных размеров ±10%.
Измерение активности катализаторов проводили в стандартной трехэлектродной ячейке при температуре 25°С, с помощью потенциостата-гальваностата Pine AFCBP1 (Pine Research Instrumentation, USA). В качестве электролита использовали 0.1 М раствор HClO4. Исследуемый катализатор наносили на торец вращающегося дискового электрода площадью 0.196 см2 в виде специально приготовленных каталитических “чернил”. Для приготовления чернил навеску 0.006 г исследуемого катализатора, 900 мкл изопропанола и 100 мкл 0.5%-ного раствора Nafion гомогенизировали ультразвуком 40 мин и перемешивали на магнитной мешалке. Аликвоту полученной суспензии объемом 6 мкл наносили на предварительно очищенный стеклографитовый торец вращающегося дискового электрода. Затем, после высыхания капли, для закрепления каталитического слоя наносили 7 мкл 0.05%-ного раствора Nafion.
В качестве электрода сравнения использовали насыщенный хлоридсеребряный электрод, в качестве вспомогательного электрода – платиновую проволоку. Значения потенциалов в работе приведены относительно обратимого водородного электрода. Для стандартизации электродов перед дальнейшими измерениями регистрировали 100 циклов в диапазоне от 0.03 до 1.26 В со скоростью развертки потенциала 200 мВ/с. После стандартизации проводили регистрацию 2 циклических вольтампераграмм (ЦВА) для определения площади ЭХАП катализатора в том же диапазоне потенциалов со скоростью развертки 20 мВ/с. Расчет величины ЭХАП вели по количеству электричества, затраченному на адсорбцию/десорбцию атомарного водорода с учетом загрузки платины на электроде.
Для измерения активности катализаторов регистрировали серию потенциодинамических кривых на вращающемся дисковом электроде в диапазоне потенциалов 0.1–1.2 В со скоростью развертки потенциала 20 мВ/с при различных скоростях вращения электрода (400, 900, 1600, 2500 об/мин). Измеренные кривые нормировали с учетом омического падения напряжения и вычитали фоновую кривую, измеренную в электролите, насыщенном Ar; далее проводили анализ зависимости тока от скорости вращения дискового электрода. Для учета омического падения напряжения в используемой ячейке были скорректированы значения потенциалов (E) по формуле: E = Eизм – IR, где Eизм – измеряемое значение потенциала, В; I – значение силы тока при данном потенциале, А; R – сопротивление электролита между электродом сравнения и исследуемым электродом, Ом. Величина сопротивления электролита в данной системе составила 25 Ом. Для расчета количества электронов, участвующих в реакции, использовали уравнение Коутецкого–Левича [38]: 1/i = 1/iк + 1/iд, где i – ток на дисковом электроде, А/см2; iк – кинетический ток, А/см2; iд – диффузионный ток. Величина диффузионного тока в условиях вращающегося дискового электрода описывается формулой iд = = 0.62nFD2/3ν–1/6cω0.5, где iд – диффузионный ток, А/см2; ω – скорость вращения дискового электрода (рад/с); n – количество электронов, участвующих в реакции электровосстановления молекулы кислорода; F – постоянная Фарадея, Кл/моль; D – коэффициент диффузии, см2/с; ν – кинематическая вязкость электролита, см2/с; с – концентрация кислорода в растворе, моль см–3. Уравнение Коутецкого–Левича представляли в виде 1/i = 1/iк + 1/Zω0.5, где Z = 0.62nFD2/3ν–1/6c. Далее строили прямолинейную зависимость тока от угловой скорости вращения электрода при постоянном потенциале 0.9 В (относительно ОВЭ) в координатах 1/i–1/ω0.5. По величине отрезка, отсекаемого на оси ординат, определяли значение кинетического тока, а по величине угла наклона прямой, соответствующего значению 1/Z, рассчитывали количество электронов (n), участвующих в реакции электровосстановления молекулы кислорода. Электрохимическое поведение полученных образцов сравнивали между собой, а также с поведением коммерческого Pt/C-электрокатализатора JM20 (20% Pt, Johnson Matthey, USA).
Стабильность оценивали методом вольтамперометрического циклирования в трехэлектродной ячейке в диапазоне потенциалов 0.6–1.4 В со скоростью развертки 100 мВ/с. Циклирование проводили в 0.1 М растворе HClO4 в атмосфере Ar при 25°C в течение 1000 циклов, при этом после каждых 100 циклов регистрировали две циклические вольтамперограммы (при скорости развертки потенциала 20 мВ/с, диапазон потенциалов – от 0.03 до 1.26 В). По второй ЦВА проводили расчет ЭХАП так, как это описано ранее. Стабильность оценивали по изменению соотношения ЭХАПj/ЭХАП0, где j – число проведенных циклов стресс-теста (ЭХАП1000/ЭХАП0). Воспроизводимость данных оценивали по серии измерений в полностью идентичных условиях, точность определения ЭХАП и относительной стабильности составляет 5 и 7% соответственно.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
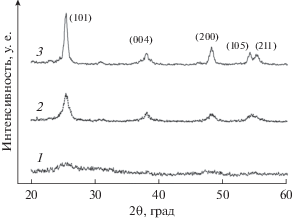
Изучение образцов TiO2, полученных как до, так и после гидротермальной и термической обработки, методом рентгенофазового анализа (РФА) демонстрирует эволюцию материала носителя в процессе синтеза: показано, что гель гидроксида титана(IV) рентгеноаморфен (рис. 1, кривая 1). После гидротермальной обработки на рентгенограмме появляются отчетливые пики, соответствующие фазе анатаза (рис. 1, кривая 2). Рентгенограммы материалов, прокаленных при 600°C, также демонстрируют отражения, соответствующие анатазной модификации диоксида титана (рис. 1, кривая 3). Пики фаз рутила, брукита или других кристаллических фаз на рентгенограммах отсутствуют, что указывает на фазовую однородность полученных продуктов.
Рис. 1.
Рентгенограммы: 1 – высушенный гель гидроксида титана(IV) в состоянии “как получено”; 2 – TiO2 после гидротермальной обработки; 3 – TiO2 после завершающей стадии отжига.
Средний размер наночастиц TiO2 в материале после отжига при 600°С, определенный по результатам ПЭМ (рис. 2), составляет от 7 до 27 нм, что хорошо коррелирует с результатами определения среднего размера областей когерентного рассеивания по методу Шерера (21 нм).
Средний диаметр пор на поверхности полученного оксида титана(IV), определенный методом БЭТ, составил 8 нм, а удельная площадь поверхности составила 104 м2/г, что хорошо согласуется с результатами [23]. Таким образом, полученный материал обладает достаточно высокой площадью поверхности, позволяющей формировать неагрегатированные наночастицы платины на его основе.
Нанесение наночастиц платины на синтезированный диоксид титана позволило получить материал Pt/TiO2, содержащий 54 мас. % платины. На рентгенограмме (рис. 3а) наряду с отражениями платины присутствуют линии анатаза в том же виде, в каком и для TiO2, непосредственно после синтеза. Средний размер кристаллитов платины (Dср), рассчитанный по результатам рентгенографических исследований (рис. 3б), составил 2.7 нм. Данное значение Dср(Pt) весьма близко к размерам НЧ в подобных материалах, изученных ранее в [23]. Также был приготовлен композиционный материал Pt/TiO2+C, содержавший 27 мас. % платины и состоящий из смеси Pt/TiO2 и углерода Vulcan XC72 с соотношением масс 1 : 1. При получении этого композита исходили из предположения, что добавка углерода приведет к увеличению электронной проводимости материала, следствием чего станет повышение доли НЧ платины, фактически участвующих в электрокатализе. Отметим, что размер НЧ платины, нанесенных на оксидный носитель, близок к размеру НЧ в коммерческом Pt/C-электрокатализаторе HiSPEC3000, Johnson Matthey (JM20), который использовали в качестве образца сравнения (табл. 1).
Рис. 3.
а – Дифрактограмма полученного Pt/TiO2-катализатора. Указаны индексы наиболее сильных отражений: черными сплошными штрихами на оси абсцисс обозначены линии анатаза, а серыми пунктирными – линии платины; б – схема определения ширины пика на середине высоты для расчета среднего диаметра кристаллитов Pt.

Таблица 1.
Параметры, характеризующие состав, структуру и электрохимическое поведение электрокатализаторов
| Образец | ω, мас. % Pt | Dср(Pt), нм | ЭХАП, м2/г(Pt) | Число электронов | Ik0.85, A/г(Pt) | Ik0.85, A/м2(Pt) | E1/2, В |
|---|---|---|---|---|---|---|---|
| Pt/TiO2 | 54 | 2.7 | 26 | 3.4 | 20 | 0.77 | 0.89 |
| Pt/TiO2+C | 27 | 2.7 | 44 | 3.7 | 82 | 1.86 | 0.88 |
| JM20 | 20 | 2.0 | 95 | 3.8 | 180* | 1.90* | 0.9 |
ЦВА электрокатализаторов на основе TiO2 демонстрируют форму, характерную для нанесенных платиновых катализаторов (рис. 4). Добавление углерода к Pt/TiO2 (рис. 4, образец Pt/TiO2+C) увеличивает как скорость протекания фарадеевских процессов (растут токи в “водородной” и “кислородной” областях ЦВА), так и токи заряжения двойного электрического слоя. Таким образом, введение в композит частиц электронного проводника, действительно, увеличивает долю наночастиц платины, “работающих” в качестве электрокатализатора, и, как следствие, площадь активной поверхности электрода. Значения ЭХАП, рассчитанные по области десорбции атомарного водорода на ЦВА (см. раздел “Экспериментальная часть”), повышаются при переходе от Pt/TiO2 к Pt/TiO2+C, однако значительно (примерно в 2 раза для Pt/TiO2+C) уступают таковому для образца сравнения Pt/C (табл. 1). Это может быть обусловлено несколькими причинами, в числе которых: больший средний размер НЧ платины в Pt/TiO2 по сравнению с Pt/C (табл. 1); большая степень агломерации НЧ платины, нанесенных на TiO2; наличие в Pt/TiO2 и Pt/TiO2+C электрически изолированных наночастиц платины, не “включенных” в цепь переноса электронов. В то же время значения ЭХАП полученных нами электрокатализаторов заметно превышают соответствующие значения для композитов Pt/TiO2/C, описанных в [23], и сопоставимы с ЭХАП катализаторов, где в качестве носителя применяли дорогостоящие и весьма сложные в получении Pt/Ti1– xMx (М = Ru, Nb) материалы [23]. Значительно меньше площадь поверхности платины также и в Pt/TiO2+С-катализаторах, полученных и исследованных в [32]. В этом случае причиной различия может быть очень большой размер НЧ платины (7 нм), обусловленный особенностями метода электрохимического диспергирования, используемого в [32] для нанесения платины.
Рис. 4.
ЦВА платиновых электрокатализаторов на основе диоксида титана. Электролит 0.1 М HClO4, атм. Ar.

Сравнение потенциодинамических кривых электровосстановления кислорода на исследуемых катализаторах и Pt/C (рис. 5) позволяет расставить их в следующий ряд по увеличению активности в РВК: Pt/TiO2 < Pt/TiO2+C < Pt/C. Обращает на себя внимание увеличение величины предельного диффузионного тока в этом же ряду. Специфика электрода в данном случае состоит в том, что электрохимическая реакция происходит не только на равнодоступной поверхности слоя катализатора, нанесенного на стеклографитовый торец вращающегося дискового электрода, но и на наночастицах платины, находящихся в толще такого слоя. По-видимому, пористость слоя, сформированного из Pt/TiO2 ниже, чем для слоя Pt/C, что обусловливает дополнительные затруднения при доставке молекул кислорода в глубину слоя.
Рис. 5.
Потенциодинамические кривые реакции электровосстановления кислорода на полученных электрокатализаторах и коммерческом образце JM20 при 1600 об/мин. Электролит 0.1 М HClO4.

Обработка результатов потенциодинамических измерений в координатах Коутецкого–Левича (рис. 6) позволила определить значения кинетических токов и рассчитать число электронов, переносимых через границу электрод/раствор при электровосстановлении молекулы кислорода (табл. 1). Известно, что реакция электровосстановления кислорода может проходить как по 2‑ (1), так и по 4- (2) электронному механизму [39]. В данном случае (табл. 1) реакция протекает по 4-электронному механизму (2):
(1)
${{{\text{O}}}_{2}} + 2{{{\text{H}}}^{ + }} + 2{\text{e}} = {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}},~~~$(2)
$2{{{\text{O}}}_{2}} + {\text{ }}4{{{\text{H}}}^{ + }} + 4{\text{e}} = {\text{ }}2{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Рис. 6.
Зависимость в координатах Коутецкого–Левича для реакции электровосстановления кислорода на исследуемых катализаторах при Е = 0.85 В (* при потенциале 0.90 В).

Отметим существенное улучшение характеристик катализатора при введении в его состав электропроводящей добавки, полуаморфного углерода марки Vulcan-72. Сопоставляя значения ЭХАП и удельных кинетических токов (масс-активности Pt), позитивное влияние углерода можно объяснить “подключением” ранее не работавщих активных центров (нанокластеров платины), закрепленных на непроводящем электроны носителе. Увеличение удельного кинетического тока в перерасчете на 1 м2 ЭХАП (табл. 1, столбец 7) дает основания полагать, что общий рост числа электроноподводящих контактов приводит и к увеличению доли наиболее активных граней наночастиц в совокупной ЭХАП. Отметим, что Pt/TiO2-электрокатализаторы близкого состава, полученные в [33], демонстрируют бóльшую удельную активность (9.7 А/м2 платины), но существенно меньшую масс-активность в расчете на 1 г платины, по сравнению с Pt/TiO2+C, полученным в данной работе. Удельная активность катализатора, приведенная в работе [33], вызывает сомнения, так как данные значения превышают таковые для Pt/C-электрокатализаторов ~ в 5 раз. При этом загрузка платины на вращающемся дисковом электроде, который использовался в работе [33], примерно в 5 раз ниже, чем в настоящей работе.
Исходя из литературных данных (см. “Введение”) мы полагали, что основным преимуществом НЧ Pt нанесенных на химически стойкий носитель будет являться высокая стабильность. Действительно, по результатам проведения ускоренных стресс-тестов катализаторы на основе диоксида титана примерно в 3 раза превосходят коммерческий Pt/C-аналог по стабильности (рис. 7). Они продемонстрировали более высокую стабильность также и по сравнению с описанными в [33] аналогами. В условиях существенно более мягкого режима циклирования, использованного в [33] при проведении стресс тестов, Pt/TiO2-образцы продемонстрировали примерно такое же снижение стабильности, что и наши катализаторы в более жестком режиме (рис. 7). Данный факт можно объяснить большим размером наночастиц платины в полученном нами катализаторе, по сравнению с катализатором, исследованным в [33].
Рис. 7.
Относительное (а) и абсолютное (б) изменение ЭХАП электрокатализаторов при многократном циклировании потенциала.

Важно, что высокую стабильность продемонстрировал не только Pt/TiO2, но и композитный катализатор Pt/TiO2+C, содержащий значительное количество углерода. По-видимому, наночастицы платины значительно ускоряют деградацию углерода только в условиях прочной адгезии к нему, т.е. при их непосредственном нанесении на поверхность частиц сажи. В то же время наличие контактов частиц углерода с поверхностью частиц TiO2 и нанесенными на оксидный носитель частицами Pt не приводит к столь же выраженной деградации катализатора, как в случае Pt/C. Аналогичные результаты, свидетельствующие о высокой стабильности Pt/TiO2+C-катализаторов в РВК получены в работе [34]. Однако авторы [34] исследовали композиционные электроды с очень маленьким содержанием платины (порядка 7 мас. %), которые были получены посредством фотохимического восстановления прекурсора платины на поверхности НЧ оксида титана в композиционном носителе TiO2/УНТ. Небольшое содержание платины, способствующее снижению проблем массопереноса в слое катализатора и обуславливающее снижение проблем коалесценции НЧ, позволило авторам [34] добиться также и высокой масс-активности катализаторов в РВК. В настоящей работе речь идет об электрохимическом поведении смеси Pt/TiO2, содержащей 54 мас. % Pt с частицами сажевого углеродного носителя Vulcan XC72, не подвергавшегося какой-либо дополнительной обработке.
ЗАКЛЮЧЕНИЕ
Для получения платиновых катализаторов синтезирован оксидный носитель на основе TiO2, модификация анатаз. Средний размер частиц (кристаллитов) TiO2 составил примерно 21 нм, удельная площадь поверхности – 104 м2/г.
Методом химического восстановления Pt(IV) получен Pt/TiO2-электрокатализатор с массовой долей Pt 54% и средним диаметром кристаллитов около 2.7 нм. ЭХАП катализатора составила 26 м2/г(Pt). Добавление дисперсного углеродного материала Vulcan-XC72 привело к заметному повышению электронной проводимости композита, вследствие чего ЭХАП платины в композитном катализаторе Pt/TiO2+C (1 : 1) достигла ~44 м2/г(Pt).
Массовая и удельная активности полученных нами Pt/TiO2- и Pt/TiO2+C-электрокатализаторов в РВК уступают соответствующим значениям для коммерческого Pt/C-электрокатализатора JM20, однако стабильность катализаторов на основе TiO2 в условиях стресс-теста в “жестких” условиях примерно в 3 раза превышает стабильность Pt/C. Это подтверждает перспективность применения композитов на основе Pt/TiO2 в качестве катализаторов для водородо-воздушных ТПТЭ, эксплуатируемых в режиме “старт-стоп”, требующем от них высокую устойчивость к деградации. Важно, что добавка углерода к Pt/TiO2 увеличивает ЭХАП и активность катализатора в РВК, практически не снижая стабильность катализатора.
Для повышения активности Pt/TiO2+C-катализаторов в РВК, на наш взгляд, необходимо проведение систематических исследований в области влияния размера НЧ платины и ее загрузки на их электрохимическое поведение, а также определение вида и оптимальной концентрации электропроводящей добавки в композиции Pt/TiO2+C.
Список литературы
Кузов, А.В., Тарасевич, М.Р., Богдановская, В.А. Катализаторы анодного окисления этанола для этанольно-воздушного топливного элемента с протонпроводящим полимерным электролитом. Электрохимия. 2010. Т. 46. № 4. С. 444. [Kuzov, A.V., Tarasevich, M.R., and Bogdanovskaya, V.A., Catalysts of Ethanol Anodic Oxidation for Ethanol-Air Fuel Cell with a Proton-Conducting Polymer Electrolyte, Russ. J. Electrochem., 2010, vol. 46, no. 4, p. 422–430.]
Sharaf, O.Z. and Orhan, M.F., An overview of fuel cell technology: Fundamentals and applications, Renew. Sustain. Energy Rev., 2014, vol. 32, p. 810.
Ярославцев, А.Б., Добровольский, Ю.А., Шаглаева, Н.С., Фролова, Л.А., Герасимова, Е.В., Сангинов, Е.А. Наноструктурированные материалы для низкотемпературных топливных элементов. Успехи химии. 2012. Т. 81. С. 191. [Yaroslavtsev, A.B., Dobrovolsky, Yu.A., Shaglaeva, N.S., Frolova, L.A., Gerasimova, E.V., and Sanginov, E.A., Nanostructured materials for low-temperature fuel cells, Russ. Chem. Rev., 2012, vol. 81, no. 3, p. 191.]
Antolini, E., Structural parameters of supported fuel cell catalysts: The effect of particle size, inter-particle distance and metal loading on catalytic activity and fuel cell performance, Appl. Catal. B-Environ., 2016, vol. 181, p. 298.
Antolini, E., Carbon supports for low-temperature fuel cell catalysts, Appl. Catal. B-Environ., 2009, vol. 88, nos. 1–2, p. 1.
Stamenkovic, V.R., Fowler, B., Mun, B.S., Wang, G.F., Ross, P.N., Lucas, C.A., and Markovic, N.M., Improved oxygen reduction activity on Pt3Ni(111) via increased surface site availability, Science, 2007, vol. 315, no. 5811, p. 493.
Stamenkovic, V.R., Mun, B.S., Arenz, M., May-rhofer, K.J.J., Lucas, C.A., Wang, G.F., Ross, P.N., and Markovic, N.M., Trends in electrocatalysis on extended and nanoscale Pt-bimetallic alloy surfaces, Nat. Mater., 2007, vol. 6, no. 3, p. 241.
Stamenkovic, V., Mun, B.S., Mayrhofer, K.J.J., Ross, P.N., Markovic, N.M., Rossmeisl, J., Greeley, J., and Norskov, J.K., Changing the activity of electrocatalysts for oxygen reduction by tuning the surface electronic structure, Angew. Chem.-Int. Ed., 2006, vol. 45, no. 18, p. 2897.
Oezaslan, M., Hasche, F., and Strasser, P., Pt-Based Core–Shell Catalyst Architectures for Oxygen Fuel Cell Electrodes, J. Phys. Chem. Lett., 2013, vol. 4, no. 19, p. 3273.
Chen, A. and Holt-Hindle, P., Platinum-Based Nanostructured Materials: Synthesis, Properties, and Applications, Chem. Rev., 2010, vol. 110, no. 6, p. 3767.
Ferreira, P.J., la O, G.J., Shao-Horn, Y., Morgan, D., Makharia, R., Kocha, S., and Gasteiger, H.A., Instability of Pt/C electrocatalysts in proton exchange membrane fuel cells – A mechanistic investigation, J. Electrochem. Soc., 2005, vol. 152, no. 11, p. A2256.
Borup, R., Meyers, J., Pivovar, B., Kim, Y.S., Mukundan, R., Garland, N., Myers, D., Wilson, M., Garzon, F., Wood, D., Zelenay, P., More, K., Stroh, K., Zawodzinski, T., Boncella, J., McGrath, J.E., Inaba, M., Miyatake, K., Hori, M., Ota, K., Ogumi, Z., Miyata, S., Nishikata, A., Siroma, Z., Uchimoto, Y., Yasuda, K., Kimijima, K.I., and Iwashita, N., Scientific aspects of polymer electrolyte fuel cell durability and degradation, Chem. Rev., 2007, vol. 107, no. 10, p. 3904.
Shao, Y.Y., Yin G.P., and Gao Y.Z., Understanding and approaches for the durability issues of Pt-based catalysts for PEM fuel cell, J. Power Sources., 2007, vol. 171, no. 2, p. 558.
Hodnik, N., Dehm, G., and Mayrhofer, K.J.J., Importance and Challenges of Electrochemical in Situ Liquid Cell Electron Microscopy for Energy Conversion Research, Acc. Chem. Res., 2016, vol. 49, no. 9, p. 2015.
Кузов, А.В., Тарасевич, М.Р., Богдановская, В.А., Модестов, А.Д., Трипачев, О.В., Корчагин, О.В. Деградационные процессы в водородно-воздушном топливном элементе в зависимости от рабочих условий и состава мембранно-электродных блоков. Электрохимия. 2016. Т. 52. № 7. С. 790. [Kuzov, A.V., Tarasevich, M.R., Bogdanovskaya, V.A., Modestov, A.D., Tripachev, O.V., and Korchagin O.V., Degradation processes in hydrogen-air fuel cell as a function of the operating conditions and composition of membrane-electrode assemblies, Russ. J. Electrochem., 2016, vol. 52, no. 7, p. 705.]
Venkatesan, S.V., Dutta, M., and Kjeang, E., Mesoscopic degradation effects of voltage cycled cathode catalyst layers in polymer electrolyte fuel cells, Electrochem. Commun., 2016, vol. 72, p. 15.
Sharma, S. and Pollet, B.G., Support materials for PEMFC and DMFC electrocatalysts-A review, J. Power Sources., 2012, vol. 208, p. 96.
Богдановская, В.А., Кольцова, Э.М., Тарасевич, М.Р., Радина, М.В., Жутаева, Г.В., Кузов, А.В. Высокоактивные и стабильные катализаторы на основе нанотрубок и модифицированной платины для топливных элементов. Электрохимия. 2016. Т. 52. № 8. С. 810. [Bogdanovskaya, V.A., Kol’tsova, E.M., Tarasevich, M.R., Radina, M.V., Zhutaeva, G.V., Kuzov, A.V., and Gavrilova, N.N., Highly active and stable catalysts based on nanotubes and modified platinum for fuel cells, Russ. J. Electrochem., 2016, vol. 52, no. 8, p. 723.]
Wang, L., Chen, J., Rudolph, V., and Zhu, Z., Nanotubules-supported Ru nanoparticles for preferential CO oxidation in H2-rich stream, Adv. Powder Technol., 2012, vol. 23, no. 4, p. 465.
Балахонов, С.В., Вацадзе, С.З., Чурагулов, Б.Р. Журн. неорган. химии, 2015. Т. 60. № 1. С. 11. [Balakhonov, S.V., Vatsadze, S.Z., and Churagulov, B.R., Effect of supercritical drying parameters on the phase composition and morphology of aerogels based on vanadium oxide, Inorg. Chem., 2015, vol. 60, no. 1, p. 9.]
Ogi, T., Nandiyanto, A.B.D., and Okuyama, K., Nanostructuring strategies in functional fine-particle synthesis towards resource and energy saving applications, Adv. Powder Technol., 2014, vol. 25, no. 1, p. 3.
Elezovic, N.R., Radmilovic, V.R., and Krstajic, N.V., Platinum nanocatalysts on metal oxide-based supports for low temperature fuel cell applications, RSC Adv., 2016, vol. 6, p. 6788.
Фролова, Л.А., Добровольский, Ю.А. Платиновые электрокатализаторы на основе оксидных носителей для водородных и метанольных топливных элементов, Изв. Академии наук. Сер. хим. 2011. № 6. С. 1076. [Frolova, L.A. and Dobrovolsky, Y.A., Platinum electrocatalysts based on oxide supports for hydrogen and methanol fuel cells, Russ. Chem. Bulletin., 2011, vol. 60, no. 6, p. 1101.]
Huang, S.-Y., Ganesan, P., and Popov, B.N., Titania supported platinum catalyst with high electrocatalytic activity and stability for polymer electrolyte membrane fuel cell, Appl. Catal. B: Environmental, 2011, vol. 102, p. 71.
Behafarid, F. and Cuenya, B.R., Coarsening phenomena of metal nanoparticles and the influence of the support pre-treatment: Pt/TiO2 (110), Surface Science, 2012, vol. 606, p. 908.
Akalework, N.G., Pan, C.-J., Su, W.-N., Rick, J., Tsai, M.-C., Lee, J.-F., Lin, J.-M., Tsai, L.-D., and Hwang, B.-J., Ultrathin TiO2-coated MWCNTs with excellent conductivity and SMSI nature as Pt catalyst support for oxygen reduction reaction in PEMFCs, J. Mater. Chem., 2012, vol. 22, p. 20977.
Esfahani, R.A.M., Videla, A., Vankova, S., and Specchia, S., Stable and methanol tolerant Pt/TiOx-C electrocatalysts for the oxygen reduction reaction, Intern. J. Hydrogen Energy, 2015, vol. 40, p. 14529.
Ando, F., Tanabe, T., Gunji, T., Tsuda, T., Kaneko, S., Takeda, T., Ohsaka, T., and Matsumoto, F., Improvement of ORR Activity and Durability of Pt Electrocatalyst Nanoparticles Anchored on TiO2/Cup-Stacked Carbon Nanotube in Acidic Aqueous Media, Electrochim Acta, 2017, vol. 232, p. 404.
Anwar, M.T., Yan, X., Shen, S., Husnain, N., Zhu, F., Luo, L., and Zhang, J., Enhanced durability of Pt electrocatalyst with tantalum doped titania as catalyst support, Intern. J. Hydrogen Energy, 2017, vol. 42, p. 30750.
Bo, Z., Ahn, S., Ardagh, M.A., Schweitzer, N.M., Canlas, C.P., Farha, O.K., and Notestein, J.M., Synthesis and stabilization of small Pt nanoparticles on TiO2 partially masked by SiO2, Applied Catalysis A: General, 2018, vol. 551, p. 122.
Dhanasekaran, P., Selvaganesh, S.V., Sarathi, L., and Bhat, S.D., Rutile TiO2 Supported Pt as Stable Electrocatalyst for Improved Oxygen Reduction Reaction and Durability in Polymer Electrolyte Fuel Cells, Electrocatalysis, 2016, vol. 7, p. 495.
Kuriganova, A.B., Leontyev, I.N., Alexandrin, A.S., Maslova, O.A., Rakhmatullin, A.I., and Smirnova, N.V., Electrochemically synthesized Pt/TiO2-C catalysts for direct methanol fuel cell applications, Mendeleev Communications, 2017, vol. 27, p. 67.
Mirshekari, G.R. and Rice, C.A., Effects of support particle size and Pt content on catalytic activity and durability of Pt/TiO2 catalyst for oxygen reduction reaction in proton exchange membrane fuel cells environment, J. Power Sources, 2018, vol. 396, p. 606.
Wang, J., Xu, M., Zhao, J., Fang, H., Huang, Q., Xiao, W., Li, T., and Wang, D., Anchoring ultrafine Pt electrocatalysts on TiO2-C via photochemical strategy to enhance the stability and efficiency for oxygen reduction reaction, Applied Catalysis B: Environmental, 2018, vol. 327, p. 228.
Bayan, E.M., Lupeiko, T.G., Pustovaya, L.E., and Fedorenko, A.G., Springer Proc. in Phys., 2016, vol. 175, p. 51.
Kirakosyan, S.A., Alekseenko, A.A., Guterman, V.E., Volochaev, V.A., and Tabachkova, N.Y., Effect of CO atmosphere on morphology and electrochemically active surface area in the synthesis of Pt/C and PtAg/C electrocatalysts, Nanotechnologies Russ., 2016, vol. 11, nos. 5–6, p. 287.
Brunauer, S., Emmett, P.H., and Teller, E., Adsorption of Gases in Multimolecular Layers, J. Am. Chem. Soc., 1938, vol. 60, no. 2, p. 309.
Alekseenko, A., Ashihina, E., Shpanko, S., Volochaev, V., Safronenko, O., and Guterman, V., Application of CO atmosphere in the liquid phase synthesis as a universal way to control the microstructure and electrochemical performance of Pt/C electrocatalysts, Appl. Catal. B: Environmental, 2018, vol. 226, p. 608.
Mayrhofer, K.J.J., Blizanac, B.B., Arenz, M., Stamenkovic, V.R., Ross, P.N., and Markovic, N.M., The impact of geometric and surface electronic properties of Pt-catalysts on the particle size in electrocatalysis, J. Phys. Chem. B., 2005, vol. 109, p. 14433.
Дополнительные материалы отсутствуют.



