Электрохимия, 2019, T. 55, № 10, стр. 1188-1198
Электрохимическое поведение полианилина под влиянием смены допирующих анионов
В. В. Абаляева a, *, О. Н. Ефимов a, **
a Учреждение Российской академии наук Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. Академика Семенова, 1, Россия
* E-mail: avva@icp.ac.ru
** E-mail: efimor@mail.ru
Поступила в редакцию 19.10.2018
После доработки 28.01.2019
Принята к публикации 30.03.2019
Аннотация
Проведено электрохимическое циклирование образцов полианилина (ПАни), полученного из анилин-сульфата (АС) в LiCl, LiClO4 и LiТЦХМ, сопровождающееся сменой электролита. Показано, что при смене электролита и аниона-допанта ПАни сохраняет электрохимическую активность во всех исследованных случаях. Электрохимическая активность для таких допантов как, Cl– и ${\text{ClO}}_{4}^{ - },$ при смене электролита падает в первых циклах, но в последующих циклах это снижение уменьшается. При возвращении испытуемого электрода в “родной” электролит электрохимическая активность и электрохимическая емкость возрастают, восстанавливаясь до первоначальных значений. В случае допирования ПАни анионом тетрацианохинодиметана (TЦХМ) каждая последующая серия циклирований показывает увеличение электрохимической активности, что выражается в увеличении площади ЦВА и также увеличении от серии к серии электрохимической емкости.
1. ВВЕДЕНИЕ
Для практических применений ПАни требуется изменение его проводимости, растворимости, морфологии и др. Одним из удобных методов влияния на свойства ПАни является возможность замещения ионов-допантов на ионы из электролита при потенциодинамическом циклировании (редопировании).
Исследования показали, что введенные в состав полианилиновой матрицы объемные полианионы на основе поликислот стерически удерживаются в матрице полимера, что приводит к изменению механизма электрохимического допирования – дедопирования с участием транспорта анионов на более быстрый транспорт протонов [1]. При использовании полистиролсульфоновой и полиакриловой кислот [2] между частично допированными цепями полианилина (поликатиона) и отрицательно заряженными цепями полианиона возникает гребнеобразная, двунитиевая структура. Такие матричные структуры растворимы в воде и метаноле и сохраняют электрохимическую активность до рН 7–8 в отличие от простых солевых форм ПАни [3, 4]. Это позволяет использовать их при изготовлении биосенсоров для биологических систем.
Второй путь уменьшить миграцию анионов из полимера может заключаться в использовании электрохимически активных анионов (ЭАА), образующих химические или координационные связи с матрицей ПАни и одновременно обладающих собственной электроактивностью. Это приводит к расширению области потенциалов, в которых электродный материал сохраняет электроактивность (“электрохимическое окно потенциалов”). Например, было показано, что использование в качестве ЭАА представителей класса хинонов позволило значительно расширить спектральный диапазон электрохромных устройств на основе ПАни [5]. Для создания нового класса высокоэффективных сенсоров использовались гетерополианионы, содержащие различные металлы [6, 7], фталоцианиды меди [8], феррицианиды [9], представители о- и п-хинонов и гетероциклических соединений (например, индиготетрасульфонат) [10].
Существенно, что в присутствии ЭАА электросинтез (ЭС) ПАни проходит при более низких потенциалах и с незначительным индукционным периодом, чем в отсутствие ЭАА [11, 12]. С этой точки зрения, наиболее эффективным и поэтому более изученным оказался гексахлориридат-анион (ГХИ) ${\text{IrCl}}_{6}^{{2 - }}$ [13], который инициирует полимеризацию алифатических и ароматических аминов и диаминов независимо от природы материала электрода и способа ЭС. Считается [14], что cильные окислительные свойства ГХИ обеспечивают легкое окисление ряда алифатических и ароматических аминов и диаминов. Известно [15, 16], что при электрохимическом и химическом синтезах ПАни лимитирующей стадией является окисление Ан до катион-радикала, после чего реакция становится автокаталитической.
Способность акцепторных молекул (например, тетрацианохинодиметана (ТЦХМ), хлоранила и т.д.) образовывать стабильные комплексы с ароматическими аминами известна давно [17]. Например, TЦХМ – сильная π-кислота – легко образует комплексы с донорными соединениями. Образование такого комплекса описывается как взаимодействие бедных электронами π-орбиталей хинона (π-кислоты или π-акцептора) с богатыми электронами π-орбиталями амина (π-основания или π-донора) [18]. Задача данного исследования заключалась в том, чтобы изучить возможность многократного ре-допирования полимера в условиях, когда окислительно-восстановительные процессы в полимере затруднены из-за отсутствия протонов в электролите. Такая необходимость может возникнуть, если анион, который необходимо ввести в состав полимера, например, не существует в кислой среде или плохо растворим в ней. При замене аниона, отвечающего за механизм компенсации заряда, инжектированного в ходе электрохимического процесса, при де-допировании/редопировании образуется полимер, который будет обладать свойствами, отличными от исходного [19–21]. Известно также [22], что изменение механизма компенсации заряда происходит в процессе дедопирования/редопирования в растворах кислот, анионы которых крупнее тех, что были использованы при синтезе. Подробно образование, выделение и изучение комплекса Ан с ТЦХМ нами было описано в [23]. В настоящей работе мы постарались выяснить, насколько возможно в процессе многократной смены такого сложного и объемного аниона в полимере, как ТЦХМ, в ходе дедопирования/редопирования сохранить электрохимическую активность полимера, учитывая что в составе изучаемых солей, согласно литературным данным, имеются как нейтральные молекулы, так и анион-радикалы ТЦХМ, а в некоторых своих комплексах ТЦХМ имеет заряд –2/3 и –1/2 [24].
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. ЭС ПАни
ЭС ПАни проводился в потенциодинамическом режиме в интервале потенциалов –0.2…+0.7 В (относительно Ag/AgCl) в трехкамерной стеклянной электрохимической ячейке (используемый объем электролита 15 мл) при комнатной температуре (21–22°С). Все потенциалы в данной работе приведены относительно этого электрода сравнения. Пространства рабочего и вспомогательного электродов были разделены пористой стеклянной перегородкой. Рабочим раствором являлся 0.2 М раствор анилинсульфата (АС) в 1 M H2SO4. Полученный из АС образец обозначен ПАни-сульфо. Рабочим электродом являлась поверхность стеклоуглеродного стержня (CУ) диаметром 5 мм (S = = 0.2 см2), впаянного в стеклянную трубку. Вспомогательным электродом служила СУ-пластина 1 × 5 см. Наработка продукта для физико-химических исследований проводилась на СУ-пластинах размером 1 × 5 см.
2.2. Электрохимические исследования
Электролитами, используемыми для электрохимического циклирования, являлись 1 M H2SO4 (Э0), 1 М раствор LiCl (Э1) с рН4, 1 М раствор LiClO4 (Э2) с рН 4.2 и 0.2 М раствор LiTЦХМ (Э3) с рН 7.5 в дистиллированной воде. Для измерения рН подготовленных электролитов использовали портативный рН-метр “Cheker” фирмы Hanna (Португалия). После проведения ЭС в Э0 электрод (ПАни-сульфо) вынимали из электрохимической ячейки с рабочим раствором, тщательно промывали в дистиллированной воде и выдерживали в ней в течение 5 мин, затем помещали в электрохимическую ячейку с исследуемым электролитом, например Э1, и циклировали в нем в течение 30 циклов в интервале потенциалов ‒0.2…+0.7 В. Полученный образец обозначался ПАни-LiCl. Затем в этом же электролите снимали зарядно-разрядные характеристики при рабочем токе 100 мкА. После этого электрод вынимали из электролита, промывали в воде, выдерживали в ней, помещали электрод в Э0 и проводили в этом электролите те же испытания (циклирование и зарядно-разрядные процессы). Для одного электрода электролиты менялись таким образом четырежды. Аналогично электрод после ЭС, проциклированный в Э2, обозначался ПАни-LiClO4. Электрод, проциклированный в Э3, обозначался ПАни-LiТЦХМ. Удельная электрохимическая емкость ПАни (СS) была вычислена согласно уравнению СS = It/S∆V, где I – постоянный ток разряда (A), t – время разряда (с) и ∆V – интервал потенциалов зарядо-разрядного процесса (В), S – площадь микроэлектрода (см2) или Сm, где m – масса ПАни (г).
Электрохимические испытания всех полученных материалов были проведены с помощью циклической вольтамперометрии и зарядно-разрядных циклирований на потенциостате PS-7 (фирма Элинс, Россия) с компьютерным программированием. Электрохимические данные в цифровой форме обрабатывали на компьютере. Цикловольтамперометрические испытания проводились в интервале –0.2…+0.7 В.
Электронно-микроскопические исследования осуществляли на растровом электронном автоэмиссионном микроскопе Supra 25 производства Zeiss с рентгеноспектральной энергодисперсионной приставкой INCA Energy производства Oxford Instruments для определения элементного состава образцов. Разрешение на получаемых изображениях составляет величину 1–2 нм.
ИК-спектры снимали на инфракрасном фурье-спектрометре Perkin Elmer Spectrum 100, оснащенном приставкой многократного нарушенного полного внутреннего отражения с германиевой призмой в диапазоне 4000–675 см–1. Сухие образцы помещали на призму приставки и прижимали с помощью механического прижимного устройства.
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исходным для исследований всегда был ПАни, полученный по стандартной методике в потенцио-динамическом режиме в интервале потенциалов –0.2…+0.7 В в 0.2 М растворе АС в 1 М H2SO4, т.е. ПАни-сульфо. Описанные в п. 2.2 операции со сменой электролитов, проведенные четырежды для каждого электрода, в водных электролитах серии Э1, Э2 и Э3 проходили под номерами 1, 3, 5, 7, соответственно те, что шли сразу после них каждый раз в Э0 – под номерами 2, 4, 6, 8.
При помещении электрода ПАни-сульфо в электролит Э1 после 30 циклов в этом электролите конечная ЦВА выглядела так, как показано на рис. 1а, ЦВА 1. Частично просматриваются пики Еа = 200 мВ и Ек = –31 мВ, которые свидетельствуют о процессах окисления–восстановления в ПАни и обратимых редокс-переходах.
Рис. 1.
(а) ЦВА ПАни-сульфо в электролите Э1 сразу после ЭС (ЦВА 1), далее поочередно после циклирований в электролите Э0 (ЦВА 3, 5, 7); (б) ЦВА ПАни в электролите Э0 поочередно после циклирований в Э1; 50 мВ/с; Ag/AgCl. (в, г) Зарядно-разрядные кривые в аналогичной последовательности, как и ЦВА, в Э1 (в) и в Э0 (г) при i = 0.1 мА. (д) Рассчитанные по зарядно-разрядным кривым СS для электролитов Э1 и Э0 в четырех сериях циклирований в каждом электролите.
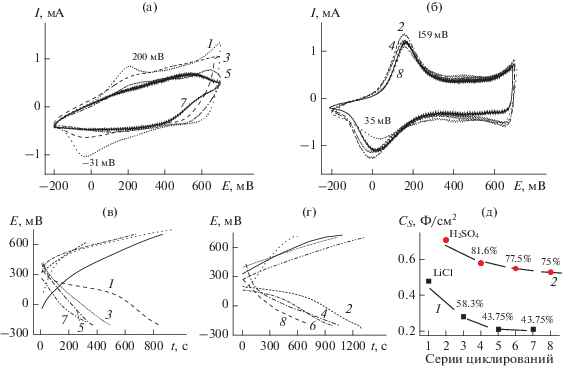
Следующее за описанным циклирование электрода в Э0 показывает ЦВА, характерную для ПАни, циклируемого в кислой среде с Еа = 159 мВ и Ек = –9 мВ (рис. 1б, ЦВА 2). Для данного электрода все последующие переносы ПАни из Э1 в Э0 показывали практически неизменную ЦВА с одинаковыми значениями анодного и катодного потенциалов ПАни (рис. 1б, ЦВА 2, 4, 6, 8). Поочередные циклирования ПАни в Э1 каждый раз значительно меняли вид ЦВА (рис. 1а, ЦВА 1, 3, 5, 7). Начиная с 3-й серии циклирований в Э1 уже не прослеживается окислительно-восстановительных превращений ПАни и соответствующих им пиков на ЦВА. После каждой серии циклирований поочередно в электролитах Э1 и Э0 были проведены зарядно-разрядные процессы в каждом электролите (рис. 1в в электролите Э1 и 1г в электролите Э0) и рассчитаны СS (рис. 1д).
Исходя из хода кривых изменения СS в каждом электролите, можно сделать вывод о том, что после первого резкого уменьшения емкости при переходе к повторным циклированиям в каждом электролите кривые практически не показывают принципиальных изменений, и четырех серий такого рода смены электролита достаточно для выяснения общей картины и практически наступления равновесия. При разряде ПАни в Э1 после 4‑й серии остается 44% первоначального значения удельной емкости, аналогичный разряд в Э0 показывает, что ПАни сохранил 75% своей первоначальной емкости. Также следует отметить, что резкий скачок уменьшения емкости следовал при первом повторном возвращении в данный электролит, и далее изменения были менее значительны.
На рис. 2 показаны аналогичные характеристики ПАни-сульфо, который циклировался в Э2 (водный раствор LiClO4). В 1-й серии циклирований, так же как и в случае с Э1, после 30 циклов в Э2 на конечной ЦВА (рис. 2а, ЦВА 1) наблюдаются окислительно-восстановительные переходы на анодной ветке ЦВА при 179 мВ и обратный переход на катодной ветке при –104 мВ. При этом величина ΔЕ cоставляет 283 мВ, что на 50 мВ больше ΔЕ, показанного в первой серии опытов в LiCl. Дальнейшие возвращения ПАни в Э2 после циклирований в Э0 приводят к тому, что окислительно-восстановительные переходы в ПАни становятся практически незаметными. ЦВА 3, 5 и 7 показывают, что в величине емкости данного электрода при циклировании в Э2, так же как и в случае Э1, основу составляет емкость двойного слоя. При возвращении ПАни в Э0 и последующем циклировании в этом электролите (рис. 2б, ЦВА 2, 4, 6, 8) наблюдается восстановление окислительно-восстановительных переходов в полимере с той лишь разницей, что в полностью восстановленном состоянии лейкоэмеральдина при Е = –200 мВ величина тока имеет отрицательное значение и по абсолютной величине увеличивается от 2-й к 8-й серии циклирований. В отличие от Cl- и ${\text{SO}}_{4}^{{ - 2}}$-анионов, как доказано спектральными исследованиями [25], анион ${\text{ClO}}_{4}^{ - }$ по отношению к ПАни ведет себя как донор электронов. Интеркаляция этого аниона в структуру ПАни может изменить соотношение бензоидных и хиноидных колец в цепи, морфологию и, соответственно, электрохимические свойства полимера [26, 27]. ПАни имеет электронную проводимость дырочного типа (р-полупроводник) [28]. Анион, являющийся донором электронов, может изменить не только морфологию полимера, но и увеличить количество бензоидных фрагментов в цепи ПАни. При циклировании этого полимера в Э0 окисление большего количества бензоидных фрагментов приведет к сдвигу анодного потенциала к более высоким значениям, что и наблюдается на рис. 2б.
Рис. 2.
(а) ЦВА ПАни-сульфо в электролите Э2 сразу после ЭС (ЦВА 1), далее поочередно после циклирований в электролите Э0 (ЦВА 3, 5, 7); (б) ЦВА ПАни в электролите Э0 поочередно после циклирований в Э2; 50 мВ/с; Ag/AgCl. (в), (г) Зарядно-разрядные кривые в аналогичной последовательности, как и ЦВА, в Э2 (в) и в Э0 (г) при i = 0.1 мА. (д) Рассчитанные по зарядно-разрядным кривым СS для электролитов Э2 и Э0 в четырех сериях циклирований в каждом электролите.

После каждой серии циклирований поочередно в электролитах Э2 и Э0 были проведены зарядно-разрядные процессы в каждом электролите (рис. 2в, 2г) и рассчитаны СS (рис. 2д). При разряде ПАни в Э2 после 4-й серии остается 44% первоначального значения удельной емкости, аналогичный разряд в Э0 показывает, что ПАни сохранил 66% своей первоначальной емкости. Также следует отметить, что резкий скачок уменьшения емкости, так же как и в случае Э1, следовал при первом повторном возвращении в данный электролит и далее изменения были менее значительны.
Рис. 3.
(а) ЦВА ПАни-сульфо в электролите Э3 сразу после ЭС (ЦВА 1), далее поочередно после циклирований в электролите Э0 (ЦВА 3, 5, 7), ЦВА LiТЦХМ (0.2 М в H2O) на СУ-электроде; (б) ЦВА ПАни в электролите Э0 поочередно после циклирований в Э3; 50 мВ/с; Ag/AgCl. (в), (г) Зарядно-разрядные кривые в аналогичной последовательности, как и ЦВА, в Э3 (в) и в Э0 (г) при i = 0.06 мА. (д) Рассчитанные по зарядно-разрядным кривым СS для электролитов Э3 и Э0 в четырех сериях циклирований в каждом электролите.
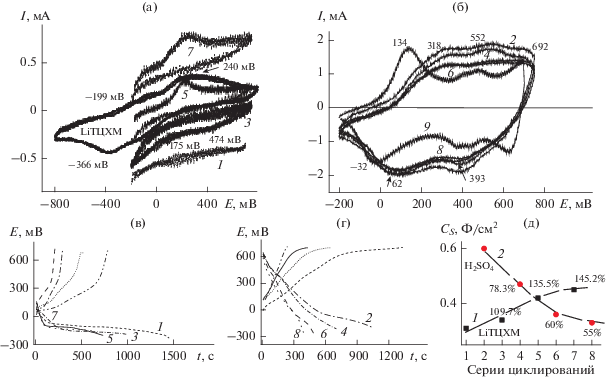
На рис. 3 показан ход электрохимических исследований в электролите Э3 (водный раствор LiTЦХМ). Первое циклирование ПАни-сульфо в электролите Э3 (рис. 3а, ЦВА 1) показывает очень слабую электрохимическую активность электрода. Следующее циклирование этого электрода в электролите Э0 (рис. 3б, ЦВА 2) восстанавливает электрохимическую активность полимера, что выражено в появлении анодных и катодных пиков ПАни, соответственно, 318, 552 и 692 мВ при анодной развертке и 393 и 62 мВ при катодной развертке. Дальнейшее попеременное циклирование этого электрода в Э3 и Э0 приведено на рис. 3а, ЦВА 3, 5, 7, и рис. 3б, ЦВА 4, 6, 8. Каждое последующее циклирование в электролите Э3 (рис. 3а, ЦВА 3, 5, 7) показывает увеличение анодного пика. Возможно, это связано с постепенным внедрением при продолжительном циклировании аниона TЦХМ в состав полимерной матрицы. При потенциале 240 мВ происходит окисление аниона TЦХМ до анион-радикала, и это хорошо видно на ЦВА LiTЦХМ, приведенной на этом же рисунке. При помещении такого электрода в Э0 анион TЦХМ, замещаясь на анион ${\text{SO}}_{4}^{{ - 2}},$ восстанавливает стандартные процессы окисления–восстановления ПАни. Вид ЦВА ПАни при циклировании в Э0 (после Э3) значительно отличается от ЦВА ПАни на рис. 1б и 2б. Основное отличие – в значительно большем количестве окислительно-восстановительных превращений в полимере. Значения Еа и Ек на ЦВА во всех последующих сериях циклирований в Э0 остаются практически постоянными, лишь незначительно уменьшается площадь каждой последующей ЦВА. Если такой электрод выдержать в течение двух суток в 1 М H2SO4, восстанавливается стандартная ЦВА ПАни с Еа = 134 мВ и Ек = –32 мВ (рис. 3б, ЦВА 9). Разрядно-зарядные кривые для этого электрода в электролите Э3 показаны на рис. 3в. Изломы, которые присутствуют на зарядных и разрядных частях кривых, находятся в интервале потенциалов от –100 до 300 мВ. В исследуемом нами интервале потенциалов изучения ПАни наблюдаются (рис. 3а, ЦВА LiTЦХМ) окислительно-восстановительные волны аниона TЦХМ, одна из которых (Еа = 240 мВ) практически совпадает с Еа на ЦВА ПАни, проциклированного в Э3. Выше уже говорилось об образовании комплексов при взаимодействии бедных электронами орбиталей хинонов (π-кислот или акцепторов) с богатыми электронами аминами (π-основаниями или донорами) [18]. Этот факт, вероятно, играет определенную роль при образовании комплекса между азотным центром ПАни и новым ЭАА – анионом тетрацианохинодиметана (TЦХМ) в образующемся комплексе. В этом комплексе ТЦХМ может находиться в состоянии дробного или неопределенного [24] заряда. В пользу этого говорят несколько окислительно-восстановительных волн на ЦВА LiТЦХМ на рис. 3а. Участие такого ЭАА в зарядно-разрядном процессе, вероятно, накладывает свой отпечаток на ход окислительно-восстановительных превращений в полимере. Часть анионов ТЦХМ может в результате донорно-акцепторного взаимодействия с аминными центрами, адсорбироваться на поверхности полимера, создавая отрицательный заряд (образование двойного слоя). Дальнейшая интеркаляция ТЦХМ из-за электростатического отталкивания затрудняется. С этого момента продолжающееся окисление полимерной матрицы ПАни приводит к резкому подъему напряжения, что и наблюдается в виде излома на кривой заряжения. При обратном процессе происходит падение напряжении при разряде такого электрода, связанное с десорбцией с поверхности анионов ТЦХМ. После этого наблюдается процесс очень медленного снижения напряжения во времени (рис. 3в). Причем, после каждой следующей серии циклирований в Э3 время такого разряда увеличивается. Соответственно, увеличивается и значение СS, которое пропорционально времени разряда электрода. Таким образом, в отличие от разряда электрода в электролитах Э1 и Э2, в электролите Э3 наблюдается увеличение СS с каждой последующей серией циклирования (рис. 3д, кривая 1). В стандартном электролите Э0 наблюдается обычный ход кривых разряжения, при этом, как и во всех предыдущих случаях в Э1 и Э2 происходит медленное, но стабильное уменьшение значения СS (рис. 3д, кривая 2) с каждой последующей серией. Возможно, увеличение количества TЦХМ в составе ПАни, которое мы наблюдаем в процессе длительного циклирования и о котором было сказано выше, позволяет при циклировании в Э3 сохранять высокую активность образующегося композитного материала. Важно отметить, что при разряде непокрытого ПАни СУ-электрода различными токами в Э3 происходит резкое падение напряжения, а наблюдаемый для допированного этим анионом ПАни процесс медленного и длительного падения напряжения является свойством композитного покрытия на электроде, т.е. ПАни, допированного ТЦХМ. В результате такого поведения этого материала к четвертой серии испытаний мы имеем практически в полтора раза увеличенное значение емкости, которое показывает этот электрод в Э3 (рис. 3а, ЦВА 7). В процессе электрохимического допирования, которым является вход–выход или замена анионов и, соответственно, протонов или катионов, важную роль играет возможность таких изменений, которая во многом определяется структурой полимерного материала и его морфологией. На рис. 4 приведены микрофотографии 4 образцов исследованных полимеров ПАни-сульфо (а), ПАни-Сl– (б), ПАни-${\text{ClO}}_{4}^{ - }$ (в) и ПАни-TЦХМ– (г). Микрофотографии сделаны для всех образцов сразу после четырех циклирований и прохождения зарядно-разрядных процессов в соответствующих электролитах: (а) после ЭС, (б) после четырех серий в Э1–Э0, (в) после четырех серий в Э2–Э0 и (г) после четырех серий в Э3–Э0. В одинаковых масштабах изображения видно, что первоначальный материал ПАни-сульфо в процессах окислительно-восстановительных превращений в вышеперечисленных электролитах претерпевает изменения в размерах микрочастиц. Первоначально полученный в ЭС ПАни-сульфо представляет однородную массу в виде стержней диаметром не выше 100 нм. При замене аниона ${\text{SO}}_{4}^{{2 - }}$ на анион Cl– наблюдается увеличение диаметра стержней до 120 нм, дальнейшее увеличение диаметра стержней до 150 нм с анионом ${\text{ClO}}_{4}^{ - },$ и далее для частиц полимера с введенным анионом TЦХМ– уже становятся заметны не только значительные увеличения размеров частиц, но и заметен процесс расслоения “одежды” стержня, хотя трубчатая структура стержня сохранена. В последнем случае диаметр частиц уже приближается к 200 нм. И хотя размеры частиц увеличиваются в процессе замены аниона ${\text{SO}}_{4}^{{2 - }}$ (родной анион) → Cl → ${\text{ClO}}_{4}^{ - }$ → TЦХМ–, из микрофотографий видно, что частицы расположены свободно, сохраняя форму стержней, и между ними достаточно места для нахождения электролита. Наконец, важно было понять, при замене аниона в водном электролите при рН, близком к нейтральному, смогут ли катионы электролита участвовать в окислительно-восстановительных превращениях полимера во время зарядно-разрядных испытаний.
Рис. 4.
СЭМ-фотографии в разных масштабах различных образцов ПАни, полученных после четырех серий циклирований и прохождения зарядно-разрядных процессов в соответствующих электролитах ПАни-сульфо (а), в LiCl (б), LiClO4 (в) и LiТЦХМ (г).

Для этого был сделан элементный анализ и рассчитан возможный состав полимеров, прошедших полный зарядно-разрядный цикл в электролитах Э2 и Э3 и после этого выдержанных при Е = +0.5 В. Результаты проведенных расчетов приведены в табл. 1.
Таблица 1.
Элементный состав и формула композитных материалов после серии зарядно-разрядных процессов в электролитах Э2 и Э3
| Элементный состав ПАни после зар.-разр. в Э2 | Рассчитанная формула | |
|---|---|---|
| C | 61.6 | C6.4H5N(ClO4)0.26Li0.125 (SО4) 0.04(H2O)0.1 |
| H | 3.92 | |
| N | 11.2 | |
| S | 1 | |
| Cl | 7.61 | |
| O | 13.93 | |
| Li | 0.64 | |
| Элементный состав ПАни после зар.-разр. в Э3 | Рассчитанная формула | |
| C | 74.7 | C6H5N(C12H4N4)0.11Li0.11 (SO4)0.04 (H2O)0.2 |
| H | 4.57 | |
| N | 14.28 | |
| O | 4.73 | |
| S | 0.97 | |
| Li | 0.74 | |
Из данных табл. 1 можно сделать вывод о том, что при вхождении анионов ${\text{ClO}}_{4}^{ - }$ и TЦХМ– в состав полимера вместе с ними входят и катионы Li, что очень важно для прохождения полноценных окислительно-восстановительных процессов в обсуждаемых электролитах. Cогласно элементному анализу, в состав полимера после циклирования в указанных электролитах входят микроколичества сульфат-аниона. Возможно, полная замена анионов при циклировании требует более медленных скоростей.
Рис. 5.
ИК-спектры электрода с ПАни-сульфо, ПАни-ClO4 (cпектры 1 и 2) и ПАни-LiТЦХМ после ЦВА 3 и ЦВА 7 в Э3 (спектры 3 и 4).

ИК-спектры полимерных образцов приведены на рис. 5. Во всех полученных полимерах присутствуют полосы, характерные для обычного проводящего ПАни. Например, в области колебаний бензольного (В) и хиноидного (Q) колец во всех спектрах имеются полосы 1496–1493 и 1580–1587 см–1, хотя соотношение интенсивностей этих пиков в образцах разное. В своем равновесном состоянии количество окисленных (хиноидных) и восстановленных (бензольных) фрагментов приблизительно равно. На спектрах рис. 5 наблюдается тенденция к увеличению соотношения Q/В от ПАни-сульфо (спектр 1) к ПАни-ТЦХМ (спектры 3 и 4). При длительном циклировании ПАни-LiTЦХМ в Э3 (LiТЦХМ) отношение Q/B (спектр 4) превышает 1 (так как возрастает количество ТЦХМ единиц, содержащих хиноидные кольца). В области C–N колебаний на всех четырех спектрах наблюдается одинаковая картина. Достаточно широкие полосы 1000–1100 см–1 на спектрах 1 (ПАни-сульфо) и 2 (ПАни-ClO4) относятся, согласно литературным данным, к нахождению в составе полимера сульфо- [29] и перхлоратных [30] групп. В ПАни-ТЦХМ в этих областях отсутствуют указанные пики поглощения. В области 730 см–1 у всех образцов имеются полосы С–Н колебаний монозамещенных ароматических колец, каким является молекула анилина во всех представленных на спектрах соединениях. Область С–Н колебаний 1,4-дизамещенного ароматического кольца обозначена только для комплексов, содержащих в своем составе молекулу ТЦХМ. Пик 860 см–1 (спектр 3 и 4) подтверждает появление в составе ПАни после ЦВА 3 и 4 фрагмента ТЦХМ [29].
Изложенные экспериментальные факты позволяют предположить, что в действительности при вхождении аниона ТЦХМ в полимерную матрицу и последующем циклировании с переменой его степени окисления ТЦХМ координационно связывается с ПАни, в результате чего происходит накопление этого аниона от 1-го к 4-му циклированию. Возможно, что реализуется схема присоединения, предложенная в [31], согласно которой TЦХМ образует ковалентную связь с ПАни: при этом авторы [31, 32] приписывают поглощение в ИК-спектрах при 2185–2210 см–1 именно ТЦХМ, ковалентно связанному с фенильным кольцом [31] или с высокой степенью переноса заряда [32], причем, согласно нашим данным (рис. 5), пик при 2185 см–1 значительно увеличивается к 4-му циклированию в LiТЦХМ, подтверждая накопление ТЦХМ в образце от первого к четвертому циклированию.
После серии циклирований ПАни в Э3 появляется слабый пик 1547 см–1, который исследователями [33] был отнесен к хиноидной форме кольца, возникающей при появлении дробных валентностей ТЦХМ. Такая нестандартная форма хиноидного кольца (основной пик которого находится при 1540 см–1) может образоваться с появлением химического взаимодействия между ТЦХМ и ПАни. Присоединение ТЦХМ к поли-анилиновому остову должно приводить к изменению расстояния между полимерными цепями и, соответственно, увеличению геометрических размеров частиц, что согласуется с данными СЭМ. Наконец, как видно из рис. 6, только на дифрактограммах образцов, содержащих ТЦХМ, наблюдается появление новых пиков (интенсивность которых также увеличивается от циклирования к циклированию в Э3) при углах, больших 20°. Это может указывать на образование новых микрокристаллических участков по мере увеличения содержания ТЦХМ. Детализация механизма реакции в условиях электрохимического синтеза потребует дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Многократная смена электролитов показала, что ПАни сохраняет электрохимическую активность во всех исследованных случаях. Электрохимическая активность для водных электролитов с анионами Cl– и ${\text{ClO}}_{4}^{ - }$ уменьшается с увеличением количества циклирований, но после первых циклов это снижение замедляется. При возвращении испытуемого электрода в “родной” электролит электрохимическая активность и электрохимическая емкость возрастают. В случае допирования ПАни анионом TЦХМ каждая последующая серия циклирований показывает увеличение электрохимической активности, что выражается в увеличении площади ЦВА и также увеличении от серии к серии электрохимической емкости. Можно предположить, что ЭАА TЦХМ прочно связывается с матрицей ПАни, сохраняя при этом собственную электрохимическую активность и увеличивая емкость электродного материала в целом. В литературе уже отмечалась возможность создания органических магнитов на основе химического [31] или координационного взаимодействия ПАни с ТЦХМ. Важным является обнаруженный факт сохранения электрохимической активности в нейтральных средах. В этом случае роль противоионов при допировании и редопировании выполняют катионы. При низких рH это преимущественно протоны, а в нейтральных средах Li+.
Список литературы
Абдуллин, Т.И., Никитина, Н.И., Евтюгин, Г.А., Будников, Г.К., Мананова, Л.З. Электрохимические свойства двухкомпонентной пленки DNA-полианилин на поверхности стеклоуглеродного электрода. Электрохимия. 2007. Т. 41. С. 1355. [Abdullin, T.I., Nikitina, I.I., Evtugin, G.A., Budnikov, G.K., and Manapova, L.Z., Electrochemical properties of a two-component DNA-polyaniline film at the surface of glassy carbon electrode, Russ. J. Electrochem., 2007, vol. 41, p. 1284.
Sun, L., Liu, H., Clark, R., and Yang, S.C., Double-Strand Polyaniline, Synth. Met., 1997, vol. 84, p. 67.
Liu, W., Anagnostopoulos, A., Bruno, F.F., Senecal, K., Kumar, J., Tripathy, S., and Samuelson, L., Biologically derived water soluble conducting polyaniline, Synth.Met., 1999, vol. 101, p. 738.
Kausaite, A. and Ramanaviciene, A., Polyaniline synthesis catalysed by glucose oxidase, Polymer, 2009, vol. 50, no. 8, p. 1846.
Yano, J., Electrochromism of Polyaniline Film Incorporating a Red Quinone 1-Amino 4-bromoanthraquinone 2-sulfonate, J. Electrochem. Soc., 1997, vol. 144, p. 477.
Ohtsuka, T., Wakabayashi, T., and Einaga, H., Optical characterization of polypyrrole-polytungstate anion composite films, Synth.Met., 1996, vol. 79, p. 235.
Sung, H. and Paik, W.K., Polypyrrole doped with heteropolytungstate anions, Electrochim. Acta., 1994, vol. 39, p. 645.
Reinolds, J.R., Pyo, M., and Qin, Y.J., Charge and Ion Transport in Poly(pyrrole copper phthalocyanine tetrasulfonate) during Redox Switching, Electrochem. Soc., 1994, vol. 141, p. 35.
Tolgyesi, M., Szues, A. Visy, C., and Novak, M., Redox anion doped polypyrolle films; electrochemical behaviour of polypyrrole prepared in Fe(CN)6, Electrochim. Acta, 1995, vol. 40, p. 1127.
Mazeikiene, R. and Malinauskas, A., Doping of polyaniline by some redox active organic anions, Europ. Polymer J., 2000, vol. 36, p. 1347.
Абаляева, В.В., Ефимов, О.Н. Синтез и электрохимическое поведение полианилина допированного электроактивными анионами. Электрохимия. 2011. Т. 47. С. 1388. [Abalyaeva, V.V. and Efimov, O.N., Synthesis and electrochemical behavior of polyaniline doped by electroactive anions, Russ. J. Electrochem., 2011, vol. 47, p. 1299.]
Абаляева, В.В., Ефимов, О.Н. Особенности электрохимического поведения полианилина допированного электроактивными анионами. Электрохимия. 2011. Т. 47. С. 1397. [Abalyaeva, V.V. and Efimov, O.N., Regularities of electrochemical behavior of polyaniline doped by electroactive anions, Russ. J. Electrochem., 2011, vol. 47, p. 1307].
Абаляева, В.В., Куликов, А.В., Ефимов, О.Н. Комплекс анилина с хлориридат-анионом как катализатор электрохимического синтеза полианилина. Высокомол. cоед. 1997. Т. 39. С. 216. [Abalyaeva, V.V., Kulikov, A.V., and Efimov, O.N., The aniline complex with the chloromidate anion as a catalyst for the electrochemical synthesis of polyaniline, High-molecular compounds, 1997, vol. 39, p. 216.]
Berman, S.S., Beamish, F.E., and Mcbry de W.A.E., The colorimetric determination of iridium by O-dianisidine, Analyt. Chim. Acta, 1956, vol. 15, p. 363.
Yang, H. and Bard, A.J., The application of fast scan cyclic voltammetry. Mechanistic study of the initial stage of electropolymerization of aniline in aqueous solutions, J. Electroanalyt. Chem., 1992, vol. 339, nos. 1–2, p. 423.
Shim, Y-B., Won, M-S., and Park, S-M., Spectroelectrochemical Studies of Polyaniline Growth Mechanisms, Electrochem. Soc., 1990, vol. 137, no. 2, p. 538.
Wang, Z.H., Li, C., Scherr, E.M., MacDiarmid, A.G., and Epstein, A.J., Three Dimensionality of “Metallic” States in Conducting Polymers: Polyaniline, Phys. Rev. Letters, 1991. vol. 66, no. 13, p. 1745.
Melby, L.R., Harder, R.J., Hertler, W.R., Manler, W., Benson, R.E., and Mochel, W.E., Substituted Quinodimethans. II. Anion-radical Derivatives and Complexes of 7,7,8,8-Tetracyanoquinodimethan, J. Am. Chem. Soc., 1962, vol. 84, p. 3374.
Dominis, A.J., Spinks, G.M., Kane-Maguire, L.A.P., and Wallace, G.G., A de-doping/re-doping study of organic soluble polyaniline, Synth. Met., 2002, vol. 129, no. 2, p. 165.
Abd-Elwahed, A. and Holze, R. Ion size and size memory effects with electropolymerized polyaniline, Synth. Met., 2002, vol. 131, p. 61.
Абд-Эльвахед, А., Хольце, Р. In situ Near-Infrared спектроэлектрохимическое исследование окислительно-восстановительных состояний полианилина в процессе роста и легирования. Электрохимия. 2003. Т. 39. С. 431. [Abd-Elwahed A. and Holze, R., In situ Near-Infrared Spectroelectrochemical Investigation of Redox States of Polyaniline during Growth and Doping, Russ. J. Electrochem., 2003, vol. 39, p. 391.]
Nekrasov, A.A., Ivanov, V.F., Gribkova, O.I., and Vannikov, A.V., Voltabsorptometric study of “structural memory” effects in polyaniline, Electrochim. Acta, 2005, vol. 50, p. 1605.
Абаляева, В.В., Дремова, Н.Н. Электрохимическое допирование полианилина анионом тетрацианохинодиметана. Электрохимия. 2016. Т. 52. С. 834. [Abalyaeva, V.V. and Dremova, N.N., Electrochemical doping of polyaniline with the tetracyanoquinodimethane anion, Russ. J. Electrochem., 2016, vol. 52, p. 746.]
Стародуб, В.А., Стародуб, Т.Н. Анион-радикальные соли и комплексы с переносом заряда на основе тетрацианохинодиметана и других сильных π-электронных акцепторов. Успехи химии. 2014. Т. 83. С. 391. [Starodub, V.A. and Starodub, T.N., Anion-radical salts and charge-transfer complexes based on tetracyanoquinodimethane and other strong π-electron acceptors, Adv. in Chem., 2014, vol. 83, р. 391.]
Hatchett, D.W., Josowicz, M., and Janata, J., Acid Doping of Polyaniline: Spectroscopic and Electrochemical Studies, J. Phys. Chem. B., 1999, vol. 103, p. 10992.
Zeng, X.-R. and Ko, T.-M., Structures and properties of chemically reduced polyanilines, Polymer, 1998, vol. 39, p. 1187.
Wey, Y., Hsueh, K.F., and Jang, G-W., A study of leucoemeraldine and effect of redox reactions on molecular weight of chemically prepared polyaniline, Macromolecules, 1994, vol. 27, p. 518.
Bhadra, S., Khastgir, D., Singha, N.K., and Lee, J.H., Progress in preparation, processing and applications of polyaniline, Prog. Polym. Sci., 2009, vol. 34, p. 783.
Abdiryim, T., Xiao-Gang, Z., and Jamal, R.J., Synthesis and characterization of poly(o-toluidine) doped with organic sulfonic acid by solid-state polymerization, Appl. Polym. Sci., 2005, vol. 96, p. 1630.
Lizarraga, L., Andrade, E.M., and Molina1, F.V., Anion exchange influence on the electrochemomechanical properties of polyaniline, Electrochim. Acta, 2007, vol. 53, p. 538.
Zaidi, N.A., Giblin, S.R., Terri, I., and Monkman, A.P., Room temperature magnetic order in an organic magnet derived from polyaniline, Polymer, 2004, vol. 45, p. 5683.
Martin, R. Bryce, M.R., Lay, A.K., Chesney, A., Batsanov, A.S., Gerson, A., and Merstetter, P., The X-ray crystal structures of 8,9-bis(methylsulfanyl)-acenaphtho[1,2-b][1,4]dithiine and its complexes with 7,7,8,8- tetracyano-p-quinodimethane (TCNQ), 2,5-dibromo-TCNQ and iodine, J. Chem. Soc., Perkin Trans., 1999, vol. 2, p. 755.
Bigoli, F., Deplano, P., Devillanova, F.A., Girlando, A., Lippolis, V., Mercuri, M.-L., Pellinghellia, M.-A., and Troguc, E.-F., New semiconductors obtained by reaction of 4-imidazolline-2-selone derivatives with TCNQ. Characterization and X-ray structure of (C9H12N4Se)2+$\left( {{\text{TCNQ}}} \right)_{3}^{{2 - }},$ J. Mater. Chem., 1998, vol. 8(5), p. 1145.
Дополнительные материалы отсутствуют.





