Электрохимия, 2019, T. 55, № 10, стр. 1199-1206
Нанобиосенсор на основе белка для электрохимического определения пероксида водорода
З. Тамлех a, Р. Рафипур a, *, С. Кашанян b, c
a Химический факультет, филиал Керманшах, Исламский университет Азад
Керманшах, Иран
b Химический факультет, Исследовательский центр сенсоров и биосенсоров (SBRC)
и Исследовательский центр нанонауки и нанотехнологии (NNRC), Университет Рази
Керманшах, Иран
c Исследовательский центр доставки нанолекарств, Университет медицинских наук Керманшах
Керманшах, Иран
* E-mail: r.rafipour@iauksh.ac.ir
Поступила в редакцию 10.10.2018
После доработки 08.02.2019
Принята к публикации 03.04.2019
Аннотация
Разработан биосенсор пероксида водорода. Электрохимическое обнаружение H2O2 осуществляли на основе иммобилизации наночастиц кобальта–ферритина (CoNP–Fer) на многостенных углеродных нанотрубках (MWCNT), захваченных в матрицы хитозана (CS). Для исследования свойств биосенсора использованы электрохимические методы, такие как дифференциальная импульсная вольтамперометрия (DPV) и циклическая вольтамперометрия (CV). Методами энергодисперсионной рентгеновской спектроскопии (EDXS) и автоэлектронной сканирующей микроскопии (FESEM) продемонстрирована успешная иммобилизация CoNP–Fer на поверхности модифицированного электрода GC. Разработанный биосенсор пероксида водорода проявлял диапазон линейности от 0.2 до 14 нМ (R2 = 0.99), предел обнаружения 1.29 нМ (S/N = 3) и чувствительность –0.1105 мкА/нМ. Кажущаяся константа скорости гетерогенного переноса электрона (Ks) и коэффициент переноса заряда (α) составляли 4.19 и 0.49 с−1 соответственно. Данный биосенсор способен обнаруживать пероксид водорода с высокой чувствительностью и селективностью и низким пределом обнаружения.
ВВЕДЕНИЕ
Среди реакционноспособных кислородных соединений (ROS) H2O2 представляет собой продукт реакции множества оксидаз. Физиологические уровни H2O2, которые присутствуют при разложении и образовании реакционноспособных свободных радикалов, могут наносить ущерб клеточным компонентам, например белкам и ДНК. H2O2 используют в процессе упаковки пищевых продуктов, таких как напитки, молоко, молочные продукты, соки и соусы, чтобы увеличить срок хранения. Он играет роль в стерилизации промышленного оборудования. В последние годы пероксид водорода используют в целлюлозно-бумажной промышленности. Таким образом, количественное определение пероксида водорода имеет большое значение [1–5]. Для обнаружения пероксида водорода существуют многочисленные методы, такие как спектроскопические и электрохимические [4, 6–8]. Электрохимические методы являются пригодными для определения H2O2 вследствие своего короткого времени отклика и низкого предела обнаружения. Особенно большое значение приобретают новые биосенсоры на основе прямого переноса электрона ферментов и окислительно-восстановительных белков, вследствие простоты реакций, чрезвычайной селективности и немногочисленных побочных реакций [9, 10]. Метод иммобилизации окислительно-восстановительных белков на поверхности электрода является проблематичным для получения биосенсоров на основе прямого переноса электрона окислительно-восстановительных белков. Показано, что белки, которые адсорбируются непосредственно на металлических электродах, необратимо денатурируются. Таким образом, образуется изолирующий слой, который препятствует переносу электронов [11]. Следовательно, необходима модификация электрода для иммобилизации окислительно-восстановительных белков. Ферритин является одним из подходящих кандидатов в качестве окислительно-восстановительных белков для биосенсоров с прямым переносом электронов [4, 11–14]. Ферритин представляет собой аккумулирующий железо белок, состоящий из 24 полипептидных блоков, которые образуют каркас белка, имеющий внешний диаметр 12 нм и внутреннюю полость диаметром 8 нм. В ферритинах млекопитающих существуют блоки двух типов, которые называют H и L. Окисление Fe2+ происходит на ферроксидазных центрах блоков H. В блоках L находится центр зародышеобразования, который составляют глутаматы и аспарагинаты. Ферритин имеет гидрофильные и гидрофобные каналы. Гидрофобные и гидрофильные каналы представляют собой протоки для электронов и ионов металлов [15–17]. Ферритин используют в качестве матрицы для биосинтеза наночастиц, таких как Ni, Pt, Mn, Pd, Co, что делает ферритин подходящим для биосенсорных приложений [18, 19]. В конструкции биосенсоров биосовместимость матрицы и неподвижность биомолекул представляют собой решающие факторы [20, 21]. Хитозан (CS) представляет собой полисахарид, который содержит многочисленные группы –NH2 и –OH. Благодаря этим функциональным группам, CS может образовывать связи с биомолекулами. Его характеризуют отсутствие токсичности, превосходная биосовместимость и высокая механическая прочность. Таким образом, в последние годы его широко использовали для модификации разнообразных электродов. CS представляет собой непроводящее соединение; поэтому в сочетании с CS используют улеродные нанотрубки вследствие их превосходных свойств электропроводности [22‒24]. В настоящей работе исследована электрохимическая активность биосенсора пероксида водорода. Этот биосенсор может обнаруживать пероксид водорода на наномолярных уровнях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приборы
Для автоэлектронной сканирующей микроскопии использовали сканирующий электронный микроскоп Mira3 TESCAN-XMU. Для энергодисперсионной рентгеновской спектроскопии использовали анодное двойное рентгеновское излучение. Электрохимические исследования осуществляли, используя прибор SAMA 500. Все экспериментальные растворы для обнаружения H2O2 выдерживали в защитной атмосфере азота в течение 10 мин, и азотную атмосферу над растворами сохраняли в течение измерений. Все эксперименты осуществляли при комнатной температуре. Три электрода, в том числе стеклоуглеродный электрод (GCE), насыщенный хлоридсеребряный электрод Ag/AgCl (3 M NaCl) и платиновую проволоку использовали в качестве рабочего, сравнительного и вспомогательного электродов, соответственно.
Материалы
Лошадиный селезеночный ферритин приобретен у компании Calbiochem. Все остальные химические реагенты приобретены у компании Merck (Германия). HsAFr приобретен у компании Calbiochem и использован без дополнительной очистки. 1-Этил-3-(3-диметиламинопропил)карбодиимид (EDC) приобретен у компании Sigma-Aldrich (Германия). Функционализированные группами COOH MWCNT (COOH-MWCNT) приобретены у компании US Research Nanomaterials (Хьюстон). N-Гидроксисукцинимид (NHS) приобретен у компании Fluka. Другие реагенты приобретены у компании Merck (Германия).
Получение биосенсора
Получение смеси карбоксилированных многостенных углеродных нанотрубок и хитозана. Согласно предшествующим исследованиям, биосинтез наночастиц кобальта осуществляли в каркасе апоферритина [12]. Модификацию стеклоуглеродного электрода планировали согласно предшествующим исследованиям [14]. Вкратце, 10 мг CS растворяли в 1 мл раствора 1.0 об. % уксусной кислоты, получая раствор 11.0 мас./об. % CS; затем раствор перемешивали при комнатной температуре в течение приблизительно трех часов. Смесь COOH–MWCNT в растворе CS получали, диспергируя 1 мг COOH–MWCNT в 100 мкл раствора CS. После этого реакционную смесь обрабатывали ультразвуком в течение пяти часов.
Получение биосенсора (иммобилизованные CoNP–Fer на модифицированном электроде) на основе смеси COOH–MWCNT/CS. Непокрытый электрод GC полировали суспензией оксида алюминия (0.05 мкм), промывали деионизованной водой и выдерживали до высыхания. Затем 7 мкл смеси COOH–MWCNT/CS наносили на чистый электрод GC. После этого электрод высушивали на воздухе. Затем 7 мкл PBS (pH 7.0) наносили на электрод, который выдерживали до высыхания. Этот процесс включает две стадии. На первой стадии аминогруппы CS депротонируются на поверхности электрода. На следующей стадии карбоксильные группы COOH–MWCNT активируются смесью NHS и EDC (по 0.5 мас./об. %). Для иммобилизации белка 7 мкл CoNP–Fer капали на модифицированный электрод, который затем высушивали на воздухе.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование биосенсора
На рис. 1 представлены циклические вольтамперограммы биосенсора и модифицированного электрода без CoNP–Fer. В случае модифицированного электрода никакой отклик тока не обнаруживается в диапазоне потенциалов от –1.1 до 0.85 В (а), однако четкие окислительно-восстановительные пики обнаружены в случае разработанного биосенсора (б). Перенос электрона происходит между CoNP–Fer и поверхностью электрода.
Рис. 1.
Циклические вольтамперограммы: a – модифицированный электрод; б – модифицированный электрод с иммобилизованным CoNP–Fer в 0.1 M PB при pH 7.5, скорость развертки потенциала: 100 мВ/с.

Согласно рис. 2а, CV реагируют на биосенсор при регистрации в фосфатном буферном растворе для нескольких скоростей развертки потенциала. Этот результат показывает, что при увеличении скорости развертки потенциала токи окислительно-восстановительных пиков увеличиваются. Согласно рис. 2б, ток анодного пика линейно зависит от квадратного корня скорости развертки потенциала в диапазоне от 20 до 200 мВ/с. Это поведение показывает, что процесс контролируется диффузией [25, 26]. Таким образом, Co(III) в комплексе CoNP–ферритин восстанавливается. Восстановленный Co(II) высвобождается в электролит, и Co(II) в растворе снова окисляется в процессе, контролируемом диффузией. Кроме того, механизм переноса электрона в CoNP–Fer, иммобилизованном на модифицированном электроде GC, очень похож на связывание кислорода ионами Fe2+ группы гема в гемоглобине [11, 27].
Рис. 2.
(а) Циклические вольтамперограммы CoNP–Fer, иммобилизованного на модифицированных электродах в 0.1 M PB при pH 7.5. Скорости развертки потенциала: 20–200 мВ/с; (б) соотношение между током пика и квадратным корнем скорости развертки потенциала. Площадь электрода: 1.5 см2.

На рис. 3 представлена морфология поверхности электрода в случае (а, б) модифицированного электрода и (в, г) биосенсора. Автоэлектронная сканирующая микроскопия демонстрирует присутствие цилиндрических углеродных нанотрубок на стеклоуглеродном электроде (рис. 3а, 3б). На рис. 3в, 3г представлено полученное методом FESEM изображение морфологии поверхности биосенсора, которая изменялась по сравнению с модифицированным стеклоуглеродным электродом, демонстрируя благоприятную иммобилизацию CoNP–Fer на поверхности модифицированного электрода GC.
Рис. 3.
(а, б) Изображения FESEM модифицированного электрода; (в, г) изображения FESEM CoNP–Fer, иммобилизованного на модифицированных электродах; (д) EDXS модифицированного электрода и (е) EDXS CoNP–Fer, иммобилизованного на модифицированных электродах.

Энергодисперсионная рентгеновская спектроскопия также доказала иммобилизацию CoNP–Fer на поверхности модифицированного электрода GC. В течение измерений FESEM осуществляли анализ EDXS, демонстрирующий существование O, C и N на поверхности электрода GC (рис. 3д). Как представлено на рис. 3е, интенсивность пика C возрастала по сравнению с исходным состоянием вследствие присутствия богатого углеродом белка. Наконец, кобальтовое ядро также подтверждает фиксацию белка CoNP–Fer на модифицированном электроде.
Электрохимическое окисление H2O2 на поверхности биосенсора. Исследования электрокаталитического окисления H2O2 посредством биосенсора осуществляли методом циклической вольтамперометрии. На рис. 4 представлены CV биосенсора и непокрытого стеклоуглеродного электрода в присутствии H2O2 (1 мМ) в 0.1 M фосфатном буферном растворе (pH 7.5). Вольтамперограммы для непокрытого GC (a) и содержащего иммобилизованный CoNP–Fer модифицированного электрода (б), зарегистрированы в диапазоне потенциалов от –1.35 до 0.9 В. Для непокрытого электрода GC анодный отклик H2O2 не может быть получен (а). Однако на модифицированном электроде с иммобилизованным CoNP–Fer ток окисления увеличивается (б), демонстрируя, что анодное окисление H2O2 катализируется на поверхности биосенсора. По-видимому, происходит реакция, аналогичная реакции между аскорбиновой кислотой и ферритином [13]. Процесс окисления H2O2 на поверхности биосенсора происходит следующим образом: H2O2 диффундирует из объема раствора на поверхность биосенсора, а затем происходят сложные реакции между центральным ионом металла и H2O2, и ионы Co(II) могут высвобождаться из ферритина под действием H2O2. Следовательно, эта процедура является приемлемой для получения биосенсоров без медиаторов [4, 28, 29].
Рис. 4.
Циклические вольтамперограммы: а – GC; б – CoNP–Fer, иммобилизованного на модифицированных электродах GC в 1 мМ пероксида водорода в 0.1 M фосфатном буферном растворе при 100 мВ/с.

Циклические вольтамперометрические отклики пероксида водорода (1 мМ) на биосенсоре регистрировали в PBS при нескольких скоростях развертки потенциала. Ток пика окисления равномерно увеличивался при увеличении скорости развертки потенциала от 0.02 до 0.2 В/с (рис. 5а). Ток пика окисления коррелирует с квадратным корнем в диапазоне от 20 до 200 мВ/с (рис. 5б). Это поведение демонстрирует контролируемый диффузией процесс [25, 26].
Рис. 5.
(а) Циклические вольтамперограммы CoNP–Fer, иммобилизованного на модифицированном электроде GC в 0.1 M фосфатном растворе, содержащем 1 мМ H2O2 при различных скоростях развертки потенциала: 20, 40, 60, 80, 100, 140, 160, 200 мВ/с; (б) соотношение между током пика и квадратным корнем скорости развертки потенциала. Площадь электрода: 1.5 см2.

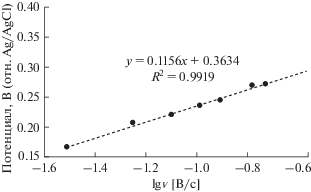
Уравнение Лавирона относится к влиянию скорости развертки потенциала на потенциал анодного пика ($E_{{\text{p}}}^{{\text{a}}}$ ) для биосенсора в 0.1 M BPS (pH 7.5), содержащем 1 мМ H2O2
(1)
$E_{{\text{p}}}^{{\text{a}}} = {{E}^{{0'}}} - \frac{{2.3RT}}{{\left( {1 - \alpha } \right)nF}}\lg \frac{{\left( {1 - \alpha } \right)Fnv}}{{RT{{K}_{{\text{s}}}}}}.$(2)
$\begin{gathered} \lg {{K}_{{\text{s}}}} = \alpha \lg \left( {1 - \alpha } \right) + \left( {1 - \alpha } \right)\lg \alpha - \\ - \,\,\lg \frac{{RT}}{{nFv}} - \frac{{\alpha \left( {1 - \alpha } \right)Fn\Delta {{E}_{{\text{p}}}}}}{{2.3RT}}. \\ \end{gathered} $Рис. 6.
Соотношение между потенциалом анодного пика $E_{{\text{p}}}^{{\text{a}}}$ и логарифмом скорости развертки потенциала (lg v), полученное из CV на рис. 5а.
Вычисление площади электроактивной поверхности. Для вычисления площади электроактивной поверхности непокрытого GC для модифицированного электрода GC и содержащего иммобилизованный CoNP–Fer модифицированного электрода GC регистрировали циклические вольтамперометрические отклики ферроцианида калия (окислительно-восстановительный зонд) на различных электродах. Для обратимого процесса используется следующее уравнение Рэндлса–Шевчика [34, 35]: D, A, c* представляют собой коэффициент диффузии (7.6 × 10–6 см2 с–1 для ферроцианида), площадь электрохимически активной поверхности и объемную концентрацию (5.0 мМ ферроцианида) соответственно. Согласно уравнению Рэндлса–Шевчика, Ip линейно зависит от v1/2, и по наклону было найдено значение A. В нашем эксперименте наклон составлял 53.639 мкА(В/с)0.5 для электрода GC, 314.97 мкА (В/с)0.5 для модифицированного электрода GC и 369.42 мкА (В/с)0.5 для CoNP–Fer, иммобилизованного на модифицированном электроде GC. Затем вычисляли площадь электрода, составляющую 1.099 мм2 для непокрытого электрода, 6.456 мм2 для модифицированного GC и 7.572 для CoNP–Fer, иммобилизованного на модифицированном электроде GC. Эффективная площадь модифицированного электрода составляет в 5.87 больше, чем в случае непокрытого электрода. Видно, что непокрытый электрод был эффективно модифицирован.
Диапазон линейности и предел обнаружения. CoNP–Fer, иммобилизованный на модифицированном электроде GC предназначен в качестве не содержащего медиаторы биосенсора для определения H2O2. На рис. 7 пик DPV биосенсора уменьшается при увеличении концентрации H2O2 в диапазоне от 0.2 до 14 нМ, и на вставке представлена калибровочная кривая. Предел обнаружения и чувствительность составляли 1.29 нМ (S/N = 3) и –0.1105 мкА/нМ соответственно. Ток DPVA уменьшался с концентрацией H2O2 вследствие образования Co2+ в электрохимических реакциях. Эти электроактивные частицы в присутствии H2O2 вне ферритиновой полости могут превращаться в осадок CoO(OH), который не является электроактивным [4]. Кроме того, при сравнении с другими сенсорами и биосенсорами H2O2 в табл. 1 разработанный биосенсор проявляет меньший предел обнаружения и более высокую чувствительность в отношении H2O2.
Рис. 7.
Дифференциальные импульсные вольтамперограммы CoNP–Fer, иммобилизованного на модифицированном электроде GC в 0.1 M фосфатном буферном растворе (pH 7.5), содержащем различные концентрации H2O2. Вставка: калибровочная кривая биосенсора в зависимости от концентрации H2O2.

Таблица 1.
Характеристики CoNP–Fer, иммобилизованного на модифицированном электроде GC для обнаружения H2O2 по сравнению с ранее описанными сенсорами
Исследования селективности биосенсора H2O2. Селективность разработанного биосенсора H2O2 исследовали с применением восьми примесных материалов, которые присутствуют в пищевых продуктах и биологических образцах (табл. 2) [39, 40]. Что касается влияния примесей по сравнению с пероксидом водорода, отклик тока биосенсора не изменялся при десятикратной концентрации. Таким образом, разработанный биосенсор проявляет замечательную селективность в определении пероксида водорода.
Таблица 2.
Влияние примесей в определении H2O2 на поверхности биосенсора. Соотношение тока получено при сравнении отклика тока при содержании 10–4 M H2O2 + 10 × 10–4 M примесей и в 10–4 M H2O2
| Примеси | Соотношение тока |
|---|---|
| Глюкоза | 0.97 |
| Лимонная кислота | 1.00 |
| Уксусная кислота | 0.99 |
| Дофамин | 0.98 |
| ${\text{SO}}_{4}^{{2 - }}$ | 0.98 |
| ${\text{CO}}_{3}^{{2 - }}$ | 0.96 |
| ${\text{NO}}_{3}^{ - }$ | 0.98 |
| Cl– | 1.02 |
ВЫВОДЫ
В настоящем исследовании CoNP–Fer иммобилизовали на матрицах MWCNT/CS посредством ковалентного связывания. Аминогруппы CS обеспечивали связывание через карбоксильные группы CNT, которые затем обеспечивали иммобилизацию белка, повышая устойчивость и чувствительность биосенсора. Показано, что иммобилизованный CoNP–Fer все же сохраняет свою биологический активность. В оптимальных условиях разработанный биосенсор проявлял предел обнаружения 1.29 нМ, высокую чувствительность –0.1105 мкА/нМ и высокую селективность. Таким образом, по сравнению с другими сенсорами и биосенсорами данный биосенсор обеспечивал обнаружение пероксида водорода.
Список литературы
Kelley, E.E., Khoo, N.K., Hundley, N.J., Malik, U.Z., Freeman, B.A., and Tarpey, M.M., Hydrogen peroxide is the major oxidant product of xanthine oxidase, Free Radic Biol Med, 2010, vol. 48, no. 4, p. 493.
Lacy, F., Gough, D.A., and Schmid-Schönbein, G.W., Role of xanthine oxidase in hydrogen peroxide production, Free Radical Biology and Medicine., 1998, vol. 25, no. 6, p. 720.
BienertJan, G.P., Schjoerring, J.K., and Jahn, T.P., Membrane transport of hydrogen peroxide,Biochim. Biophys. Acta, 2006, vol. 1758, p. 994.
Rafipour, R., Kashanian, S., and Tarighat, F.A., Sensitive electrochemical biosensing of H2O2 based on cobalt nanoparticles synthesised in iron storage protein molecules,IET nanobiotechnol, 2014, vol. 8, no. 4, p. 196.
Birben, E., Sahiner, U.M., Sackesen, C., Erzurum, S., and Kalayci, O., Oxidative stress and antioxidant defense, World Allergy Organ J., 2012, vol. 5, p. 9.
Nasir, M., Rauf, S., Muhammad, N., Nawaz, M. H., Chaudhry, A.A., Malik, M.H., Shahid, S.A., and Hayat, A., Biomimetic nitrogen doped titania nanoparticles as a colorimetric platform for hydrogen peroxide detection, J. Colloid Interface Sci., 2017, vol. 505, p. 1147.
Farrokhnia, M., Karimi, S., Momeni, S., and Khalililaghab, S., Colorimetric sensor assay for detection of hydrogen peroxide using green synthesis of silver chloride nanoparticles: Experimental and theoretical evidence,Sensor. Actuat. B-Chem, 2017, vol. 246, p. 979.
Sherino, B., Mohamad, S., Halim, S.N.A., and Manan, N.S.A., Electrochemical detection of hydrogen peroxide on a new microporous Ni–metal organic framework material-carbon paste electrode, Sensor. Actuat. B-Chem, 2018, vol. 254, p. 1148.
Wu, Y. and Hu, S., Biosensors based on direct electron transfer in redox proteins, Microchim. Acta., 2007, vol. 159, nos. 1–2, p. 1.
Zhang, W. and Li, G., Third-generation biosensors based on the direct electron transfer of proteins, Anal. Sci., 2004, vol. 20, no. 4, p. 603.
Kashanian, S., Rafipour, R., Tarighat, F., and Ravan, H., Immobilisation of cobaltferritin onto gold electrode based on self-assembled monolayers, IET Nanobiotechnol., 2012, vol. 6, no. 3, p. 102.
Kashanian, S., Tarighat, F.A., Rafipour, R., and Abbasi-Tarighat, M., Biomimetic synthesis and characterization of cobalt nanoparticles using apoferritin, and investigation of direct electron transfer of Co (NPs)–ferritin at modified glassy carbon electrode to design a novel nanobiosensor,Mol. Biol. Rep., 2012, vol. 39, no. 9, p. 8793.
Rafipour, R., Kashanian, S., Hashemi, S., Shahabadi, N., and Omidfar, K., An electrochemical biosensor based on cobalt nanoparticles synthesized in iron storage protein molecules to determine ascorbic acid, Biotechnol. Appl. Biochem., 2016, vol. 63, no. 5, p. 740.
Rafipour, R., Kashanian, S., Hashemi, S., Omidfar, K., and Ezzati Nazhad Dolatabadi, J., Apoferritin-templated biosynthesis of manganese nanoparticles and investigation of direct electron transfer of MnNPs–HsAFr at modified glassy carbon electrode, Biotechnol. Appl. Biochem., 2017, vol. 64, no. 1, p. 110.
Munro, H.N. and Linder, M.C., Ferritin: structure, biosynthesis, and role in iron metabolism, Physiol. Rev., 1978, vol. 58, no. 2, p. 317.
Theil, E.C., Behera, R.K., and Tosha, T., Ferritins for chemistry and for life, Coord. Chem. Rev., 2013, vol. 257, no. 2, p. 579.
Andrews, S.C., Harrison, P.M., Yewdall, S.J., Arosio, P., Levi, S., Bottke, W., von Darl, M., Briat, J.-F., Laulhère, J.-P., and Lobreaux, S., Structure, function, and evolution of ferritins, J. Inorg. Biochem., 1992, vol. 47, no. 1, p. 161.
Uchida, M., Kang, S., Reichhardt, C., Harlen, K., and Douglas, T., The ferritin superfamily: Supramolecular templates for materials synthesis, Biochim. Biophys. Acta, 2010, vol. 1800, no. 8, p. 834.
Yoshimura, H., Protein-assisted nanoparticle synthesis, Colloids. Surf. A, 2006, vol. 282, p. 464.
Zhu, C., Yang, G., Li, H., Du, D., and Lin, Y., Electrochemical sensors and biosensors based on nanomaterials and nanostructures, Anal. Chem., 2014, vol. 87, no. 1, p. 230.
Xu, Z., Chen, X., and Dong, S., Electrochemical biosensors based on advanced bioimmobilization matrices, Trends. Anal. Chem., 2006, vol. 25, no. 9, p. 899.
Domard, A. and Domard, M., Chitosan: structure-properties relationship and biomedical applications, Polyme. Biomater, 2001, vol. 2, p. 187.
Ali, A. and Ahmed, S., A review on chitosan and its nanocomposites in drug delivery, Int. J. Biol. Macromol, 2017.
Wu, Z., Chen, Z., Du, X., Logan, J.M., Sippel, J., Nikolou, M., Kamaras, K., Reynolds, J.R., Tanner, D.B., and Hebard, A.F., Transparent, conductive carbon nanotube films, Science., 2004, vol. 305, no. 5688, p. 1273.
Goyal, R.N., Gupta, V.K., and Bachheti, N., Fullerene-C60-modified electrode as a sensitive voltammetric sensor for detection of nandrolone—an anabolic steroid used in doping, Anal. Chim. Acta., 2007, vol. 597, no. 1, p. 82.
Wang, S.-F., Xie, F., and Hu, R.-F., Carbon-coated nickel magnetic nanoparticles modified electrodes as a sensor for determination of acetaminophen, Sensor. Actuat. B-Chem., 2007, vol. 123, no. 1, p. 495.
Park, C.W., Park, H.J., Kim, J.H., Won, K., and Yoon, H.H., Immobilization and charcteriazation of ferritin on gold electrode,Ultramicroscopy, 2009, vol. 109, no. 8, p. 1001.
Salimi, A., Sharifi, E., Noorbakhsh, A. and Soltanian, S., Electrochem Commun, 2006, vol. 8, no. 9, p. 1499.
Karim-Nezhad, G., Pashazadeh, S., and Pashazadeh, A., Ni/Al LDH nanoparticles modified carbon paste electrode: application to electro-catalytic oxidation of methanol, Anal. Bioanal. Electrochem, 2012, vol. 4, p. 399.
Li, X., Niu, X., Zhao, W., Chen, W., Yin, C., Men, Y., Li, G., and Sun, W., Black phosphorene and PEDOT: PSS-modified electrode for electrochemistry of hemoglobin, Electrochem. Commun, 2018, vol. 86, p. 68.
Fotouhi, L., Fatollahzadeh, M., and Heravi, M.M., Electrochemical behavior and voltammetric determination of sulfaguanidine at a glassy carbon electrode modified with a multi-walled carbon nanotube, Int. J. Electrochem. Sci, 2012, vol. 7, p. 3919.
Hong, J., Zhao, Y.-X., Xiao, B.-L., Moosavi-Movahedi, A.A., Ghourchian, H., and Sheibani, N., Direct electrochemistry of hemoglobin immobilized on a functionalized multi-walled carbon nanotubes and gold nanoparticles nanocomplex-modified glassy carbon electrode, Sensors., 2013, vol. 13, no. 7, p. 8595.
Yin, Y., Lü, Y., Wu, P., and Cai, C., Direct electrochemistry of redox proteins and enzymes promoted by carbon nanotubes., Sensors., 2005, vol. 5, no. 4, p. 220.
Bard, A.J., Faulkner, L.R., Leddy, J., and Zoski, C.G., Electrochemical methods: fundamentals and applications, wiley New York, 1980.
Ngamchuea, K., Eloul, S., Tschulik, K., and Compton, R.G., Planar diffusion to macro disc electrodes–what electrode size is required for the Cottrell and Randles-Sevcik equations to apply quantitatively? J. Solid. State. Electrochem., 2014, vol. 18, no. 12, p. 3251.
Antink, W.H., Choi, Y., Seong, K.-d., and Piao, Y., Simple synthesis of CuO/Ag nanocomposite electrode using precursor ink for non-enzymatic electrochemical hydrogen peroxide sensing, Sensor. Actuat. B-Chem, 2018, vol. 255, p. 1995.
Wu, Y., Wang, F., Lu, K., Lv, M., and Zhao, Y., Self-assembled dipeptide-graphene nanostructures onto an electrode surface for highly sensitive amperometric hydrogen peroxide biosensors, Sensor. Actut. B-Chem, 2017, vol. 244, p. 1022.
Suarez, G., Santschi, C., Martin, O.J., and Slaveykova, V.I., Biosensor based on chemically-designed anchorable cytochrome c for the detection of H2O2 released by aquaticells., Biosensors and Bioelectronics, 2013, vol. 42, p. 385.
Zhang, P., Guo, D., and Li, Q., Maganese oxide ultrathin nanosheets sensors for non-enzymatic detection of H2O2, Materials letters, 2014, vol. 125, p. 202.
Karimi, A., Husain, S., Hosseini, M., Azar, P.A., and Ganjali, M., Rapid and sensitive detection of hydrogen peroxide in milk by Enzyme-free eelctrochemiluminesence sensor based on a polypyrrole-cerium oxide nanocomposite., Sensors and Actuators B: Chemical, 2018, vol. 271, p. 90.
Дополнительные материалы отсутствуют.


