Электрохимия, 2019, T. 55, № 10, стр. 1177-1187
Коррозионные характеристики латуни T2 в охлаждающей воде статора генератора электростанции
Бин Фен a, b, Фанглин Чжа a, c, *, Ли Ли d, Чжикьянг Вей b, Кай Лю a, c
a Главная лаборатория высокоэффективной и чистой технологии тепловой энергии провинции Хунань
410007 Чанша, КНР
b Исследовательский институт государственной сетевой электроэнергетической корпорации
410007 Чанша, КНР
c Исследовательский испытательный институт Сяндянь провинции Хунань
410004 Чанша, КНР
d Больница матери и ребенка провинции Хунань
410005 Чанша, КНР
* E-mail: 840021533@qq.com
Поступила в редакцию 21.09.2018
После доработки 07.12.2018
Принята к публикации 30.03.2019
Аннотация
В данной работе исследован процесс роста пассивирующей пленки на латуни T2 в охлаждающей воде генератора, проанализировано влияние утечки CO2 на кристаллическую структуру и противокоррозионные свойства пассивирующей пленки, а также предпринята попытка восстановления пассивирующей пленки посредством регулирования pH раствора. Авторы применяли следующие методы: спектроскопия электрохимического импеданса (СЭИ), потенциодинамическая поляризация (ПП), потенциостатическое сканирование (ПС), сканирующая электронная микроскопия (СЭМ) и рентгеновская фотоэлектронная спектроскопия (РФС). Результаты исследований показали, что тонкая и плотная пассивирующая пленка Cu2O образовывалась на поверхности латуни T2 после выдерживания в охлаждающей воде в течение двух суток. Затем постепенно образовывался рыхлый наружный слой CuO; в течение этого периода Cu2O постепенно окислялся в CuO, и, таким образом разрушалась плотная структура внутреннего слоя Cu2O. Наконец, двухслойная пассивирующая пленка, состоящая из Cu2O и CuO, образовывалась на 24-е сут выдерживания. Коррозионные язвы и трещины появлялись на наружной пассивирующей пленке после эрозии под действием CO2. Противокоррозионные свойства пассивирующей пленки не могу быть полностью восстановлены сами по себе в щелочном растворе.
ВВЕДЕНИЕ
Охлаждение циркулирующей водой представляет собой эффективный способ предотвращения перегрева статора генератора [1–4]. Охлаждающая вода протекает через полый медный провод статора и отводит тепло, которое производит статор [4, 5]. Латунь T2 представляет собой оптимальный материал для полых проводов статора генератора благодаря своей превосходной электропроводности и теплопроводности. Оксидный слой, образующийся на меди, уменьшает проточную площадь полых проводов, и накапливающийся оксидный слой даже закупоривает полые провода, что может вызывать перегрев статора и влиять на безопасность генератора. Согласно неполной статистике, причиной 53.7% случаев выхода из строя генератора было закупоривание полых проводов статора. В своем исследовании Robert Svoboda показывает, что растворимость оксидов меди зависит, главным образом, от pH, а также, в меньшей степени, от температуры [6]. Чтобы ингибировать коррозию меди [7–12], на электростанциях установлены высокие стандарты качества охлаждающей воды. Однако строгий контроль качества охлаждающей воды не может полностью предотвратить возникновение соответствующих аварий. Согласно литературе, некоторые статоры генераторов перегреваются только после 2-летней эксплуатации. При этом большинство генераторов работают без сбоев в течение приблизительно 10 лет после ввода в эксплуатацию [13–19].
В ряду отчетов об авариях авторы обнаружили два случая [1]: утечка CO2 в систему охлаждающей воды статора генератора электростанции мощностью 330 МВт была устранена в течение двух суток, и при этом значение pH охлаждающей воды было возвращено на слабощелочной уровень. Однако через неделю полые провода были закупорены оксидом меди, что в конечном счете привело к отключению генератора. В течение планового ремонта другой электростанции мощностью 600 МВт система охлаждающей воды статора генератора была неудовлетворительно герметизирована, и воздух проник в полые провода. Катушка статора перегревалась вскоре после пуска установки [1, 3]. В описанных выше случаях авторы обнаружили, что быстрое закупоривание проводов статора было связано с утечкой CO2. Несомненно, что утечка CO2 ускоряет коррозию меди [20–24], в своем исследовании Ruiyuan Zhang показывает, что в растворе с низким значением pH ион ${\text{HCO}}_{3}^{ - }$ ведет себя как агрессивный ион, который способствует язвенной коррозии [14]. Но почему полые провода статора, которые подвергаются эрозии под действием CO2, все же оказываются блокированными оксидом меди в течение короткого времени, даже если своевременно было отрегулировано значение pH охлаждающей воды?
В настоящей работе процесс коррозии латуни T2 под действием охлаждающей воды статора генератора исследовали электрохимическим методом в сочетании с СЭМ и РФС. Были исследованы процесс роста оксидной пленки на поверхности латуни T2, структура и свойства оксидной пленки после эрозии под действием CO2, а также предпринята попытка восстановления характеристик оксидной пленки посредством повторной пассивации. Результаты перечисленных выше исследований помогут более наглядно и подробно понять коррозионные характеристики латуни T2 в охлаждающей воде статора и, таким образом, обеспечить способ предотвращения коррозии полых проводов статора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Раствор
В настоящей работе использовали два различных раствора. Модельный раствор, имеющий pH 8.5 ± 0.1, получали добавлением раствора NaOH в деионизованную воду, насыщали растворенным кислородом (6–7 мг/л), и его проводимость составляла ≤2 мкСм/см. Модельный раствор моделировал рабочее состояние охлаждающей воды статора генератора. Коррозионный раствор получали путем барботирования CO2 в модельный раствор и снижая значение pH до 5–6.0, что моделировало состояние охлаждающей воды в случае утечки CO2.
Электрод и образец
В настоящем исследовании использовали образцы латуни T2, имеющие размеры 10 × 10 × 2 мм и состав: Bi, 0.001%; Sb, 0.002%; As, 0.002%; Fe, 0.005%; Pb, 0.005% и Cu. Каждую поверхность образцов обрабатывали абразивной бумагой на основе карбида кремния с зернистостью от #200 до #3000 и подвергали заключительной полировке коллоидным диоксидом кремния. Для проведения электрохимических исследований получали следующие электроды: медный провод присоединяли к поверхности 10 × 10 мм образца и использовали в качестве рабочего электрода. Образец пропитывали эпоксидной смолой на другой открытой поверхности 10 × 10 мм. Перед исследованием путем выдерживания электроды и образцы обезжиривали этанолом, промывали деионизованой водой и сушили в потоке горячего воздуха. Образцы использовали для исследований методами СЭМ и РФС, электроды использовали для электрохимических исследованиях.
Эксперименты по выдерживанию
Эксперименты по выдерживанию осуществляли в течение трех последовательных периодов. Пассивация: медные электроды и образцы выдерживали в модельном растворе в течение 24 сут и заменяли модельный раствор каждые 24 ч. Эрозия под действием CO2: пассивированные электроды и образцы выдерживали в коррозионном растворе в течение 24 ч. Самовосстановление: электроды и образцы повторно выдерживали в модельном растворе в течение 7 сут. Все эксперименты по выдерживанию осуществляли при 50°C (323 K), температуру контролировали посредством водяной бани.
Методики экспериментов
Все электрохимические эксперименты осуществляли при 50°C в модельном растворе (периоды пассивации и самовосстановления) или в коррозионном растворе (период эрозии под действием CO2), используя потенциостат (Gamry Instruments, Reference 600). Использовали стандартную трехэлектродную ячейку, в которой рабочий электрод представлял собой электрод из латуни T2, противоэлектрод представлял собой Pt-электрод, электрод сравнения представлял собой электрод Hg–HgO (0.140 В отн. с. в. э.). Все потенциалы, приведенные в данной работе, представлены по отношению к электроду Hg–HgO, если отсутствуют иные условия.
Исследования СЭИ проводили при потенциале разомкнутой цепи в диапазоне частот от 100 кГц до 10 МГц при амплитуде напряжения переменного тока 5 мВ. Измерения потенциодинамической поляризации осуществляли при развертке потенциала от 0 до 0.8 В со скоростью 0.5 мВ/с. Потенциостатическое сканирование осуществляли при –220 и –550 мВ в течение 400 с.
Анализ поверхности
Поверхность образцов наблюдали с помощью цифровой камеры (Nikon P600) и сканирующего электронного микроскопа (СЭМ, JSM-6700F) и анализировали методом рентгеновской фотоэлектроной спектроскопии (РФС, Thermo Fisher Scientific, K-Alpha 1063), используя источник монохроматического рентгеновского излучения AlKα (12 000 эВ) с диаметром электронного пучка 400 мкм.
РЕЗУЛЬТАТЫ
Период пассивации
На рис. 1 представлено состояние поверхности образцов латуни T2 после выдерживания в модельном растворе в течение различных периодов пассивации. Как видно на рис. 1, в 1-е сут пассивирующая пленка, образующаяся на поверхности образца, не была сплошной, и можно было еще наблюдать исходный (желтый) цвет латуни T2. На 2-е сут сплошная темно-лиловая пленка образовывалась на поверхности латуни T2; на 5‑е сут серый слой окисления образовывался на поверхности темно-лиловой пленки. В продолжающемся процессе пассивации цвет пассивирующей пленки постепенно становился все темнее и, наконец, превращался в черный. Изменение цвета может представлять собой результат изменения химического состава пассивирующей пленки.
Рис. 1.
Морфология поверхности образцов латуни T2 после различных периодов пассивации в модельном растворе: 1 (1), 2 (2), 5 (3), 7 (4), 9 (5), 12 (6), 15 (7), 17 (8), 21 (9), 24 (10).

Для определения химического состава пассивирующей пленки, использовали метод РФС. На рис. 2 представлены спектры РФС Cu2p3/2 пассивирующей пленки, где присутствуют два пика при 932.38 и 934.78 эВ [25, 26]. Эти два пика представляют собой пик Cu(I)/Cu(0) и пик Cu(II), соответственно, согласно справочнику спектров РФС. Результаты РФС показали, что состав пассивирующей пленки представлял собой Cu2O после пассивации в течение 2 сут (линия (a)) и CuO + Cu2O после пассивации в течение 24 сут.
Рис. 2.
Спектры РФС пассивирующей пленки Cu2p3/2 в каждый период выдерживания: a – пассивация в течение 2 сут; б – пассивация в течение 24 сут.

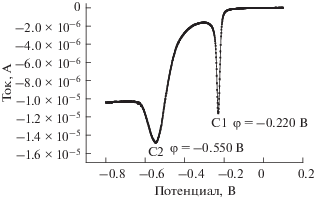
Поскольку измерение РФС представляет собой метод качественного типа, потенциодинамическую поляризацию и потенциостатическое сканирование использовали как количественные методы анализа химического состава пассивирующей пленки. Кривая потенциодинамической поляризации латуни T2 после пассивации в течение 2 сут выбрана в качестве примера и представлена на рис. 3. Кривая содержит два пика восстановления при –220 и –550 мВ соответственно. Электродные реакции для каждого пика представлены ниже [25]:
(1)
${\text{Пик}}\;{\text{C1:}}\,\,{\text{C}}{{{\text{u}}}^{{2 + }}} + {\text{e}} \to {\text{C}}{{{\text{u}}}^{ + }},\,\,\,\,\varphi = - 220\,\,{\text{мВ}}{\text{.}}$(2)
${\text{Пик}}\,\,{\text{C2:}}\,\,{\text{C}}{{{\text{u}}}^{ + }} + {\text{e}} \to {\text{Cu}},\,\,\,\,\,\varphi = - 550\,\,{\text{мВ}}.$Рис. 3.
Кривая потенциодинамической поляризации образца латуни T2 после пассивации в течение 2 сут при скорости развертки потенциала 0.5 мВ/с в модельном растворе.
Кривые потенциостатического сканирования латуни T2 после пассивации в течение 2 сут представлены на рис. 4. Путем интегрирования кривых зависимости тока от времени получены заряды восстановления для двух электродных реакций: Q1 представляет собой заряд Cu2+, восстановленных до Cu+, и Q2 представляет собой заряд Cu+, восстановленных до Cu. Количество CuO и Cu2O в пассивирующей пленке количественно оценивают величины Q1 и Q2–Q1 соответственно. На рис. 5 представлен результат интегрирования кривых потенциостатического сканирования в каждый период выдерживания. В начальный период пассивации пассивирующая пленка представляет собой, главным образом, Cu2O и постепенно превращается в пленку CuO в процессе пассивации. Можно видеть, что суммарное количество CuO и Cu2O не изменяется в течение 17–24 сут, и это показывает, что толщина пассивирующей пленки больше не увеличивается после 17 сут, в то время как окисление Cu2O до CuO продолжается до 24 сут.
Рис. 4.
Кривая потенциостатического сканирования образца латуни T2 после пассивации при –220 мВ в течение 2 сут и –550 мВ в течение 400 с соответственно.

Рис. 5.
Результат интегрирования кривых потенциостатического сканирования в течение каждого периода выдерживания.

На рис. 6 представлены полученные методом СЭМ изображения образцов латуни T2 в течение периода пассивации. Как можно видеть на рис. 6a, латунь T2 была частично покрыта пассивирующей пленкой после пассивации в течение суток, причем пассивирующая пленка была тонкой, и оставались заметными следы полированного металла. На 2-е сут пассивации (рис. 6б) слой сплошной пассивирующей пленки покрывал поверхность, причем на поверхности пленки были заметны отдельные прикрепленные зернистые продукты. В процессе пассивации пассивирующая пленка становилась толще и разделялась на внутренний слой и наружный слой (рис. 6в), причем кристаллы внутреннего слоя имели неудовлетворительную однородность. Наконец, образовался плотный слой пассивирующей пленки, как представлено на рис. 6г.
Рис. 6.
Полученные методом СЭМ изображения латуни T2 в течение периода пассивации: 1 сут (а), 2 сут (б), 12 сут (в), 24 сут (г).

В целях оценки коррозионной стойкости пассивирующей пленки проведено исследование методом СЭИ, и на рис. 7 представлена часть диаграмм Найквиста в течение периода пассивации. Из результатов СЭМ известно, что пассивирующая пленка состояла из двух слоев, включая внутренний слой Cu2O и наружный слой CuO. На рис. 8 представлены эквивалентные электрические схемы (ЭЭС), используемые в настоящей работе, причем перед вторыми сутками пассивации пассивирующая пленка представляла собой единственный слой Cu2O, и ЭЭС соответствовала схеме, представленной на рис. 8a. После вторых суток образовывался наружный слой (слой CuO), и ЭЭС соответствовала схеме, представленной на рис. 8б. В ЭЭС постояннофазовый элемент (ПФЭ) использовали вместо чистой емкости вследствие поверхностной шероховатости и адсорбции примесей. Можно видеть, что линии аппроксимации хорошо соответствуют экспериментальному графику на рис. 7. Среди всех параметров электрических элементов сопротивление пассивирующей пленки: Rf = Rf1 + Rf2 выбрано в качестве показателя оценки способности пассивирующей пленки защищать металл от реагентов, причем высокое значение Rf показывает плотную защитную пленку. Необходимо проиллюстрировать, что Rf не находится в неизбежной связи с сопротивлением поляризации Rp (Rp = Rf + Rt, показатель для оценки коррозионной стойкости латуни T2 в модельном растворе). Сопротивление переноса заряда (Rt) связано с потенциалом, адсорбированным зарядом, концентрацией реагентов и т.д. При этом с Rf находятся в простой связи степень уплотнения (основной фактор) и толщина пленки.
Рис. 7.
Диаграммы Найквиста латуни T2 после пассивации путем выдерживания в модельном растворе в течение различных периодов.

Рис. 8.
Эквивалентная электрическая схема, используемая для аппроксимации диаграмм Найквиста: a – пассивация в течение 0–2 сут; б – пассивация в течение 2–24 сут. Rs, Rf1, Rf2, Rt означают сопротивление раствора, слоя Cu2O, слоя CuO, сопротивление переносу заряда соответственно; Qf1, Qf2, Qdl означают пространственную зарядную емкость слоя Cu2O, слоя CuO и двойного слоя границы раздела соответственно. RE и WE означают электрод сравнения и рабочий электрод, соответственно.

На рис. 9 значения Rf, Rf1, Rf2 представлены в зависимости от продолжительности выдерживания. В начальный период пассивации Rf быстро увеличивается и составляет приблизительно 360 кОм см2 после выдерживания в течение 2 сут в модельном растворе, и основной вклад в Rf обеспечивает Rf1. Значительное уменьшение Rf и Rf1 можно наблюдать в течение следующих семи суток. На 9-е сутки пассивации Rf и Rf1 уменьшаются до минимального уровня, а затем Rf постепенно увеличивается, в то время как Rf1 сохраняет устойчивость. На 24-е сут значение Rf превышает 320 кОм см2 и сохраняет устойчивость до окончания пассивации. В течение всего периода пассивации Rf2 постепенно увеличивается, и после 9-х сут основной вклад в Rf обеспечивает Rf2. Изменение поведения Rf в течение периода пассивации показало, что слой защитной пленки образовался на поверхности образца в течение первых 2‑х сут, и последующее падение Rf предполагает изменение структуры или состава пассивирующей пленки, которое происходит, как показывают результаты СЭМ.
Вообще говоря, чем толще пассивирующая пленка, тем выше значение Rf. Однако фактическая ситуация заключалась в том, что образование наружной пассивирующей пленки вызывало уменьшение значения Rf. Авторы заметили, что на 12-е сутки пассивации (рис. 6в) наружная пассивирующая пленка все еще не образовывалась полностью, решетка внутренней пассивирующей пленки нарушалась, и присутствовали многочисленные межзеренные пространства. Можно сделать вывод, что наружная пассивирующая пленка разрушала плотную структуру внутренней пассивирующей пленки в течение процесса образования, что приводило к уменьшению Rf1 от вторых до девятых суток. По мере постепенного роста наружной пассивирующей пленки значение Rf увеличивалось соответствующим образом.
Эрозия под действием CO2 и период самовосстановления
Пассивированные электроды из латуни T2 выдерживали в коррозионном растворе в течение 1 сут (период эрозии под действием CO2) и затем возвращали в модельный раствор на 7 сут (период самовосстановления). Диаграммы Найквиста представлены на рис. 10. Для этих двух периодов получали значения Rf , Rf1, Rf2 после аппроксимации эквивалентной электрической схемы на рис. 8. На рис. 11 представлена кривая зависимости Rf от продолжительности выдерживания. Значения Rf и Rf2 резко уменьшались после эрозии в течение 1 ч в коррозионном растворе, причем увеличение продолжительности эрозии под действием CO2 не приводило к значительному изменению Rf, показывая, что CO2 может вызывать сильную коррозию пассивирующей пленки в течение короткого времени (1 ч). В течение периода эрозии под действием CO2 значение Rf1 составляло приблизительно 70 кОм см2, резко уменьшаясь по сравнению с 24 сут пассивации. В течение периода самовосстановления значение Rf и Rf2 значительно увеличивались, а значение Rf1 оставалось почти постоянным. После самовосстановления в течение 3 сут значения Rf и Rf2 сохраняли устойчивость, значение Rf составляло приблизительно 260 кОм см2 на 7-е сут периода самовосстановления, на 60 кОм см2 меньше, чем на 24‑е сут пассивации. Результаты показали, что коррозия латуни T2 может быть эффективно ингибирована в течение короткого времени посредством регулирования pH раствора, но пассивирующая пленка не может быть полностью восстановлена до состояния перед эрозией под действием CO2. После эрозии под действием CO2 в течение суток межзеренные пустоты и коррозионные язвы появлялись на пассивирующей пленке на рис. 12a, что было причиной резкого уменьшения Rf в течение периода эрозии под действием CO2 на рис. 11. Пустоты исчезали после самовосстановления в течение 7 сут (рис. 12б), хотя решетка была менее однородной по сравнению с не подвергнутым эрозии образцом на рис. 5.
Рис. 10.
Диаграммы Найквиста латуни T2 в течение каждого периода выдерживания: 1 – пассивация в течение 24 сут; 2 – эрозия под действием CO2 в течение 1 ч; 3 – эрозия под действием CO2 в течение 5 ч; 4 – эрозия под действием CO2 в течение 1 сут; 5 – самовосстановление в течение 3 сут; 6 – самовосстановление в течение 7 сут.

Рис. 11.
Зависимость Rf, Rf1, Rf2 от продолжительности выдерживания в течение периода эрозии под действием CO2 и самовосстановления.

Рис. 12.
Полученные методом СЭМ изображения латуни T2 в течение каждого периода выдерживания: a – эрозия под действием CO2 в течение 1 сут; б – самовосстановление в течение 7 сут.

Как представлено на рис. 5 (часть эрозии под действием CO2 и самовосстановления), количество CuO уменьшалось после эрозии под действием CO2, причем растворенная пленка CuO может частично восстанавливаться в процессе самовосстановления. Количество Cu2O оставалось постоянным в течение эрозии под действием CO2 и периода самовосстановления. Наружный слой CuO легче подвергался коррозии под действием CO2 вследствие открытости раствора. Межзеренные пустоты могут быть повторно заполнены CuO, вновь образовавшимся в период самовосстановления.
ОБСУЖДЕНИЕ
Чтобы лучше понять электрохимическое поведение латуни T2 в щелочном растворе, обогащенном кислородом в присутствии и при отсутствии CO2. На рис. 13 представлены схематические изображения, демонстрирующие изменение пассивирующей пленки в течение каждого периода выдерживания. После анализа приведенных выше результатов предложен представленный ниже механизм пассивации и коррозии.
Рис. 13.
Схематические изображения изменения пассивирующей пленки на границе раздела раствор/латунь T2 в течение каждого периода выдерживания: пассивация, эрозия под действием CO2 и самовосстановление.

Когда латунь T2 выдерживали в модельном растворе, на границе раздела раствор/металл (рис. 13a) протекали следующие реакции [1–3, 6]:
(3)
${{{\text{O}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 4{\text{e}} \to 4{\text{O}}{{{\text{H}}}^{ - }},$(4)
${\text{Cu}} \to {\text{C}}{{{\text{u}}}^{ + }} + {\text{e}} \to {\text{C}}{{{\text{u}}}^{{2 + }}} + {\text{e}},$(6)
$2{\text{CuOH}} \to {\text{C}}{{{\text{u}}}_{{\text{2}}}}{\text{O}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Ионизация Cu разделяется на две стадии как показывает реакция (4), поскольку реакция протекала на поверхности латунь T2, образование Cu2+ ингибировалось восстановлением элементарной Cu в ходе следующей реакции:
В этом случае в начальный период пассивации только пассивирующая пленка Cu2O образовывалась на поверхности металла. Сначала пассивирующая пленка Cu2O была фрагментарной, как представлено на рис. 13б; после пассивации в течение нескольких суток поверхность латуни T2 была полностью покрыта (рис. 13в). Прочно прикрепленная пассивирующая пленка Cu2O препятствовала контакту металла с раствором, и для раствора была открыта пассивирующая пленка Cu2O, а не металл. Затем Cu2O продолжал окисляться и превращался в CuO под действием O2 в течение следующих суток, и плотная структура пассивирующей пленки Cu2O разрушалась посредством внедрения вновь образовавшегося CuO, как представлено на рис. 13г. Пустоты между кристаллами CuO и Cu2O являются более доступными для диффузии элементарной Cu через пассивирующую пленку, деинтеркалированная Cu окислялась до CuO вместо Cu2O, поскольку реакция протекала на поверхности пассивирующей пленки, а не металла. При окончании пассивации двухслойная структура пассивирующей пленки образовывалась на поверхности металла, как представлено на рис. 13д. Следует отметить, что внутренняя пассивирующая пленка фактически представляла собой не слой кристалла чистого Cu2O, а слой пленки Cu2O с внедренным CuO. В течение этого периода происходят следующие реакции:
(10)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{\text{O}}{{{\text{H}}}^{ - }} \to {\text{Cu(OH}}{{{\text{)}}}_{2}},$(11)
${\text{Cu(OH}}{{{\text{)}}}_{{\text{2}}}} \to {\text{CuO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$В течение периода эрозии под действием CO2 раствор барботировали CO2, ионы H+, образующиеся при ионизации H2CO3, превращали щелочной раствор в кислый. Пассивирующая пленка была неустойчивой в кислой среде. Пассивирующая пленка CuO растворялась, образуя Cu(HCO3)2 и CuCO3, которые осаждались на поверхности пленки CuO, в то время как основная масса осажденного Cu(HCO3)2/CuCO3 повторно растворяется под действием H+. Даже внутренняя пассивирующая пленка Cu2O может подвергаться эрозии, если период эрозии является достаточно продолжительным. Подвергнутая коррозии пассивирующая пленка обеспечивает слабую защиту для металла. В течение этого периода происходят следующие реакции:
(12)
${\text{CuO}} + {\text{ }}2{{{\text{H}}}^{ + }} \to {\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(13)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{\text{HCO}}_{3}^{ - } \to {\text{Cu(HC}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}},$(14)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {\text{CO}}_{3}^{{2 - }} \to {\text{CuC}}{{{\text{O}}}_{3}}.$В течение периода самовосстановления вытравленные язвы повторно заполнялись CuO, и небольшое количество остаточного Cu(HCO3)2/CuCO3 от периода эрозии под действием CO2 внедрялось в восстановленную пленку. Поскольку площадь вытравленных язв была очевидно меньше, чем открытая поверхность металла, возникала коррозионная ячейка с большим катодом и малым анодом. Осаждение CuO и/или Cu2O происходило значительно быстрее, чем в период пассивации. В результате этого кристаллическая структура становилась менее плотной и однородной, чем до эрозии под действием CO2.
ВЫВОДЫ
Пассивирующая пленка латуни T2 состоит из внутреннего слоя Cu2O и наружного слоя CuO в щелочной среде, обогащенной кислородом, причем наружная пассивирующая пленка CuO является рыхлой и легко отслаивается, блокируя полые провода статора. В случае эрозии под действием CO2 рыхлый наружный слой CuO растворяется, и ускоряется коррозия латуни T2. Даже если pH раствора соответствует щелочной среде, после коррозии пассивирующая пленка не может полностью восстанавливаться. Это блокирование является причиной выхода из строя генератора электростанции после утечки CO2.
Когда происходит утечка CO2, она должна быть устранена немедленно, и при этом должна быть постепенно заменена охлаждающая вода. Значение pH охлаждающей воды должно при этом находиться на уровне от 8.0 до 9.0, и скорость потока охлаждающей воды необходимо увеличивать соответствующим образом для смыва отслаивающегося оксидного слоя с полого медного провода.
Список литературы
Wang, S., Research on Corrosion Protection of Inner Cooling Water System in Generator. Changsha: Changsha University of Science and Technology, 2010.
Svoboda, R. and Plamer D.A., Behavior of Copper in Generator Stator Cooling-Water Systems, Power Plant Chemistry, 2009, vol. 11, p. 70.
Duffeau, F., Aspden, D., and Coetzee, G., Guide on Stator Water Chemistry Management, Study Committee, 2010, vol. 4, p. 37.
Prevention of Flow Restrictions in Generator Stator Water Cooling Circuits. EPRI, USA, 2002.
Schleithoff, K. and Emshoff, H.W., Optimization of the Conditioning of Generator Cooling Water, VGB Kraftswerktechnik, 1990, vol. 70, p. 677.
Robert, S. and Donald, A.P., Behaviour of Copper in Generator Stator Cooling-Water Systems, ICPWS XV, Berlin, September, 2008, p. 8.
Syrett, B., Electrochemical Corrosion Potential (ECP) of Hollow Copper Strands in Water Cooled Generator, EPRI, 2007.
Tyapkov, V.F., Chudakova, I.Y., and Alekseenko, O.A., Achieving More Reliable Operation of Turbine Generators at Nuclear Power Plants by Improving the Water Chemistry of the Generator Stator Cooling System, Thermal Engineering, 2011, vol. 58, p. 655. [Тяпков В.Ф., Чудакова И.Ю., Алексеенко О.А. Повышение надежности эксплуатации турбогенераторов аэс путем совершенствования вхр системы охлаждения его статора. Теплоэнергетика. 2011. Т. 58. № 8. С. 32.]
Svoboda, R. and Seipp, H.G., Flow Restrictions Water Cooled Generator Stator Coils-Prevention, Diagnosis, and Removal. Part 1: Behavior of Copper in Water Cooled Generator Coils, Power Plant Chem., 2004, vol. 6, p. 7.
Wei, Y.J., Xia, D.H., and Song, S.Z., Detection of SCC of 304 NG stainless steel in an acidic NaCl solution using electrochemical noise based on chaos and wavelet analysis, Russ. J. Electrochem., 2016, vol. 52, p. 560. [Вэй Ё.-Ж., Сиа Д.-Х., Сон Ш.-Ж., Обнаружение коррозионного растрескивания в нержавеющей стали 304 NG в подкисленном растворе nacl с использованием электрохимических шумов, теории хаоса и вейвлет-анализа. Электрохимия. 2016. Т. 52. № 6. С. 627.]
Sharon, P.M. and Felix, W.R.M., Operating Experience Gained During the Copper Oxide Plugging Incident in Koeberg Unit1 Generator Stator, Power Plant Chem., 2001, vol. 3, p. 262.
Yuan, Z.D., The Effects of Abrasive Particles on the Electrochemical Behavior of Adrenaline at Different Electrodes, Russ. J. Electrochem., 2014, vol. 50, p. 80. [Юан Ж.Д. Влияние обработки поверхности электродов абразивными частицами на электрохимическое поведение адреналин. Электрохимия. 2014. Т. 50. С. 89.]
Ding, H.Y., Feng Y.J., and Lu, J.W., Study on the Service Life and Deactivation Mechanism of Ti/SnO2–Sb Electrode by Physical and Electrochemical Methods, Russ. J. Electrochem., 2010, vol. 46, p. 72. [Дин Х.Я., Фен Ю.Ж., Лу Ж.В., Исследование физическими и электрохимическими методами срока службы и механизма деактивирования электрода Ti/SnO2–Sb. Электрохимия. 2010. Т. 46. С. 75.]
Rui, Y.Z. and Shun, A.C., Copper Corrosion Behavior in Stator Cooling Water, Mater. Performance, 2016, vol. 55, p. 46.
Ye, C.S., Zhang, J., and Qian, Q., Quasi-dynamicsimulation test of corrosion control for generator copper conductors, Corros. Sci. and Protection Technol., 2004, vol. 16, p. 41.
Zha, F.L., Feng, B., and Xu, S., Electrochemical Corrosion Behavior of Copper in Soil Extract Solution, Corros. Sci. and Protection Technol., 2014, vol. 26, p. 446.
Xu, Q.J., Zhu, L.J., and Qi, H., Photoelectrochemical Study of the Corrosion and Inhibition on Cu, Acta Metallurg. Sinica, 2008, vol. 44, p. 1360.
Cao, F.H., Len, V.H., Zhang, Z., and Zhang, J.Q., Corrosion behavior of magnesium and its alloy in NaCl solution, Russ. J. Electrochem., 2007, vol. 43, p. 837. [Цао Ф.Р., Лен В.Х., Жан Ж., Жан Я.К. Коррозионное поведение чистого магния и его сплава в растворе NaCl. Электрохимия. 2007. Т. 43. С. 878.]
Dai, J., Hu, L.H., and Liu, W.Q., Study on the Flat Band Potential of Nanoporous TiO2 Film Electrode, Acta Phys. Sinica, 2008, vol. 57, p. 5310.
Q, D.Z., Rohwerder, M., and Zhao, Z., Semiconducting Behavior of Temporararily Protective Oil Coating on the Surface of AISI 304 Stainless steel in 5% Na2SO4 Solution during Its Degradation, J. Electrochem. Soc., 2004, vol. 151, p. B446.
Ortiz, R., Ogura, T., and Valtierra, J.M., A Catalytic Application of Cu2O and CuO Films Deposited over Fiberglass, Appl. Surface Sci., 2001, vol. 174, p. 177.
Du, G., Li, J., Wang, W.K., Jiang, C., and Song, S.Z., Detection and characterization of stress-corrosion cracking on 304 stainless steel by electrochemical noise and acoustic emission techniques, Corros. Sci., 2011, vol. 53, p. 2918.
Kuleshova, N.F., Vvedenskii, A.V., and Bobrinskaya, E.V., Anodic Oxidation of Serine Anion on Smooth and Platinized Platinum, Russ. J. Electrochem., 2018, vol. 54, p. 529. [Кулешова Н.Е., Введенский А.В., Бобринская Е.В., Анодное окисление аниона серина на гладкой и платинированной платине. Электрохимия. 2018. Т. 54. С. 679.]
Ma, C., Zhou, B., Xia, D.H., et al. In-situ Study the Corrosion Degradation Mechanism of Tinplate in Salty Water by Scanning Electrochemical Microscopy, Russ. J. Electrochem., 2018, vol. 54, p. 216. [Ма Ч., Жоу Б., Сиа Д.-Х., Гао Ж.-М., Ван Ж.-К., Жан Ж.-М., Бехнамян Я., Ху В.-Б., Исследование “in situ” механизма коррозионного разрушения белой жести в соленой воде методом сканирующей электрохимической микроскопии. Электрохимия. 2018. Т. 54. С. 249.]
Ojani, R., Raoof, J.B., and Hosseini Zavvarmahalleh, S.R., Electrocatalytic oxidation of methanol on carbon paste electrode modified by nickel ions dispersed into poly(1,5-diaminonaphthalene) film, Electrochim. Acta, 2008, vol. 53, no. 5, p. 2402.
Norouzi, B. and Mirkazemi, T., Electrochemical sensor for amoxicillin using Cu/poly (o-toluidine) (sodium dodecyl sulfate) modified carbon paste electrode, Russ. J. Electrochem., 2016, vol. 52, no. 1, p. 37. [Нороузи, Б., Мирказеми, Т. Электрохимический сенсор на амоксициллин с использованием электрода из угольной пасты, модифицированного Cu/полиотолуидином–додецилсульфатом натрия. Электрохимия. 2016. Т. 52. С. 43.]
Дополнительные материалы отсутствуют.



