Электрохимия, 2019, T. 55, № 3, стр. 341-349
Синтез новых наносфер NiFe2O4 для применения в высокоэффективных псевдоконденсаторах
А. Гасеми a, М. Хейрманд a, *, Х. Хели b
a Химический факультет, Школа фундаментальных наук, Ясуджский университет
Ясудж, Иран
b Центр наномедицинских и нанобиологических исследований, Ширазский университет медицинских наук
Шираз, Иран
* E-mail: kheirmand@yu.ac.ir
Поступила в редакцию 14.03.2018
После доработки 15.09.2018
Принята к публикации 17.10.2018
Аннотация
Описан синтез монодисперсных наносфер NiFe2O4 простым методом. Структура, морфология и характеристики наносфер определены с применением электронной сканирующей микроскопии, рентгеновской дифракции и ИК-спектроскопии с преобразованием Фурье. Электрохимические свойства полученных наносфер исследованы для определения их пригодности и чувствительности для применения в качестве материала электродов суперконденсаторов. Наносферы NiFe2O4 проявляли высокую удельную емкость 122 Ф г–1 и очень большую удельную энергию 16.9 Вт ч кг–1 при высокой плотности тока 8.0 А г–1. Максимальная удельная емкость наносфер была еще больше, достигая 137 Ф г–1 при плотности тока 4 А г–1. Для электродов на основе наносфер NiFe2O4 характерна долгосрочная устойчивость электрохимических характеристик. Емкость не уменьшалась по сравнению с исходным значением в течение 100 циклов гальваностатического заряда–разряда.
ВВЕДЕНИЕ
Конденсаторы, аккумуляторы и топливные элементы представляют собой устройства для хранения энергии, которые имеют свои собственные ограничения. Конденсаторы имеют высокие плотности мощности, но низкие плотности энергии, в то время как для аккумуляторов и топливных элементов наблюдается обратное. Суперконденсатор стал одним из перспективных устройств для хранения энергии, который может заполнить пробел между аккумуляторами и конденсаторами [1–3].
Электрохимические конденсаторы или суперконденсаторы в последние годы привлекают большое внимание благодаря своему продолжительному сроку службы, огромной плотности мощности, высокой эффективности заряда–разряда и низкой температурной чувствительности [3–6].
В зависимости от механизма аккумулирования заряда, суперконденсаторы можно классифицировать по двум типам: i) электрические двойнослойные суперконденсаторы, которые основаны на нефарадеевском разделении заряда на границе раздела электрод/электролит, где электродный материал обычно представляет собой активированный уголь, и ii) псевдоконденсаторы, основу которых составляют фарадеевские окислительно-восстановительные реакции электроактивных материалов, и которые содержат, главным образом, оксиды металлов или проводящие полимеры [1, 7, 8].
Среди различных оксидов металлов относящиеся к типу шпинели ферриты переходных металлов (MFe2O4, M = Ni2+, Mn2+, Zn2+ или Co2+) привлекли значительное внимание в качестве перспективных материалов вследствие низкого магнитного момента насыщения, низкой стоимости, экологической безопасности, хороших электрических свойств, термической устойчивости и пригодности для химической модификации в широком круге приложений [9–12]. Среди разнообразных ферритов металлов NiFe2O4 представляет собой один из многоцелевых и технологически важных ферритных материалов, имеющих превосходные характеристики, такие как высокая электрохимическая устойчивость, каталитические свойства, механическая твердость и распространенность в природе [12–17]. Ферриты никеля нашли применение в качестве материалов для аккумулирования энергии [13–15, 18–20]. В данном отношении были описаны наночастицы [18], тонкие пленки [21] и нанокомпозиты с проводящими полимерами [22, 23] на основе ферритов никеля. Методы синтеза значительно влияют на удельную емкость (SC) ферритов никеля посредством воздействия на размер образующихся частиц и их морфологию [17, 19], и для ферритов никеля были описаны различные значения SC.
Показано, что размер и форма частиц играют главную роль в регулировании электрохимических свойств электродных материалов. Наноструктуры ферритов с регулируемыми размерами и морфологией, включая нанокристаллы [24], полые сферы [25], наностержни-нанопроволоки [26] и нанотрубки [27] были успешно получены с применением разнообразных методов синтеза: гидротермальный-сольвотермический [28], термолитический [29], темплатный [30], золь-гелевый [31], соосадительный [32] и электрохимический [33].
В настоящем исследовании были сделаны попытки регулирования структурных и электрохимических свойств наносфер NiFe2O4 (NFNS) для использования в суперконденсаторах с применением нового пути синтеза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Все химические реагенты приобретали у компании Merck (Германия) и использовали без дополнительной очистки. Во всех исследованиях использовали бидистиллированную воду.
Синтез NFNS
Сначала дофамин растворяли в смеси воды и этанола (объемное соотношение 5 : 1) при коцентрации 0.8 мг мл–1 по отношению к объему воды. Затем в полученный раствор добавляли 19 мг NiCl2 ⋅ 6H2O и 45 мг FeSO4 ⋅ 7H2O при медленном перемешивании [34] для получения дофаминового спиртового раствора с молярным соотношением Ni2+ : Fe2+, равным 1 : 2. После этого pH раствора доводили до 8.5, используя трис-буферный раствор. Раствор медленно перемешивали в течение трех суток при комнатной температуре. После этого раствор центрифугировали и пятикратно промывали бидистилированной водой, а затем высушивали при комнатной температуре. Наконец, образец прокаливали при 600°C при скорости нагревания 2°C/мин в течение 2 ч в атмосфере Ar.
Аппаратура
Электрохимические эксперименты проводили в трехэлектродной ячейке, содержащей раствор 0.5 М KOH, или в симметричной двухэлектродной ячейке, которой управлял потенциостат/гальваностат μ-Autolab, тип III, FRA2 (Нидерланды). В качестве электрода сравнения и противоэлектрода использовали Ag/AgCl (3 М KCl) и платиновую проволоку, соответственно. Системой управляли посредством ПК с программным обеспечением GPES и FRA 4.9. Электрохимические характеристики NFNS исследовали методами циклической вольтамперометрии, циклов заряда–разряда и спектроскопии электрохимического импеданса (EIS). Для EIS использовали диапазон частот от 100 кГц до 25 МГц с амплитудой напряжения переменного тока 10 мВ и временем установления равновесия 5 с.
Автоэлектронную сканирующую микроскопию (FESEM) осуществляли с помощью прибора, Sigma-IGMA/VP компании Zeiss (Германия). Просвечивающую электронную микроскопию (TEM) осуществляли с помощью прибора СМ 30 компании Philips. Инфракрасные спектры с преобразованием Фурье (FTIR) регистрировали для исследования природы образующихся химических связей с помощью спектрометра Tensor 27 компании Bruker (Германия). Рентгеновские дифрактограммы (XRD) регистрировали с помощью дифрактометра X’Pert компании Philips (Нидерланды) с источником излучения CuKα при скорости сканирования 1 град/мин в диапазоне 2θ от 15° до 90°.
Изготовление электродов
Изготовление рабочих электродов для трехэлектродной ячейки. Стеклоуглеродный (GC) электрод диаметром 2 мм сначала полировали на полировальной подложке, используя порошок оксида алюминия с размером частиц 0.05 мкм с водяной смазкой, а затем обрабатывали ультразвуком в ультразвуковой ванне, содержащей смесь воды и этанола в объемном соотношении 1 : 3. После этого электрод использовали непосредственно, модифицировали ацетиленовой сажей (GC/AB) или модифицировали NFNS (GC/NFNS). Для изготовления электрода получали GC/AB смесь 66 мас. % ацетиленовой сажи и 34 мас. % поливинилидендифторида и добавляли N-метил-2-пирролидон с образованием суспензии. Суспензию интенсивно встряхивали, и порцию объема выливали на поверхность электрода GC для достижения массы активного материала (AB), составляющей ∼0.02 мг, после высушивания при 60°C в течение 24 ч. Для осаждения электрода GC/NFNS получали смесь 80 мас. % NFNS, 15 мас. % ацетиленовой сажи и 5 мас. % поливинилидендифторида и добавляли N-метил-2-пирролидон с образованием суспензии. Суспензию интенсивно встряхивали, и порцию объема выливали на поверхность электрода GC для достижения массы активного материала (NFNS), составляющей ∼0.1 мг, после высушивания при 60°C в течение 24 ч.
Изготовление электродов для двухэлектродной ячейки. Для исследования заряда–разряда с использованием двухэлектродной симметричной ячейки графитовые пластинчатые подложки сначала полировали сверхтонкой наждачной бумагой, промывали водой, обезжиривали ацетоном, подвергали травлению в растворе HNO3 (1 : 3, об./об.) и тщательно промывали водой. Суспензию активного материала (NFNS) выдерживали до относительно сухого состояния для получения пасты. Пасту наносили на графитовые пластинки площадью 1.0 см2 и затем нагревали до 60°C в печи в течение 24 ч. Электроды содержали ∼1.29 мг активного материала. Электроды прижимали друг к другу с помощью зажима. В качестве разделителя использовали бумагу Pellon®, пропитанную раствором 0.5 М KOH.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В течение синтеза NFNS протекают следующие реакции. Сначала ионы Fe2+ окисляются кислородом воздуха:
(1)
$4{\text{F}}{{{\text{e}}}^{{2 + }}} + {{{\text{O}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to 4{\text{F}}{{{\text{e}}}^{{3 + }}} + 4{\text{O}}{{{\text{H}}}^{--}},$(2)
$2{\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{N}}{{{\text{i}}}^{{2 + }}} + 8{\text{O}}{{{\text{H}}}^{ - }} \to {\text{NiF}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + 4{{{\text{H}}}_{{\text{2}}}}{\text{O}},$В ходе соосаждения Fe3+ и Ni2+ одновременно осаждаются, и дофамин выступает как вещество, которым обеспечивается предварительная стабилизация, определяющая формы получаемого в результате продукта. Этот продукт затем нагревают при 600°C в отсутствие кислорода, вызывая разложение полидофамина до элементарного углерода. Таким образом, NFNS содержит феррит и углерод в форме композита. Для исследования размера, формы и структуры частиц NFNS были получены изображения FESEM, которые представлены на рис. 1. NFNS представляет собой высокооднородные и почти монодисперсные наносферы со средним диаметром 332 ± 40 нм (n = 100). Поверхность NFNS имеет высокую пористость и должна обеспечивать пути проникновения частиц электролита, когда NFNS используют в качестве материала электрода псевдоконденсатора. Дополнительное исследование структуры NFNS осуществляли методом TEM. Рисунок 2 представляет полученное методом TEM изображение NFNS, показывая, что образец состоит из углеродных сфер (менее контрастных) и ферритовых наночастиц (более контрастных) мельче 25 нм, равномерно диспергированных между углеродных сфер.
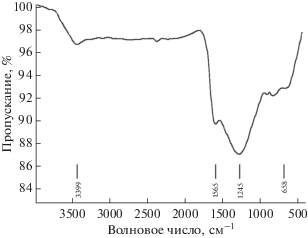
Рисунок 3 представляет спектр поглощения FTIR NFNS в диапазоне от 3500 до 500 см–1. Пик при 658 см–1 соответствует характеристическим колебаниям NiFe2O4, которые представляют собой валентные колебания интегралов перекрывания между ионами Fe3+ и O2–, находящимися в тетраэдрической координации ферритов типа обратной шпинели. Полосы при 1245 и 3399 см–1 обусловлены связью N–O и валентными колебаниями OH, соответственно [16].
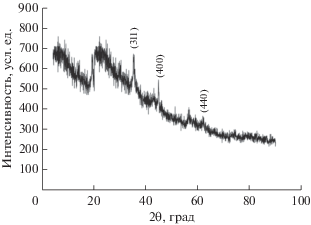
Рисунок 4 представляет порошковую рентгеновскую дифрактограмму (XRD) NFNS. Наиболее интенсивный пик XRD при 2θ = 35.4° соответствует плоскости (311) NiFe2O4. Он является показателем присутствия структуры обратной шпинели. Другие пики, соответствующие плоскостям (440) и (400), также присутствуют с низкими относительными интенсивностями. Дифракционные пики образца являются идентичными и соответствующими NiFe2O4 (карта JCPDS № 54-0964).
Циклическую вольтамперометрию (CV) использовали для оценки электрохимических емкостных свойств NFNS. Рисунок 5 представляет кривые CV электродов GC, GC/AB и GC/NFNS в электролите 0.5 М KOH при скорости развертки потенциала 50 мВ с–1. Кривые CV электродов GC и GC/AB представляют собой аналогичные прямоугольники без каких-либо окислительно-восстановительных пиков с очень низкими токами заряда. Однако кривая CV для электрода GC/NFNS представляет окислительно-восстановительные пики с максимальным током заряда. Поскольку NFNS состоит из ионов переходных металлов, которые могут легко вступать в окислительно-восстановительные реакции (Ni2+/3+ и/или Fe3+/2+), на кривой CV было обнаружено образование пиков, свидетельствующих о присутствии псевдоемкостных свойств. В псевдоконденсаторах, помимо емкости двойного электрического слоя поверхности электрода, происходит окислительно-восстановительная реакция, когда ионы электрохимически адсорбируются на или вблизи поверхности материала с сопутствующим процессом (процессами) фарадеевского переноса заряда [35]. В шпинельной кристаллической структуре NFNS октаэдрические позиции занимают ионы Ni2+ и Fe3+, в то время как тетраэдрические позиции занимают только Fe3+ [18]. В отношении окислительно-восстановительных реакций ферритов в щелочных растворах предполагается участие ионов гидроксида или гидроксония [36]:
(4)
$\begin{gathered} \delta {\text{N}}{{{\text{i}}}^{{3 + }}} + (2 - \delta ){\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{OH}}_{{{\text{(aq)}}}}^{ - } + {\text{e}} \to \delta {\text{N}}{{{\text{i}}}^{{2 + }}} + \\ + \,\,(2 - \delta ){\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{OH}}_{{({\text{а д с о р б и р о в а н н ы й )}}}}^{ - } \\ \end{gathered} $(5)
$\begin{gathered} \delta {\text{N}}{{{\text{i}}}^{{3 + }}} + (2 - \delta ){\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{H}}_{{{\text{(aq)}}}}^{ + } + {\text{e}} \to \delta {\text{N}}{{{\text{i}}}^{{2 + }}} + \\ + \,\,(2 - \delta ){\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{H}}_{{({\text{р е ш е т к а }})}}^{ + }, \\ \end{gathered} $Рис. 5.
Кривые CV электродов GC, GC/AB и GC/NFNS, снятые при скорости развертки потенциала 50 мВ с–1 в электролите 0.5 М KOH.
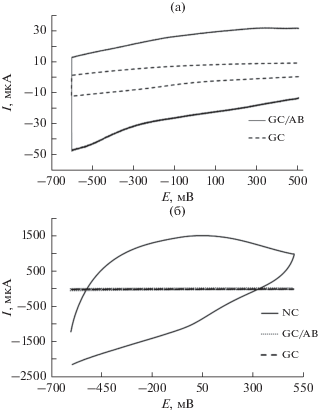
CV-кривая электрода GC/NFNS демонстрирует высокую интегральную площадь, что свидетельствует о высокой электрохимической емкости.
Рисунок 6 представляет CV-кривые электрода GC/NFNS, снятые при различных концентрациях KOH от 0.05 до 2.0 М. Результаты показывают, что как токи окисления–восстановления, так и токи заряда одновременно увеличиваются при повышении концентрации KOH. Повышение концентрации электролита (в пределах проведенного эксперимента) увеличивает полную проводимость системы электрод–электролит, с одной стороны, и упрощает ионный обмен, требуемый для окислительно-восстановительных реакций феррита, с другой стороны. Это приводит к тому, что концентрация электролита существенно сказывается на поведении NFNS в суперконденсаторе. Однако данный концентрационный эффект является ничтожным при повышенных концентрациях вследствие увеличения активности ионов. Таким образом, для дальнейших исследований была выбрана концентрация 0.5 М.
Рис. 6.
Кривые CV электрода GC/NFNS для различных концентраций электролита KOH при скорости развертки потенциала 50 мВ с–1.
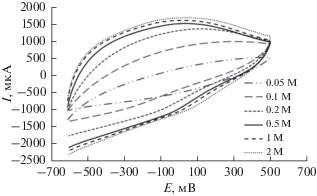
Рисунок 7 представляет графики Найквиста электродов GC, GC/AB и GC/NFNS при потенциале разомкнутой цепи –105 мВ (отн. Ag/AgCl) в электролите 0.5 М KOH. Для электрода GC зафиксированы два вогнутых полукруга во всем диапазоне развертки частоты, что связано с незначительностью окислительно-восстановительных реакций, протекающих на углеродной поверхности с участием кислородных функциональных групп. Аналогичным образом, электрод GC/AB демонстрирует похожую картину с вследствие большей активной площади ацетиленовой сажи. На графике Найквиста, полученном для электрода GC/NFNS, сильно вогнутый полукруг наблюдался при высоких частотах. Полукругу в высокочастотной области соответствует сопротивление переносу заряда, с которым связаны фарадеевские окислительно-восстановительные процессы NFNS (уравнения (4) и (5)).
Рис. 7.
Графики Найквиста электродов GC, GC/AB и GC/NFNS при потенциале разомкнутой цепи в электролите 0.5 М KOH.
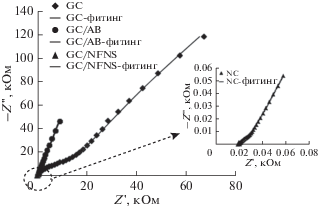
Рисунок 8a представляет эквивалентную электрическую схему, которой соответствуют диаграммы Найквиста электродов GC и GC/AB, и рис. 8б представляет эквивалентную электрическую схему для профиля импеданса электрода GC/NFNS. Элементы схемы Rs, CPEdl и Rct представляют собой омическое сопротивление раствора, элемент постоянной фазы для емкости двойного слоя и сопротивление переносу заряда окислительно-восстановительных реакций, соответственно. Сочетание Rct и CPEF определяет низкочастотный полукруг на диаграммах Найквиста электродов GC и GC/AB. Таблица 1 представляет значения элементов схемы для эквивалентных электрических схем на рис. 8, полученные посредством фитинга экспериментальных диаграмм Найквиста. Диаметр полукруга для электрода GC/NFNS значительно меньше, чем для электродов GC и GC/AB, свидетельствуя, что NFNS обеспечивает наилучшую скорость переноса заряда. Линейная область низкочастотной зоны электрода GC/NFNS (с углом от 45° до 90° по отношению к действительной оси) характеризуется открытым элементом Варбурга и описывает диффузионно-емкостное поведение, возникающее вследствие диффузионного накопления ионов электролита в материале матрицы [37–39] (см. также уравнения (4), (5)). Результаты показывают, что электрод GC/NFNS имеет значительно меньшее сопротивление межфазовому переносу заряда (32.67 Ом) по сравнению с электродами GC (18 733 Ом) и GC/AB (75 Ом). Электрод GC/NFNS также представляет низкий импеданс Варбурга (RW = 0.1054 Ом). Значения емкости двойного слоя (Cdl) для электродов вычислены по параметрам CPEdl (Tdl и n) и Rct1 согласно следующему уравнению и представлены в табл. 1 [37]:
(6)
${{C}_{{{\text{dl}}}}} = {{\left[ {{{T}_{{{\text{dl}}}}}R_{{{\text{ct}}1}}^{{(1 - n)}}} \right]}^{{1{\text{/}}n}}}.$Рис. 8.
Эквивалентные электрические схемы для диаграмм Найквиста электродов GC и GC/AB (a) и электрода GC/NFNS (б).
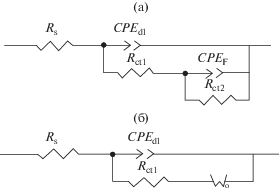
Таблица 1.
Значения элементов схемы в эквивалентных электрических схемах, представленных на рис. 8, полученные путем фитинга экспериментальных диаграмм Найквиста
| Электрод | Rs, Ом | CPEdl | Rct1, Ом | Cdl, мкФ | CPEF | Rct2, МОм | ||
|---|---|---|---|---|---|---|---|---|
| Tdl, мкОм–1 сn | n | TF, мкОм–1 сn | n | |||||
| GC | 271.2 | 6.36 | 0.93 | 18733 | 5.42 | 26.5 | 0.75657 | 1.69 |
| GC/AB | 175.5 | 17.5 | 0.82 | 75.0 | 4.08 | 7.96 | 0.90 | 7.96 |
| WO | ||||||||
| RW, Ом | TW, Ом–1 сn | nW | ||||||
| GC/NFNS | 19.49 | 6525 | 0.53 | 32.67 | 1656.9 | 0.1054 | 5.74 × 10–5 | 0.42 |
Значение Cdl для NFNS (1656 мкФ) значительно больше, чем для электродов GC (5.42 мкФ) или GC/AB (4.08 мкФ), показывая, что NFNS представляет собой весьма перспективный электродный материал для применения в суперконденсаторах. Кроме того, следует отметить, что емкостное поведение электрода GC/NFNS (например, на кривых CV или заряда–разряда) обуславливают одновременно Cdl и TW (емкость двойного слоя и псевдоемкость).
Гальваностатические испытания заряда–разряда проводили для электрода GC/NFNS при различных плотностях тока (от 1 до 8 А г–1), как представлено на рис. 9. Следующее уравнение использовали для вычисления SC (Ф г–1) из гальваностатических кривых заряда–разряда:
где I представляет собой ток разряда, Δt представляет собой время разряда, ΔV –напряжение разряда, m – массу активного материала. Максимальную удельную энергию (SE) NFNS получали согласно следующему уравнению:Рис. 9.
Гальваностатические кривые заряда–разряда для электрода GC/NFNS при различных плотностях тока.
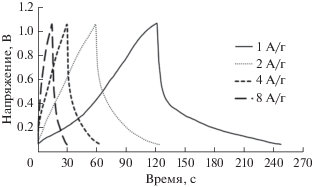
Значения SC и максимума SE электрода GC/NFNS представлены в табл. 2. Следует отметить, что даже после восьмикратного увеличения плотности тока от 1 до 8 А г–1 SC может оставаться на уровне 122 Ф г–1. Сравнение нескольких различных ферритов, используемых в качестве электродных материалов для суперконденсаторов, представлено в табл. 3. Показано, что NFNS имеет более высокое или сопоставимое значение SC по сравнению с другими ферритами.
Таблица 2.
Значения SC и SE для NFNS при различных плотностях тока
| Плотность тока, А г–1 | SC, Ф г–1 | SE, Вт ч кг–1 |
|---|---|---|
| 1 | 137 | 19.1 |
| 2 | 133 | 18.5 |
| 4 | 126 | 17.5 |
| 8 | 122 | 16.9 |
Таблица 3.
Сравнение нескольких различных ферритов, применяемых в качестве материалов электродов суперконденсаторов
| Тип феррита | Размер, форма, структура (феррита) | SC, Ф г–1 | Литература |
|---|---|---|---|
| Bi-феррит | Наночешуйка | 72.2 | [40] |
| Mn-феррит | Нанокристаллический кластер | 97.1 | [41] |
| Cu-феррит | Тонкая пленка | 4 | [42] |
| Mn-феррит | – | 105 | [43] |
| Mn-феррит | Нанокристалл | 60 | [24] |
| Ni-феррит | Нанокристалл | 127 | [24] |
| Ni-феррит* | Нанокристалл | 251 | [24] |
| Li-феррит | Наночастица | 50 | [45] |
| Cu-феррит | Тонкая пленка | 72 | [46] |
| Ni–Zn-феррит | Тонкая пленка | 67 | [22] |
| Ni–Zn-феррит | Нанокристалл | 19 | [16] |
| Mn-феррит | – | 99 | [47] |
| Mn-феррит | – | 100 | [48] |
| Ni-феррит | Субмикронный размер | 18.5 | [49] |
| Ni–Co-феррит | Нанокристалл | 60 | [50] |
| Ni–Cu-феррит | Нанокристалл | 17 | [50] |
| Co-феррит | – | 123 | [51] |
| Ni-феррит | Наночастицы, диспергированные в углеродных микросферах | 122 | Настоящее исследование |
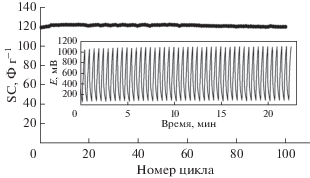
Устойчивость в циклических испытаниях представляет собой еще один значительный фактор, который определяет эффективность и долговечность суперконденсаторов. Рисунок 10 иллюстрирует SC полученного электрода в течение 100 циклов гальваностатического заряда–разряда при плотности тока 8 А г–1. Остаточная емкость не уменьшается и сохраняется близкой к своему исходному значению в течение 100 циклов. Это показывает высокую долгосрочную устойчивость электрода GC/NFNS (рис. 10, вставка).
ВЫВОДЫ
Новый метод синтеза был использован при получении NFNS в качестве электродного материала для применения в псевдоконденсаторах. Результаты показали, что NFNS состоит из углеродных сфер, содержащих диспергированные наночастицы феррита. Было обнаружено, что токи окисления–восстановления увеличиваются при повышении концентрации электролита KOH. Значения SC = 122 Ф г–1 и SE = 16.9 Вт ч кг–1 были получены при высокой плотности тока 8 А г–1 для полученного NFNS. Результаты продемонстрировали высокую устойчивость электрода GC/NFNS при длительном циклическом испытании, в котором остаточная емкость достигала 100.5% своего исходного значения после 100 гальваностатических циклов заряда–разряда.
Список литературы
Simon, P. and Gogotsi, Y., Materials for electrochemical capacitors, Nature materials, 2008, vol. 7, no. 11, p. 845.
Miller, J.R. and Simon, P., Electrochemical capacitors for energy management, Science Magazine, 2008, vol. 321, no. 5889, p. 651.
Sattarahmady, N., Dehdari Vais, R., and Heli, H., Fibroin nanofibrils as an electrode material for electrical double-layer biosupercapacitor applications, J.Appl. Electrochem., 2015, vol. 45, p. 577.
Li, Y., Xie, H., Wang, J., and Chen, L., Preparation and electrochemical performances of α-MnO2 nanorod for supercapacitor, Materials Letters, 2011, vol. 65, no. 2, p. 403.
Sattarahmady, N., Parsa, A., and Heli, H., Albumin nanoparticle-coated carbon composite electrode for electrical double-layer biosupercapacitor applications, J. Mater. Sci., 2013, vol. 48, p. 2346.
Shiri, L., Sattarahmady, N., and Heli, H., Iron oxyhydroxide cobalt hexacyanoferrate coaxial nanostructure: Synthesis, characterization and pseudocapacitive behavior, J.Electroanal. Chem., 2014, vol. 719, p. 143.
Zhang, L.L. and Zhao, X., Carbon-based materials as supercapacitor electrodes, Chemical Society Reviews, 2009, vol. 38, no. 9, p. 2520.
Liu, C., Li, F., Ma, L.P., and Cheng, H.M., Advanced materials for energy storage, Advanced materials, 2010, vol. 22, no. 8.
Pullar, R.C., Hexagonal ferrites: a review of the synthesis, properties and applications of hexaferrite ceramics, Progress in Materials Science, 2012, vol. 57, no. 7, p. 1191.
Mathew, D.S. and Juang, R.S., An overview of the structure and magnetism of spinel ferrite nanoparticles and their synthesis in microemulsions, Chemical Engineering J., 2007, vol. 129, no. 1–3, p. 51.
Sattarahmady, N., Heidari, M., Zare, T., Lotfi, M., and Heli, H., Zinc–Nickel Ferrite Nanoparticles as a Contrast Agent in Magnetic Resonance Imaging, Applied Magnetic Resonance, 2016, vol. 47, p. 925.
Sattarahmady, N., Zare, T., Mehdizadeh, A.R., Azarpira, N., Heidari, M., Lotfi, M., and Heli, H., Dextrin-coated zinc substituted cobalt-ferrite nanoparticles as an MRI contrast agent: In vitro and in vivo imaging studies, Colloids and Surfaces B: Biointerfaces, 2015, vol. 129, p. 15.
Senthilkumar, B., Sankar, K.V., Sanjeeviraja, C., and Selvan, R.K., Synthesis and physico-chemical property evaluation of PANI–NiFe2O4 nanocomposite as electrodes for supercapacitors, J. of Alloys and Compounds, 2013, vol. 553, p. 350.
Sen, P. and De, A., Electrochemical performances of poly (3,4-ethylene dioxythiophene)–NiFe2O4 nanocomposite as electrode for supercapacitor, Electrochim. Acta, 2010, vol. 55, no. 16, p. 4677.
Pawar, D., Pawar, S., Patil, P., and Kolekar, S., Synthesis of nanocrystalline nickel–zinc ferrite (Ni0.8Zn0.2Fe2O4) thin films by chemical bath deposition method, Journal of Alloys and Compounds, 2011, vol. 509, no. 8, p. 3587.
Gunjakar, J., More, A., Shinde, V., and Lokhande, C., Synthesis of nanocrystalline nickel ferrite (NiFe2O4) thin films using low temperature modified chemical method, J. Alloys and Compounds, 2008, vol. 465, no. 1–2, p. 468.
Senthilkumar, B., Selvan, R.K., Vinothbabu, P., Perelshtein, I., and Gedanken, A., Structural, magnetic, electrical and electrochemical properties of NiFe2O4 synthesized by the molten salt technique, Materials Chemistry and Physics, 2011, vol. 130, no. 1–2, p. 285.
Yu, Z.Y., Chen, L.F., and Yu, S.H., Growth of NiFe2O4 nanoparticles on carbon cloth for high performance flexible supercapacitors, J. Materials Chemistry A, 2014, vol. 2, p. 10889.
Anwar, S., Muthu, K.S., Ganesh, V., and Lakshminarasimhan, N., A Comparative Study of Electrochemical Capacitive Behavior of NiFe2O4 Synthesized by Different Routes, N., J. Electrochem. Soc., 2011, vol. 158, p. A976.
Xu, H., Wang, X.L., Liu, H., Wang, J.X., Dong, X.T., Liu, G.X., Yu, W.S., Yang, Y., and Zhang, H.B., Facile synthesis of Fe3O4/NiFe2O4 nanosheets with enhanced Lithium-ion storage by one-step chemical dealloying, J. Mater. Sci., 2018, vol. 53, p. 15631.
Pawar, D.K., Shaikh, J.S., Pawar, B.S., Pawar, S.M., Patil, P.S., and Kolekar, S.S., Synthesis of hydrophilic nickel zinc ferrite thin films by chemical route for supercapacitor application, J. Porous Materials, 2012, vol. 19, p. 649.
Wang, W., Hao, Q., Lei, W., Xia, X., and Wang, X., Ternary nitrogen-doped graphene/nickel ferrite/polyaniline nanocomposites for high-performance supercapacitors, J. Power Sources, 2014, vol. 269, p. 250.
Sen, P. and De, A., Electrochemical performances of poly(3,4-ethylenedioxythiophene)–NiFe2O4 nanocomposite as electrode for supercapacitor, Electrochim. Acta, 2010, vol. 55, p. 4677.
Blanco-Gutierrez, V., Saez-Puche, R., and Torralvo-Fernandez, M.J., Super paramagnetism and interparticle interactions in ZnFe2O4 nanocrystals, J. Mater. Chem., 2012, vol. 22, no. 7, p. 2992.
Guo, P., Zhang, G., Yu, J., Li, H., and Zhao, X., Controlled synthesis, magnetic and photocatalytic properties of hollow spheres and colloidal nanocrystal clusters of manganese ferrite, Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2012, vol. 395, p. 168.
Wang, J., Chen, Q., Hou, B., and Peng, Z., Synthesis and Magnetic Properties of Single Crystals of MnFe2O4 Nanorods, Eur. J. Inorg. Chem., 2004, vol. 2004, no. 6, p. 1165.
Fan, H.M., Yi, J.B., Yang, Y., Kho, K.W., Tan, H.R., Shen, Z.X., Ding, J., Sun, X.W., Olivo, M.C., and Feng, Y.P., Single-crystalline MFe2O4 nanotubes/nanorings synthesized by thermal transformation process for biological applications, Acs Nano, 2009, vol. 3, no. 9, p. 2798.
Cui, L., Guo, P., Zhang, G., Li, Q., Wang, R., Zhou, M., Ran, L., and Zhao, X., Facile synthesis of cobalt ferrite submicrospheres with tunable magnetic and electrocatalytic properties, Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, vol. 423, p. 170.
Bao, N., Shen, L., Wang, Y.H.A., Ma, J., Mazumdar, D., and Gupta, A., Controlled growth of monodisperse self-supported super paramagnetic nanostructures of spherical and rod-like CoFe2O4 nanocrystals, J. Amer. Chem. Soc., 2009, vol. 131, no. 36, p. 12900.
Xu, Y., Wei, J., Yao, J., Fu, J., and Xue, D., Synthesis of CoFe2O4 nanotube arrays through an improved sol–gel template approach, Materials Letters, 2008, vol. 62, no. 8–9, p. 1403.
Zhang, S., Dong, D., Sui, Y., Liu, Z., Wang, H., Qian, Z., and Su, W., Preparation of core shell particles consisting of cobalt ferrite and silica by sol–gel process, J.alloys and compounds, 2006, vol. 415, no. 1–2, p. 257.
Aijun, H., Juanjuan, L., Mingquan, Y., Yan, L., and Xinhua, P., Preparation of nano-MnFe2O4 and its catalytic performance of thermal decomposition of ammonium perchlorate, Chinese Journal of Chemical Engineering, 2011, vol. 19, no. 6, p. 1047.
Sartale, S. and Lokhande, C., A room temperature two-step electrochemical process for large area nanocrystalline ferrite thin films deposition, J. electroceram., 2005, vol. 15, no. 1, p. 35.
Yao, X., Zhao, C., Kong, J., Wu, H., Zhou, D., and Lu, X., Dopamine-assisted one-pot synthesis of zinc ferrite-embedded porous carbon nanospheres for ultrafast and stable lithium ion batteries, Chemical Communications, 2014, vol. 50, no. 93, p. 14597.
Conway, B.E., Electrochemical supercapacitors: scientific fundamentals and technological applications, Springer Science & Business Media, 2013.
Kuo, Sh.-L., Lee, J.-Fu, and Wu, N.-L., Study on Pseudocapacitance Mechanism of Aqueous MnFe2OSupercapacitor, J. Electrochem. Soc., 2007, vol. 154, p. A34.
Barsoukov, E. and Macdonald, J.R., Impedance Spectroscopy: Theory, Experiment, and Applications, New Jersey, John Wiley & Sons, Inc., 2005
Sattarahmady, N. and Heli, H., A non-enzymatic amperometric sensor for glucose based on cobalt oxide nanoparticles, Journal of Experimental Nanoscience, 2012, vol. 7, p. 529.
Heli, H., Majdi, S., Sattarahmady, N., and Parsaei, A., Electrocatalytic oxidation and sensitive detection of deferoxamine on nanoparticles of Fe2O3 NaCo[Fe(CN)6]-modified paste electrode, J. Solid State Electrochemistry, 2010, vol. 14, p. 1637.
Jadhav, V.V., Zate, M.K., Liu, S., Naushad, M., Mane, R.S., Hui, K.N., and Han, S.-H., Mixed-phase bismuth ferrite nanoflake electrodes for supercapacitor application, Applied Nanoscience, 2016, vol. 6, p. 511.
Wang, R., Li, Q., Cheng, L., Li, H., Wang, B., Zhao, X.S., and Guo, P., Electrochemical properties of manganese ferrite-based supercapacitors in aqueous electrolyte: The effect of ionic radius, Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2014, vol. 457, p. 94.
Ham, D., Chang, J., Pathan, S.H., Kim, W.Y., Mane, R.S., Pawar, B.N., Joo, O.-S., Chung, H., Yoon, M.-Y., and Han, S.-H., Electrochemical capacitive properties of spray-pyrolyzed copper-ferrite thin films, Current Applied Physics, 2009, vol. 9, p. S98.
Kuo S.-L. and Wu, N.-L., Electrochemical characterization on MnFe2O4/carbon black composite aqueous supercapacitors, J. Power Sources, 2006, vol. 162, p. 1437.
Wu, N.-L. and Chen, Y.-H., Characterization of a New Type of Asymmetric Supercapacitors: LiMn2O4/MnFe2O4, ECS Transactions, 2008, vol. 16, p. 223.
Santos-Pena, J., Crosnier, O., and Brousse, T., Nanosized α-LiFeO2 as electrochemical supercapacitor electrode in neutral sulfate electrolytes, Electrochim. Acta, 2010, vol. 55, p. 7511.
Kale, M.R. and Tendolkar, N.P., Super-Capacitive Properties of Nanocrystalline Copper Ferrite Thin Films Deposited by Environment Friendly Electrodeposition Method, International Journal of Scientific & Engineering Research, 2013, vol. 4, p. 12.
Lin, Y-P. and Wu, N-L., Characterization of MnFe2O4/LiMn2O4 aqueous asymmetric supercapacitor, J. Power Sources, 2011, vol. 196, p. 851.
Kuo, S.-L., Lee, J.-F., and Wu, N.-L., Study on Pseudocapacitance Mechanism of Aqueous MnFe2O4 Supercapacitor, J. Electrochem. Soc., 2007, vol. 154, p. A34.
Senthilkumar, B., Selvan, R.K., Vinothbabu, P., Perelshtein, I., and Gedanken, A., Structural, magnetic, electrical and electrochemical properties of NiFe2O4 synthesized by the molten salt technique, Materials Chemistry and Physics, 2011, vol. 130, p. 285.
Bhujun, B., Tan, M.T.T., and Shanmugam, A.S., Study of mixed ternary transition metal ferrites as potential electrodes for supercapacitor applications, Results in Physics, 2017, vol. 7, p. 345.
He, P., Yang, K., Wang, W., Dong, F., Du, L., and Deng, Y., Reduced graphene oxide-CoFe2O4 composites for supercapacitor electrode, Russ. J. Electrochem., 2013, vol. 49, p. 359.
Дополнительные материалы отсутствуют.