Электрохимия, 2019, T. 55, № 3, стр. 329-334
Влияние температуры на поведение электродов из феррофосфата лития
Е. К. Тусеева a, Т. Л. Кулова a, А. М. Скундин a, *, А. К. Галеева b, А. П. Курбатов b, c
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Ленинский просп., 31, корп. 4, Россия
b Центр физико-химических методов исследования и анализа
Алматы, Казахстан
c Казахский национальный университет им. Аль-Фараби
Алматы, Казахстан
* E-mail: askundin@mail.ru
Поступила в редакцию 08.06.2018
После доработки 01.09.2018
Принята к публикации 16.10.2018
Аннотация
Проведено систематическое исследование влияния температуры (в диапазоне от –45 до +60°С) на процесс экстракции лития из LiFePO4 и его внедрения в FePO4. При токе около С/1.5 с понижением температуры уменьшается емкость, возрастает поляризация, расширяется диапазон составов, соответствующих неравновесным твердым растворам, а также увеличивается наклон прямолинейного участка гальваностатических кривых, соответствующего двухфазной системе. Уменьшение емкости при снижении температуры не описывается простым уравнением Аррениуса; предполагается, что процесс на электродах из феррофосфата лития протекает в смешанном диффузионно-активационном режиме. Поляризация анодного и катодного процессов сложным образом увеличивается при снижении температуры, причем поляризация анодного процесса заметно превышает поляризацию катодного процесса.
ВВЕДЕНИЕ
За последние два десятилетия феррофосфат лития LiFePO4 стал одним из основных материалов положительного электрода литий-ионных аккумуляторов благодаря уникальным свойствам – высокой стабильности, способности работать при высоких плотностях тока, относительно низкой себестоимости, безопасности, плоской разрядной кривой и т.п. В литературе можно найти огромное количество работ, посвященных технологии синтеза, различным модификациям, а также исследованию свойств LiFePO4, здесь можно сослаться на недавние обзоры [1–5]. В то же время, вопрос о влиянии температуры на характеристики электродов на основе LiFePO4 освещен довольно слабо. Считается, что одним из препятствий для использования литий-ионных аккумуляторов с положительными электродами на основе LiFePO4 на электротранспорте являются недостаточно высокие характеристики материала при пониженных температурах. Поэтому основные усилия исследователей были направлены на поиск способов повышения характеристик таких электродов при температуре –20°С (модификация LiFePO4, подбор электролита и т.п.). Во многих источниках приводится только сравнение характеристик электродов при комнатной температуре и температуре –20°С (например, [6–20]). В некоторых работах приведены данные о характеристиках электродов на основе LiFePO4 при повышенных температурах [21–32], и лишь единичные работы охватывают более или менее широкие температурные интервалы [33, 34].
В настоящей работе методами гальваностатического циклирования исследованы характеристики электродов на основе LiFePO4 при температурах от –45 до +60°С. В определенной степени эта работа является продолжением исследований электродов на основе титаната лития [35].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электроды изготавливали из коммерческого LiFePO4 марки KJ2. По данным поставщика 50% всех частиц этого материала имеют размер менее 4 мкм, а 10% частиц меньше 0.7 мкм. Содержание углерода в материале составляет 4.7%. Рабочие электроды изготавливали по стандартной намазной технологии. В качестве токоотвода использовали сетку из нержавеющей стали. Активную массу готовили смешением порошка LiFePO4 (85 мас. %), сажи (10 мас. %, Timcal, Бельгия) и поливинилиденфторида (5 мас. %, Aldrich), предварительно растворенного в N-метилпирролидиноне (Aldrich). Количество активного вещества на электроде составляло около 4 мг см–2. Электроды прессовали давлением 1000 кг см–2 с последующей сушкой под вакуумом при температуре 120°С. Электрохимические измерения проводили в трехэлектродных герметичных ячейках с литиевым вспомогательным электродом и литиевым электродом сравнения. Ячейки собирали и заполняли электролитом в перчаточном боксе с атмосферой сухого аргона (ОАО “Спектроскопические системы”, Россия). Содержание воды и кислорода в боксе не превышало 1 ppm. В качестве электролита использовали 1 М LiPF6 в смеси этиленкарбонат–диметилкарбонат–пропилацетат (2 : 3 : 5) (все компоненты электролита имели квалификацию “extra dry” и были приобретены в Aldrich). Содержание воды в электролите, определенное кулонометрическим титрованием по К. Фишеру (установка 917 Ti-Touch фирмы Metrohm, Швейцария), не превышало 20 ppm. В качестве сепаратора использовали нетканый полипропилен толщиной 15 мкм (НПО “Уфим”, Россия). На каждой собранной ячейке проводили измерения при всех температурах без промежуточного демонтажа ячеек, причем первое измерение (3 цикла заряда–разряда) проводили при температуре +20°С, затем проводили измерения сериями по 3 цикла при снижающейся температуре (последовательно +10, 0, –10, –15, –20, –25, –30, –35, –40 и ‒45°С), затем вновь при температуре +20°С и затем серии по 3 цикла при температурах +45 и +60°С. В заключение проводили измерения вновь при температуре 20°С. Сопоставление разрядных емкостей, полученных в первой и последней серии измерений при температуре +20°С, позволило оценить степень деградации при циклировании. Оказалось, что снижение емкости за все время измерений (менее 1.5%, что характерно для феррофосфатной системы) было сопоставимо с разбросом емкости внутри каждой серии (как правило, емкость несколько увеличивалась от первого цикла к третьему). Таким образом, деградация электродов при циклировании не влияла существенно на изменение характеристик с температурой.
Гальваностатические измерения проводили с помощью компьютеризированного стенда АЗРВРИК 50 mA–10 V (ОАО “НТЦ Бустер”, Россия). Во всех случаях ток заряда был равен току разряда. Ячейка размещалась в камере тепла–холода КТХ-74-65/165 (ОАО “Смоленское СКТБ СПУ”, Россия), обеспечивающей поддержание рабочей температуры с погрешностью не более 0.5°С. Перед началом гальваностатических измерений ячейку выдерживали при рабочей температуре в течение 1 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
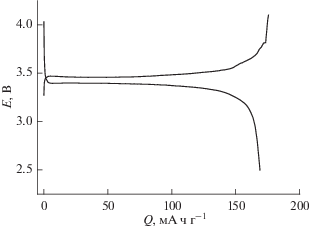
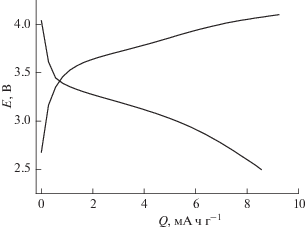
На рис. 1 и 2 приведены зарядные и разрядные кривые, полученные при токе 100 мА г–1 (что примерно соответствует режиму С/1.5) и наивысшей (+60°С) и наинизшей (–45°С) температурах. Общепризнано, что характерная особенность электродов на основе феррофосфата лития, функционирующих по двухфазному механизму, – это постоянство потенциала на большей части разрядной или зарядной кривой. Однако не всегда учитывается тот факт, что горизонтальная разрядная кривая отражает термодинамическое равновесие между фазами исходного материала (FePO4) и продукта разряда (LiFePO4). Реально, как видно уже из рис. 1, основная часть разрядной кривой не горизонтальна, а скривленный участок, соответствующий однофазной системе (твердому раствору FePO4 в LiFePO4), занимает около 30% емкости, что значительно превышает равновесный состав твердого раствора. С понижением температуры отличие зарядных и разрядных кривых от равновесных сказывается сильнее. На рис. 2 видно, что снижение температуры сопровождается изменением наклонов линейных (точнее, близких к линейным) участков разрядных и зарядных кривых, а также сильным снижением разрядной емкости.
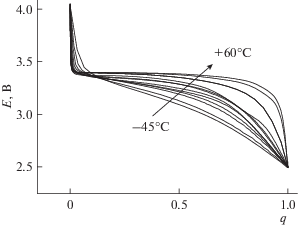
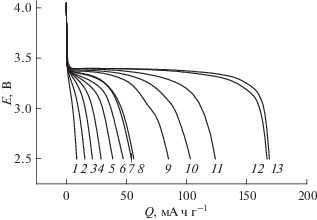
На рис. 3 приведена сводка разрядных (катодных) кривых, полученных при всех исследованных температурах. Этот рисунок позволяет наглядно оценить снижение разрядной емкости при снижении температуры. Качественно близкие результаты (полученные в совершенно ином электролите) приведены в работе [33].
Рис. 3.
Гальваностатические катодные кривые на электроде из LiFePO4, полученные при токе 100 мА г–1 и температурах –45 (1), –40 (2), –35 (3), –30 (4), ‒25 (5), –20 (6), –15 (7), –10 (8), 0 (9), +10 (10), +20 (11), +45 (12) и +60°С (13).
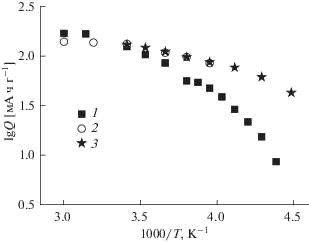
Природа зависимости разрядной емкости от температуры подробно обсуждалась в [35] и [36]. Предполагалось, что в гальваностатических опытах при невысоких плотностях тока литий внедряется во всю глубину частиц активного материала, но при увеличении плотности тока толщина диффузионного слоя к моменту достижения нулевой поверхностной концентрации и резкого изменения потенциала (т.е., когда время опыта равно переходному времени τ), становится меньше размера частиц материала, и емкость оказывается меньше предельной. Поскольку переходное время, а следовательно, и разрядная емкость, пропорциональны коэффициенту диффузии лития, температурная зависимость емкости должна быть такой же, как температурная зависимость коэффициента диффузии.
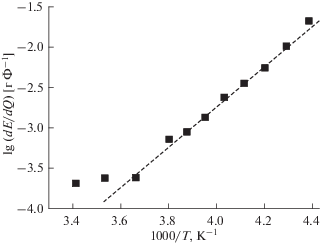
Действительно, как было обнаружено в [35], температурная зависимость емкости электрода на основе титаната лития в определенном температурном интервале описывается уравнением Аррениуса с разумным значением энергии активации (около 35 кДж/моль). Близкая закономерность была отмечена в [36] для температурной зависимости емкости графитового электрода. Для электродов на основе феррофосфата лития это оказалось не так. На рис. 4 приведена температурная зависимость разрядной емкости электрода на основе LiFePO4 в аррениусовских координатах. Как видно, при температурах выше 45°С разрядная емкость не зависит от температуры и близка к предельному теоретическому значению. При более низких температурах понижение температуры сопровождается увеличением энергии активации (повышением наклона кривой в аррениусовских координатах). Для сравнения на рис. 4 приведены данные, заимствованные из литературы. В работах [26] и [33] были созданы специальные условия для улучшения характеристик феррофосфата лития при низких температурах – в первом случае частицы феррофосфата были покрыты тонким слоем полиацена, во втором случае был использован электролит на основе смеси тетрафторбората и бисоксалатобората лития. Видно, что и в этих случаях температурная зависимость линеаризируется лишь на ограниченных интервалах обратной температуры. Для реализации температурной зависимости емкости в форме уравнения Аррениуса должны соблюдаться определенные условия, в частности диффузия потенциалопределяющих частиц должна быть лимитирующей стадией всего электродного процесса, геометрия диффузии должна быть близка к полубесконечной, не должно быть широкого распределения частиц активного материала по размерам и т.д. Весьма вероятно, что в данном случае нельзя считать диффузию лимитирующей стадией процесса.
Наглядное представление о том, как количественно изменяется форма разрядной кривой с изменением температуры, дает рис. 5, где разрядные кривые приведены в нормализованных координатах (когда по оси абсцисс отложено отношение текущей емкости к конечной емкости).
Выше уже отмечалось, что на всех разрядных кривых можно выделить некоторый средний прямолинейный участок, соответствующий существованию двух несмешивающихся фаз. При температуре +60°С этот участок практически горизонтален (потенциал не изменяется по мере разряда). При снижении температуры абсолютное значение наклона этого участка увеличивается, т.е. поляризация увеличивается по мере разряда. (Наклон имеет размерность г Ф–1 или Ом г с–1). Температурная зависимость этого наклона при температурах ниже 0°С описывается уравнением Аррениуса с относительно высоким значением энергии активации 47.8 кДж моль–1 (рис. 6). Столь высокое значение формальной энергии активации, возможно, указывает на смешанный диффузионно-активационный режим процесса внедрения лития, что и объясняет особенности температурной зависимости разрядной емкости электродов на основе феррофосфата лития.
Часто в качестве количественной характеристики поляризации используют характерное значение потенциала, соответствующего половине емкости в гальваностатических измерениях (см., например, [34, 35]). На рис. 7 приведены данные о характерных потенциалах анодного и катодного процессов на электроде на основе феррофосфата лития. Формально эти зависимости можно кусочно описать уравнением Аррениуса с наклонами 95.8 и –106 ВК (в интервале температур от –15 до +45°С) и 548 и –357 ВК (в интервале температур от –45 до –15°С) для анодного и катодного процессов соответственно.
Рис. 7.
Характерные значения потенциалов катодного (1) и анодного (2) процессов по данным настоящей работы. Значения характерных потенциалов катодного процесса из [34] (3).
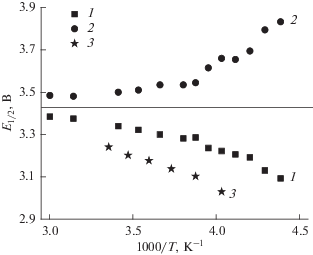
Интересно, что в отличие от результатов, полученных на электродах из титаната лития [35], в данном случае при низких температурах анодная поляризация заметно превышает катодную и сильнее возрастает при снижении температуры.
На рис. 7 для сравнения приведены данные также для характерного потенциала катодного процесса из работы [34]. Гальваностатические измерения в этой работе проводили при меньшем токе (С/5), причина повышенной катодной поляризации здесь остается неясной.
ЗАКЛЮЧЕНИЕ
В настоящей работе проведено систематическое исследование влияния температуры на процесс внедрения лития в электроды на основе феррофосфата лития LiFePO4 в стандартном электролите 1 М LiPF6 в смеси этиленкарбонат–диметилкарбонат–пропилацетат (2 : 3 : 5). Гальваностатические циклические измерения проведены в диапазоне температур от –45 до +60°С.
Установлено, что с понижением температуры происходит сильное снижение разрядной и зарядной емкости, а также рост перенапряжения по мере заряда и разряда. Температурная зависимость разрядной емкости не описывается простым уравнением Аррениуса (что наблюдалось, в частности, при работе электродов из титаната лития и из углерода). Это позволяет предположить, что процесс на электродах из феррофосфата лития протекает в смешанном диффузионно-активационном режиме.
Список литературы
Yuan, L.-X., Wang, Z.-H., Zhang, W.-X., Hu, X.-L., Chen, J.-T., Huang, Y.-H., and Goodenough, J.B., Development and challenges of LiFePO4 cathode material for lithium-ion batteries, Energy Environ. Sci., 2011, vol. 4, p. 269.
Wang, Y., He, P., and Zhou, H., Olivine LiFePO4: development and future, Energy Environ. Sci., 2011, vol. 4, p. 805.
Wang, J. and Sun, X., Olivine LiFePO4: the remaining challenges for future energy storage, Energy Environ. Sci., 2015, vol. 8, p. 1110.
Gong, C., Xue, Z., Wen, S., Ye, Y., Xie, X., Advanced carbon materials/olivine LiFePO4 composites cathode for lithium ion batteries, J. Power Sources, 2016, vol. 318, p. 93.
Eftekhari, A., LiFePO4/C nanocomposites for lithium-ion batteries, J. Power Sources, 2017, vol. 343, p. 395.
Ma, Z., Shao, G., Wang, X., Song, J., and Wang, G., Li3V2(PO4)3 modified LiFePO4/C cathode materials with improved high-rate and low-temperature properties, Ionics, 2013, vol. 19, issue 12, p. 1861.
Chen, L., Lu, C., Chen, Q., Gu, Y., Wang, M., and Chen, Y., Preparation and characterization of nano-LiFePO4/C using two-fluid spray dryer, Applied Mechanics and Materials, 2014, vol. 563, p. 62.
Zhao, N., Li, Y., Zhao, X., Zhi, X., and Liang, G., Effect of particle size and purity on the low temperature electrochemical performance of LiFePO4/C cathode material, J. Alloys and Comp., 2016, vol. 683, p. 123.
Liu, H., Liu, Y., An, L., Zhao, X., Wang, L., and Liang, G., High energy density LiFePO4/C cathode material synthesized by wet ball milling combined with spray drying method, J. Electrochem. Soc., 2017, vol. 164, issue 14, p. A3666.
Zhi, X., Liang, G., Ou, X., Zhang, S., and Wang, L., Synthesis and electrochemical performance of LiFePO4/C composite by improved solid-state method using a complex carbon source, J. Electrochem. Soc., 2017, vol. 164, issue 6, p. A1285.
Li, S., Liu, X., Liu, G., Wan, Y., and Liu, H., Highly enhanced low-temperature performances of LiFePO4/C cathode materials prepared by polyol route for lithium-ion batteries, Ionics, 2017, vol. 23, issue 1, p. 19.
Wang, G., Kang, H., Chen, M., Yan, K., Hu, X., and Cairns, E.J., Effects of Solvents on the Electrochemical Performance of LiFePO4/C Composite Electrodes, ChemElectroChem., 2017, vol. 4, issue 2, p. 376.
Xie, D., Cai, G., Liu, Z., Guo, R., Sun, D., Zhang, C., Wan,Y., Peng, J., and Jiang, H., The low temperature electrochemical performances of LiFePO4/C/graphene nanofiber with 3D-bridge network structure. Electrochim. Acta, 2016. vol. 217. p. 62.
Zheng, F., Yang, C., Ji, X., Hu, D., Chen, Y., and Liu, M., Surfactants assisted synthesis and electrochemical properties of nano-LiFePO4/C cathode materials for low temperature applications, J. Power Sources, 2015, vol. 288, p. 337.
Cai, G., Guo, R., Liu, L., Yang, Y., Zhang, C., Wu, C., Guo, W., and Jiang, H., Enhanced low temperature electrochemical performances of LiFePO4/C by surface modification with Ti3SiC2, J. Power Sources, 2015, vol. 288, p. 136.
Wang, H.-Q., Zhang, X.-H., Zheng, F.-H., Huang, Y.-G., and Li, Q.-Y., Surfactant effect on synthesis of core-shell LiFePO4/C cathode materials for lithium-ion batteries, J. Solid State Electrochem., 2015, vol. 19, p. 187.
Ma, Z., Shao, G., Qin, X., Fan, Y., Wang, G., Song, J., and Liu, T., Ionic conductor cerous phosphate and carbon hybrid coating LiFePO4 with improved electrochemical properties for lithium ion batteries, J. Power Source, 2014, vol. 269, p. 194.
Liao, L., Cheng, X., Ma, Y., Zuo, P., Fang, W., Yin, G., and Gao, Y., Fluoroethylene carbonate as electrolyte additive to improve low temperature performance of LiFePO4 electrode, Electrochim. Acta, 2013, vol. 87, p. 466.
Gong, C., Xue, Z., Wang, X., Zhou, X.-P., Xi, X.-L., and Mai, Y.-W., Poly(ethylene glycol) grafted multi-walled carbon nanotubes/LiFePO4 composite cathodes for lithium ion batteries, J. Power Sources, 2014, vol. 246, p. 260.
Yang, X., Xu, Y., Zhang, H., Huang, Y., Jiang, Q., and Zhao, C., Enhanced high rate and low-temperature performances of mesoporous LiFePO4/Ketjen Black nanocomposite cathode material, Electrochim. Acta, 2013, vol. 114, p. 259.
Xiao, Z., Zhang, Y., and Hu, G., An investigation into LiFePO4/C electrode by medium scan rate cyclic voltammetry, J. Appl. Electrochem., 2014, vol. 45, p. 225.
Yang, C.-C., Jang, J.-H., and Jiang, J.-R., Comparison electrochemical performances of spherical LiFePO4/C cathode materials at low and high temperatures, Energy Procedia, 2014, vol. 61, p. 1402.
Yang, C.-C., Jang, J.-H., and Jiang, J.-R., Study of electrochemical performances of lithium titanium oxide-coated LiFePO4/C cathode composite at low and high temperatures, Applied Energy, 2016, vol. 162, p. 1419.
Wu, G., Liu, N., Gao, X., Tian, X., Zhu, Y., Zhou, Y., and Zhu, Q., A hydrothermally synthesized LiFePO4/C composite with superior low-temperature performance and cycle life, Appl. Surface Science, 2018, vol. 435, p. 1329.
Oh, S.W., Myung, S.-T., Oh, S.-M., Oh, K.H., Amine, K., Scrosati, B., and Sun, Y.-K., Double Carbon Coating of LiFePO4 as High Rate Electrode for Rechargeable Lithium Batteries, Advanced materials, 2010, vol. 22, p. 4842.
Xie, H.-M., Wang, R.-S., Ying, J.-R., Zhang, L.-Y., Jalbout, A. F., Yu, H.-Y., Yang, G.-L., Pan, X.-M., and Su, Z.-M., Optimized LiFePO4–Polyacene Cathode Material for Lithium-Ion Batteries, Advanced materials, 2006, vol. 18, p. 2609.
Hsieh, C.-T., Pai, C.-T., Chen, Y.-F., Yu, P.-Y., and Juang, R.-S., Electrochemical performance of lithium iron phosphate cathodes at various temperatures, Electrochim. Acta, 2014, vol. 115, p. 96.
Lewandowski, A., Kurc, B., Swiderska-Mocek, A., and Kusa, N., Graphite LiFePO4 lithium-ion battery working at the heat engine coolant temperature, J. Power Sources, 2014, vol. 266, p. 132.
Wongittharom, N., Wang, C.-H., Wang, Y.-C., Fey, G.T.-K., Li, H.-Y., Wu, T.-Y., Lee, T.-C., and Chang, J.-K., Charge-storage performance of Li/LiFePO4 cells with additive incorporated ionic liquid electrolytes at various temperatures, J. Power Sources, 2014, vol. 260, p. 268.
Huang, Y., Xu, Y., and Yang, X., Enhanced electrochemical performances of LiFePO4/C by co-doping with magnesium and fluorine, Electrochim. Acta, 2013, vol. 113, p. 156.
Chen, M.-S., Wu, S.-h., and Pang, W.K., Effects of vanadium substitution on the cycling performance of olivine cathode materials, J. Power Sources, 2013, vol. 241, p. 690.
Kurita, T., Lu, J., Yaegashi, M., Yamada, Y., Nishimura, S.-i., Tanaka, T., Uzumaki, T., and Yamada, A., Challenges toward higher temperature operation of LiFePO4, J. Power Sources, 2012, vol. 214, p. 166.
Zhang, S.S., Xu, K., and Jow, T.R., An improved electrolyte for the LiFePO4 cathode working in a wide temperature range, J. Power Sources, 2006, vol. 159, p. 702.
Wu, X.-L., Guo, Y.-G., Su, J., Xiong, J.-W., Zhang, Y.-L., and Wan, L.-J., Carbon-Nanotube-Decorated Nano-LiFePO4@C Cathode Material with Superior High-Rate and Low-Temperature Performances for Lithium-Ion Batteries, Advanced Energy Materials, 2013, vol. 3, p. 1155.
Тусеева, Е.К., Кулова, Т.Л., Скундин, А.М. Влияние температуры на поведение электродов из титаната лития. Электрохимия [в печати, принято в № 2, 2019 г.].
Кулова, Т.Л. Влияние температуры на обратимые и необратимые процессы при интеркаляции лития в графит. Электрохимия. 2004. Т. 40. С. 1221 [Kulova, T.L., Effect of Temperature on Reversible and Irreversible Processes during Lithium Intercalation in Graphite. Russ. J. Electrochem., 2004. vol. 40. p. 1052].
Дополнительные материалы отсутствуют.